Оценка эффективности лечения гиперактивности мочевого пузыря и анализ морфологических особенностей детрузора у больных доброкачественной гиперплазией предстательной железы
Автор: Неймарк А.И., Лихачев А.Г., Саламанов В.И., Громов О.В., Селиванов А.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.25, 2010 года.
Бесплатный доступ
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одной из основных причин гиперак тивности мочевого пузыря (ГАМП). Непроизвольные сокращения детрузора встречаются у 40-60% пациентов с ДГПЖ. Симптомы ирритации (симптомы ГАМП) при ДГПЖ в большей степени влияют на качество жизни, чем симптомы обструкции. Лечение ГАМП при ДГПЖ начинается с применения адреноблокаторов, при их недоста точной эффективности добавляются М холиноблокаторы. Комбинация препаратов из этих 2 групп дает наи больший терапевтический эффект в отношении ГАМП. Основными морфологическими особенностями детрузо ра при ГАМП с ДГПЖ являются увеличение площади склероза и изменения в строении лейомиоцитов.
Гиперактивный детрузор, морфология, доброкачественная гиперплазия простаты, обструкция, ирритация
Короткий адрес: https://sciup.org/14919177
IDR: 14919177 | УДК: 616.624-009.12-091:616.65-006.55
Текст научной статьи Оценка эффективности лечения гиперактивности мочевого пузыря и анализ морфологических особенностей детрузора у больных доброкачественной гиперплазией предстательной железы
Оперативное лечение ДГПЖ направлено на ликвидацию инфравезикальной обструкции (ИВО), но этого, довольно часто, оказывается недостаточно для нормализации мочеиспускания и улучшения качества жизни пациентов [3, 4]. ГАМП – одна из основных причин неудовлетворительных результатов оперативного лечения ДГПЖ. Ирритативные симптомы (наполнения) ДГПЖ возникают раньше, чем обструктивные (опорожнения), и больше влияют на качество жизни пациентов. Почему не всегда удается достичь успеха в лечении гиперактивности мочевого пузыря при ДГПЖ? Поиск ответа на этот вопрос давно проводится и одним из направлений таких исследований является изучение структурных (морфологических) изменений детрузора при ДГПЖ в сочетании с ГАМП.
Цель исследования: оценить эффективность лечения
ГАМП при ДГПЖ. Изучить морфологические особенности детрузора у пациентов с ДГПЖ, у которых лечение гиперактивности мочевого пузыря оказалось малоэффективным.
Материал и методы
В основу работы положены результаты клинического, урологического и морфологического обследований 71 мужчины.
Критериями включения в исследование были возраст старше 45 лет, наличие впервые выявленной и объективно доказанной ДГПЖ с нарушением акта мочеиспускания.
Из исследования исключались пациенты в возрасте менее 45 лет, с признаками рака предстательной железы, с наличием в анамнезе травмы позвоночника и костей таза, с сахарным диабетом.
Всем пациентам проводилось клиническое и урологическое обследование при первичном обращении и в ходе лечения.
Клиническое исследование включало: сбор жалоб, анамнеза, общий анализ мочи и крови, биохимическое исследование крови.
Урологическое обследование состояло в заполнении таблицы Международной суммарной оценки симптомов при заболеваниях простаты I-PSS и индекса качества жизни QOL, пальцевого ректального исследования предстательной железы, определения уровня простатспецифи-ческого антигена (ПСА) крови, трансректального ультразвукового исследования (ТРУЗИ) предстательной железы с определением ее объема и количества остаточной мочи, а также уродинамического обследования методом урофлоуметрии. В соответствии с критериями, предложенными Е.Л. Вишневским, симптомы I-PSS разделяли на обструктивные (1, 3, 5, 6) и ирритативные (2, 4, 7).
Инфравезикальная обструкция в области пузырноуретрального сегмента может быть следствием наличия как механического фактора – ДГПЖ, так и динамического, обусловленного повышенным тонусом гладких мышц шейки мочевого пузыря, заднего отдела уретры и предстательной железы [2].
Динамический компонент ИВО при наличии ДГПЖ обусловлен, преимущественно, гиперактивностью детрузора (ГД) [1]. Согласно стандартизованной терминологии, симптомами, характеризующими ГАМП при оценке функции нижних отделов мочевого тракта, являются полла-киурия (более 8 микций за сутки), ноктурия (1–2 мик-ции за ночь), ургентность (повелительные позывы к мочеиспусканию) с недержанием мочи или без него [5]. На основании результатов таблицы I-PSS изучили суммарный балл, а также количество баллов, отражающих ир-ритативную и обструктивную симптоматику в отдельности, рассчитали коэффициент суммарного соотношения обструктивных симптомов к ирритативным (SO/SI), определили количественный показатель (индекс) качества жизни (QOL).
Урофлоуметрическое исследование проводилось на аппарате “URODYN-1000” (“Dantec”, Дания) с определением: максимальной скорости потока мочи (Qmax, мл/с), средней скорости потока мочи (Qave, мл/с), выпущенного объема мочи – функциональной емкости мочевого пузыря (Vcomp, мл), времени мочеиспускания (ТQ, с), времени достижения максимальной скорости (ТQmax, с), времени ожидания потока мочи (Тdelay, с).
ТРУЗИ предстательной железы проводилось на аппарате АLОКА 3500 эндокавитальным датчиком с частотой 7,5 МГц, что позволяло определять аденоматозную зону предстательной железы, ее размеры, наличие внутрипу-зырного компонента. Основными показателями являлись объем предстательной железы (ПЖ) и объем остаточной мочи (ООМ).
Лечение проводилось в два этапа. На первом этапе для дифференциальной диагностики между механической уретральной обструкцией, приводящей к нарушению детрузорно-уретрального взаимодействия и повышенным тонусом (гиперактивностью) мочевого пузыря всем пациентам, после первичного обследования, назначалось лечение α-адреноблокатором – тамсулозин (омник) 0,4 мг в сутки после завтрака в течение 3 месяцев. По окончании курса лечения проводилось контрольное обследование. Оценивалась динамика суммарных балов I-PSS, ир-ритативных и обструктивных симптомов, максимальной скорости потока мочи (Qmax, мл/с), функциональной емкости мочевого пузыря (Vcomp, мл), объем остаточной мочи (ООМ).
Второй этап лечения проводился на основании динамики показателей ИВО и ГД.
В зависимости от полученных результатов пациенты были разделены на 4 группы. 1-ю и 2-ю группы составили пациенты с невыраженной обструктивной симптоматикой или значительным уменьшением ее проявлений на фоне проводимого лечения, суммарный балл I-PSS был<19. В 1-ю группу (n=15) были включены пациенты, у которых ирритативные симптомы уменьшались, с Qmax 10–13 мл/с. В данной группе к α -адреноблокатору добавляли М-холиноблокатор оксибутинин (дриптан).
Во 2-й группе (n=13) Qmax составила более 13 мл/с и симптомы ирритации не менялись. У данного контингента пациентов α -адреноблокатор отменялся, и лечение продолжали М-холиноблокатором в монотерапии.
Лечение дриптаном в обеих группах начинали с дозы 2,5 мг в сутки. В дальнейшем дозу постепенно увеличивали до достижения терапевтического эффекта, максимум 7,5-10 мг в сутки. Ограничением к назначению дриптана являлся ООМ более 30–40% от Vcomp. Продолжительность 2-го этапа составила также 3 месяца.
В 3-ю группу (n=29) вошли пациенты с уменьшением обструктивных и ирритативных симптомов, которые, по критериям включения, не вошли в 1 и 2-ю группы, а оперативное лечение не было показано. Пациенты этой группы продолжали лечение α -адреноблокаторами.
4-ю группу (n=14) составили пациенты с выраженными ирритативными и обструктивными симптомами, величина которых после лечения на 1-м этапе мало менялась: суммарный балл I-PSS был >20, Qmax – менее 10 мл/с, что явилось показанием для оперативного лечения с целью ликвидации ИВО. Им была выполнена трансуретральная резекция (ТУР) аденомы предстательной железы или открытая (чрезпузырная) аденомэктомия с биопсией шейки мочевого пузыря (с захватом мышечного слоя) и последующим гистологическим исследованием биоптата.
Пациенты 4-й группы составили основную (опытную) группу. Средний возраст пациентов данной группы составил 70 лет (от 62 до 78 лет), средняя продолжительность болезни – 4,01±1,04 года (от 1 года до15 лет).
Контрольную группу составили 12 мужчин в возрасте от 55 до 80 лет (средний возраст 67,5 лет), умершие от различных причин и не имевшие аденомы предстательной железы.
Морфологическое исследование биоптатов проводилось методом световой микроскопии. Срезы ткани, фиксированной в 10% растворе нейтрального формалина и заключенной в парафин, окрашивали гематоксилином и эозином, пикрофуксином по методу Ван Гизона. Были исследованы все слои стенки мочевого пузыря, но наибольший интерес представлял мышечный слой. Для ко- личественного анализа морфологических изменений применяли метод подсчета по решетке. Для этого в окуляр вкладывалась решетка 16х16 клеточек. Рабочее увеличение объектива 40 крат, окуляра 7 крат. Оценивались следующие морфометрические и расчетные показатели: склероз, ядра миоцитов и миоциты в пересечении, гипертрофия, отек интерстиция, полнокровие.
Цифровые данные подвергнуты статистической обработке с помощью компьютерной программы SPSS. Статистическую обработку полученных результатов проводили с использованием общепринятых методов параметрической статистики. Для описания средних групповых значений признаков рассчитывали средние арифметические и их стандартные ошибки, в ряде случаев и 95% доверительные интервалы. Для анализа межгрупповых различий применяли t-критерий Стьюдента. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимался равным 0,05.
Результаты и обсуждение
Анализ исследования I-PSS показал, что все пациенты при первичном обращении имели комбинированные расстройства мочеиспускания.
У 23 пациентов с легкой степенью клинических проявлений (0–7 баллов по I-PSS) SO/SI составило 0,43, у 31 человека с проявлениями средней тяжести (8–19 баллов) – 1,19, а у 17 пациентов с тяжелой симптоматикой (20– 35 баллов) – 1,29. Таким образом, частота обструктивного компонента выше в группе пациентов с тяжелой симптоматикой, тогда как в группе пациентов с легкими клиническими проявлениями преобладает ирритативная симптоматика.
Результаты полученных данных до и после 1-го этапа лечения отражены в таблице 1.
Влияние α -адреноблокаторов на динамический ком-
Таблица 1
Динамика показателей симптомов по шкале I-PSS и результатов клинических исследований
|
Показатель |
До лечения (n=71) |
После 1-го этапа лечения (n=71) |
|
Суммарный индекс симптоматики по шкале I-PSS. баллы |
14,0±2,0* |
10,4±1,2 |
|
Суммарный индекс ирритативной симптоматики по шкале I-PSS, баллы |
6,9±0,8* |
5,0±0,6 |
|
Суммарный индекс обструктивной симптоматики по шкале I-PSS, баллы |
7,1±1,2 |
5,4±0,7 |
|
Коэффициент отношения суммарных обструктивных индексов I-PSS к ирритативным (SO/SI) |
0,9±0,1 |
1,3±0,2 |
|
Индекс качества жизни QOL, баллы |
3,8±0,3* |
3,1±0,3 |
|
ООМ, мл |
64,5±20,0* |
32,6±8,6 |
|
Vcomp, мл |
138,8±12,4*** |
166,8±11,2 |
|
Qmax, мл/с |
8,9±1,0** |
13,0±0,7 |
|
ГД абс/% |
40/56,3% |
32/45,07% |
Примечание. Звездочки – различия между группами: * – значение р<0,05;
** – значение р<0,01; *** – значение р<0,001.
понент расстройств мочеиспускания подтверждается увеличением SO/SI.
Наряду с улучшением качества жизни пациентов отмечено также уменьшение ООМ и увеличение показателей Vcomp и Qmax, а частота ГД при лечении α -адреноб-локаторами снижалась в меньшей степени.
Объем ПЖ по УЗИ мало менялся и составлял в среднем 43,09±2,02 см3.
Уровень ПСА крови колебался в пределах нормальных значений и составлял в среднем 1,23±0,19 нг/мл.
Таким образом, монотерапия α -адреноблокаторами способствует снижению как ирритативных, так и обструктивных нарушений мочеиспускания у пациентов с ДГПЖ, преимущественно ирритативного компонента.
В таблице 2 представлены результаты 1-го этапа лечения в зависимости от степени тяжести симптомов по шкале I-PSS.
Снижение суммарного индекса ирритации наиболее существенно отмечалось в группе пациентов с тяжелыми клиническими проявлениями, у которых до лечения суммарный индекс I-PSS был выше 20 баллов. Уменьшение SO/SI сопровождалось снижением, как суммарного индекса ирритативных симптомов, так и обструктивных, преимущественно за счет последних.
В группе пациентов с клиническими проявлениями
Таблица 2
Динамика показателей симптомов по шкале I-PSS и результатов клинических исследований в зависимости от степени тяжести
|
Показатель |
Степень тяжести I-PSS |
До лечения |
После 1-го этапа лечения |
|
Суммарный индекс симптоматики по шкале I-PSS, баллы |
I (n=23) II (n=31) |
6,5±2,1 12,0±1,4 |
4,1±0,7 9,8±1,7 |
|
III (n=17) |
26,1±1,1*** |
14,0±2,3 |
|
|
Суммарный индекс |
I |
3,8±0,8 |
2,8±0,4 |
|
ирритативной симптоматики по шкале I-PSS, баллы |
II |
6,3±0,8 |
4,6±0,9 |
|
III |
11,5±0,8*** |
6,7±1,2 |
|
|
Суммарный индекс обструктивной симптоматики по шкале I-PSS, баллы |
I II |
3,7±1,3* 5,7±0,9 |
1,2±0,5 5,3±0,9 |
|
III |
14,5±0,8 ** |
7,2±1,6 |
|
|
Индекс качества жизни QOL, |
I |
2,5±0,3 |
2,4±0,4 |
|
баллы |
II |
4,0±0,3 |
3,1±0,5 |
|
III |
5,0±0,5 |
3,8±0,5 |
|
|
Коэффициент отношения суммарных |
I |
0,8±0,1 |
0,4±0,2 |
|
обструктивных индексов |
II |
0,9±0,1 |
1,6±0,5 |
|
I-PSS к ирритативным(SO/SI) |
III |
1,3±0,1 |
1,4±0,6 |
|
Vcomp, мл |
I |
193,8±28,4*** |
218,6±26,4 |
|
II |
117,7±14,4*** |
154,1±12,3 |
|
|
III |
116,7±17,0* |
134,8±12,9 |
|
|
Qmax, мл/с |
I |
15,9±1,9* |
17,4±1,4 |
|
II |
9,5±0,9*** |
12,0±0,7 |
|
|
III |
8,8±1,3* |
10,2±1,0 |
Примечание: Звездочки – различия между группами: * – значение р<0,05;
** – значение р<0,01; *** – значение р<0,001.
Таблица 3
Динамика показателей симптомов по шкале I-PSS и результатов клинических исследований в 1-й и 2-й группах
|
Показатель |
Группа |
После 1-го этапа лечения |
После 2-го этапа лечения |
|
Суммарный индекс симптоматики по шкале I-PSS, баллы |
1 (n=15) 2 (n=13) |
9,8±2,8 14,5±3,3 |
8,4±1,4 11,3±2,3 |
|
Суммарный индекс ирритативной симптоматики по шкале I-PSS, баллы |
1 2 |
5,4±1,2 8,0±0,6 |
4,5±0,7 5,6±1,3 |
|
Суммарный индекс обструктивной симптоматики по шкале I-PSS, баллы |
1 2 |
4,4±1,6 6,6±1,9 |
3,9±0,7 5,8±1,3 |
|
Коэффициент отношения суммарных обструктивных индексов I-PSS к ирритативным(SO/SI) |
1 2 |
0,6±0,1 0,8±0,1 |
0,8±0,1 1,5±0,6 |
|
Индекс качества жизни QOL, баллы |
1 2 |
3,6±0,4 4,0±0,5 |
3,1±0,5 3,5±0,671 |
|
Vcomp мл |
1 2 |
207,5±19,6*** 127,6±24,0* |
231,1±17,3 153,1±19,0 |
|
Qmax мл/с |
1 2 |
16,3±1,5* 9,15±0,45* |
17,2±1,3 11,6±0,4 |
Примечание. Звездочки – различия между группами: * – значение р<0,05;
** – значение р<0,01; *** – значение р<0,001.
средней степени тяжести указанные показатели менялись аналогично таковым в группе с тяжелыми проявлениями, но эти изменения не были статистически значимыми.
Для пациентов с симптоматикой легкой степени выраженности с суммарным индексом I-PSS до 7 баллов было характерным статистически незначимое снижение его на фоне уменьшения как ирритативных, так и обструктивных симптомов. При этом снижение индекса обструктивных симптомов было статистически значимым.
Показатели Vcomp и Qmax у всех пациентов увеличились с разной степенью статистической значимости. В группе пациентов с тяжелыми проявлениями произошли наименьшие изменения этих параметров, т.к. обструктивный компонент был изначально более выражен, чем при легкой и средней степени тяжести.
По результатам монотерапии α -адреноблокаторами все пациенты были разделены на 4 группы.
Результаты лечения на 2-м этапе клинического иссле-ования отражены в таблице 3.
Во всех 4 группах отмечено статистически значимое снижение общего суммарного индекса I-PSS, преимущественно за счет ирритативной симптоматики.
Лечение дриптаном в монотерапии и в комбинации с омником не вызывала статистически значимых изменений в суммарных индексах I-PSS. В обеих группах наблюдалось снижение параметров. Однако у пациентов после комбинированной терапии индексы I-PSS менялись в большей степени. Так, при лечении пациентов только дриптаном I-PSS уменьшился на 14,2%, а при комбинированном лечении – на 22,0%. Показатели урофлоуметри-ческого исследования, как при монотерапии дриптаном, так и в случае комбинированного лечения омником и дриптаном менялись статистически значимо. В этих груп-
Таблица 4
Результаты морфометрического исследования мышечного слоя мочевого пузыря в контрольной группе и у пациентов с ДГПЖ
|
Контрольная группа (n=12) |
Опытная группа (n=14) |
|
|
Склероз (в пересечениях по решетке) |
26,4±5,0** |
63,9±9,4 |
|
Ядра миоцитов (в пересечениях по решетке) |
4,72±0,46* |
2,90±0,18 |
|
Миоциты (в пересечениях по решетке) |
129,6±2,0* |
105,0±3,7 |
|
Ядерно-цитоплазматическое соотношение |
0,036±0,003* |
0,027±0,001 |
|
Площадь склероза (%) |
10,3±1,9* |
24,9±3,6 |
|
Площадь занимаемая лейомиоцитами (%) |
50,6±0,7 |
41,0±1,4 |
Примечание: Звездочки – различия между группами: * – значение р<0,05; ** – значение р<0,01; *** – значение р<0,001.
пах отмечалось увеличение и максимальной скорости потока мочи (Qmax) и функциональной емкости мочевого пузыря (Vcomp).
Таким образом, лечение пациентов с ДГПЖ дрипта-ном в монотерапии и в сочетании с омником улучшает клинические и уродинамические показатели. В большей степени это наблюдается при комбинированном лечении.
У пациентов с ДГПЖ, подвергнутых оперативному лечению с последующим гистологическим исследованием биоптатов, средний объем простаты составлял 56,57±3,2 см3 (от 38,4 до 75,4 см3), средний ООМ – 64,64±20,06 мл (от 0 до 250 мл), ПСА крови – от 1,43 до 4,4 (среднее 2,77±0,41 нг/мл), функциональная емкость мочевого пузыря (Vcomp) – от 89 мл до 144 мл (в среднем 112,2±5,01 мл), максимальная скорость потока мочи (Qmax) – от 7,3 до 11,4 мл/с (в среднем 8,71±0,33), средний суммарный балл I-PSS – 23,6±1,43 балла (от 20 до 28), где средний суммарный балл ирритативных симптомов составил 11,8±0,91, а обструктивных – 11,2±1,88 (SO/SI=0,95±0,18), индекс качества жизни QOL – от 4 до 5 (в среднем 4,6±0,24 балла). Результаты морфометрического исследования мышечного слоя мочевого пузыря в контрольной и опытной группах представлены в таблице 4.
При сравнении двух групп пациентов определяется, статистически значимо выше, уровень развития фиброзной ткани (склероз) в мышечной оболочке мочевого пузыря в основной группе (рис. 1).
Видна мышечная оболочка мочевого пузыря, с гипертрофированными лейомиоцитами, склеротические массы окружают группы гладкомышечных волокон, замуровывая их.
Фиброзная ткань занимает до 30% объема мышечного слоя – против 5–10% в контрольной группе (рис. 2).
Видна мышечная оболочка мочевого пузыря, преимущественно сохранного вида, склеротические массы в небольшом количестве, расположены диффузно в виде тонких прослоек между пучками мышечных волокон. Лейо-миоциты со слабо выраженной гипертрофией.
Также у пациентов с ДГПЖ и ГАМП, отмечается выраженная и умеренно выраженная гипертрофия лейомио-цитов: смещение ядерно-цитоплазматического соотношения в сторону цитоплазмы и уменьшение площади
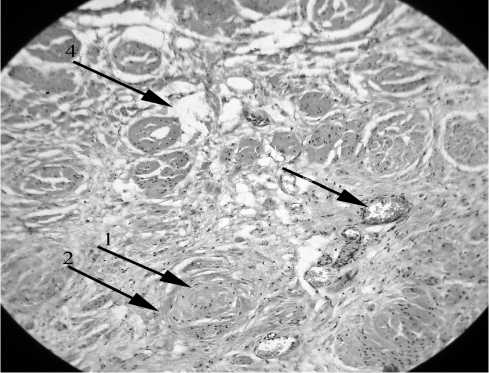
Рис. 1. Опытный мочевой пузырь, окраска по Ван-Гизону, увеличение 15х20. Стрелки: №1 – гипертрофированные лейоми-оциты с пузырьковидным ядром, обильной гомогенной цитоплазмой; №2 – фиброзная ткань, замуровывающая группы лей-омиоцитов; №3 – полнокровный расширенный артериальный сосуд; №4 – отек интерстиция отечная жидкость не окрашивается, раздвигает стромальные структуры, за счет чего определяются “пустоты” в препарате
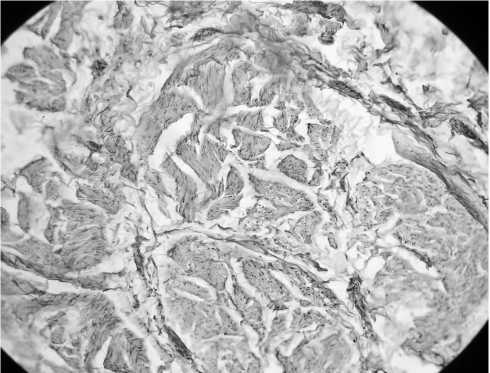
Рис. 2. Контрольный мочевой пузырь, окраска по Ван-Гизону, увеличение 15х20
мышечной ткани. Вследствие этого возрастает внутреннее сопротивление сокращениям мочевого пузыря за счет наличия мощного фиброзного каркаса, на деформацию
которого, при сокращении, необходимо тратить большие усилий. Отек и полнокровие мышечной оболочки статистически значимо более выражены в группе пациентов с ДГПЖ и ГАМП, что может быть проявлением действия нейроэндокринных механизмов постоянной активации лейомиоцитов и нервных окончаний за счет гиперактивности мочевого пузыря.
Выводы
-
1. Клиническая картина ДГПЖ всегда сопряжена с симптомами ГАМП.
-
2. Симптомы ГАМП при ДГПЖ почти в половине случаев купируются применением α -адреноблокатора, при недостаточной эффективности их к лечению добавляется М-холиноблокатор.
-
3. Комбинация тамсулозина (омник) и оксибутинина (дриптан) дает наибольший терапевтический эффект в отношении ГАМП и сужает круг показаний для оперативного лечения ДГПЖ.
-
4. Отличительными чертами морфологического строения детрузора при ГАМП с ДГПЖ являются: отек и полнокровие мышцы, увеличение площади склеротической ткани, уменьшение количества и гипертрофия лейомиоцитов, уменьшение их ядерно-цитоплазма-тического отношения за счет увеличения цитоплазматического компонента, а также уменьшения площади их ядер.
Список литературы Оценка эффективности лечения гиперактивности мочевого пузыря и анализ морфологических особенностей детрузора у больных доброкачественной гиперплазией предстательной железы
- Лоран О.Б., Вишневский А.Е., Секамова С.М. Ультраструктурное исследование детрузора у больных доброкачественной гиперплазией предстательной железы.//Урология и Нефрология. -1996. -№4. -C. 27-31.
- Мазо Е.Б., Чепуров А.К., Кривобородов Г.Г., Тарасова Е.В.,Маленко В.П. Фармакопрофилометрия с -адреноблокаторами в диагностике динамической инфравезикальной обструкции в зоне пузырно уретрального сегмента//Урология. -1998.
- Аль-Шукри С.X., Ткачук В.Я., Горбачев А.Г., Кузьмин И.В., Амдий Р.Э., Козлов В.В. Уродинамические исследования в диагностике инфравезикальной обструкции у мужчин//Урология. -1998. -С. 27-32.
- Аль-Шукри С.X., Амдий Р.Э. Значение комбинированного уродинамического обследования больных с неудовлетворительными результатами оперативного лечения аденомы предстательной железы. Урология. -2006. -№4, С. 11-13.
- Abrams P., Cardozo L., Fall M., Griffiths D. et al. The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub committee of the International Continence Society//Neurourol. Urodyn. -2002. -Vol.21. -P. 167-178.


