Оценка эффективности процесса биосинтеза этанола дрожжами рода Saccharomyces
Автор: Калинина Ирина Валерьевна, Фаткуллин Ринат Ильгидарович, Попова Наталия Викторовна, Шарипова Альбина Раяновна
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 4 т.6, 2018 года.
Бесплатный доступ
Этиловый спирт как сырьевой компонент или основной продукт широко используется в различных отраслях пищевой промышленности, в том числе для изготовления ликеро-водочных изделий (60 %), крепления вин (17 %), получения пищевого уксуса, ароматических и парфюмерно-косметических изделий. Он также широко применим для получения экстрактов, дезинфицирующих препаратов. Технология спирта основана на процессах сбраживания углеводсодержащего сырья в этанол микроорганизмами. В качестве основного продуцента этанола преимущественно используют производственные расы дрожжей рода Saccharomyces. К спиртовым расам дрожжей предъявляются достаточно жесткие требования по показателям бродильной активности; степени сбраживания углеводов устойчивости к продуктам собственного обмена (особенно к этанолу). Эффективное развитие технологии спирта в значительной степени связано с успехами прикладных исследованиях, в том числе в конкретных процессах спиртового производства. Целью настоящего исследования стало изучение технологических свойств двух производственных рас дрожжей Saccharomyces cerevisiae S-04 и Saccharomyces uvarum (Carlsbergensis) для биосинтеза этанола в сопоставлении с физиологией клеток и их жизнеспособностью. Исследования дрожжей проводились как в условиях использования их в сухом виде, так и в регидратированном. Представлены результаты микроскопии окрашенных и неокрашенных препаратов дрожжей. Приведен анализ бродильной активности, оцененной по экспресс-методики, и в модельных условиях брожения на пивном сусле. Полученные результаты показали, что исследуемые штаммы дрожжей принципиально отличаются по своей бродильной активности. Было установлено различное влияние процесса регидратации на дрожжи: для Saccharomyces uvarum (Carlsbergensis) этот процесс имел положительный эффект, тогда как бродильная активность Saccharomyces cerevisiae S-04 при регидратации снизилась. Было установлено значительное расхождение между результатами оценки бродильной активности экспресс-методом и на сусле.
Биосинтез этанола, дрожжи, бродильная активность
Короткий адрес: https://sciup.org/147233253
IDR: 147233253 | УДК: 663.12+663.45 | DOI: 10.14529/food180410
Текст научной статьи Оценка эффективности процесса биосинтеза этанола дрожжами рода Saccharomyces
Этанол, как исходное соединение, широко применяется во многих сферах, включая химическую промышленность, пищевые технологии, медицину, биотехнологии. Он выполняет роль растворителя, экстрагента, антифриза или используется в процессах дальнейшего синтеза. Активно развивается направление использования этанола в качестве топлива в двигателях внутреннего сгорания.
Крупномасштабное промышленное получение этанола развито или развивается во многих странах.
Сырьем для производства спирта служат разнообразные растительные материалы, содержащие в достаточном количестве сбраживаемые сахара или другие углеводы, которые можно осахарить. Наиболее широко используются крахмалосодержащие материалы -картофель, зерно (рожь, пшеница, кукуруза, ячмень, овес, просо), сахаросодержащие ма- териалы - меласса, дефектная сахарная свекла, а также древесина и отходы сельскохозяйственных растений. В качестве продуцента этанола преимущественно используют Sac-charomyces cerevisiae [4, 7, 8, 16, 17].
К спиртовым расам дрожжей предъявляются достаточно жесткие требования: они должны обладать высокой бродильной активностью; быстро и полностью сбраживать сахара, а также использовать другие компоненты питательной среды в анаэробных условиях, быть устойчивыми к продуктам собственного обмена (особенно к этанолу), хорошо противостоять развитию инфекций. Кроме того, они должны обладать способностью переносить высокие концентрации сухих веществ, и, по возможности, сбраживать разные виды углеводов, в том числе рафинозу, галактозу и декстрины [15, 17, 20].
В последние годы ведутся активные работы в области биотехнологии, направленные на селекцию рас дрожжей с заданными производственными характеристиками. Исключительный интерес биотехнологов к дрожжам связан с особенностями их метаболизма. Наличие двух путей энергетического обмена у дрожжей – анаэробного (гликолиза) и оксидативного, – каждый из которых может быть реализован в отдельности, а также протекать одновременно, легло в основу получения продуктов брожения, в частности пива, и биомассы хлебопекарных дрожжей.
Для создания высокоэффективных пищевых технологий, в частности технологии биосинтеза этанола, необходимо знать особенности физиологии и метаболизма дрожжей. Основываясь на этих знаниях, возможна максимальная реализация потенциала дрожжей в целях повышения эффективности процесса накопления желаемых продуктов метаболизма в любой отрасли биотехнологии, где используются дрожжи, в частности в биосинтезе этанола, производстве витаминов, пивоварении, виноделии и других отраслях [1–3, 9].
В бродильных производствах в последние годы активно применяются сухие дрожжи. Они весьма перспективны для предприятий малой производительности, которые не располагают необходимым оборудованием для разведения чистой культуры дрожжей, поэтому используют препараты активных сухих дрожжей. Однако жизнеспособность таких дрожжей зачастую снижена, и количество мертвых клеток существенно превышает требуемый уровень.
Кроме того, в процессе брожения дрожжевые клетки сталкиваются с различными стрессами (рис. 1), включая высокую осмолярность, вызванную углеводными субстратами, повышенную концентрацию самого этанола, реакционноспособные кислородные виды кислорода и повышенную температуру.
Осмотический стресс, вызванный высокими концентрациями сахара в ферментационном стартере, является основным стрессом, с которым сталкиваются дрожжевые клетки во время процесса брожения этанола. При воздействии осмотического шока дрожжевые клетки быстро теряют внутриклеточную воду, что приводит к потере давления тургора с последующей усадкой клеток. Таким образом, плазматическая мембрана является основной целью повреждения, вызванного гиперосмолярностью.
Основными мишенями этанола в дрожжевых клетках считаются клеточные мембраны, особенно плазматическая мембрана. Сам этанол нарушает плазматическую мембрану путем интеркалирования в гидрофильный интерьер липидного бислоя, что приводит к потере целостности мембраны и увеличению ее проницаемости [11, 14, 17, 18].
Окислительный стресс – это состояние, которое возникает в результате дисбаланса внутриклеточного проокислителя/антиок-сиданта в пользу прооксидантов. Наиболее распространенными внутриклеточными прооксидантами являются реакционно-способные виды кислорода, которые представляют собой различные молекулы, полученные из кислорода, содержащие один или несколько неспаренных электронов. РОС являются токсичными и могут привести к повреждению нескольких клеточных компонентов, включая белки, липиды и ДНК.
Во время промышленной ферментации этанолом повышенная температура ферментации за пределами оптимального диапазона может влиять на метаболизм и жизнеспособность дрожжей, что приводит к снижению производительности этанола. Тепловой стресс значительно нарушает стабильность белков, ферментов, мембран и структур цитоскелета, что приводит к дисфункции белка, метаболическим дисбалансам и клеточному коллапсу [15, 17–20].
Несмотря на то, что производство этанола путем дрожжевого биосинтеза представляет собой крупнейшую из всех глобальных биотехнологий, эксплуатируемых человечеством на протяжении тысячелетий, многие аспекты алкогольной ферментации до сих пор остаются плохо понятыми.
Целью настоящего исследования стало изучение технологических свойств двух образцов сухих дрожжей Saccharomyces для биосинтеза этанола в сопоставлении с физиологией клеток и их жизнеспособностью.
Объекты и методы исследований
В качестве объектов исследования были выбраны:
Образец 1 – сухие пивные дрожжи производителя Fermentis Safale, производственная раса Saccharomyces cerevisiae S-04 вида Sac-charomyces cerevisiae , верхового брожения, предназначены для производства пива типа эль.
Образец 2 – сухие пивные дрожжи производителя «BREWFERM LAGER», производственная раса Saccharomyces uvarum (Carls- зовавшегося этанола определяли с применением экспресс-анализатора «Колос». Сусло готовили путем осахаривания ячменного со-
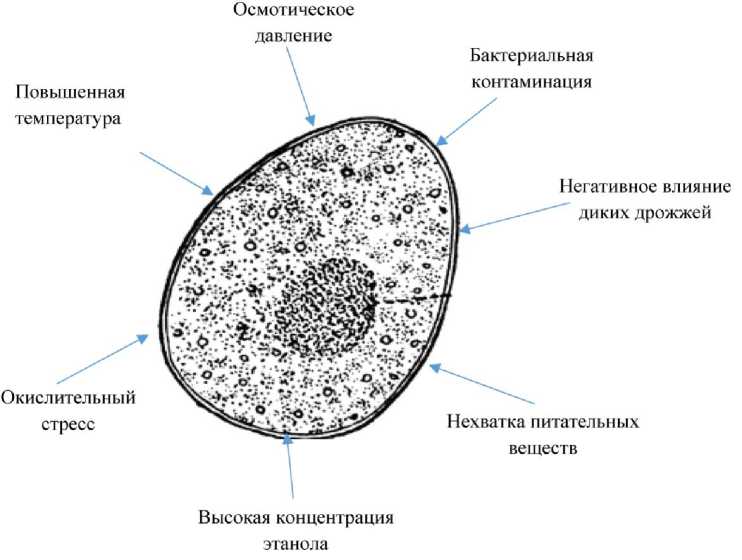
Рис. 1. Факторы, негативно влияющие на дрожжевые клетки в процессе биосинтеза этанола [19, 20]
bergensis), рода Saccharomyces, низового брожения, предназначены для производства пива типа лагер.
Исследование бродильной способности дрожжей оценивалось как в сухом, так и в ре-гидратированном виде по следующей номенклатуре показателей [10]:
-
– морфология дрожжей и чистота культуры микроскопированием. Готовился препарат неокрашенный «раздавленная капля» и окрашенный раствором Люголя;
-
– бродильная активность экспресс-методом с использованием питательной среды YP (8×2 % пептона, 8×2 % дрожжевого экстракта);
– оценка эффективности биосинтеза этанола в процессе сбраживания сусла (бродильная активность на сусле). Проводили путем оценки количества накопленного этанола после брожения в течение 24 часов в аэробных и анаэробных условиях при температуре 27 °С. Экстрактивность используемого сусла составила 11 %. Дрожжи вносили в количестве 0,1 г или 1 мл на 200 сл сусла. Количество обра-
- лода. Использовали сусло с содержанием сухих веществ 11 %.
Регидратация дрожжей осуществлялась в режиме: разведение в дистиллированной воде температурой 30–40 °С, гидромодуль 1:10 и время 10 минут.
Результаты и обсуждение
Культурные дрожжи должны быть стойкими к инфицированию. Загрязнение чистой культуры дрожжей может быть обусловлено рядом причин, среди которых неправильное ведение технологического процесса, несоблюдение санитарного режима при отделении чистых культур; недостаточно тщательная дезинфекция оборудования и коммуникаций и т. д.
Наиболее часто среди сопутствующих микроорганизмов обнаруживаются молочнокислые, уксуснокислые бактерии и дикие дрожжи, которые, так же как и культурные дрожжи, используют сахара питательной среды в качестве основного источника питания, что снижает выход спирта. Эти микроорганизмы образуют органические кислоты и дру- гие продукты, которые могут отрицательно влиять на бродильную активность культурных дрожжей [5, 8, 15, 19].
При контроле культуры дрожжей основным методом исследования является микроскопирование . При микроскопировании дрожжевой суспензии оценивают морфологическое состояние дрожжей, присутствие почкующихся клеток, мертвых клеток, наличие посторонних микроорганизмов, содержание в дрожжах запасных питательных веществ (гликогена и волютина).
В дрожжах хорошего качества морфологическое состояние должно быть удовлетворительным. Содержание почкующихся клеток более 50 %, количество дрожжей, содержащих гликоген, должно быть не менее 70^75 %; количество мертвых клеток не должно превышать 5 % [4, 13, 15].
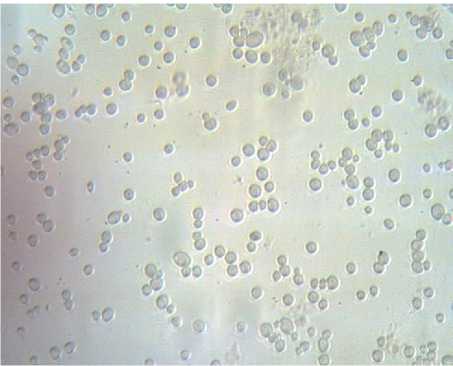
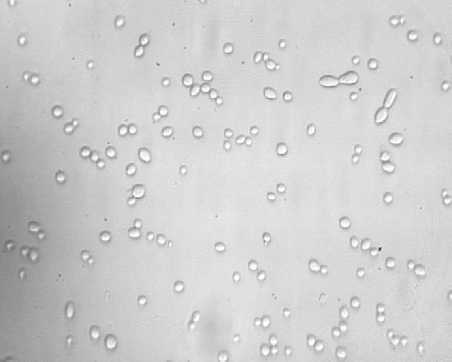
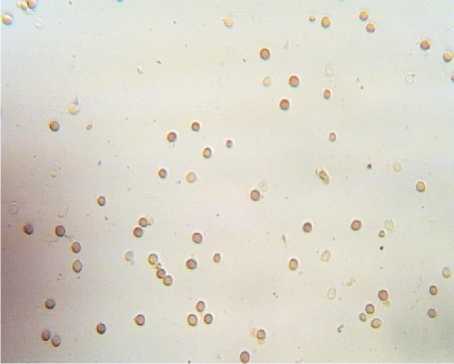
В рамках исследований физиологическое состояние дрожжей определяли путем микроскопирования неокрашенного препарата и окрашенного (рис. 2).
Известно, что количество гликогена в клетках дрожжей меняется как от их возраста, так ив зависимости от условий культивирова- ния. В зрелых клетках гликоген занимает от 1/3 до 2/3 клетки и более. В клетках с низкой физиологической активностью окрашенный гликоген занимает менее 1/4 клетки. В молодых клетках гликоген отсутствует и при окрашивании раствором йода клетки приобретают бледно-желтый цвет [2, 6, 12].
Результаты микроскопии показали, что исходное состояние дрожжевых суспензий было близким. Исследуемые дрожжи имели овальную форму, клетки дрожжей Saccharo-myces uvarum отличались несколько большими размерами, чем клетки Saccharomyces cerevisiae S-04.
Количество почкующихся клеток для образца Saccharomy cesuvarum составило 20 %, тогда как для образца Saccharomyces cere-visiae S-04 - 32 % (при подсчете 10 полей зрения).
Окраска суспензий дрожжей йодсодержащим раствором показала, что в суспензии дрожжей Saccharomyces cerevisiae S-04 превалировали дрожжи зрелые (окрашенные в коричневый цвет), клетки дрожжей Saccharomy-ces uvarum можно было отнести к молодым (отмечалось преимущество клеток со светло-
а-1
б-1
а-2
Рис. 2. Результаты микроскопии дрожжей (×600): а – образец 1; б – образец 2
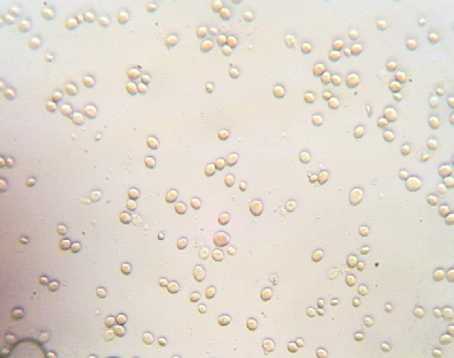
б-2
желтой окраской).
Для оценки жизненной силы и бродильной активности дрожжей использовали подход определения количества углекислоты, выделенного изучаемыми дрожжами в анаэробных условиях за 1 ч (рис. 3).Образование СО 2 определяется через увеличение давления в закрытых сосудах.
Известно, что в дрожжевой клетке диссимиляция сахара может происходить либо аэробным путем за счет дыхания, либо анаэробным путем за счет брожения. В рамках биотехнологического процесса дрожжевого синтеза этанола наиболее предпочтителен второй путь [8, 12, 16].
Полученные результаты показали, что исследуемые образцы дрожжей характеризуются разным уровнем бродильной активности по накоплению диоксида углерода. При использовании дрожжей в сухом виде, согласно рекомендациям производителя, бродильная активность дрожжей Saccharomyces uvarum составила 3,8 %, тогда как дрожжей Saccharo-myces cerevisiae S-04 – 3,6 %, что на 5 % ниже. Полученные результаты в целом согласуются с оценкой физиологического состояния дрожжей. Количество зрелых и почкующихся
Исследования, представленные в литературе, показывают, что жизнеспособность сухих дрожжей зачастую снижена, и количество мертвых клеток существенно превышает требуемый уровень. Внесение сухих дрожжей непосредственно в сусло зачастую приводит к гибели значительного количества клеток (до 30 % и выше).
За 5–10 мин процесса регидратации восстанавливается первоначальное состояние клеточных структур. Затем наступает фаза реактивации, при которой происходит восстановление функций клеточных органелл и ферментной активности. Некоторые клеточные структуры при высушивании повреждаются и, если эти повреждения обратимы, то при реактивации происходит их восстановление [9, 11, 14].
Вместе с тем, необходимо учитывать, что бродильная активность дрожжей во многом определяется их ферментативной активностью и может значительно варьировать в зависимости от состава сбраживаемой среды. Способность дрожжей сбраживать различные виды углеводов является их несомненным технологическим преимуществом. Большинство существующих
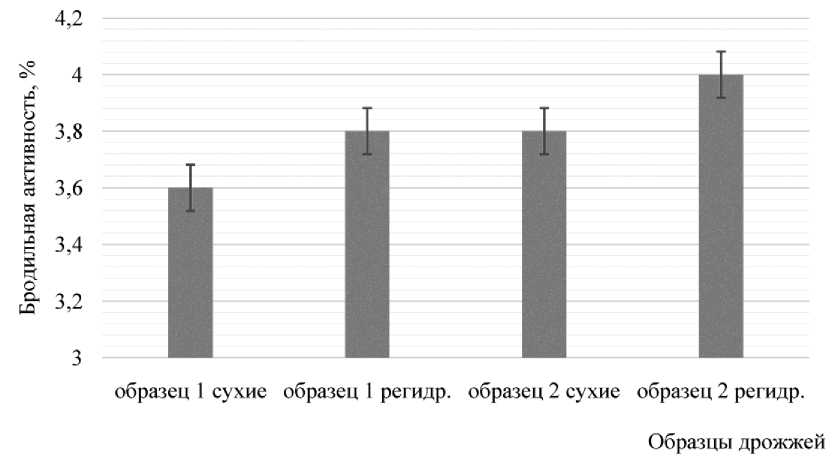
Рис. 3. Бродильная активность исследуемых образцов дрожжей (экспресс-метод), %
клеток для образца Saccharomyces cerevisiae S-04 было выше.
Процесс регидратации дрожжей оказал положительное влияние на бродильную активность обоих образцов, прирост бродильной активности составил в среднем 5 %.
в настоящее время штаммов дрожжей способны сбраживать глюкозу, фруктозу, маннозу и галактозу, причем скорость сбраживания различных сахаров принципиально различается.
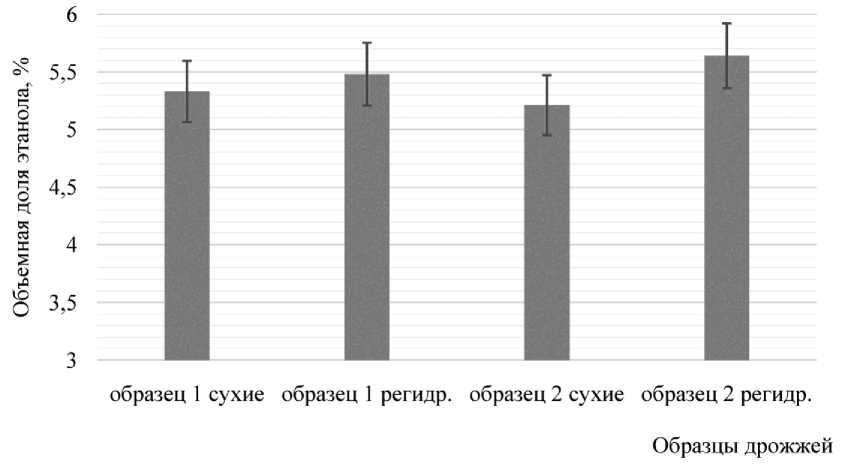
Рис. 4. Бродильная активность исследуемых образцов дрожжей (на сусле), %
Основными продуктами гидролиза крахмала в сусле являются глюкоза, мальтоза, мальтотриоза, олигосахариды с числом гликозидных остатков более трех, а также а-1,4 (неразветвленные) и а-1,6 (разветвленные) декстрины.
Полученные результаты показали, что наиболее высокой бродильной активностью по отношению к ячменному суслу отличались дрожжи Saccharomyces cerevisiae S-04 при варианте их внесения в сухом виде. Количество накопленного этанола составило 5,33 об. %. При внесении данных дрожжей в ре-гидратированном виде бродильная активность Saccharomyces cerevisiae S-04 дрожжей увеличилась на 2,8 %, а для дрожжей Saccharomyces uvarum - на 8,3 %. Такие результаты могут быть связаны с тем, что регидратация способствует восстановлению функций клеток дрожжей, определяющих их бродильную активность. Сопоставление результатов оценки бродильной активности двумя методами показало некоторое расхождение, что может быть определено значительным количеством факторов и требует дополнительного анализа.
Заключение
Таким образом, представленные материалы свидетельствуют о том, что бродильная активность спиртообразующих дрожжей определяется огромным количеством воздействующих факторов. Для обеспечения эффективного протекания процесса биосинтеза этанола важно отслеживать исходное состояние дрожжей, их жизнеспособность, чистоту, бродильную активность, учитывать состав сбраживаемой среды, условия протекания процесса брожения.
Одним из перспективных подходов может быть и поиск эффективных методов воздействия на микроорганизмы или сбраживаемый субстрат с целью увеличения бродильной активности, доступности питательных веществ, что и является предметом будущих исследований.
При таксономическом описании дрожжей в данной работе использовалась терминология, принятая при характеристики систематики дрожжей Бабьевой И.П. (Бабьева И.П., Чернов И.Ю. Биология дрожжей. М.: Товарищество научных изданий КМК. 2004. 221 с.).
Статья выполнена при поддержке Правительства РФ (Постановление №211 от 16.03.2013 г.), соглашение № 02.A03.21.0011 и при финансовой поддержке государственных заданий № 40.8095.2017/БЧ (2017123-ГЗ) и № 19.8259.2017/БЧ и гранта РФФИ 18-53-45015.
Список литературы Оценка эффективности процесса биосинтеза этанола дрожжами рода Saccharomyces
- Бабьева, И.П. Биология дрожжей / И.П. Бабьева, И.Ю. Чернов. - М.: Изд-во МГУ, 2004. - 239 с.
- Баева, А.А. Методы исследования свойств сырья и готовой продукции / А.А. Баева. - Владикавказ, 2010. - 67 с.
- Бартенев, Ю.С. Влияние величины засева дрожжей и температуры на процесс брожения и образования высших спиртов: автореф. … канд. техн. наук. - М.: МТИПП, 1973. - 32 с.
- Бекер, М.Е. Анабиоз микроорганизмов / М.Е. Бекер, Б.Э. Дамберг, А.И. Рапопорт. - Рига.: Зинатне, 1981. - 253 с.
- Бирюзова, В.И. Ультраструктурная организация дрожжевой клетки / В.И. Бирюзова. - М.: Наука, 1993. - 224 с.
- Борисова, С.В. Использование дрожжей в промышленности / С.В. Борисова, О.А. Решетник, З.Ш. Мингалеева. - СПб.: ГИОРД, 2008. - 216 с.
- Кретова, Ю.И. Актуальные аспекты обеспечения качества сырьевых компонентов в технологии производства напитков / Ю.И. Кретова, И.В. Калинина // Вестник Воронежского государственного университета инженерных технологий. - 2017. - Т. 79, № 1 (71). - С. 169-177.
- DOI: 10.20914/2310-1202-2017-1-169-177
- Клунова, С.М. Биотехнология / С.М. Клунова, Т.А. Егорова, Е.А. Живухина. - М.: Издат. центр «Академия», 2010. - 256 с.
- Кузьмина, С.С. Методы исследования свойств сырья и готовой продукции / С.С. Кузьмина. - Барнаул: АлтГТУ, 2008. - 103 с.
- Меледина, Т.В. Физиологическое состояние дрожжей: учебное пособие / Т.В. Меледина, С.Г. Давыденко, Л.М. Васильева. - СПб.: НИУ ИТМО; ИХиБТ, 2013. - 48 с.
- Оганесянц, Л.А. Технология безалкогольных напитков / Л.А. Оганесянц, А.Л. Панасюк, М.В. Гернет. - СПб.: ГИОРД, 2012. - 344 с.
- Палагина, К.К. Технологические расчеты дрожжевого производства / К.К. Палагина. - М.: Пищевая промышленность, 2008. - 54 с.
- Семихатова, Н.М. Производство дрожжей: учебное пособие / Н.М. Семихатова, М.В. Малыгина, С.П. Папок. - М.: Пищевая промышленность, 1967. - 155 с.
- Устинова, А.С. Влияние углеводного состава высококонцентрированного ячменного сусла на бродильную активность спиртовых дрожжей / А.С. Устинова, Н.В. Баракова, Е.В. Борисова // Производство спирта и ликероводочных изделий. - 2013. - № 3. - С. 37-40.
- Siderius M., Van Wuytswinkel O., Reijenga K.A., Kelders M., Mager W.H. The control of intracellular glycerol in Saccharomyces cerevisiae influences osmotic stress response and resistance to increased temperature // Mol. Microbiol. - 2000. - V. 36. - P. 1381-1390.
- Pahlman A.K., Granath K., Ansell R., Hohmann S., Adler L. The yeast glycerol 3-phosphatases Gpp1p and Gpp2p are required for glycerol biosynthesis and differentially involved in the cellular responses to osmotic, anaerobic, and oxidative stress // J. Biol. Chem. - 2001. - V. 276. - P. 3555-3563.
- Hounsa C.G., Brandt E.V., Thevelein J., Hohmann S., Prior B.A. Role of trehalose in survival of Saccharomyces cerevisiae under osmotic stress // Microbiology. - 1998. - V. 144. - P. 671-680.
- Apweiler E., Sameith K., Margaritis T., Brabers N., van de Pasch L., Bakker L.V., van Leenen D., Holstege F.C., Kemmeren P. Yeast glucose pathways converge on the transcriptional regulation of trehalose biosynthesis // BMC Genomics. - 2012. - V. 13. - P. 239.
- Alexandre H., Rousseaux I., Charpentier C. Ethanol adaptation mechanisms in Saccharomyces cerevisiae // Biotechnol. Appl. Biochem. - 1994. - V. 20 (Pt 2). - P. 173-183.
- Stanley D., Bandara A., Fraser S., Chambers P.J., Stanley G.A. The ethanol stress response and ethanol tolerance of Saccharomyces cerevisiae // J. Appl. Microbiol. - 2010. - V. 109. - P. 13-24.


