Оценка эффективности выделения ДНК из разных частей растений рыжика посевного Camelina sativa (L.) Crantz
Автор: Рамазанова С.А., Логинова Е.Д.
Рубрика: Селекция, семеноводство и биотехнология сельскохозяйственных растений
Статья в выпуске: 2 (202), 2025 года.
Бесплатный доступ
В статье представлены результаты оценки эффективности выделения ДНК из различных частей растений рыжика посевного (Camelina sativa (L.) Crantz) с использованием автоматизированной станции. Цель работы заключалась в адаптации метода экстракции ДНК для получения достаточно качественной ДНК, пригодной для молекулярногенетических исследований, таких как ПЦР и генетическая паспортизация. В качестве растительного материала использовались сухие семена, 7дневные проростки и листья рыжика посевного. Выделение ДНК проводили с применением набора реагентов на основе магнитных частиц и автоматической станции. Качество и количество ДНК оценивали с помощью спектрофотометрии и электрофореза в агарозном геле, а её пригодность для ПЦР проверяли с использованием SSRмаркеров. Результаты показали, что наибольший выход ДНК с наименьшим загрязнением был достигнут при выделении из листьев. Однако, несмотря на низкую чистоту образцов, полученных из семян и проростков, все они оказались пригодными для ПЦРанализа. Для экспрессдиагностики и генетической паспортизации наиболее удобным материалом являются семена, так как они доступны в больших количествах и не требуют дополнительной подготовки. Исследование подтвердило эффективность автоматизированного метода выделения ДНК для генетических исследований рыжика посевного, что особенно важно для масштабных проектов по изучению генетического разнообразия.
Рыжик посевной, Camelina sativa (L.) Crantz, ДНК, генетическое разнообразие, SSR-маркеры, микросателлиты, автоматизированное выделение ДНК, ПЦР
Короткий адрес: https://sciup.org/142244909
IDR: 142244909 | УДК: 633.85:577.21 | DOI: 10.25230/2412-608X-2025-2-202-27-31
Текст научной статьи Оценка эффективности выделения ДНК из разных частей растений рыжика посевного Camelina sativa (L.) Crantz
Введение. Выделение ДНК из растительных тканей является важным этапом для проведения молекулярно-генетических исследований, таких как ПЦР, секвенирование, генетическая паспортизация и анализ генетического разнообразия. Однако этот процесс часто сопровождается рядом трудностей, связанных с особенностями растительных клеток. В первую очередь наличием у растений плотной клеточной стенки, состоящей из целлюлозы, гемицеллюлозы, пектинов и во многих случаях лигнина, что затрудняет высвобождение ДНК. Также растительные клетки содержат большое количество вторичных метаболитов, таких как полифенолы, танины и алкалоиды, которые могут связываться с ДНК и ингибировать её выделение [1].
Выбор ткани для выделения ДНК из растений зависит от нескольких факторов, включающих цель исследования, доступность материала и содержание вторичных метаболитов, которые могут влиять на качество выделенной ДНК. Например, выделение ДНК из проростков имеет ряд преимуществ. Проростки содержат активно делящиеся клетки, что облегчает выделение ДНК. В проростках меньше вторичных метаболитов по сравнению с листьями, что снижает риск загрязнения ДНК. Однако листья могут быть собраны в любое время вегетационного периода, а для получения проростков рыжика необходимо дополнительное время [2-4].
Выделение ДНК из семян, а особенно с высокой масличностью, таких как семена подсолнечника, сои, рапса, рыжика посевного и других масличных культур, представляет собой более сложную задачу из-за высокого содержания липидов, полисахаридов и вторичных метаболитов. Эти компоненты могут существенно затруднять процесс выделения ДНК, снижая её качество и пригодность для последующих молекулярных анализов. Липиды, например, образуют эмульсии с водными растворами, что затрудняет разделение фаз во время экстракции, и они могут связываться с ДНК, снижая её чистоту и выход [1; 3]. А при недостаточной очистке липиды могут загрязнять препараты ДНК, что приводит к ингибированию фермента ДНК-полимеразы, используемой для ПЦР [4]. Целлюлоза и пектины, присутствующие в клеточных стенках семян, образуют вязкие растворы, что тоже затрудняет экстракцию ДНК [5]. Они могут связываться с ДНК, образуя комплексы, которые также ингибируют ДНК-полимеразу. Полифенолы и танины могут окисляться и связываться с ДНК, что приводит к её деградации и снижению качества. Они тоже образуют комплексы с ДНК, что усложняет её выделение и очистку, и ингибируют ДНК-полимеразу [3–6]. Помимо вышеперечисленного, семена рыжика посевного имеют плотную структуру, препятствующую разрушению клеточных стенок и высвобождению ДНК.
Генетическая паспортизация, основанная на анализе полиморфизма ДНК, предполагает проведение большого количества анализов. Поэтому метод выделения ДНК должен быть высокопроизводительным и по возможности автоматизированным. Классические методы выделения ДНК на основе ЦТАБ (цетилтриметиламмоний бромида) позволяют получать чистые и концентрированные препараты. Однако они довольно длительны, трудоемки и опасны для здоровья, так как предполагают использование высокотоксичных летучих веществ (хлороформа и изоамилового спирта и меркаптоэтанола) [2; 7].
В настоящее время разработаны приборы для автоматического и полуавтоматического выделения ДНК. Например, с помощью станций для выделения и очистки нуклеиновых кислот и в зависимости от комплектации можно провести выделение 12–96 образцов за один запуск прибора.
Однако для каждой культуры необходим подбор индивидуального протокола выделения ДНК из-за различий в химическом составе, структуре тканей, содержании вторичных метаболитов и целей исследования. Использование универсального протокола может привести к низкому качеству ДНК, её деградации или ингибированию при последующих молекулярных анализах [8].
Поэтому целью исследования являлась адаптация метода экстракции ДНК из рыжика посевного на автоматической станции для получения высококачественной ДНК, пригодной для молекулярно-генетических исследований.
Материалы и методы. Работу проводили в 2025 г. в лаборатории молекулярногенетических исследований ФГБНУ ФНЦ ВНИИМК. Материалом для исследования служили разные части растений яровой формы рыжика посевного сорта Омич (ФГБНУ ФНЦ ВНИИМК): сухие семена; 7-дневные проростки и листовые пластинки настоящих листьев. Выделение ДНК проводили с использованием набора реагентов для экстракции ДНК Магно-Прайм ФИТО (ООО «НекстБио», РФ) на станции автоматического выделения и очистки нуклеиновых кислот Auto-Pure 96 (Allsheng, КНР). Предварительно весь растительный материал измельчали с помощью гомогенезатора KZ-III-FP (Servicebio, КНР). Определение качества и количества выделенной ДНК осуществляли на микроспектрофотометре Nano-300 (Allsheng, КНР) в трехкратной повторности на основании измерения оптической плотности раствора при длине волны 260 нм для НК, 280 – белков и фенолов, 230 – других органических соединений. Оптимальным соотношением оптических плотностей, полученных при А260/280 нм и А260/230 нм, считалось от 1,8 до 2 и от 1,8 до 2,2 соответственно. Дополнительно качество ДНК оценивали методом электрофореза в 1 % агарозном геле, который проводили в камере горизонтального электрофореза SE-2 (Хеликон, РФ) при силе тока 90 mA и напряжении 180 V в течение 30 мин. Гель окрашивали бромистым этидием (EtBr). Документирование результатов электрофореза обеспечивалось с помощью гель-доку-ментирующей системы GenoSens Touch 2200 (Clinx Science Instruments, КНР). После выделения ДНК с каждым образцом была проведена полимеразная цепная реакция (ПЦР) с парой праймеров Рсh1рL271(FACACCGGTTTTGTAGATTC-GT; R-CAAGTGGACCGCCACTGTAT), один из которых имел флуоресцентную метку TAMRA (НПО «Синтол», РФ), в 25 мкл реакционной смеси, содержащей 2,5 мкл 10x ПЦР-Буфер-Б; 0,2 мM каждого dNTP; по 10 пМ каждого праймера; 100 нг матричной ДНК и 1 ед. SynTaq ДНК- полимеразы (НПО Синтол, РФ). Температурно-временные режимы ПЦР: начальная денатурация – 94 °С – 3 мин, затем 35 циклов: денатурация 94 °С – 30 сек, отжиг праймера при 60 °С – 40 сек, элонгация при 72 °С – 40 сек, финальная элонгация – 5 мин. Эффективность способов выделения определяли по наличию/отсутствию амплификации. Детекция продуктов ПЦР осуществлялась методом капиллярного электрофореза на генетическом анализаторе Нанофор 05 (НПО Синтол, РФ).
Результаты и обсуждение. Изучение генетического разнообразия рыжика посевного Camelina sativa (L.) Crantz предполагает большое количество рутинных анализов в короткие сроки. Поэтому для нашего исследования мы выбрали набор для экстракции ДНК с сорбцией на магнитных частицах для автоматической станции Auto-Pure 96 (Allsheng, КНР). Для генотипирования сортообразцов рыжика ДНК необходимо выделять из каждого растения индивидуально. Как было сказано выше, качество выделенной ДНК играет ключевую роль в обеспечении достоверности результатов ПЦР. Малое количество и высокая степень загрязнения ДНК могут привести к амплификации только одного, более короткого аллеля в гетерозиготах, что проявляется как «выпадение» (dropout) длинного аллеля [9]. В силу того, что семена рыжика отличаются малыми размерами (1,5–2,0 мм), а масса 1000 семян составляет всего 1,0–1,1 г, возникла необходимость оценить, возможно ли получить достаточное количество ДНК из одного семени с применением вышеуказанного метода выделения. В целях оценки его эффективности в исследование были включены и другие части растения рыжика посевного.
Качество выделенной ДНК было оценено методом электрофореза в 1 % агарозном геле. Результаты электрофореза продемонстрировали, что ДНК, выделенная из проростков и листьев, обладает приемлемым качеством и содержит крупные фрагменты ДНК. Об этом свидетельствует наличие на фореграмме чётких фраг- ментов без ярко светящихся шлейфов (дорожки 1–8, рис.). Однако в образцах, выделенных из семян (дорожки 9–12, рис.), фрагменты были слабо светящимися или не визуализировались вовсе.
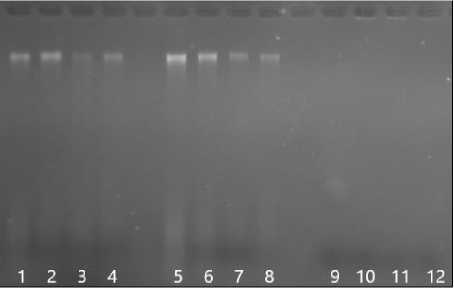
Рисунок – Электрофореграмма ДНК в 1 % агарозном геле, выделенной из разных частей растений рыжика посевного:
Дорожки 1–4 – из семидневных проростков, 5–8 – из листьев, 9–12 – из семян
В результате проведённых измерений концентрации ДНК на микроспектрофотометре было выявлено, что наибольшее количество ДНК было экстрагировано из листьев рыжика. Концентрация ДНК варьировалась от 120,83 нг/мкл до 136,686 нг/мкл, а среднее значение составило 133,17 нг/мкл. Образцы ДНК, выделенные из проростков и семян растений рыжика, имели значительно меньшую концентрацию – в среднем 28,45 и 20,81 нг/мкл соответственно (таблица).
Показатели соотношения А260/280 были лучшими у образцов ДНК, выделенной из листьев, и варьировались от 1,46 до 2,00, среднее значение составило 1,73. Это свидетельствует о незначительном загрязнении ДНК белками и фенолами. Однако показатели соотношения А260/А230 свидетельствуют об обратном. Только у трех образцов этот показатель находился в диапазоне от 1,8 до 2,2, у остальных он был значительно ниже 1,8, и минимальное значение составило 0,47. Это говорит о сильном загрязнении полученных растворов ДНК полисахаридами. Для образцов ДНК, экстрагированной из проростков и семян, оба показателя были низкими, что указывает на загрязнения как белками, так и полисахаридами (таблица).
Таблица
Качественная и количественная оценка выделенной ДНК по результатам измерения на спектрофотометре
|
Часть растения |
Концентрация* ДНК (нг/мкл) |
A 260/280 |
A 260/230 |
|
Листья |
133,17 ± 10,10 |
1,73 ± 0,19 |
1,33 ± 0,62 |
|
Проростки |
28,45 ± 13,60 |
1,51 ± 0,22 |
1,04 ± 0,70 |
|
Семена |
20,81 ± 7,92 |
1,25 ± 019 |
0,59 ± 0,45 |
* средние значения
Для проверки образцов экстрагированной ДНК на пригодность к ПЦР-анализу были проведены ПЦР с парой праймеров SSR-локуса Рсh1рL271. В каждую реакционную смесь добавляли одинаковое количество ДНК всех групп образцов путем приведения растворов к одной концентрации. Несмотря на низкую степень очистки экстрагированной ДНК, проведение ПЦР показало наличие амплификации во всех образцах. Примеси органических соединений, которые являются ингибиторами ПЦР, не оказали значительного влияния на качество амплификации. Таким образом, для проведения ПЦР-анализа выделение ДНК можно проводить из любого типа растительного материала.
Однако для целей генотипирования, идентификации и паспортизации, в случае необходимости проведения экспресс-ана-лиза, предпочтительно использовать семена рыжика, поскольку они доступны в большом количестве и могут храниться в течение длительного времени без соблюдения специальных условий.
Заключение. Результаты нашего исследования показали, что выделение ДНК из листьев рыжика посевного (Camelina sativa (L.) Crantz) позволяет получить самый высокий выход и чистоту продукта. Для ПЦР-анализа подходит ДНК, экстрагированная из любой части растения рыжика посевного. Несмотря на примеси белков и других органических соединений в растворах, результаты ПЦР-анализа ДНК были удовлетворительными. Использование семян рыжика для выделения ДНК предоставляет возможность проведения экспресс-анализа, за счет исключения этапа проращивания семян. Таким образом, для технологии генетической паспортизации рыжика посевного приемлемой является экстракция ДНК из семян с сорбцией на магнитных частицах при помощи автоматической станции.
Исследование выполнено при финансовой поддержке Кубанского научного фонда в рамках научного проекта № Н-24.1/10.


