Оценка морфологических изменений эритроцитов периферической крови рыб при высоком содержании ионов свинца в водной среде
Автор: Фомина Любовь Леонидовна
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Биологические и сельскохозяйственные науки
Статья в выпуске: 3 (19), 2015 года.
Бесплатный доступ
В работе приводятся результаты морфологического исследования крови карасей (Carassius сarassius L.) и окуней (Perca fluviatilis L.), находившихся в аквариуме с содержанием свинца менее 0,005 мг/дм3 - контрольная группа, в аквариуме с содержанием свинца 1,21 мг/дм3 - опытная группа. При оценке клеток крови учитывались разнообразные деструктивные нарушения эритроцитов.
Рыбы, кровь, воздействие свинца, морфологические изменения эритроцитов, микроядра
Короткий адрес: https://sciup.org/14998811
IDR: 14998811 | УДК: 639.3:574.5.504.453
Текст научной статьи Оценка морфологических изменений эритроцитов периферической крови рыб при высоком содержании ионов свинца в водной среде
Важным средством экологического мониторинга являются биоиндикация и биотестирование – использование для контроля состояния среды некоторых организмов, особо чувствительных к изменениям среды и к появлению в ней вредных примесей.
Комплексная оценка состояния водной биоты, ее прогностическая ценность может быть надежно осуществима на основании детальных характеристик основных компонентов гидробиоценоза: микробиоты, фито- и зоопланктона, фито- и зообентоса, а также – состояния жизненно-важных органов представителей рыб разных экологических групп [2, 4].
Кровь, как наиболее лабильная ткань, быстро реагирует на действие различных экзогенных и эндогенных факторов. Исследование морфологии крови не требует больших материальных затрат, позволяет быстро получить результаты, свидетельствующие о загрязнении водоема, в отличие от других, может быть еще более высокоточных, но достаточно длительных, трудоемких и дорогостоящих методов.
У рыб регистрируются разнообразные деструктивные нарушения в строении эритроцитов, такие как пойкилоцитоз, вакуолизация цитоплазмы, изменения в мембране эритроцитов, уплотнение ядра, микроядра [5, 6]. Уровень цитопатоло-гических изменений структуры ядра может служить индикатором состояния организма рыб, его адаптационных возможностей, а оценить степень воздействия токсикантов на структуру хромосом и выявить генетические изменения у единичной особи или группы особей позволяет учет частоты образования микроядер, микро-ядерный тест [3].
В первой серии экспериментов мы установили, что при загрязнении водоемов ионами свинца выше допустимой концентрации в 5 раз, количество эритроцитов с микроядрами в периферической крови рыб резко увеличивалось на 4-й день эксперимента с 3,44±1,05 % до 6,48±0,72 %. Количество эритроцитов с другими патологическими изменениями также резко возрастало к 4-му дню с 9,44±2,85 % до 89,33±0,67 %, но затем их количество уменьшалось до 61,75±1,82 % [7].
Таким образом, учет частоты встречаемости эритроцитов с патологическими изменениями в периферической крови рыб, в том числе, микроядерный тест, применим для биоиндикации состояния водной среды при загрязнении водоемов ионами свинца выше допустимой концентрации в 5 раз.
Цель работы – оценить влияние высокого содержания ионов свинца (выше допустимой концентрации в 12 раз) в водной среде на морфологию эритроцитов рыб в условиях эксперимента.
Материалы и методы исследования.
Работа выполнена на кафедре анатомии и физиологии факультета ветеринарной медицины и биотехнологий ФГБОУ ВПО ВГМХА имени Н.В. Верещагина. Исследования проводили на карасях (Carassius сarassius L.) и окунях (Perca fluviatilis L.) массой 100-150 г.
Морфологические особенности эритроцитов исследовались у рыб, находящихся в аквариуме с содержанием свинца менее 0,005 мг/дм3 (ПДК – 0,1 мг/дм3) – контрольная группа (n=14), в аквариуме с содержанием свинца 1,21 мг/дм3 – опытная группа (n=6). Кормили рыб дождевыми червями, опарышами, гаммару-сом, дафнией и другими кормами для аквариумных рыб. Забор крови проводился ежедневно шприцем из хвостового гемального канала.
Для окрашивания мазков крови применяли ДИАХИМ-ДИФФКВИК Набор для быстрого дифференцированного окрашивания биопрепаратов.
На препаратах проводился учет эритроцитов с микроядрами (МЯ) и другими патологическими изменениями (ДПИ) [1, 8, 9, 10].
Долю клеток с микроядрами (МЯ %) определяли отношением количества клеток с микроядрами к общему количеству проанализированных эритроцитов. Долю клеток с другими типами патологии ядра (ДПИ) определяли аналогично. Статистическую обработку выполняли, используя программный пакет «Microsoft Excel». Достоверность различий устанавливали, используя критерий Стьюдента.
Результаты и обсуждение.
Количество эритроцитов с микроядрами в крови рыб контрольной группы не превышало уровень, наблюдаемый при спонтанном мутагенезе - 0,25 ±0,11 % (фоновый уровень: 0,5-1,0‰) [6]. Количество эритроцитов с другими патологическими изменениями составило 3,98±0,45 % , р <0,05.
При нахождении окуней и карасей в аквариуме с содержанием свинца 1,21 мг/ дм3 в крови рыб увеличивалось содержание эритроцитов с пойкилоцитозом, протуберанцами, уплотнением ядра, микроядрами.
Количество микроядер в эритроцитах и количество эритроцитов с другими патологическими изменениями у рыб опытной группы резко возрастало на 4-й день эксперимента с 1,84 ± 1,06 до 4,8 ± 1,4% и с 9,5 ± 2,1 до 27,6 ± 8,94 % соответственно (табл. 1).
Таблица 1 – Частота встречаемости клеток с микроядрами и другими нарушениями в эритроцитах крови рыб опытной группы
|
Опытная группа (n=6) |
Эритроциты с микроядрами (МЯ %) |
Эритроциты с другими патологическими изменениями (ДПИ%) |
|
1-й день эксперимента |
2,56±0,33* |
8,8 ± 1,63* |
|
2-й день эксперимента |
2,1 ± 0,69* |
13,32± 6,39 |
|
3-й день эксперимента |
1,84 ± 1,06 |
9,5 ± 2,1* |
|
4-й день эксперимента |
4,8 ± 1,4* |
27,6 ± 8,94* |
|
5-й день эксперимента |
3,12 ± 1,54 |
10,36 ± 5,53 |
|
Среднее по группе |
2,88±0,53* |
13,91±3,51* |
* - разность с контрольной группой достоверна, Р<0,05
На 5-й день количество морфологически измененных эритроцитов уменьшалось, что можно объяснить тяжелым поражением кроветворных органов, прекращением гемопоэза и снижением клеточной адаптации эритроцитов рыб опытной группы (рис 1).
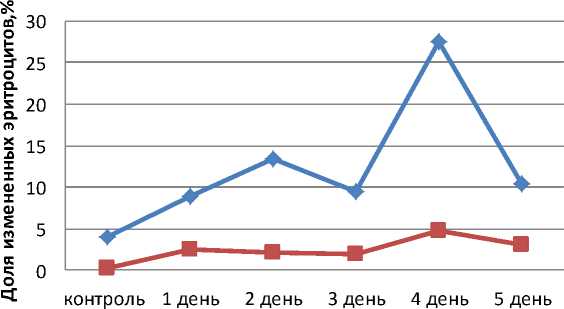
Рис. 1. Динамика изменений эритроцитов в опытной группе
Корреляционный анализ показал среднюю степень корреляции между количеством морфологически измененных эритроцитов и временем нахождения в загрязненной воде у рыб опытной группы. Величина коэффициента корреляции: R±mr=0,51±0,11 для микроядер и 0,35±0,08 для других патологических изменений при р < 0, 01, что значительно ниже уровня корреляции, полученного нами в первой серии экспериментов [7].
При сравнении морфологических изменений крови было замечено, что у окуней (Perca fluviatilis) основные изменения при токсическом воздействии происходят в мембране и цитоплазме эритроцитов, а у карасей (Carassius сarassius L.) в ядре (рис. 2).
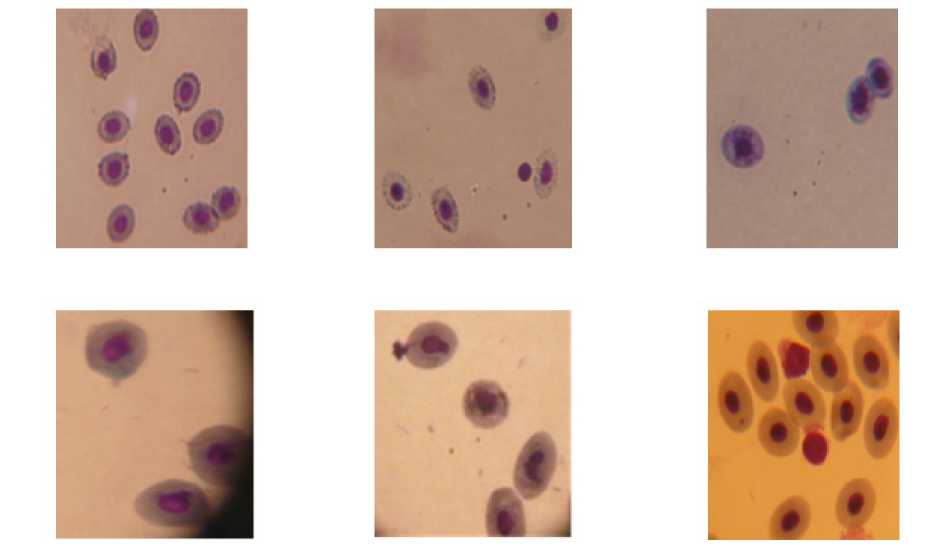
Рис. 2. Верхний ряд – морфологические изменения эритроцитов у окуней (изменения мембраны и цитоплазмы эритроцитов). Нижний ряд – у карасей (изменения ядра, микроядра) (ув. ×1000)
В результате различных ответных реакций на токсическое воздействие, ка- раси оказались более устойчивы к загрязнению свинцом – все особи выжили в аквариуме с высоким содержанием ионов свинца до конца эксперимента. Окуни погибали на 6-7 дни нахождения в загрязненной воде.
Следовательно, можно согласиться с авторами утверждающими, что образование микроядер в клетках может представлять собой компенсаторно-приспособительный процесс и формирование клеток с микроядрами может рассматриваться в качестве показателя развития патологических изменений в структуре эритроцитов под действием повреждающих факторов среды и нарушения цитогенетического гомеостаза [3, 5].
Выводы и предложения.
В результате исследования было выявлено, что часто встречаемыми изменениями эритроцитов рыб, возникающими при воздействии солями свинца, являются разнообразные деструктивные нарушения в строении эритроцитов: пойкилоци-тоз, вакуолизация цитоплазмы, изменения в мембране эритроцитов, изменения в структуре ядер клеток, такие как кариопикноз, хроматинолиз, кариолизис, кари-орексис, деформация ядер, протуберанцы – выросты в виде хроматиновых нитей, что в совокупности ведет к необратимым изменениям функции клетки.
Основные деструктивные нарушения эритроцитов возникали на 4 сутки пребывания рыб в загрязненном аквариуме, что косвенно может указывать на продолжительность гемопоэза у рыб. Интенсивность и скорость нарастания изменений в эритроцитах уменьшалась при повышении степени загрязнения аквариума, что можно объяснить тяжелым поражением кроветворных органов, прекращением гемопоэза и снижением клеточной адаптации эритроцитов рыб второй группы.
Коэффициент корреляции в опытной группе не показал сильной зависимости интенсивности морфологических изменений эритроцитов от продолжительности воздействия токсического фактора.
Таким образом, учет частоты встречаемости эритроцитов с патологическими изменениями в периферической крови рыб, в том числе, микроядерный тест, рекомендуемый некоторыми авторами для биоиндикации состояния водной среды [6, 10], применим для оценки состояния водной среды при загрязнении водоемов ионами свинца выше допустимой концентрации в 5 раз. При более высоких уровнях загрязнения происходит временное повышение количества поврежденных эритроцитов, а затем, по-видимому, адаптационные возможности клеток исчерпываются, происходит нарушение гемопоэза и морфологически измененные эритроциты исчезают из кровяного русла.
Список литературы Оценка морфологических изменений эритроцитов периферической крови рыб при высоком содержании ионов свинца в водной среде
- Абдуллаева, Н. М. Цитогематологическое исследование рыб при воздействии тяжелых металлов и сырой нефти/Н. М. Абдуллаева: автореф. дис.. канд. биол. наук. -Махачкала, 2007.-22 с.
- Гашев, С. Н. Методика комплексной оценки состояния сообществ и популяций доминирующих видов или видов-индикаторов мелких млекопитающих, амфибий и рыб/С. Н. Гашев, Н. А. Сазонова, А. Г. Селюков и др. -Тюмень: ТюмГУ, 2005. -94 с.
- Ильинских, И. Н. Микроядерный анализ и цитогенетическая нестабильность/И. Н. Ильинский, В. В. Новицкий, Н. Н. Ванчугова, Н. Н Ильинских. -Томск: Наука, 1992. -272 с.
- Кейстер, И. А. Морфологический состав крови ряпушки и ее изменения как биоиндикационные показатели условий обитания в белом озере (Вологодская область)/И. А. Кейстер//Современные проблемы науки и образования. -2009. -№3 -С. 117-125.
- Кузина, Т. В. Изменения структуры ядра эритроцитов периферической крови промысловых рыб Волго-Каспийского канала/Т. В. Кузина//Вестн. Моск. гос. обл. ун-та. Сер. Естеств. науки. -2011. -№2. -С. 50-57.
- Кузина, Т. В. Цитофизиологические особенности крови промысловых рыб Волго-Каспийского канала: дис.. канд. биол. наук/Т. В. Кузина. -Астрахань, 2011. -181 с.
- Фомина, Л. Л. Морфологические изменения эритроцитов периферической крови рыб в условиях интоксикации водной среды ионами свинца/Л. Л. Фомина, Д. Ю. Мешалкин//Вестник Бурятской государственной сельскохозяйственной академии им. В. Р. Филиппова. -2015. -№2. -С. 22-26.
- Шахтамиров, И. Я. Кариопатология у животных в зонах стойких органических загрязнителей внешней среды: дис.. д-ра биол. наук. -Санкт-Петербург, 2014. -276 с.
- Яхненко, В. М. Особенности состава и структуры клеток крови рыб озера Байкал/В. М. Яхненко//Вест. Иркут. гос. сельскохоз. акад. -2013. -Т. 2, № 57/2. -С. 71-75.
- Яхненко, В. М. Особенности состава и структуры клеток крови рыб пелагиали и прибрежья озера Байкал/В. М. Яхненко, И. В. Клименков//Изв. РАН. Сер. Биология.-2009. -№1.-С. 46-54.


