Оценка риска никельсодержащих наноматериалов: идентификация опасного фактора
Автор: Гмошинский И.В., Хотимченко С.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Аналитические обзоры
Статья в выпуске: 2 (34), 2021 года.
Бесплатный доступ
Наночастицы (НЧ) никеля (Ni) и его соединений привлекают большое внимание с точки зрения перспектив их инновационного использования в качестве катализаторов, материалов для электротехники, электроники и фотоники, лекарственных и диагностических препаратов, пестицидов. Производство этих веществ в наноформе имеет широкие перспективы в ближайшем будущем, что влечет за собой усиление нагрузки этими наноматериалами на организм человека. При этом Ni и его соединения даже в формах традиционной дисперсности высокотоксичны для человека. Механизмы их токсичности состоят в развитии окислительного стресса, нарушении функции клеточных мембран и митохондрий, экспрессии ядерных факторов транскрипции, отвечающих за развитие апоптоза, каспаз, а также протоонкогенов. Ведущую роль в токсичности Ni-содержащих наноматериалов играет, по-видимому, эмиссия из них ионов тяжелого металла Ni++, обладающего прооксидантной активностью, влияющего на активность ферментов и экспрессию генов. В модельных экспериментах in vitro с использованием культур клеток, являющихся морфологическими и функциональными аналогами клеток эпителия дыхательных путей и желудочно-кишечного тракта, печени, почек, нервной системы, для Ni-содержащих наноматериалов отмечено цитотоксическое действие, способность провоцировать оксидантный стресс, влиять на экспрессию белков апоптоза и ядерных транскрипционных факторов, вызывать апоптоз и некроз. Имеются данные, свидетельствующие о наличии у Ni-cодержащих наноматериалов злокачественного трансформирующего действия in vitro. В совокупности это указывает на соединения никеля в наноформе как новый опасный фактор, требующий оценки создаваемых им рисков для здоровья работников предприятий, населения и потребителей продукции. В обзоре проанализированы источники литературы по вопросу о цитотоксичности Ni-содержащих наноматериалов и механизмах их действия на молекулярно-генетическом и клеточном уровне за период преимущественно с 2011 г.
Никель, оксид никеля, наночастицы, цитотоксичность, генотоксичность, трансформирующая способность, апоптоз, экспрессия генов, оценка риска
Короткий адрес: https://sciup.org/142229593
IDR: 142229593 | УДК: 544.77: | DOI: 10.21668/health.risk/2021.2.17
Текст обзорной статьи Оценка риска никельсодержащих наноматериалов: идентификация опасного фактора
Наночастицы (НЧ) никеля Ni и его соединений привлекают большое внимание с точки зрения перспектив их инновационного использования в технике, при производстве потребительской продукции и в медицине. Уже с начала XX в. металлический Ni используется в качестве катализатора при гидрогенизации пищевых и технических жиров [1]. Основным недостатком такого технологического процесса является побочное образование значительных количеств транс-изомеров ненасыщенных жирных кислот вследствие неравновесного характера процессов гидрирования, определяемого кинетическими закономерностями диффузии молекул субстрата к поверхности никелевого катализатора. В значитель- ной степени снизить влияние этих эффектов можно с использованием катализатора на основе иммобилизованных на инертных носителях (диоксиде кремния, углероде) никелевых НЧ [2]. Сообщается о синтезе широкого ассортимента такого рода катализаторов, содержащих НЧ размером как менее 10 нм (так называемые кластерные частицы), так и существенно большего диаметра [3]. Наноструктурные Ni-содержащие катализаторы находят применение и в технологиях тонкого органического синтеза, в том числе в фармацевтической промышленности [4].
В электронике, электротехнике и фотонике применение НЧ Ni определяется их уникальными магнитными и электрохимическими свойствами.
Гмошинский Иван Всеволодович – доктор биологических наук, ведущий научный сотрудник лаборатории пищевой токсикологии и оценки безопасности нанотехнологий (e-mail: ; тел.: 8 (495) 698-53-71; ORCID: .
Хотимченко Сергей Анатольевич – член-корреспондент РАН, доктор медицинских наук, профессор, заведующий лабораторией пищевой токсикологии и оценки безопасности нанотехнологий (e-mail: ; тел.: 8 (495) 698-52-35; ORCID: .
Так сообщается о создании элементов памяти на основе сконструированных из НЧ Ni наноколец [5]. Гетероструктуры на основе НЧ Ni, его оксида (NiO), а также углеродных нанотрубок и графена предлагаются в качестве материала электродов в обладающих высокой электрической емкостью перезаряжаемых аккумуляторах [6], многослойных керамических суперконденсаторах [7] и солнечных батареях [8]. Разработаны высокочувствительные магнитные и химические сенсоры на основе Ni-со-держащих наночастиц [2], находящие применение в медицинской диагностике при выявлении опухолевых клеток [9]. НЧ никеля могут преднамеренно вводиться или случайно присутствовать в косметических средствах, включая тональную косметику и красители [10]. Терапевтическое использование НЧ Ni и его сплавов с медью включает контролируемую магнитную гипертермию и тераностику [11]. Наконец, имеются разработки по использованию НЧ Ni и его соединений, получаемых биотехнологическим путем, в инсектицидах, предназначенных для контроля численности комаров-переносчиков инфекционных болезней [12, 13].
Годовое производство НЧ Ni и его соединений только в США оценивалось в 2019 г. величиной 20 т и имело тенденцию к дальнейшему увеличению [14].
В совокупности все эти данные показывают, что НЧ Ni и его соединений относятся к нанотехнологической продукции, производство которой имеет широкие перспективы роста в ближайшем времени, что с неизбежностью приведет к усилению нагрузки этими наноматериалами как на организм человека, так и на экосистемы [15]. Возникающие при этом возможные риски для здоровья связаны c тем, что Ni и его соединения даже в формах традиционной дисперсности высокотоксичны. Многие экспериментальные и эпидемиологические исследования показали, что металлический никель и его соединения являются канцерогенами (обзор ранних работ см. в [16]). На основании этих данных IARC классифицировал соединения Ni (II) как группу 1 (канцерогенные для человека), тогда как металлический Ni классифицируется как группа 2B (возможно, канцерогенен для человека). Известна также высокая аллергенность соединений Ni [17]. После публикации в 2008 г. статьи Kornick и Zug по вопросу эпидемиологии никелевого дерматита [18] никель был признан «аллергеном года» Американским обществом по изучению контактного дерматита.
Существуют опасения, что из-за своего очень небольшого размера НЧ Ni и его соединений могут с гораздо большей легкостью попадать в организм через дыхательные пути, желудочно-кишечный тракт или через кожу, чем их аналоги макроскопи- ческой формы дисперсности, что может привести к усугублению перечисленных вредных эффектов. Наибольшую озабоченность вызывают наноформы Ni как вредные факторы на производстве (в химической, металлургической, электротехнической и других отраслях промышленности), где риски, связанные с экспонированием работников предприятий, являются наибольшими [15, 19].
В совокупности это свидетельствует о необходимости оценки потенциальных рисков для здоровья человека соединений Ni в наноформе как самостоятельных вредных факторов. В соответствии с используемой в России методикой1 необходимыми предварительными стадиями в оценке риска являются идентификация опасного фактора и оценка зависимости «доза – ответ», то есть количественная характеристика опасности. Первое из этих звеньев в оценке риска включает анализ механизмов токсического действия, проявлений токсичности и биомаркеров, позволяющих идентифицировать факт неблагоприятного влияния изучаемого вещества на организм.
Цель настоящего обзора - анализ и обобщение данных об идентификации Ni-cодержащих наноматериалов как опасных факторов на основе результатов экспериментов in vitro и о предполагаемых молекулярно-генетических, биохимических и цитологических механизмах их токсического действия. При этом основное внимание уделяется данным, опубликованным в течение последнего десятилетия (в период с 2011 г.) и представленным в источниках, удовлетворяющих требованиям научной достоверности и полноты и содержащихся в международных реферативных базах данных PubMed, WoS и Scopus.
Цитотоксичность Ni-содержащих наноматериалов. Под «цитотоксичностью» в литературе понимается способность веществ снижать жизнеспособность клеток и оказывать на них повреждающее действие на морфологическом и метаболическом уровне при инкубации in vitro . Применительно к НЧ Ni и его соединениями такие исследования интенсивно проводятся с начала 2000-х гг. [20]. Исследования цитотоксичности не дают прямого ответа на вопрос о величине токсических доз для организма в целом, однако они полезны, во-первых, как средство скрининга потенциально токсичных наноматериалов и, во-вторых, являются ценным источником информации о молекулярных механизмах и биомаркерах их действия на клетки и, следовательно, на организм в целом.
Большинство токсикологических исследований in vitro выполняются на неограниченно делящихся в культуре клетках, которые, как правило, являются опухолевыми. Тем не менее все эти клетки имеют аналоги среди нормальных клеток органов и тканей, с которыми они сходны по своим морфофункциональным, геномным и метаболомным параметрам. Поэтому уместно рассмотреть имеющиеся данные в последовательности, отражающей действие Ni-со-держащих НЧ на клетки органов, являющихся мишенями действия наноматериала в условиях реальной экспозиции организма.
Клетки органов дыхания. НЧ металлического Ni и NiO, но не микрочастицы (МЧ) Ni захватывались эпителиальными клетками легких человека линии H460 и клетками первичной культуры эпителия бронхов человека, причем из поглощенных частиц обоих видов происходило высвобождение ионов Ni++ [21]. НЧ Ni, NiO и раствора NiCl 2 вызывали стабилизацию и ядерную транслокацию индуцируемого гипоксией транскрипционного фактора HIF-1 α , что приводило к повышению содержания его мишени NRDG1 (Cap43). Микрочастицы (МЧ) Ni не оказывали такого действия, тогда как активация HIF-1 α под действием НЧ была даже более выражена, чем под действием солевой формы. НЧ NiO были в равной степени токсичными для клеток обеих линий, микрочастицы Ni были нетоксичными, а токсичность НЧ Ni была промежуточной. Во всех случаях токсичности наблюдалась активация каспаз и поли (АДФ-рибоза) полимеразы, что указывает на развитие апоптоза.
В культуре эпителиоцитов бронхов человека HEp-2 и клеток рака молочной железы MCF-7 НЧ NiO проявляли цитотоксичность с развитием окислительного стресса, истощением количества глутатиона и накоплением липоперекисей. Наблюдалась активация каспазы-3, фрагментация ДНК, экспрессия маркеров апоптоза. Действие НЧ на клетки могло быть блокировано добавлением куркумина [22]. В клетках легочного эпителия хомяка V79 при действии НЧ NiO размером 30 нм в концентрации 250 и 2500 мкг/мл наблюдали появление микроядер. В ко-мет-тесте фрагментация ДНК наблюдалась при концентрации НЧ 62 мкг/мл и выше [23].
Изучение токсичности НЧ NiO для двух линий клеток легочного эпителия человека в дозах от 20 до 100 мкг/мл показало, что уже через 45 мин экспозиции возрастала концентрация реакционноспособных форм кислорода (РСК), а через 24 ч происходила гибель значительного числа клеток путем как некроза, так и апоптоза [24]. Это сопровождалось образованием больших количеств интерлейкинов IL-6 и IL-8, опосредуемым сигнальным путем MAPK киназы, запускающим активность транскрипционного фактора NF-kB. Отмечалось нарушение клеточного цикла, генотоксический эффект, повреждение ДНК. Перечисленные эффекты наблюдались как в A549-клет-ках, активно захватывающих НЧ, так и в BEAS-2B, для которых их эндоцитоз не был характерным.
С использованием клеточной линии A549 в работе [25] НЧ Ni, NiO и МЧ Ni дозозависимо вызывали изменения активности митохондрий и увеличивали пролиферацию клеток. При обработке клеток
A549 НЧ Ni было обнаружено снижение жизнеспособности и повреждение ДНК, причем в сопоставимых по содержанию Ni дозах металлические НЧ обладали большей генотоксичностью, чем МЧ, и вызывали большую активацию онкогенов [26]. Экспонирование клеток A549 сублетальными дозами НЧ NiO сопровождалось признаками эпителиальномезенхимального перехода, опосредуемого активацией TGF- β 1/Smads - сигнального пути. Этому соответствовало усиление экспрессии коллагена 1-го типа, TGF- β 1, p-Smad2, p-Smad3, α -актина, vimentin, E-cadherin и фибронектина, то есть изменения, характеризующие на тканевом уровне развитие фиброза. Вещество SB431542, являющееся антагонистом TGF- β 1, обладало способностью блокировать эти изменения [27]. Под действием НЧ NiO (диаметром 20 нм) в клетках A549 возрастала экспрессия гемоксигеназы-1 (HO-1) и сурфактантного бел-ка-D, то есть генов, регулируемых индуцируемым гипоксией транскрипционным фактором HIF-1 α [28]. Эти данные совпали с полученными на альтернативной клеточной модели в исследовании [21].
Окислительный стресс, индуцируемый НЧ NiO в клетках A549, мог быть частично блокирован эфирным маслом из Pistacia lentiscus , содержащим терпеноиды [29].
Под воздействием НЧ NiO в концентрациях 5, 10 и 20 мкг/мл в клетках бронхолегочного эпителия человека BEAS-2B наблюдали снижение экспрессии деацетилазы гистонов SIRT1, что вызывало гиперацетилирование гена p53 и гиперэкспрессию Bax (Bcl-2-ассоциированный X белок). Эффект подавления SIRT1 мог быть снят под действием ресвератрола. Эти данные показывают, что SIRT1 может быть одной из ключевых молекул в развитии клеточной токсичности Ni-содержащих наноматериалов [30]. При культивировании клеток этой линии в течение шести месяцев с очень низкими дозами (0,5 мкг/мл по Ni) НЧ Ni, NiO или солью NiCl 2 наблюдали значительные изменения в транскриптоме при сохранении видимой жизнеспособности клеток [31]. Наибольшее число (197) генов, ответивших изменением экспрессии, отмечено в случае солевой формы. При воздействии всех форм Ni изменялась экспрессия генов Ca-связывающих белков S100A14 и S100A2 , а также TIMP3 , CCND2, EPCAM, IL4R и DDIT4 . Биоинформатический анализ позволил выявить в качестве мишеней наноформ Ni сигнальные пути цитокинов IL-1 α , IL-1 β и VEGF-A.
НЧ Ni и NiO эффективно захватывались клетками BEAS-2B в культуре [32]. В отличие от этого, ионы Ni++ мало проникали в клетки. Наноформы Ni, NiO и соль Ni вызывали хромосомные аберрации, разрывы ДНК и накопление внутриклеточных РСК в экспонированных клетках. Это сопровождалось ростом уровня внутриклеточного Са, причем добавление хелатирующих агентов снижало проявления генотоксичности. Генотоксичность и мутагенность НЧ Ni (около 100 нм) и NiO (около 50 нм)
в сравнении с солью NiCl 2 была изучена для клеток бронхиального эпителия человека HBEC с помощью комет-теста и окрашивания на γ-H2AX (H2A histone family member X). Оба вида НЧ в значительной степени агрегировали в культуральной среде. Показано возрастание числа разрывов ДНК под действием НЧ NiO и, в меньшей степени, - НЧ Ni; для растворимой соли Ni подобные эффекты отсутствовали при сопоставимых дозах [33].
Клетки органов ЖКТ. Эпителий кишки является одной из первичных мишеней воздействия НЧ при их пероральном поступлении. В работе [34] токсичность НЧ NiO размером 15 нм была выявлена в культуре клеток человека Сасо-2, являющихся аналогом энтероцитов тонкой кишки. НЧ вызывали снижение на 50 % выживаемости клеток в концентрации 352 мкг/мл, окислительный стресс и повреждение ДНК при 30 - 150 мкг/мл. Основным механизмом клеточной гибели был апоптоз.
При действии НЧ NiO диаметром 44 нм на клетки HepG2 человека, являющиеся аналогами гепатоцитов, отмечено дозозависимое развитие окислительного стресса и гибель клеток, образование микроядер, конденсация хроматина, экспрессия Bax и каспазы-3, подавление Bcl-2, что указывает на наличие апоптоза. Эти явления ингибировались аскорбиновой кислотой [35]. Ту же линию клеток в работе [36] обрабатывали НЧ металлического Ni диаметром 28 нм в концентрации 25–100 мкг/мл, что вызывало дозозависимый окислительный стресс. При сублетальной нагрузке НЧ выявлено большое количество клеток в subG1 фазе клеточного цикла, что отвечает запуску апоптоза. Отмечалась экспрессия каспазы-3 и апоптотическая фрагментация ДНК, повышение экспрессии p53 и отношения Bax/Bcl-2 с одновременной потерей митохондриального мембранного потенциала, что указывает на развитие апоптоза клеток по «митохондриальному» пути.
Анализ в клетках HepG2 повреждения ДНК с помощью комет-теста показал 26-кратное возрастание фрагментации ДНК при концентрации НЧ NiO 0,1 мг/мл. Одновременно проточная цитометрия выявила повышение концентрации РСК. Было отмечено усиление экспрессии супероксиддисмутазы (СОД), а также p53, Bax и Bcl2 [37]. Транскриптом-ный анализ c использованием тотального РНК-секвенирования показал [38], что изменения в экспрессии генов клеток HepG2 начинают происходить при содержании НЧ NiO более 5 мкг/мл. Экспрессия связанных с гипоксией HIF-1α и микро-РНК (miR)-210 повышалась при 25-100 мкг/мл этих НЧ, причем даже при концентрациях, не вызывавших видимого цитотоксического эффекта, наблюдались разнообразные изменения в транскриптоме, включая активацию метаболических путей гликолиза, синтеза глутатиона, лизосомального пищеварения и аутофагии. Повышались внутриклеточные уровни NO, кальция, активность эстеразы и отмечалось нарушение мембранного потенциала митохондрий. Дисре- гуляция клеточного цикла выражалась в появлении 30,5 % subG1 апоптотического пика. Таким образом, цитотоксичность НЧ NiO для клеток печени проявляется, преимущественно, через гипоксию и окислительный стресс, вызывающий транскриптомные изменения, апоптоз и фрагментацию ДНК.
На возможное фиброгенное действие НЧ NiO на клетки печени указывают данные работы [39], в которой при действии этих НЧ в концентрации 100 мкг/мл на клетки HepG2 отмечалась повышенная экспрессия TGF-β1, p-Smad2, p-Smad3, α -актина гладких мышц, металлопротеиназы матрикса (MMP) изоформы 9, тканевого ингибитора металлопротеиназы (TIMP)-1 и сниженная - E-cadherin и Smad7.
В сравнительном аспекте цитотоксичность НЧ Ni, NiO и Ni(OH)2 для бронхоальвеолярных клеток A549 и гепатоцит-подобных клеток HepG2 изучена в единственном исследовании [40]. НЧ металлического Ni были достоверно более токсичными для первой, чем для второй из этих линий, для оксидных НЧ подобных различий не наблюдалось. Основными механизмами цитотоксичности были окислительный стресс, нарушение митохондриального мембранного потенциала и индукция синтеза каспазы-3, вследствие чего развивался апоптоз. Цитотоксичность различных видов НЧ, выраженная через массу наноматериала, коррелировала с их удельной площадью поверхности и растворимостью в биологическом окружении.
Клетки почек. В эксперименте на клетках эпителия почечных канальцев NRK-52E НЧ NiO средним размером 10 - 20 нм в дозе до 500 мкг/мл захватывались клетками и дозозависимо вызывали повышение уровней малонового диальдегида, продукта окислительной деструкции ДНК 8-оксо-2-дезоксигуанозина (8-oxo-G), карбонилированного белка и истощение запасов глутатиона. При концентрации более 290 мкг/мл эти НЧ вызывали гибель более 50 % клеток по пути как апоптоза, так и некроза [41].
Клетки кожи. НЧ металлического Ni были цитотоксичными и генотоксичными для эпидермальных клеток кожи человека линии A431 в концентрациях от 2 до 20 мкг/мл и приводили к апоптозу и повреждению ДНК [42]. Гибель клеток происходила при явлениях окислительного стресса, истощения запасов глутатиона и активации каспазы-3, причем это действие ингибировалось N-ацетилцистеином, что указывает на возможную протективную функцию клеточных тиолов и, в частности, глутатиона в отношении токсических эффектов НЧ. При действии на эпидермальные клетки мыши линии JB6 НЧ Ni в тесте восстановления тетразолиевого красителя (МТТ) были более цитотоксичными в сопоставимой концентрации, чем соответствующие МЧ. Обе формы Ni вызывали апоптоз, однако активность НЧ была выше [43]. В этой же линии клеток НЧ Ni вызывали экспрессию активаторного белка-1 (AP-1) и NF- κ B, причем эти явления ингибировались эпигал-локатехин-3-галлатом (EGCG). Было показано, что
EGCG ослаблял цитотоксичность НЧ за счет подавления ответа MAPK-сигнального пути [44].
Клетки иммунной системы. В работе [45] изучена цитотоксичность НЧ NiO в культуре лимфоцитов периферической крови человека. Размер первичных НЧ составил 18 нм, они сильно агрегировали в водных средах. IC50 через 24 ч экспозиции составила 24 мкг/мл. Комет-тест и анализ микроядер выявили высокую генотоксичность НЧ. Основным механизмом гибели лимфоцитов был апоптоз, вызываемый продукцией РСК и липоперекисей.
В первичной культуре моноцитов мышей интактные и оксидно пассивированные НЧ Ni вызывали усиление экспрессии miR-21, MMP-2, MMP-9, а также TIMP-1 и TIMP-2. Эти эффекты не наблюдались в клетках от мышей с нокаутом гена miR-21, а также в клетках мышей дикого типа под действием НЧ Ni, покрытых слоем углерода. Полученные данные указывают на важную роль miR-21 в индукции воспалительного ответа на никелевые НЧ [46].
Клетки системы репродукции. На первичной культуре стволовых клеток Сертоли семенников крысы показано, что НЧ Ni стимулировали апоптоз с участием генов Igfbp3 , некодирующей РНК LOC102551356 и митохондриального механизма. Igfbp3 рассматривается как таргетный ген в р53-опосредуемом механизме апоптоза [47]. Действие НЧ Ni на клетки линии GC-1, являющиеся аналогами клеток сперматого-ний мыши, сопровождалось изменением ультраструктуры, задержкой клеточного цикла в G1-фазе и активацией апоптоза по механизму ингибирования PI3K/AKT/mTOR сигнального пути [48].
Эмбриональные клетки. В работе [33] наблюдали генотоксичность НЧ Ni, которая проявлялась в виде разрывов однонитевой ДНК, в мышиных эмбриональных стволовых клеток линии mES с использованием Hprt-теста, основанного на мутации репортерного гена HPRT (гипоксантин фосфо-рибозилтрансфераза), а также в шести линиях эмбриональных стволовых клеток мыши, переконструированных таким образом, чтобы отвечать флуоресценцией на развитие ряда путей генотоксичности и злокачественной трансформации (так называемая система ToxTracker). Интересно, что в этих системах, НЧ Ni обладали более выраженным генотоксическим действием по сравнению с НЧ NiO и раствором хлорида Ni.
Клетки соединительной ткани. Генотоксичность и мутагенность НЧ Ni для линии клеток фибробластов легких китайского хомячка в системе воздействия на поверхности раздела «воздух – жидкость» изучена в работе [49]. Наблюдалась гибель более 50 % клеток после 48 ч воздействия при количествах НЧ 0,15 и 0,32 мкг/см2 поверхности культуры при увеличении числа разрывов цепей ДНК, которое значительно усиливалось после воздействия ингибитора репарации однонитевой ДНК.
Нейроны. НЧ NiO средним диаметром 15,0 нм захватывались дозозависимым образом нейронопо- добными клетками SH-SY5Y и вызывали 50 % гибель клеток в дозе 229 мкг/мл. Отмечались морфологические изменения, 3-11-кратное возрастание фрагментации ДНК и 80-99%-ный апоптоз на фоне окислительного стресса [50]. В работе [51] в клетках этой же линии указанные НЧ дозозависимо вызывали апоптоз. Для объяснения механизма действия Ni-содержащих НЧ на нейроны было проведено термодинамическое моделирование, показавшее взаимодействие НЧ NiO с tau-белком. Результатом этого явилась экспрессия гена апоптоза Bax и повышение отношения Bax/Bcl-2, возрастание активности лактатдегидрогеназы и каспаз 3 и 9. В дальнейших исследованиях [52] показано, что в высоких дозах НЧ NiO вызывали окислительный стресс и апоптоз SH-SY5Y-клеток, тогда как при использовании нелетальных доз преобладало взаимодействие наноматериала со структурами tau-белка с увеличением доли гидрофобного tau и образовании его аморфных агрегатов.
Изучение в сравнительном аспекте действия НЧ NiO и Mn3O4 с диаметрами в интервале 12 - 24 нм на нейрональные клетки человека было проведено в работе [53]. Для анализа множественных данных, характеризующих цитотоксичность, был применен статистический подход «поверхности отклика» (response surface methodology), что, по мнению авторов, позволяло осуществить экстраполяцию полученных результатов на случай действия НЧ in vivo . Было показано, что при действии в культуре нейронов НЧ NiO были менее токсичными для клеток, чем НЧ Mn 3 O 4 , однако при совместном введении вклад НЧ NiO в цитотоксичность был преобладающим. Проведенный авторами статистический анализ выявил разнообразие комбинированных токсических воздействий, зависящих от природы, размера и концентрации частиц. Одним из основных факторов, снижающих цитотоксичность, была растворимость НЧ в биологическом окружении, которая уменьшалась при добавлении к культурам клеток фетальной телячьей сыворотки.
Трансформирующая активность in vitro. Данные, полученные в ряде рассмотренных выше работ, указывают на возможность протекания процессов, сходных со злокачественной трансформацией, под воздействием НЧ Ni и его соединений. Так, по мнению авторов исследования [21], вызываемая НЧ Ni и NiO устойчивая активация в клетках HIF-1α сигнального пути может приводить к злокачественной трансформации с последующим формированием опухолей in vivo. На линии эпидермальных клеток мыши JB6 [54] показано, что под действием НЧ Ni диаметром 50 нм отмечается активация синтеза промотера опухолевой трансформации activator protein-1 и NF-κB, а также высокий уровень экспрессии R-Ras, c-myc, C-Jun, p65 и p50, что не компенсируется относительно гораздо меньшей экспрессией проапоптотического фактора p53. C использованием метода культивирования на мягком агаре авторы работы установили, что для клеток, обработанных НЧ Ni, характерно образование колоний, рассматриваемое как аналог злокачественного роста. Интересно, что при изученном в этой же работе действии на клетки МЧ Ni микронного размера экспрессия p53 являлась преобладающим событием. Выявленные в клетках эпителия бронхов человека, обработанных НЧ Ni и NiO, многочисленные разрывы ДНК также рассматриваются как предпосылка злокачественной трансформации [33]. Интерпретация полученных в системах in vitro фактов затрудняется тем обстоятельством, что в большинстве работ одновременно с активацией онкогенов наблюдали экспрессию проапоптотических факторов, включая Akt-киназу и p53 под действием Ni-содер-жащих наноматериалов [43]. Возможные расхождения в оценках генотоксичности и трансформирующей способности наноформ Ni в различных тест-системах in vitro могут быть связаны и с различиями между используемыми клеточными линиями в параметрах поглощения НЧ клетками. Механизмами захвата НЧ Ni и его соединений клетками являются, предположительно, макропиноцитоз или клатрин-зависимый эндоцитоз [55]. Поглощение частиц может зависеть от концентрации ионов Са++ в среде культивации, а также от размера, заряда и свойств поверхности частиц.
Кроме того, следует иметь в виду, что подавляющее большинство данных о генотоксичности и «канцерогенной» активности Ni-содержащих наноматериалов были получены на клеточных линиях, которые уже были в той или иной степени трансформированы по сравнению со своими первичными аналогами. Таким образом, вопрос о наличии у НЧ Ni и NiO канцерогенного действия, по-видимому, не может быть решен однозначно с привлечением одних только данных, полученных на клеточных культурах.
Молекулярные и клеточные механизмы цитотоксичности. Полученные в исследованиях in vitro данные позволяет сделать содержательные выводы о молекулярных и клеточных механизмах цитотоксичности Ni -содержащих НЧ.
Окислительный стресс. Окислительный стресс развивается вследствие дисбаланса между окислением (преимущественно ферментативным) органических субстратов в процессах метаболизма и активностью антиоксидантной системы. При этом синтезируется избыточное количество РСК, превышающее способность организма к их элиминации, что вызывает необратимое окислительное повреждение белков и липидов мембран. Избыток РСК может повредить митохондрии, которые, вследствие этого, сами могут усилить накопление РСК, то есть окислительный стресс способен развиваться по механизму положительной обратной связи с активизацией в конечном счете митохондриального пути апоптоза [20].
Окислительный стресс рассматривается как один из основных видов нанотоксичности, реали- зуемых в случае большого числа искусственных наноматериалов. Для тех из них, которые обладают относительно высокой устойчивостью и низкой растворимостью в биологических средах (например, НЧ оксидов Si, Ti, Ce, Zr, Al), его первичным пусковым механизмом является неферментативная каталитическая генерация РСК на межфазной границе НЧ со средой [56]. В случае углеродных нанотрубок преобладает, по-видимому, развитие окислительного стресса вследствие гиперпродукции окислителей клетками (в первую очередь макрофагами), являющимися первичными мишенями действия наноматериала. Для Ni-содержащих НЧ, с учетом их довольно высокой растворимости, второй из указанных механизмов сочетается, по-видимому, с влиянием ионов Ni на ферментативные системы, отвечающие за баланс синтеза и элиминации РСК [20].
Повреждение клеток и их мембран под действием РСК может быть основным механизмом токсичности НЧ Ni, благодаря тому, что Ni++ способен связываться с аминокислотами, полипептидами и ферментами, провоцируя синтез РСК [57]. На роль окислительного стресса в цитотоксичности НЧ Ni и его соединений указывают и многочисленные факты ингибирования их действия при введении антиоксидантов [29, 35, 42, 44].
Апопотоз. Апоптоз представляет собой запрограммированную гибель клеток с очень сложным механизмом, включающим действие семейства цистеиновых протеаз, белков p53, Bcl-2 и других. Выделяют два основных пути апоптоза, а именно путь рецептора смерти и митохондриальный путь [20]. Первый из них в основном заключается в том, что апоптотический фактор Fas (CD95) и Fas-ассоциированный белок домена смерти (FADD) образуют Fas-ассоциированный сигнальный комплекс клеточной смерти (DISC) с расщеплением lamin A и β-актина, которые могут связывать и активировать каспазу-8 и последующую каспазу-3. Митохондриальные пути апоптоза включают каспазо-зависимый и каспазонезависимый путь. Механизм первого из них состоит в том, что факторы Bax и Bak связываются с мембраной митохондрий, высвобождая из них цитохром С. Он, в свою очередь, образует апоптотиче-ские комплексы с адаптерным белком Apaf-1 и каспазой-8, которые затем активируют каспазу-3, запускающую апоптоз. Механизм независимого от каспаз апоптоза заключается в том, что фактор, индуцирующий апоптоз (AIF), непосредственно высвобождается митохондриями в цитоплазму, откуда проникает в ядро, где происходит разрушение ДНК [16]. Апоптоз, индуцированный НЧ Ni и его соединений, включает как путь, опосредованный рецептором смерти, так и пути, опосредованные митохондриями. Это следует из данных о том, что в яичниках самок крыс НЧ Ni одновременно увеличивают уровни проапоптотических факторов, таких как каспаза-3, каспаза-8, каспаза-9, Fas, Bax, Bid, цитохром C и AIF, и при этом снижают уровни антиапоптоти- ческого фактора Bcl-2 [58]. По данным работы [43] цитотоксичность НЧ Ni в основном развивается вследствие апоптоза, обусловленного рецептором смерти, а именно по пути активации Fas. Однако в этой же работе было показано, что НЧ Ni активируют Bcl-2, вследствие чего цитохром C не высвобождается из митохондрий в цитоплазму, и данный путь развития апоптоза, по-видимому, не реализуется.
Сходные результаты получены в работах [54, 59], где было показано, что высвобождение цитохрома С под действием НЧ Ni ингибируется Bcl-2. Как известно, Bcl-2 является разновидностью протоонкогена, который может ингибировать апоптоз [20 ] . Таким образом, НЧ Ni могут парадоксальным образом не только стимулировать, но и ингибировать апоптоз за счет активации Bcl-2, и за счет этого индуцировать клеточный «канцерогенез». Было также обнаружено [54, 59], что НЧ Ni подавляют экспрессию проапоптотического фактора p53. Если активация p53 снижена, апоптоз, опосредованный каспазой-8 и каспазой-3, ингибируется, что может в конечном итоге приводить к возникновению опухолей.
Повреждение ДНК и генотоксичность. Как известно, клеточный цикл делится на четыре фазы, а именно профазу синтеза ДНК (фаза G0/G1), фазу синтеза ДНК (фаза S), анафазу синтеза ДНК (фаза G2) и фазу деления клетки (фаза M). Фаза G0/G1 - это ключ к нормальному началу клеточного цикла. Если фаза G0/G1 заблокирована, клетки не перейдут на стадию митоза и пролиферации, что в конечном итоге приведет к апоптозу. В клетках эпидермиса человека фаза G0/G1 блокируется НЧ Ni при 2,5 и 5,0 мкг/мл, что влечет за собой апоптоз, в то время как фаза G2/M блокируется НЧ Ni при 7,5 и 10,0 мкг/мл, что приводит к появлению большого числа разрывов ДНК [44]. Эти результаты позволяют понять, почему низкая концентрация НЧ Ni способствует апоптозу, в то время как высокая концентрация НЧ Ni повреждает клеточную ДНК и приводит к мутагенезу с возможностью дальнейшей злокачественной трансформации.
MAPK-сигнальный путь. Путь передачи сигнала MAPK, также известный как путь митоген-активи-руемой протеинкиназы, включает три параллельных пути, а именно путь ERK, путь JNK/SAPKK и путь P38MAPK. Далее по ходу пути передачи сигнала MAPK находятся два фактора транскрипции: актива-торный белок-1 (AP-1) и ядерный фактор-jB (NF-jB), которые участвуют в регуляции сразу многих важных процессов клеточной активности, таких как пролиферация, дифференцировка клеток и апоптоз. AP-1 представляет собой димер, состоящий из субъединиц c-Fos и c-Jun, а NF-jB представляет собой димер, состоящий из субъединиц p65 и р50. Три пути MAPK играют важную роль в онкогенезе. ERK1/2 активируется путем фосфорилирования, которое регулирует c-Fos, c-myc и C-Jun, тем самым повышая активность фактора транскрипции AP-1. Путем фосфорилирования также могут быть активированы конечные кина- зы JNK, фосфорилирующие C-Jun и далее AP-1. Фосфорилирование P38MARK приводит к деполимеризации IjB и NF-jB. Под действием НЧ Ni экспрессия белков R-Ras, c-myc, C-Jun, p65 и p50 медленно повышается, и, по сравнению с МЧ Ni, НЧ с большей вероятностью повышают активность AP-1 и NF-jB [54]. В концентрации свыше 2,5 мкг/мл НЧ Ni значительно повышали экспрессию фосфорилированного ERK1/2 (p-ERK1/2), фосфорилированного JNK (p-JNK) и фосфорилированного P38 (p-P38) [44]. Таким образом, НЧ Ni обладают способностью в модельных системах in vitro активировать AP-1 и NF-jB посредством сигнального пути MAPK, что в конечном итоге может приводить к злокачественной трансформации.
HIF-1 α -сигнальный путь. Фактор-1, индуцируемый гипоксией (HIF-1) - это гетеродимер, состоящий из субъединиц HIF-1 α и HIF-1 β [20]. HIF-1 α отвечает за активность комплекса и первоначально локализован в цитоплазме, тогда как HIF-1 β экспрессирован как в цитоплазме, так и в нуклеоплазме, и его функция состоит в стабилизации активного комплекса. Транслокация HIF-1 α в ядро клетки под влиянием Ni-содержащих НЧ рассматривается рядом авторов как ключевое звено в проявлении ими фиброгенной, генотоксической и трансформирующей активности. По данным исследования на моноцитах человека, воздействие 10 и 30 мкг/мл НЧ Ni увеличивало содержание HIF-1 α , который участвовал в активации MMP-2 и MMP-9 и TIMP-1 [60]. Предполагается, что путь HIF-1 α участвует в аномальной экспрессии и изменениях активности ММР, индуцированных НЧ Ni. Помимо этого активация пути HIF-1 α может приводить к злокачественной трансформации клеток и возникновению опухолей. Известно, что НЧ Ni сильнее активируют путь HIF-1 α по сравнению с МЧ Ni или его растворимой солью [21].
Гипотетическая схема событий, развивающихся под воздействием Ni-содержащих наноматериалов на клеточном уровне, приведена на рисунке.
Наиболее информативные биомаркеры токсического действия Ni-содержащих наноматериалов, выявленные в экспериментах на клеточных культурах, представлены в таблице.
Выводы. Таким образом, анализ литературы показывает, что НЧ металлического Ni, его соединений (NiO, Ni(OH) 2 ), а также никелевые нановолокна и наностержни являются высокотоксичными. На уровне клеток первичными проявлениями токсичности являются, по-видимому, развитие окислительного стресса, нарушение функции клеточных мембран, митохондрий, экспрессия ядерных факторов транскрипции, отвечающих за развитие апоптоза, каспаз, а также ряда протоонкогенов. Для НЧ Ni и его соединений в различных дозах парадоксальным образом характерны как стимуляция апоптоза, так и его угнетение с провоцированием злокачественной трансформации клеток. В основе этих противоречивых эффектов, как можно предположить,
Фиброгенез
Пм
CD95
Фгс
FADD
РСК p53
Разрывы ДНК
JNK‐1
Активация онкогенов
MAPK‐ каскад
MAPKAPK2
ERK P38MAPK
Каспаза 8
Каспаза 3
Апоптоз
Злокачественный рост
Фрагментация цитоскелета
Дерегуляция клеточного цикла
MMP2,9 TIMP


CytC
Apaf11з ••• *••
JNK/
SAPKK
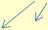
AP‐1
NF‐jB
Рис. Основные контуры и мишени токсического действия НЧ Ni и его соединений на клеточном уровне: НЧ - наночастицы; Ni++ - ионы никеля, Пм - плазматичесая мебрана, Ям - ядерная мембрана, Я - ядро, МХ - митохондрии, Фгс - фагосома/фаголизосома; РСК - реакционноспособные формы кислорода; + - стимуляция; ┬ - ингибирование
Наиболее значимые биомаркеры цитотоксического действия Ni-содержащих наноматериалов in vitro
(хлорида, нитрата, сульфата) на клетки, по-види-мому, не имеется, откуда можно сделать вывод, что ведущую роль в проявлении токсичности этих наноматериалов играет эмиссия из них ионов Ni++. В этом отношении Ni-содержащие наноматериалы существенно отличаются от практически нерастворимых в биологических средах наночастиц, таких как охарактеризованные ранее наночастицы аморфного диоксида кремния [61], для которых ведущую роль в проявлении токсического действия играет каталитическая генерация РСК на их поверхности, а также ограниченно растворимые наночастицы серебра, активно влияющие на микроэлементный гомеостаз [62]. Вместе с тем действующие дозы НЧ Ni и его соединений часто оказывается ниже, чем у растворимых солей этого металла, что указывает на важную роль облегченных процессов внутриклеточного проникновения этих наноматериалов в их цитотоксических эффектах.
Следующим необходимым звеном в оценке риска является характеристика опасности, то есть определение токсических и максимальных недействующих доз (NOAEL) вредного химического фактора при различных путях его поступления в организм, то есть через органы дыхания, неповрежден- ные кожные покровы и желудочно-кишечный тракт. Такая информация не может быть получена исключительно в исследованиях in vitro, не учитывающих биокинетические закономерности вредного фактора, его способность к проникновению через биологические барьеры и биоаккумуляции, и требует проведения экспериментов in vivo на лабораторных животных, а также обобщения имеющихся данных клинических наблюдений. Эти вопросы, применительно к Ni-содержащим наноматериалам, будут рассмотрены в следующей обзорной статье.
Финансирование. Работа проведена за счет средств субсидии на выполнение государственного задания в рамках программы фундаментальных научных исследований (тема Минобрнауки России № 0529-2019-0057).
Список литературы Оценка риска никельсодержащих наноматериалов: идентификация опасного фактора
- О'Брайен Р. Жиры и масла. Производство, состав и свойства, применение. - СПб.: Профессия, 2007. - 383 с.
- Role of NF-кБ activation and Th1/Th2 imbalance in pulmonary toxicity induced by nano NiO / X. Chang, A. Zhu, F. Liu, L. Zou, L. Su, S. Li, Y. Sun // Environ. Toxicol. - 2017. - Vol. 32, № 4. - P. 1354-1362. DOI: 10.1002/tox.22329
- Solid-state synthesis of ordered mesoporous carbon catalysts via a mechanochemical assembly through coordination cross-linking / P. Zhang, L. Wang, S. Yang, J.A. Schott, X. Liu, S.M. Mahurin, C. Huang, Y. Zhang [et al.] // Nat. Commun. -2017. - Vol. 28, № 8. - P. 15020. DOI: 10.1038/ncomms15020
- A reusable magnetic nickel nanoparticle based catalyst for the aqueous synthesis of diverse heterocycles and their evaluation as potential antibacterial agent / D. Bhattacharjee, S.K. Sheet, S. Khatua, K. Biswas, S. Joshi, B. Myrboh // Bioor-ganic Medicinal Chemistry. - 2018. - Vol. 26, № 18. - P. 5018-5028. DOI: 10.1016/j.bmc.2018.08.033
- Magnetic bistability and controllable reversal of asymmetric ferromagnetic nanorings / F.Q. Zhu, G.W. Chern, O. Tcherny-shyov, X.C. Zhu, J.G. Zhu, C.L. Chien // Phys. Rev. Lett. - 2006. - Vol. 96, № 2. - P. 027205. DOI: 10.1103/PhysRevLett.96.027205
- Performance enhancement and side reactions in rechargeable nickel-iron batteries with nanostructured electrodes / D. Lei, D.C. Lee, A. Magasinski, E. Zhao, D. Steingart, G. Yushin // ACS Appl. Materials. Interfaces. - 2016. - Vol. 8, № 3. -P. 2088-2096. DOI: 10.1021/acsami.5b10547
- Chou K.S., Chang S.C., Huang K.C. Study on the characteristics of nanosized nickel particles using sodium boro-hydride to promote conversion // Azo J. Mater. Online. - 2007. - Vol. 3. - P. 172-179. DOI: 10.2240/azojomo0232
- Graphene supported nickel nanoparticle as a viable replacement for platinum in dye sensitized solar cells / R. Bajpai, S. Roy, N. Kulshrestha, J. Rafiee, N. Koratkar, D.S. Misra // Nanoscale. - 2012. - Vol. 4, № 3. - P. 926-930. DOI: 10.1039/c2nr11127f
- A micro-/nano-chip and quantum dots-based 3D cytosensor for quantitative analysis of circulating tumor cells / X. Wu, T. Xiao, Z. Luo, R. He, Y. Cao, Z. Guo [et al.] // J. Nanobiotechnol. - 2018. - Vol. 16, № 1. - P. 65. DOI: 10.1186/s12951-018-0390-x
- Borowska S., Brzoska M.M. Metals in cosmetics: implications for human health // J. Appl. Toxicol. - 2015. - Vol. 35, № 6. - P. 551-752. DOI: 10.1002/jat.3129
- Synthesis of copper-nickel nanoparticles prepared by mechanical milling for use in magnetic hyperthermia / I. Ban, J. Stergar, M. Drofenik, G. Ferk, D. Makovec // J. Magn. Magn. Mater. - 2011. - Vol. 323, № 17. - P. 2254-2258. DOI: 10.1016/j.jmmm.2011.04.004
- Angajala G., Ramya R., Subashini R. In-vitro anti-inflammatory and mosquito larvicidal efficacy of nickel nanoparticles phytofabricated from aqueous leaf extracts of Aegle marmelos Correa // Acta Tropica. - 2014. - № 135. - P. 19-26. DOI: 10.1016/j.actatropica.2014.03.012
- Spectroscopic investigation of biosynthesized nickel nanoparticles and its larvicidal, pesticidal activities / G. Elango, S.M. Roopan, K.I. Dhamodaran, K. Elumalai, N.A. Al-Dhabi, M.V. Arasu // J. Photochem. Photobiol. B: Biology. - 2016. -Vol. 162. - P. 162-167. DOI: 10.1016/j.jphotobiol.2016.06.045
- High-throughput transcriptomics: insights into the pathways involved in (nano) nickel toxicity in a key invertebrate test species / S.I.L. Gomes, C.P. Roca, J.J. Scott-Fordsmand, M.J.B. Amorim // Environ. Pollut. - 2019. - № 245. - P. 131-140. DOI: 10.1016/j.envpol.2018.10.123
- Some inferences from in vivo experiments with metal and metal oxide nanoparticles: the pulmonary phagocytosis response, subchronic systemic toxicity and genotoxicity, regulatory proposals, searching for bioprotectors, a self-overview / B. Katsnelson, L. Privalova, M.P. Sutunkova, V.B. Gurvich, N.V. Loginova, I.A. Minigalieva, E.P. Kireyeva, V.Y. Shur [et al.] // Int. J. Nanomed. - 2015. - Vol. 16, № 10. - P. 3013-3029. DOI: 10.2147/IJN.S80843
- Magaye R., Zhao J. Recent progress in studies of metallic nickel and nickel-based nanoparticles' genotoxicity and carcinogenicity // Environ. Toxicol. Pharmacol. - 2012. - Vol. 34, № 3. - P. 644-650. DOI: 10.1016/j.etap.2012.08.012
- Nanomaterial induced immune responses and cytotoxicity / A. Ali, M. Suhail, S. Mathew, M.A. Shah, S.M. Harakeh, S. Ahmad, Z. Kazmi, M.A.R. Alhamdan [et al.] // J. Nanosci. Nanotechnol. - 2016. - Vol. 16, № 1. - P. 40-57. DOI: 10.1166/jnn.2016.10885
- Komick R., Zug K.A. Nickel // Dermatitis. - 2008. - Vol. 19, № 1. - P. 3-8. DOI: 10.2310/6620.2008.07082
- Nano-metal oxides: exposure and engineering control assessment / A. Garcia, A. Eastlake, J.L. Topmiller, C. Sparks, K. Martinez, C.L. Geraci // J. Occup. Environ. Hyg. - 2017. - Vol. 14, № 9. - P. 727-737. DOI: 10.1080/15459624.2017.1326699
- Wu Y., Kong L. Advance on toxicity of metal nickel nanoparticles // Environ. Geochem. Health. - 2020. - Vol. 42, № 7. - P. 2277-2286. DOI: 10.1007/s10653-019-00491-4
- Bioavailability, intracellular mobilization of nickel, and HIF-1a activation in human lung epithelial cells exposed to metallic nickel and nickel oxide nanoparticles / J.R. Pietruska, X. Liu, A. Smith, K. McNeil, P. Weston, A. Zhitkovich, R. Hurt, A.B. Kane // Toxicol. Sci. - 2011. - Vol. 124, № 1. - P. 138-148. DOI: 10.1093/toxsci/kfr206
- Nickel oxide nanoparticles induce cytotoxicity, oxidative stress and apoptosis in cultured human cells that is abrogated by the dietary antioxidant curcumin / M.A. Siddiqui, M. Ahamed, J. Ahmad, M.A.M. Khan, J. Musarrat, A.A. Al-Khedhairy, S.A. Alrokayan // Food Chem. Toxicol. - 2012. - Vol. 50, № 3-4. - P. 641-647. DOI: 10.1016/j.fct.2012.01.017
- Evaluation of the genotoxic properties of nickel oxide nanoparticles in vitro and in vivo / R.F. De Carli, D.D.S. Chaves, T.R. Cardozo, A.P. de Souza, A. Seeber, W.H. Flores, K.F. Honatel, M. Lehmann, R.R. Dihl // Mutat. Res. Genet. Toxicol. Environ. Mutagen. - 2018. - Vol. 836, Pt. B. - P. 47-53. DOI: 10.1016/j.mrgentox.2018.06.003
- Capasso L., Camatini M., Gualtieri M. Nickel oxide nanoparticles induce inflammation and genotoxic effect in lung epithelial cells // Toxicol. Lett. - 2014. - Vol. 226, № 1. - P. 28-34. DOI: 10.1016/j.toxlet.2014.01.040
- Nickel release, ROS generation and toxicity of Ni and NiO micro- and nanoparticles / S. Latvala, J. Hedberg, S. Di Bucchianico, L. Moller, I. Odnevall Wallinder, K. Elihn, H.L. Karlsson // PLoS ONE. - 2016. - Vol. 11, № 7. - P. e0159684. DOI: 10.1371/journal.pone.0159684
- In vitro and in vivo evaluation of the toxicities induced by metallic nickel nano and fine particles / R. Magaye, Y. Gu, Y. Wang, H. Su, Q. Zhou, G. Mao, H. Shi, X. Yue [et al.] // J. Mol. Histol. - 2016. - Vol. 47, № 3. - P. 273-286. DOI: 10.1007/s10735-016-9671-6
- Nano nickel oxide promotes epithelial-mesenchymal transition through transforming growth factor p1/smads signaling pathway in A549 cells / X. Chang, M. Tian, Q. Zhang, J. Gao, S. Li, Y. Sun // Environ Toxicol. - 2020. - Vol. 35, № 12. -P. 1308-1317. DOI: 10.1002/tox.22995
- Evaluation of acute oxidative stress induced by NiO nanoparticles in vivo and in vitro / M. Horie, H. Fukui, K. Nishio, S. Endoh, H. Kato, K. Fujita, A. Miyauchi, M. Shichiri [et al.] // J. Occup. Health. - 2011. - Vol. 53, № 2. - P. 64-74. DOI: 10.1539/joh.L10121
- NiO nanoparticles induce cytotoxicity mediated through ROS generation and impairing the antioxidant defense in the human lung epithelial cells, A549: preventive effect of Pistacia lentiscus essential oil / M. Khiari, Z. Kechrid, F. Klibet, A. Elfeki, M.S. Shaarani, D. Krishnaiah // Toxicol. Rep. - 2018. - Vol. 21, № 5. - P. 480-488. DOI: 10.1016/j.toxrep.2018.03.012
- NiO nanoparticles induce apoptosis through repressing SIRT1 in human bronchial epithelial cells / W.-X. Duan, M.-D. He, L. Mao, F.-H. Qian, Y.-M. Li, H.-F. Pi, C. Liu, C.-H. Chen [et al.] // Toxicol. Appl. Pharmacol. - 2015. - Vol. 286, № 2. - P. 80-91. DOI: 10.1016/j.taap.2015.03.024
- Transcriptome profiling and toxicity following long-term, low dose exposure of human lung cells to Ni and NiO nanoparticles-comparison with NiCl2 / A.R. Gliga, S. Di Bucchianico, E. Akerlund, H.L. Karlsson // Nanomaterials (Basel). -2020. - Vol. 10, № 4. - P. 649. DOI: 10.3390/nano10040649
- Calcium-dependent cyto- and genotoxicity of nickel metal and nickel oxide nanoparticles in human lung cells / S. Di Bucchianico, A.R. Gliga, E. Akerlund, S. Skoglund, I.O. Wallinder, B. Fadeel, H.L. Karlsson // Part. Fibre Toxicol. - 2018. -Vol. 15, № 1. - P. 32. DOI: 10.1186/s12989-018-0268-y
- Genotoxic and mutagenic properties of Ni and NiO nanoparticles investigated by comet assay, y-H2AX staining, Hprt mutation assay and ToxTracker reporter cell lines / E. Akerlund, F. Cappellini, S. Di Bucchianico, S. Islam, S. Skoglund, R. Derr, I.O. Wallinder, G. Hendriks, H.L. Karlsson // Environ. Mol. Mutagen. - 2018. - Vol. 59, № 3. - P. 211-222. DOI: 10.1002/em.22163
- Abudayyak M., Guzel E., Ozhan G. Cytotoxic, genotoxic, and apoptotic effects of nickel oxide nanoparticles in intestinal epithelial cells // Turk. J. Pharm. Sci. - 2020. - Vol. 17, № 4. - P. 446-451. DOI: 10.4274/tjps.galenos.2019.76376
- Nickel oxide nanoparticles exert cytotoxicity via oxidative stress and induce apoptotic response in human liver cells, HepG2 / M. Ahamed, D. Ali, H.A. Alhadlaq, M.J. Akhtar // Chemosphere. - 2013. - Vol. 93, № 10. - P. 2514-2522. DOI: 10.1016/j.chemosphere.2013.09.047
- Concentration-dependent induction of reactive oxygen species, cell cycle arrest and apoptosis in human liver cells after nickel nanoparticles exposure / J. Ahmad, H.A. Alhadlaq, M.A. Siddiqui, Q. Saquib, A.A. Al-Khedhairy, J. Musarrat, M. Ahamed // Environ. Toxicol. - 2015. - Vol. 30, № 2. - P. 137-148. DOI: 10.1002/tox.21879
- Nickel oxide nanoparticles induced transcriptomic alterations in HEPG2 cells / Q. Saquib, M. Siddiqui, J. Ahmad, S. Ansari, M. Faisal, R. Wahab, A. Alatar, A.A. Al-Khedhairy, J. Musarrat // Adv. Exp. Med. Biol. - 2018. - Vol. 1048. -P. 163-174. DOI: 10.1007/978-3-319-72041-8_10
- High-throughput transcriptomics: an insight on the pathways affected in HepG2 cells exposed to nickel oxide nanopar-ticles / Q. Saquib, P. Xia, M.A. Siddiqui, J. Zhang, Y. Xie, M. Faisal, S.M. Ansari, H.A. Alwathnani [et al.] // Chemosphere. -2020. - Vol. 244. - P. 125488. DOI: 10.1016/j.chemosphere.2019.125488
- TGF-P1 mediated Smad signaling pathway and EMT in hepatic fibrosis induced by Nano NiO in vivo and in vitro / Q. Zhang, X. Chang, H. Wang, Y. Liu, X. Wang, M. Wu, H. Zhan, S. Li, Y. Sun // Environ. Toxicol. - 2020. - Vol. 35, № 4. -P. 419-429. DOI: 10.1002/tox.22878
- Cytotoxicity of NiO and Ni (OH) 2 nanoparticles is mediated by oxidative stress-induced cell death and suppression of cell proliferation / M.H. Cambre, N.J. Holl, B. Wang, L. Harper, H.-J. Lee, C.C. Chusuei, F.Y.S. Hou, E.T. Williams [et al.] // Int. J. Mol Sci. - 2020. - Vol. 21, № 7. - P. 2355. DOI: 10.3390/ijms21072355
- Abudayyak M., Guzel E., Ozhan G. Nickel oxide nanoparticles induce oxidative DNA damage and apoptosis in kidney cell line, NRK-52E // Biol. Trace Elem. Res. - 2017. - Vol. 178, № 1. - P. 98-104. DOI: 10.1007/s12011-016-0892-z
- Reactive oxygen species-mediated DNA damage and apoptosis in human skin epidermal cells after exposure to nickel nanoparticles / S. Alarifi, D. Ali, S. Alakhtani, E.S. Al Suhaibani, A.A. Al-Qahtani // Biol. Trace Elem. Res. - 2014. - Vol. 157, № i. - P. 84-93. DOI: 10.1007/s12011-013-9871-9
- Metallic nickel nano- and fine particles induce JB6 cell apoptosis through a caspase-8/AIF mediated cytochrome c-independent pathway / J. Zhao, L. Bowman, X. Zhang, X. Shi, B. Jiang, V. Castranova, M. Ding // J. Nanobiotechnol. - 2009. -Vol. 7. - P. 2. DOI: 10.1186/1477-3155-7-2
- Inhibition of nickel nanoparticles-induced toxicity by epigallocatechin-3-gallate in JB6 cells may be through down-regulation of the MAPK signaling pathways / Y. Gu, Y. Wang, Q. Zhou, L. Bowman, G. Mao, B. Zou, J. Xu, Y. Liu [et al.] // PLoS One. - 2016. - Vol. ii, № 3. - P. e0150954. DOI: 10.1371/journal.pone.0150954
- Dumala N., Mangalampalli B., Grover P. In vitro genotoxicity assessment of nickel (II) oxide nanoparticles on lymphocytes of human peripheral blood // J. Appl. Toxicol. - 2019. - Vol. 39, № 7. - P. 955-965. DOI: 10.1002/jat.3784
- The role of miR-21 in nickel nanoparticle-induced MMP-2 and MMP-9 production in mouse primary monocytes: in vitro and in vivo studies / Y. Mo, Y. Zhang, L. Mo, R. Wan, M. Jiang, Q. Zhang // Environ. Pollut. - 2020. - Vol. 267. -P. 115597. DOI: 10.1016/j.envpol.2020.115597
- Molecular mechanisms underlying nickel nanoparticle induced rat Sertoli-germ cells apoptosis / L. Kong, W. Hu, X. Gao, Y. Wu, Y. Xue, K. Cheng, M. Tang // Sci. Total Environ. - 2019. - Vol. 692. - P. 240-248. DOI: 10.1016/j.scitotenv.2019.07.107
- Effect and mechanism of PI3K/AKT/mTOR signaling pathway in the apoptosis of GC-i cells induced by nickel nanoparticles / Y. Wu, J. Ma, Y. Sun, M. Tang, L. Kong // Chemosphere. - 2020. - Vol. 255. - P. 126913. DOI: 10.1016/j.chemosphere.2020.126913
- In vitro genotoxicity of airborne Ni-NP in air-liquid interface / S. Latvala, D. Vare, H.L. Karlsson, K. Elihn // J. Appl. Toxicol. - 2017. - Vol. 37, № 12. - P. 1420-1427. DOI: 10.1002/jat.3510
- Abudayyak M., Guzel E., Özhan G. Nickel oxide nanoparticles are highly toxic to SH-SY5Y neuronal cells // Neuro-chem. Int. - 2017. - Vol. 108. - P. 7-14. DOI: 10.1016/j.neuint.2017.01.017
- The effects of nickel oxide nanoparticles on tau protein and neuron-like cells: biothermodynamics and molecular studies / M. Hajimohammadjafartehrani, S.H. Hosseinali, A. Dehkohneh, P. Ghoraeian, M. Ale-Ebrahim, K. Akhtari, K. Shahpasand, A.A. Saboury, F. Attar, M. Falahati // Int. J. Biol. Macromol. - 2019. - Vol. 127. - P. 330-339. DOI: 10.1016/j.ijbiomac.2019.01.050
- Biophysical, molecular dynamics and cellular studies on the interaction of nickel oxide nanoparticles with tau proteins and neuron-like cells / S.H. Hosseinali, Z.P. Boushehri, B. Rasti, M. Mirpour, K. Shahpasand, M. Falahati // Int. J. Biol. Macromol. - 2019. - Vol. 125. - P. 778-784. DOI: 10.1016/j.ijbiomac.2018.12.062
- Are in vivo and in vitro assessments of comparative and combined toxicity of the same metallic nanoparticles compatible, or contradictory, or both? A juxtaposition of data obtained in respective experiments with NiO and Mn3O4 nanoparticles / I. Mini-galieva, T. Bushueva, E. Fröhlich, C. Meindl, K. Öhlinger, V. Panov, A. Varaksin, V. Shur [et al.] // Food Chem Toxicol. - 2017. -Vol. 109, Pt. i. - P. 393-404. DOI: 10.1016/j.fct.2017.09.032
- Metallic nickel nanoparticles may exhibit higher carcinogenic potential than fine particles in JB6 cells / R. Magaye, Q. Zhou, L. Bowman, B. Zou, G. Mao, J. Xu, V. Castranova, J. Zhao, M. Ding // PLoS One. - 2014. - Vol. 9, № 4. - P. e92418. DOI: 10.1371/journal.pone.0092418
- Muñoz A., Costa M. Elucidating the mechanisms of nickel compound uptake - a review of particulate and nano-nickel endocytosis and toxicity // Toxicol. Appl. Pharmacol. - 2012. - Vol. 260, № i. - P. 1-16. DOI: 10.1016/j.taap.2011.12.014
- Manke A., Wang L., Rojanasakul Y. Mechanisms of nanoparticle-induced oxidative stress and toxicity // Biomed. Res. Int. - 2013. - Vol. 2013. - P. 942916. DOI: 10.1155/2013/942916
- Cameron K.S., Buchner V., Tchounwou P.B. Exploring the molecular mechanisms of nickel-induced genotoxicity and carcinogenicity: a literature review // Rev. Environ. Health. - 2011. - Vol. 26, № 2. - P. 81-92. DOI: 10.1515/reveh.2011.012
- Mechanisms involved in reproductive toxicity caused by nickel nanoparticle in female rats / L. Kong, X. Gao, J. Zhu, K. Cheng, M. Tang // Environ. Toxicol. - 2016. - Vol. 31, № ii. - P. 1674-1683. DOI: 10.1002/tox.22288
- Acute toxicity of nickel nanoparticles in rats after intravenous injection / R.R. Magaye, X. Yue, B. Zou, H. Shi, H. Yu, K. Liu, X. Lin, J. Xu [et al.] // Int. J. Nanomed. - 2014. - Vol. 9. - P. 1393-1402. DOI: 10.2147/ijn.S56212
- The role of hypoxia inducible factor-ialpha in the increased MMP-2 and MMP-9 production by human monocytes exposed to nickel nanoparticles / R. Wan, Y. Mo, S. Chien, Y. Li, D.J. Tollerud, Q. Zhang // Nanotoxicology. - 2011. - Vol. 5, № 4. - P. 568-582. DOI: 10.3109/17435390.2010.537791
- Токсикологическая оценка наноструктурного диоксида кремния. IV. Иммунологические и аллергологические показатели у животных, сенсибилизированных пищевым аллергеном, и заключительное обсуждение / А.А. Шумакова, B.А. Шипелин, Э.Н. Трушина, О.К. Мустафина, И.В. Гмошинский, Р.А. Ханферьян, С.А. Хотимченко, В.А. Тутельян // Вопросы питания. - 2015. - Т. 84, № 5. - С. 102-111.
- Influence of orally introduced silver nanoparticles on content of essential and toxic trace elements in organism / I.V. Gmoshinski, A.A. Shumakova, V.A. Shipelin, G.Yu. Maltsev, S.A. Khotimchenko // Nanotechnologies in Russia. - 2016. -Vol. ii, № 9-10. - P. 646-652. DOI: 10.1134/S1995078016050074


