Оценка ультраструктурных изменений ассоциации микроорганизмов, участвующих в возникновении и распространении болезней пальцев и копытец крупного рогатого скота, под воздействием комплексного средства «СВ»
Автор: Тарасова Е.Ю., Хузин Д.А., Саитов В.Р., Потехина Р.М., Кашеваров Г.С., Юсупов С.А., Быкова П.В.
Статья в выпуске: 3 т.259, 2024 года.
Бесплатный доступ
Цель исследования заключалась в оценке ультраструктурных изменений ассоциации микроорганизмов (потенциальных возбудителей болезней пальцев и копытец крупного рогатого скота) под воздействием нового комплексного средства «СВ» для сухих копытных ванн. При морфологическом исследовании микроорганизмов на ультраструктурном уровне при воздействии разработанного средства показано, что «СВ» обладает бактерицидными и фунгицидными свойствами, выражающимися просветлением электронной плотности срезов микроорганизмов, нарушением конфигурации бактериальных клеток, увеличением перинуклеарного пространства, вплоть до проявления полных деструктивных процессов. Результаты исследования свидетельствуют о возможности внедрения средства «СВ», разработанного в ФГБНУ «ФЦТРБ-ВНИВИ», при проведении лечебно-профилактических мероприятий в сельхозпредприятиях, неблагополучных по болезням пальцев и копытец крупного рогатого скота.
Сухая копытная ванна, микст-инфекция, ультратонкие срезы, микроорганизм, клеточная стенка, электронная плотность, деструкция, морфометрия
Короткий адрес: https://sciup.org/142242493
IDR: 142242493 | УДК: 57.012.4:57.021:573.4:636.2 | DOI: 10.31588/2413_4201_1883_3_259_237
Текст научной статьи Оценка ультраструктурных изменений ассоциации микроорганизмов, участвующих в возникновении и распространении болезней пальцев и копытец крупного рогатого скота, под воздействием комплексного средства «СВ»
Разработка новых антимикробных средств, обладающих эффективностью в отношение ассоциации потенциальных возбудителей, вызывающих болезни пальцев и копытец крупного рогатого скота, имеет важное научно-практическое значение [1-3, 5].
Немаловажную роль в оценке антимикробного воздействия играют морфологические и особенно электронномикроскопические исследования, позволяющие четко визуализировать ультраструктурное состояние и степень влияния тех или иных реагентов [6].
Мероприятия, направленные на разрыв путей передачи возбудителей инфекционного процесса во внешней среде, в частности с использованием копытных ванн, являются наиболее действенным и общедоступным способом предупреждения возникновения и распространения инфекций у продуктивных животных, что особенно актуально в условиях высокой концентрации животных на ограниченных площадях молочных комплексов [7-12].
Критическое действие биоцида характеризуется полной деструкцией генетического аппарата микроорганизмов и, как следствие их гибелью, при этом важно щадящее действие таких средств на ткани макроорганизма для сохранения их жизнеспособности [4, 14, 15].
В связи с этим, изучение ультраструктуры микроорганизмов, участвующих в патологии дистального отдела конечностей, целенаправленно подвергшихся воздействию различных биоцидных средств, позволяющее объективно документировать степень деструкции микроорганизмов является весьма актуальной задачей.
Цель исследования заключалась в оценке ультраструктурных изменений ассоциации микроорганизмов (потенциальных возбудителей болезней пальцев и копытец крупного рогатого скота) под воздействием нового комплексного средства «СВ» для сухих копытных ванн. В состав, разработанного в ФГБНУ «ФЦТРБ-ВНИВИ», средства «СВ» входят активно действующие вещества, обладающие выраженными фунгицидными, бактерицидными, адсорбционными и противовоспалительными свойствами (соли меди и цинка, поливиниловый спирт, бензолсульфохлорамид натрия, неорганические адсорбенты).
Материал и методы исследований. Объектами исследования являлись разработанное в ФГБНУ «ФЦТРБ-ВНИВИ» средство «СВ» для групповой профилактики и лечения болезней дистального отдела конечностей крупного рогатого скота методом сухих копытных ванн, суточные культуры тест-микроорганизмов ( E. coli М-17, S. aureus
209 Р, S. enterica subsp. enterica serovar Enteritidis ВОЗ, Cl. perfringens АТСС 13124, C. albicans АТСС 10231) и выделенных изолятов (Streptococcus spp., Proteus spp.), выращенных на соответствующих питательных средах.
Для проведения морфологических исследований на ультраструктурном уровне при воздействии «СВ» культуры суспендировали посредством изотонического раствора до достижения 2×109 клеток в 1 см3. Эффективность «СВ» изучали в различных концентрациях и экспозициях с исходными штаммами. Затем проводили центрифугирование при 5000 об/мин в течение 15 минут. Осадки культур дважды отмывали изотоническим раствором.
Электронно-микроскопические исследования выполнялись согласно методике получения ультратонких срезов [5]. Для расчета площади бактериальных клеток на откалиброванных микрофотографиях использовали морфометрическую программу с открытым исходным кодом FIJI–ImageJ [13]. Средние значения показателей вычисляли в программе MS Excel.
Результат исследований. Ранее нами было изучено влияние средства «СВ» на тест-штамм F. necrophorum 8TS630501 [6]. В данный эксперимент включены микроорганизмы, которые в естественных условиях могут являться потенциальными возбудителями, участвующими в возникновении и распространении болезней пальцев и копытец крупного рогатого скота. Среди них имеются кокковые и палочковидные формы, грамположительные, грамотрицательные бактерии, аэробы, анаэробы, факультативные анаэробы и микроскопические грибы (Таблица 1).
Таблица 1 – Микроорганизмы в отношении которых определяли эффективность «СВ»
|
№ п/п |
Название микроорганизма |
Характеристика |
|
1 |
S. aureus |
Грамположительные, факультативные анаэробы, кокки |
|
2 |
Streptococcus spp. |
Грамположительные, факультативные анаэробы, кокки |
|
3 |
Cl. perfringens |
Грамположительные, анаэробы |
|
4 |
E. coli |
Грамотрицательные, аэробы, факультативные анаэробы |
|
5 |
S. enterica |
Грамотрицательные, аэробы |
|
6 |
Proteus spp. |
Грамотрицательные, анаэробы |
|
7 |
C. albicans |
Диплоидный грибок |
На ультратонких срезах бактериальные клетки и микроскопические грибы групп биологического контроля ( S. aureus , Streptococcus spp., Cl. perfringens , E. coli , S. enterica , Proteus spp. и C. albicans ) имеют субмикроскопические признаки, характерные для их нативного состояния.
Кокковые, грамположительные формы S. aureus и Streptococcus spp. округлой конфигурации (Рисунок 1.1), площадью сечения в среднем от 0,39 до 0,47 мкм. Клеточная стенка относительно ровная, под ней располагается относительно ровная цитоплазматическая мембрана, плотно прилегающая к внутреннему слою клеточной стенки и, вместе с тем, тесно связанная с цитоплазмой. На микрофотографиях хорошо просматривается гомогенный плотный слой муреина (пептигликанов) у стафилококков, его толщина в среднем составляет 86,1 нм, стрептококков – 52,1 нм. Важной особенностью ультраструктуры цитоплазмы грамположительных S. aureus и Streptococcus spp. является высокая электронная плотность содержимого, более плотная, чем у рассматриваемых нами грамотрицательных бактерий. Нити ДНК в зоне электронно-плотного вещества не просматриваются.
Грамположительные, споровые, анаэробные Cl. perfringens, крупные веретенообразной формы, ширина (0,8–4,2 мкм), длина до 8 мкм. Клеточная стенка имеет экзоспориум и кортекс (Рисунок 2.5). Центральная часть эндоспоры – это сердцевина или спороплазма.
Грамотрицательные аэробы и анаэробы – E. coli , S. enterica и Proteus spp., палочковидной (Рисунки 1.3, 1.5, 2.3), в том числе округлой формы, в длину от 0,8 до 4,9 мкм, в ширину от 0,3 до 0,8 мкм. На электронограммах хорошо визуализируется извилистая многослойная клеточная стенка и цитоплазматическая мембрана, окружающие бактериальные клетки, характерные для грамотрицательных микроорганизмов. Ультраструктура цитоплазмы E. coli , S. enterica и Proteus spp., характеризуется средней и достаточно высокой электронной плотностью. В центральной части ряда бактерий иногда просматривается нуклеоид.
Интактные диплоидные микроскопические грибы C. albicans на ультратонких срезах имеют овальноокруглую форму (Рисунок 2.1), площадью сечения в среднем 54,3 нм. Клеточная стенка в среднем толщиной 0,05 мкм, ровная, гомогенной структуры, средней электронной плотности. Цитоплазма плотной консистенции, ядро в центральной части, округлой формы с неправильными границами. Цитоплазма клеток C. albicans содержит крупную вакуоль (Рисунок 2.1) с электронноплотным содержимым, от 3 до 4-х липидных капель, митохондрии с плотным матриксом и пластинчатыми кристами, пероксисомы и отдельные цистерны эндоплазматической сети.
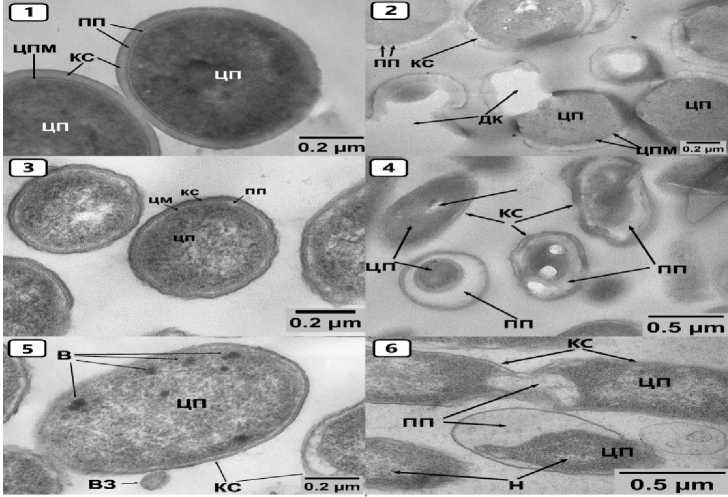
Рисунок 1 – Staphylococcus aureus, E. coli, Salmonella enterica – нативные клетки (1, 3, 5), клетки при воздействии «СВ» (2, 4, 6) . Условные обозначения: В – включения цитоплазмы, ВЗ – везикулы внешней мембраны, ДК – дефекты клеток, КС – клеточная стенка, Н – нуклеоид, ПП – периплазматическое пространство, ЦМ – цитоплазматическая мембрана, ЦП – цитоплазма, ЦПМ – цитоплазматическая мембрана
Бактериальные клетки и микроскопические грибы опытных групп ( S. aureus , Streptococcus spp., Cl. perfringens , E. coli , S. enterica , Proteus spp. и C. albicans ) после воздействия «СВ», претерпевают определенные изменения на субмикроскопическом уровне.
Кокковые, грамположительные формы S. aureus и Streptococcus spp. после применения «СВ» в дозах 2,0 и 4,0 % и экспозициях 30 и 60 минут в целом имеют округло-овальную форму (Рисунок 1.2). В сравнении с контрольными штаммами отмечается незначительное уменьшение размеров площади сечения от 0,38 до 0,43 мкм. На микрофотографиях наблюдается деструкция клеточных стенок с потерей содержимого. Бактерии на срезах становятся менее электронно-плотными, нуклеоид не просматривается.
Грамположительные, споровые, анаэробные Cl. perfringens, после воздействия «СВ» в дозах 8,0 и 10,0 % и экспозициях 1 и 4 часа претерпевают поэтапную деформацию и деструкцию всех слоев спор (Рисунок 2.6). Экзоспориум прогибается или выгибается, после чего идет разрыв и действие СВ на последующие слои споры. Цитоплазма (спороплазма) проявлению уплотняется (уменьшается) и просветляется (Рисунок 2.6). Грамотрицательные аэробы и анаэробы ( E. coli , S. enterica и Proteus spp.), после применения «СВ» в дозах 1,0, 2,0, 4,0 % и экспозициях 30 и 60 минут палочковидной и овальной формы, редко округлой. Размеры несколько меньшие, чем в группах биологического контроля – в длину от 0,8 до 4,9 мкм, в ширину от 0,3 до 0,8 мкм. В клеточной стенке и плазматической мембране отмечается изменение конфигурации, в виде неровностей, углублений (Рисунки 1.4, 1.6, 2.4). Увеличивается периплазматическое пространство, иногда занимающее большую площадь, чем цитоплазма.
Бактериальные клетки имеют меньшую электронную плотность цитоплазмы, чем в группе контроля. В центральной части ряда бактерий цитоплазма становится электронно-прозрачной с видимыми нитями нуклеоида. После воздействия «СВ» на ультраструктуру C. albicans в дозах 1,0, 2,0 % и экспозициях 60 и 180 минут нарушается правильность овальноокруглого строения клеток, размеры клеток не изменяются (площадь сечения в среднем 54,3 нм). Нарушается ровность клеточной стенки (Рисунок 2.2) на всем протяжении и ее гомогенность, при этом она в сравнении с контролем утолщается до 0,11 мкм. Цитоплазма ближе к центру сохраняет плотную консистенцию, но по периферии появляются участки ее просветления. Ядро хорошо видно в центральной зоне, митохондрии определяются с трудом, остальные органоиды не визуализируются. В целом отмечаются деструктивные процессы – хаотичное расположение по периферии фрагментов (обломков) содержимого цитоплазмы.
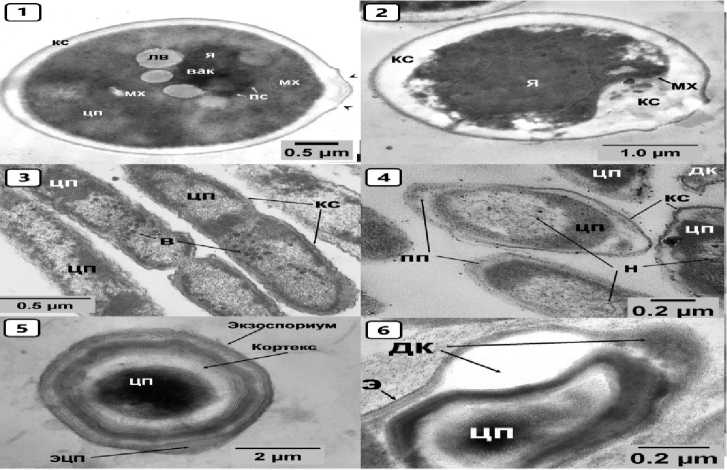
Рисунок 2 – C. albicans, Proteus spp. , Cl. perfringens – нативные клетки (1, 3, 5) ; экспериментальные клетки (2, 4, 6). Условные обозначения : В – включения цитоплазмы, ВАК – вакуоль, ДК – дефекты клеток, КС – клеточная стенка, ЛВ – липидные включения, МХ – митохондрии, ПП – периплазматическое пространство, ПС – пероксисомы, ЦП – цитоплазма, Э – экзоспориум, ЭЦП – экзоспориальная цитоплазма, Я – ядро
Заключение. При морфологическом исследовании микроорганизмов, участвующих в возникновении болезней пальцев и копытец крупного рогатого скота, на ультраструктурном уровне при воздействии разработанного средства, показано, что «СВ» обладает выраженными бактерицидными и фунгицидными свойствами, выражающимися просветлением электронной плотности срезов микроорганизмов, нарушением конфигурации бактериальных клеток, увеличением перинуклеарного пространства, вплоть до проявления полных деструктивных процессов.
Список литературы Оценка ультраструктурных изменений ассоциации микроорганизмов, участвующих в возникновении и распространении болезней пальцев и копытец крупного рогатого скота, под воздействием комплексного средства «СВ»
- Анализ рынка дезинфицирующих средств, используемых в отдельных животноводческих хозяйствах Приволжского федерального округа / Е. Ю. Тарасова, А. М. Тремасова, Д. А. Хузин [и др.] // Ветеринарный врач. – 2022. – № 3. – С. 58-66.
- Антимикробная активность экспериментальных образцов средства для сухих ножных ванн / Е. Ю. Тарасова, Р. М. Потехина, Д. А. Хузин [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2023. – Т. 256. – № 4. – С. 254–259.
- Болезни пальцев и копытец у коров, их профилактика и лечение / Д. А. Хузин, Т. Р. Гайнутдинов, Ф. А. Хусниев [и др.] // Ветеринарный врач. – 2014. – № 5. – С. 24-29.
- Изучение антимикробной активности новых дезинфицирующих средств из группы четвертичных аммониевых соединений / Ф. М. Нехайчик, Д. Н. Мингалеев, Л. Е. Матросова [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2020. – Т. 244. – № 4. – С. 134-138.
- Методические рекомендации по электронно-микроскопическим исследованиям биологических объектов / А. В. Иванов, А. А. Иванов, А. Н. Чернов [и др.]. – Казань: ФГБНУ «Росинформагротех», 2011. – 67 с.
- Оценка ультраструктурных изменений Fusobacterium necrophorum под воздействием средств, применяемых для групповой профилактики болезней дистального отдела конечностей копытных животных / К. В. Перфилова, Г. С. Кашеваров, В. Р. Саитов [и др.] // Вестник Курской государственной сельскохозяйственной академии. – 2023. – № 1. – С. 153-158.
- Плесневые грибы и пиогенные бактерии – причины болезней пальцев и копытец у коров / Р. М. Потехина, Д. А. Хузин, В. Ю. Титова [и др.] // Ветеринарный врач. – 2021. – № 2. – С. 44-49.
- Профилактическая эффективность различных средств и методов лечения некротических поражений копытец крупного рогатого скота / Х. Н. Макаев, Д. А. Хузин, Р. М. Потехина, Н. А. Мухамметшин // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2012. – Т. 209. – С. 202-206.
- Роль сапрофитных и условно-патогенных микроорганизмов в возникновении и распространении оппортунистических инфекций крупного рогатого скота / Д. А. Хузин, С. А. Юсупов, А. И. Ерошин [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2022. – Т. 252. – № 4. – С. 267-272.
- Экспериментальный сочетанный микотоксикоз свиней на фоне инфекционной нагрузки / Э. И. Семенов, Л. Е. Матросова, С. А. Танасева [и др.] // Сельскохозяйственная биология. – 2022. – Т. 57. – № 2. – С. 371-383.
- Этиология, патогенез и меры борьбы с некробактериозом крупного рогатого скота / Д. А. Хузин, Х. Н. Макаев, Ф. А. Хусниев [и др.] // Ветеринарный врач. – 2010. – № 5. – С. 49-51.
- Эффективность препаратов для ножных ванн при поражениях копытец крупного рогатого скота / А. А. Сидорчук, Ю. В. Белкина, А. В. Пчельников // Актуальные проблемы ветеринарной медицины, биотехнологии и морфологии: сборник трудов Национальной научно-практической конференции. – Кинель: Самарский ГАУ, 2021. – С. 168-172.
- Fiji: an open-source platform for biological-image analysis / J. Schindelin, I. Arganda-Carreras, E. Frise [et al.] // Nature methods. – 2012. – Vol. 9. – No 7. – P. 676–682.
- Metabolite-associated enzymatic properties of microorganisms with an antagonistic effect on Aspergillus and Fusarium fungi, pathogenic for crops and farm animals / S. R. Khabirova, I. I. Idiyatov, E. A. Shuralev, A. M. Tremasova // IOP Conference Series: Earth and Environmental Science. – 2021. – Т. 723. – P. 022022.
- The ABC-Type Efflux Pump MacAB is involved in protection of Serratia marcescens against aminoglycoside antibiotics, polymyxins, and oxidative Stress / T. V. Shirshikova, L. K. Kamaletdinova, L. E. Matrosova [et al.] // mSphere. – 2021. – Vol. 6. – № 2. – P. 1-16.


