Оценка уровня индивидуальной гигиены рта до и после проведенного лучевого лечения на фоне местного лечения мукозитов
Автор: Аванесов А.М., Гвоздикова Е.Н., Нгуен З.Х., Голуб С.В., Кандакова Е.Ю., Хайдар Д.А.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Медицинская практика
Статья в выпуске: 4 т.20, 2020 года.
Бесплатный доступ
Настоящая работа выполнена в рамках большого исследования кафедры общей и клинической стоматологии РУДН, проводимого на базе Российского научного центра рентгенорадиологии, и посвящена оценке эффективности и определению значимости протокола гигиены полости рта у пациентов, проходящих лучевую терапию по поводу злокачественных новообразований.Материалы и методы. В стоматологическом кабинете Российского научного центра рентгенорадиологии (ФГБУ «PНЦPP» Минздрава России) с 2017 до 2019 были обследованы59 пациентов, в том числе 48 пациентов, получавших лучевую терапию по поводу плоскоклеточного рака орофарингеальной области (группа I) и 11 соматически и стоматологических здоровых людей (группа II). Все пациенты I группы имели морфологически подтвержденный диагноз плоскоклеточный рак и получали лучевую терапию. Больные I группы были разделены на 3 подгруппы согласно возрасту.Всем пациентам I и II групп осуществлялась оценка состояния уровня индивидуальной гигиены рта. Пациентам I группы оценка выполнялась до начала курса и после проведенной лучевой терапии с помощью индекса гигиены Федорова-Володкиной. Также проводилась количественная оценка микробного налета и зубного камня при помощи критериев индекса Grееn-Vеrmilliоn (OHI-S). Для определения интенсивности воспалительных заболеваний пародонта использовался индекс PMA. Определение индексов выполнялось по стандартным методикам. Пациентам II группы оценка уровня индивидуальной гигиены проводилась при первичном осмотре, а также в порядке контроля после данных рекомендаций по уходу за полостью рта.Результаты. В подгруппах Iа, Iб и Iв после окончания курса противоопухолевого лечения значения всех индексов имели тенденцию к уменьшению, несмотря на отягощенный соматический статус пациентов и сложное, тяжелое противоопухолевое лечение. После лечения снижение показателя индекса PMA составило 16,21%, 14,09%, 16,75% в подгруппахIa, Iб и Iв (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Злокачественные новообразования головы и шеи, гигиена полости рта, лучевая терапия, мукозит
Короткий адрес: https://sciup.org/149132154
IDR: 149132154
Текст научной статьи Оценка уровня индивидуальной гигиены рта до и после проведенного лучевого лечения на фоне местного лечения мукозитов
Благодаря совершенствованию терапевтических и диагностических методов лечения, выживаемость больных с опухолями головы и шеи постепенно увеличивалась сразу по ряду нозологий и локализаций [2, 11, 17, 19, 20]. Наиболее важными факторами, влияющими на выбор тактики лечения, являются: гистологическая форма опухоли, локализация, предшествующие оперативные вмешательства и лучевая терапия, распространенность первичной опухоли, состояние пациента (возраст, общее состояние, профессия, желание самого пациента) [1, 6, 8, 21].
Существенным фактором, ограничивающим радикальность противоопухолевого лечения, является возникновение осложнений. Во рту может развиваться оральный мукозит, который нарушает сразу несколько функций человека: речь, глотание, жевание, сон, питание. Эффективность профилактики и лечения орального мукозита отличается по данным разным авторов [5, 7], но все авторы сходятся во мнении, что не существует на 100% эффективных методов его профилактики и лечения.
Из-за побочных эффектов лечения, пациенты испытывают значительное снижение качества их работы и социальной жизни [4, 16, 18], что может негативно отразиться на последующей реабилитации.
На наш взгляд, применение даже элементарных гигиенических процедур, мотивация пациента, обучение его методам гигиенического ухода за полостью рта способны эффективно предотвращать развитие орального мукозита, а также снижать его интенсивность.
Целью данной работы является разработка комплекса гигиенических мероприятий и оценка его эффективности для профилактики и лечения орального мукозита.
Материалы и методы
В стоматологическом кабинете Российского научного центра рентгенорадиологии с 2017 до 2019 были обследованы 59 пациентов, в том числе 48 пациентов по поводу плоскоклеточного рака орофарингеальной области (группа I), получавших лучевую терапию в отделении дистанционной лучевой терапии, и 11 пациентов соматически и стоматологически здоровых (группа II).
Больные I группы были разделены на 3 подгруппы по возрасту: Iа – пациенты с 18 до 44 лет, Iб – пациенты с 45 до 59 лет, Iв – пациенты с 60 до 74 лет. Все пациенты подгрупп Iа, Iб, и Iв получали местное стоматологическое лечение ежедневно по следующей схеме:
-
1. Исключение алкоголя, курения, горячей, острой, твердой пищи во время проведения облучения.
-
2. Чистка зубов 2 раза в день (утром и вечером). Рекомендуется применять щетки с мягкой щетиной, зубную пасту без раздражающих веществ, идеально –детскую. Запрещается применение зубной нити.
-
3. Полоскание полости рта отварами шалфея, ромашки, препаратом действия Тонзинал 6–8 раз в сутки. После приема пищи полоскание рта антисептическими растворами Хлоргексидин 0,05% или Мирамистин 0,01%. После полоскания рекомендуется наносить на слизистую оболочку рта касторовое масло для увлажнения. Использование спиртосодержащих растворов для полоскания для профилактики и лечения мукозита противопоказано.
-
4. Увлажнение губ вазелином, гигиенический губной помадой 3–4 раза в день.
-
5. Минимизация (или вообще отказ) применения частичных/полных съёмных зубных протезов, так как они могут вызвать чрезмерное раздражение слизистой оболочки и усилить болевой синдром.
-
6. Ежедневно аппликации препаратов пролонгированного действия пластин ЦМ-1, пластин Фармадонт 1-2 (назначались в зависимости от выраженности клинических симптомов) 2–3 раза в день.
-
7. Контроль уровня индивидуальной гигиены, измерение гемомикроциркуляции по каждому этапу лучевого терапии: до облучения, 0–20 Гр, 22–40 Гр, 42 Гр и более и после облучения у стоматолога.
Препараты пролонгированного действия Тонзинал, пластины ЦМ-1 и Фармадонт 1-2 производятся в России, по современным промышленным технологиям, при этом имеют доступную для большинства пациентов стоимость. Препараты гипоаллергенные и нетоксичны для организма больного, обладают местным противовоспалительным, сорбирующим, противомикробным действием. Пролонгированность данных препаратов обеспечивается их длительной фиксацией на поверхности слизистой оболочки рта. Необходимо отметить, что в итоге суммарное воздействие на слизистую составляет 7–8 часов, что значительно выше по сравнению с использованием традиционных форм препаратов.
Лучевая терапия была предоставлена всем пациентам на линейных ускорителях Clinac C2100 (Varían) с энергией фотонов 6 МэВ, использовался стандартный режим фракционирования (РОД – 2 Гр, 5 фракций в неделю). Дозиметрическое планирование проводилось на системе планирования Ecliрse, производства кампании Varian, с использованием алгоритма расчета доз по изоцентрическому методу с учетом кривизны поверхности и неоднородности тканей. Конечным результатом планирования стало создание индивидуального плана лечения, с указанием параметров облучения (количества мониторных единиц, угла поворота гэнтри, линейных размеров лечебных полей, параметров раскрытия многолепесткового коллиматора и т.д.). При проведении дозиметрического планирования обязательным условием было покрытие лечебного объема не менее чем 95% изодозы. Облучение включало зону первичной опухоли и регионарные лимфатические узлы, объем и дозы облучения выбирались лечащим врачом радиотерапевтом с учетом клинических рекомендаций МЗ РФ, а также международных рекомендаций RTOG (Radiation Therapy Oncology Group – Группа лучевой терапии онкологии) и MSKCC (Memorial Sloan-Kettering Cancer Center – Мемориальный онкологический центр им. Слоуна-Кеттеринга). Первичная опухоль и вовлеченные лимфоузлы облучались вплоть до СОД 66–70 Гр, лимфатические узлы высокого риска прогрессирования облучались вплоть до СОД 54–60 Гр, профилактическое облучение других групп лимфоузлов низкого риска прогрессирования проводилось до СОД 44–46 Гр. При проведении дозиметрического планирования также контролировалась доза на критические органы и ткани, использовались следующие ограничения (D max – максимальная доза, D mean – средняя доза, D × cm3 – доза в указанном объеме в кубических сантиметрах, D × % доза в указанном объеме в процентах):
-
• ствол мозга D max <54 Гр;
-
• зрительные нервы D max <54 Гр;
-
• зрительный перекрест D max <54 Гр;
-
• спинной мозг D max <45 Гр;
-
• плечевое сплетение D max <65 Гр;
-
• слизистая ротовой полости D mean <40 Гр;
-
• подчелюстная слюнная железа D mean <39 Гр;
-
• околоушная слюнная железа D mean <26 Гр для каждой железы, D 20 cm3<20 Гр для суммарного объема желез, D 50% <30 Гр для каждой железы;
-
• улитка (внутреннее ухо) D mean <45 Гр,
-
• глаза D mean <35 Гр, D max <50 Гр;
-
• хрусталики D max <25 Гр для опухолей основания черепа, D max <5 Гр для низко расположенных опухолей;
-
• гортань D mean <45 Гр;
-
• нижняя челюсть D max <70 Гр;
-
• пищевод D mean <45 Гр.
До начала курса и после проведенной лучевой терапии всем пациентам I группы и II группы проводилась оценка гигиенического состояния полости рта с помощью индекса гигиены Федорова-Володкиной, а также определение количественной оценки микробного налета и зубного камня при помощи критериев индекса Grееn-Vеrmilliоn (OHI-S). Для определения интенсивности воспалительных заболеваний пародонта использовался индекс PMA. Определение индексов проводилось по стандартным методикам.
Результаты
Оценку гигиенического состояния полости рта, а именно количественную оценку микробного налета и зубного камня проводили с помощью стоматологических индексов Федорова-Володкиной (таблица 1) и индекса Grееn-Vеrmilliоn (OHI-S) (таблица 2). Оценка интенсивности воспаления в тканях пародонта проводилась с помощью индексов PMA (таблица 3).
Таблица 1. Показатели стоматологических индексов Федорова-Володкиной у пациентов до и после лечения во всех группах
|
Группа (возраст, лет) |
Число пациентов |
Значение индекса Федорова-Володкиной |
||||
|
до лечения |
0–20 Гр |
22–40 Гр |
≥ 42 Гр |
после лечения |
||
|
Ia (18–44) |
9 |
2,1±0,3 |
2,0±0,4 |
1,8±0,3 |
1,6±0,3 |
1,6±0,3 |
|
Iб (45–59) |
28 |
2,9±0,4 |
2,5±0,4 |
2,2±0,5 |
2,1±0,5 |
1,9±0,5 |
|
Iв (60–74) |
11 |
3,3±0,4 |
2,7±0,4 |
2,5±0,5 |
2,2±0,5 |
2,1±0,5 |
|
Всего I группа |
48 |
2,8±0,6 |
2,4±0,5 |
2,2±0,5 |
2,0±0,5 |
1,9±0,5 |
|
II группа |
11 |
2,0±0,1 |
1,2±0,1 |
|||
Как видно из таблицы 1 и рисунка 1, полученные значения индекса Федорова-Володкиной до лечения, как по отдельности в каждой подгруппе, так и в I и II группах в целом, соответствуют неудовлетворительным и плохим показателям. После проведенного малоинвазивного стоматологического лечения (избирательное пришлифовывание зубов, лечение кариеса, коррекция навыков индивидуальной гигиены рта) наблюдается снижение показателей индексов Федорова-Володкиной у I группы с 2,8 до 1,9, а во II группе – с 2,02 до 1,24 (p<0,05). Это доказывает, что даже на фоне лучевого лечения малоинвазивные стоматологические мероприятия способны положительно отразиться на стоматологическом статусе всех пациентов.
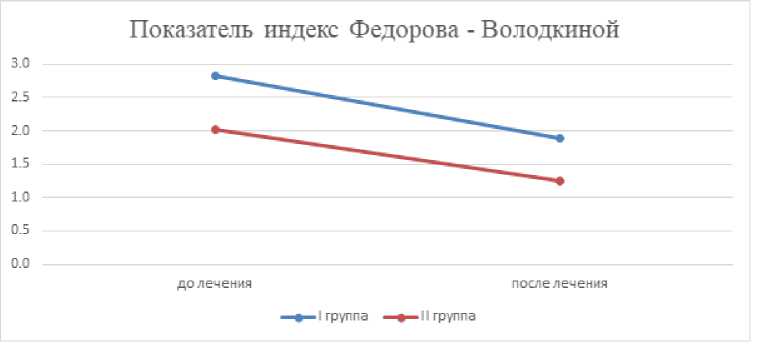
Рис. 1. Показатели индекса Федорова-Володкиной у пациентов I и II группы до и после противоопухолевого лечения пациентов.
Как видно из рисунка 2, в подгруппе Iа показатель индекса Федорова-Володкиной до лечения был 2,1±0,3, а после первичного стоматологического осмотра и рекомендаций на каждом этапе противоопухолевого лечения происходило снижение данного индекса до итогового значения после завершения лечения 1,6±0,3, что показывает улучшение гигиенической картины во рту у данной группы пациентов.
la (18-44)
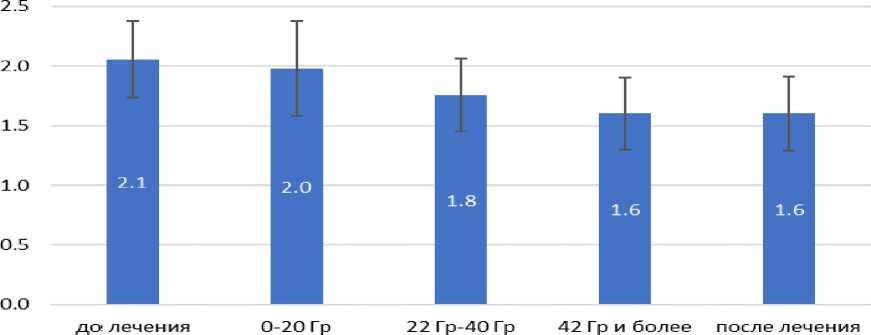
Рис. 2. Диаграмма изменения значений индекса Федорова-Володкиной у Iа подгруппы на фоне противоопухолевого лечения.
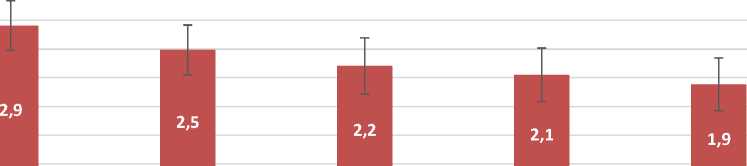
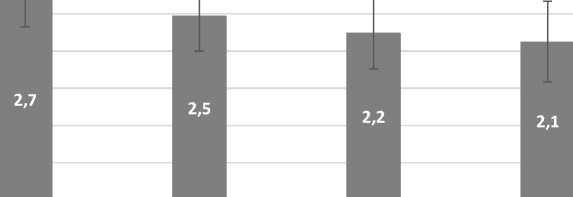
Аналогичные результаты получены в подгруппах Iб и Iв (Рис. 3 и 4).
Iб (45-59)
4,0
3,5
3,0
2,5
2,0
1,5
1,0
0,5
0,0
до лечения 0-20 Гр 22 Гр-40 Гр 42 Гр и более после лечения
Рис. 3. Диаграмма изменения значений индекса Федорова – Володкиной у Iб подгруппы на фоне противоопухолевого лечения.
Iв (60-74)
4,0
I

до лечения 0-20 Гр 22 Гр-40 Гр 42 Гр и более после лечения
3,5
3,0
2,5
2,0
1,5
1,0
0,5
0,0
Рис. 4. Диаграмма изменения значений индекса Федорова-Володкиной у Iв подгруппы на фоне противоопухолевого лечения.
Результаты определения значений индекса Grееn-Vеrmiliоn представлены в таблице 2
и на рисунке 5.
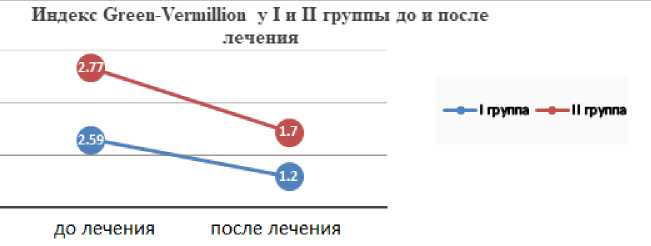
Рис. 5. Диаграмма изменения показателей индекса Grееn-Vеrmilliоn у пациентов I и II группы до и после противоопухолевого лечения.
Таблица 2. Показатели стоматологического индекса Grееn-Vеrmilliоn до и после противоопухолевого лечения во всех группах
|
Группа (возраст, лет) |
Число пациентов |
Значение индекса Grееn-Vеrmilliоn |
||||
|
до лечения |
0–20 Гр |
22–40 Гр |
≥42 Гр |
после лечения |
||
|
Ia (18–44) |
9 |
2,48±0,85 |
1,33±0,08 |
1,63±0,09 |
1,10±0,08 |
1,02±0,09 |
|
Iб (45–59) |
28 |
2,60±0,91 |
1,36±0,08 |
1,79±0,08 |
1,15±0,07 |
1,14±0,09 |
|
Iв (60–74) |
11 |
2,79±0,94 |
2,22±0,17 |
1,49±0,18 |
1,64±0,15 |
1,40±0,20 |
|
Всего I группа |
48 |
2,59±0,89 |
2,14±0,20 |
1,64±0,12 |
1,3±0,10 |
1,2±0,18 |
|
II группа |
11 |
2,77±0,12 |
1,70±0,16 |
|||
Полученные результаты демонстрируют, что и в I группе, и во II группе показатели индекса Grееn-Vеrmiliоn снижаются. В I группе это снижение составляет 38,62%, во II подгруппе – 53,66%, p<0,05.
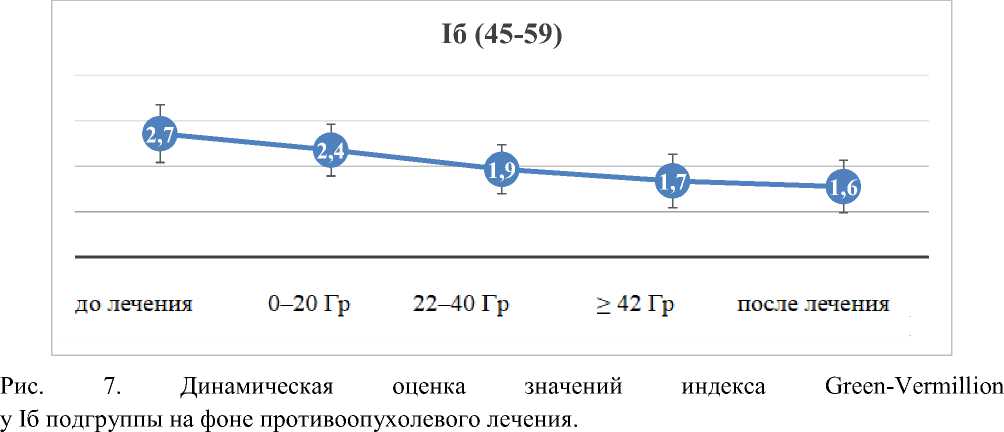
Результаты динамической оценки значений индекса Grееn-Vеrmilliоn у Iа, Iб и Iв подгрупп представлены на рисунках 6, 7 и 8.
Ia (18-44)


до лечения
0–20 Гр 22–40 Гр
≥ 42 Гр после лечения
Рис. 6. Динамическая оценка значений индекса у Iа подгруппы на фоне противоопухолевого лечения.
Grееn-Vеrmilliоn
Iв (60-74)
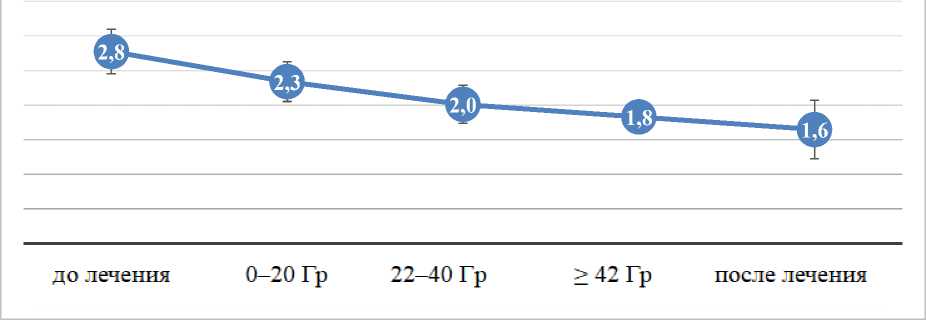
Рис. 8. Динамическая оценка значений индекса Grееn-Vеrmilliоn у Iв подгруппы на фоне противоопухолевого лечения.
Как видно из рисунков 6–8, снижение значений индекса Grееn-Vеrmiliоn происходит в каждой подгруппе исследования: в подгруппе Iа на 38,46%, в подгруппе Iб на 40,74%, в подгруппе I в на 2,85%.
Результаты сравнения интенсивности воспалительных заболеваний пародонта у I и II групп до и после оказания стоматологического пособия на фоне противоопухолевого лечения представлены в таблице 3.
Таблица 3 . Индекс РМА до и после проведенного лечения
|
Группа (возраст, лет) |
Значение индекса РМА |
||||
|
до лечения |
0–20 Гр |
22–40 Гр |
≥ 42 Гр |
после лечения |
|
|
Ia (18–44) |
42,06±2,30 |
28,13±1,55 |
30,75±1,50 |
31,75±1,16 |
35,25±1,76 |
|
Iб (45–59) |
46,07±0,10 |
32,84±0,99 |
35,03±0,93 |
37,29±0,91 |
39,19±0,95 |
|
Iв (60–74) |
51,92±0,99 |
37,23±0,96 |
39,22±0,96 |
40,81±0,92 |
43,22±0,90 |
|
II группа |
23,10±0,83 |
14,72±8,70 |
|||
Исходные значения индекса РМА во всех трех подгруппах практически не отличались и составляли в процентах 40,1±2,3 в Ia подгруппе, 46,1±0,1 в Iб подгруппе и 51,9±1,0 в Iв подгруппе. В ходе исследования с применением стоматологического сопровождения, а также соблюдения всех правил ухода за полостью рта на 1-ом этапе лечения (0–22 Гр) были получены значительные улучшения во всех подгруппах: 28,13±1,55, 32,84±0,99 и 37,23±0,23
в подруппах 1а, 1б и 1в, соответственно. На 2-ом этапе лучевой терапии отмечалось ухудшение показателей во всех подгруппах, кроме подгруппы Ia, что, вероятно, связано с тем, что пациенты этой подгуппы более внимательно и ответственно подошли к уходу за полостью рта.
После окончания курса противоопухолевого лечения в подгруппах Iа, Iб и Iв значения всех индексов имеют тенденцию к уменьшению. После лечения зарегистрировано снижение показателя индекса PMA на 16,21%, 14,09% и 16,75%. Индекс Grееn-Vеrmilliоn снизился на 58,87%, 56,15% и 43,77%, соответственно. У пациентов II группы после стоматологического сопровождения отмечено улучшение показателей PMA на 30,74% и Grееn-Vеrmilliоn на 38,62% по сравнению с состоянием до стоматологического лечения. Заключение
В результате проведенного исследования, нами разработаны следующие принципы осуществления гигиенических мероприятий в полости рта у данной категории пациентов.
-
1. У всех пациентов необходимо оценивать исходный уровень индивидуальной гигиены рта с помощью гигиенических и пародонтологических индексов и мотивировать пациентов к соблюдению индивидуальной гигиены рта.
-
2. Гигиеническое обучение пациентов с опухолями головы и шеи должно обязательно включать информирование пациентов об исходном состоянии гигиены полости рта и возможных последствиях при ее недостатке. Также обязательным является обучение пациентов правилам и методам ухода за полостью рта, подбор средств индивидуальной гигиены рта.
-
3. У пациентов с ксеростомией гигиенические мероприятия приобретают особо важное значение, ввиду отсутствия у этих пациентов слюны, как важного фактора защиты слизистой оболочки рта от механических и бактериальных повреждений.
-
4. Назначение медикаментозных препаратов (антисептиков, препаратов пролонгированного действия) – это необходимая мера для профилактики осложнений лучевого лечения для минимизации дискомфорта у пациентов.
-
5. Пациентам с риском развития остеорадионекроза следует максимально устранять все травматические факторы в полости рта, в том числе необходимо отказаться от съёмного зубного протеза.
Обсуждение
Побочные эффекты противоопухолевого лечения, возникающие во рту, являются одним из основным источником болевых ощущений у пациентов, проходящих лучевую терапию [3, 4, 8, 22]. Действительно, облучение головы и шеи может необратимо повредить слизистую оболочку полости рта, мышцы и кости, что может привести к постоянной ксеростомии, обширному кариесу, мягкому остеонекрозу челюсти [23].
Побочные эффекты лучевой терапии включают: мукозит, кровотечение во рту, сухость во рту, изменения вкуса, рвоту, диарею, слабость, уязвимость к инфекциям, легкое кровотечение при чистке зубов. Мукозит может возникнуть у до 40% пациентов, проходящих лечение лучевой терапией [6–8, 10, 15], и его частота зависит от диагноза пациента, возраста, здоровья полости рта, а также типа, дозы и частоты приема суммарной очаговой дозы ионизирующего излучения [1, 2, 24, 25]. Острая тяжедая форма мукозита вызывает значительный дискомфорт и нарушение способности пациента есть и глотать, что может привести к перерывам в лечении, необходимости использования зонда для питания и госпитализации [12–14].
Пациенты, которые проходят лечение от злокачественных новообразований орофарингеальной области, могут минимизировать развитие осложнений в полости рта, изменив свое отношении к гигиене [9]. Соблюдение протокола индивидуальной гигиены полости рта может предотвратить развитие таких осложнений.
Список литературы Оценка уровня индивидуальной гигиены рта до и после проведенного лучевого лечения на фоне местного лечения мукозитов
- Аванесов А.М. Клинические и организационные предпосылки к возникновению осложнений в полости рта у больных, получающих лучевое и химиолучевое лечение. Опухоли головы и шеи. Приложение. Сборник тезисов. 2017. № 2. С. 94.
- Аванесов А.М., Гвоздикова Е.Н. Определение групп стоматологического риска развития лучевого мукозита у больных с плоскоклеточным раком орофарингеальной области на фоне лучевой терапии. Лучевая диагностика и терапия. 2017. Т. 2. № 8. С. 66.
- Алымов Ю.В, Мудунов А.М., Алиева С.Б. и др. Роль препаратов гиалуроновой кислоты в профилактике и лечении лучевого мукозита полости рта и ротоглотки. Опухоли головы и шеи. 2019.Т. 9. № 3. С. 29-37.
- Гвоздикова Е. Н. Особенности тактики лечения оральных мукозитов у онкологических больных на фоне лучевого лечения и\или химиотерапии автореф. дис. … канд. мед. наук. Москва. 2017. 42 с.
- Петровский В.Ю., Цаллагова З.С., Абдуллаева С.Т., Измайлов Т.Р. Клинический случай первично-множественного злокачественного заболевания: плоскоклеточный рак языка Т2NоМо (2006 г.) и базальноклеточный рак кожи грудной клетки Т1NоМо (2019 г). Вестник РНЦРР. 2019. Т. 19. № 3. С. 133-142.
- Титова В.А., Снигирева Г.П., Петровский В.Ю., Телышева Е.Н. Современные подходы к лучевому лечению опухолей полости рта. Сибирский онкологический журнал. 2016. Т. 15. № 5. С. 47-54.
- Шипилова А.Н., Титова В.А., Крейнина Ю.М. и др. Низкоинтенсивное лазерное воздействие в программах реабилитации больных, получающих химиолучевое лечение (лекция). Вестник РНЦРР. 2011. № 11-4. С. 264-276.
- Annica A., Torgny A., Bodil F.M., et al. Explorative study on quality of life in relation to salivary secretion rate in head and neck cancer patients treated with radiotherapy. Head Neck. 2014. V.38. No. 5. P. 782-791. 37
- Diaz-Sanchez R.M., Pachón-Ibáñez J., Marín-Conde F., et al. Double-blind, randomized pilot study of bioadhesive chlorhexidine gel in the prevention and treatment of mucositis induced by chemoradiotherapy of head and neck cancer. Med Oral Patol Oral Cir Bucal. 2015. V. 20. No. 3. e378-385.
- Psoter W.J., Aguilar M.L. Head and Neck Cancer Radiation Therapy with and Without Chemotherapy May Result in Decreased Health-related Quality of Life Followed by a Return to Baseline Over a 1-year Period. J Evid Based Dent Pract. 2015. V. 15. No. 1. P. 25-27.
- Volpato L.E., Silva T.C., Oliveira T.M., et al. Radiation therapy and chemotherapy-induced oral mucositis. Bras. Otorrinolaringol. 2007. V. 73. No. 4. P. 562-568.
- Mercadante V., Lodi G., Porter S., Fedele S. Questionable validity of the systematic review and meta-analysis by Lovelace et al. on management of radiotherapy-induced salivary hypofunction and xerostomia in patients with oral or head and neck cancer. Oral Surg Oral Med Oral Pathol Oral Radiol. 2015. V. 119. No. 1. P. 120-121.
- Nardi G.M., Sabatini S., Lauritano D., et al. Effectiveness of two different desensitizing varnishes in reducing tooth sensitivity: a randomized double-blind clinical trial. Oral Implantol (Rome). 2016. V. 9. No. 4. P. 185-189.
- Rice N., Polyzois I., Ekanayake K., et al. The management of osteoradionecrosis of the jaws -- A review. Surgeon. 2015. V. 13. No. 2. P. 101-109.
- Silvestre-Rangil J., Silvestre F.J. Clinico-therapeutic management of osteoradionecrosis: a literature review and update. Med Oral Patol Oral Cir Bucal. 2011. V. 16. No.7. P. 900-904.
- Mangalath U., Aslam S.A., Abdul Khadar A.H., et al. Recent trends in prevention of oral cancer. J Int Soc Prev Community Dent. 2014. V. 4. Suppl. 3. P. S131-138.
- Devi S., Singh N. Dental care during and after radiotherapy in head and neck cancer. Natl J Maxillofac Surg. 2014. V. 5. No. 2. P. 117-125.
- Beech N., Robinson S., Porceddu S., Batstone M. Dental management of patients irradiated for head and neck cancer. Aus Dent J. 2014. V. 59. No. 1. P. 20-28. 38
- Al-Mamgani A., Levendag P.C., van Rooij P., et al. Intensity-modulated radio therapy followed by a brachytherapy boost for oropharyngeal cancer. Head Neck. 2013. V. 35. No. 12. P. 1689-1697.
- Epstein J.B., Thariat J., Bensadoun R.J., et al. Oral complications of cancer and cancer therapy: From cancer treatment to survivorship. CA Cancer J Clin. 2012. V. 62. No. 6. P. 400-422.
- Plemons J.M., Al-Hashimi I., Marek C.L. Managing xerostomia and salivary gland hypofunction: executive summary of a report from the American Dental Association Council on Scientific Affairs. J Am Dent Assoc. 2014. V. 145. No. 8. P. 867-873.
- Sessions D. G., Spector G. J., Lenox J., et al. Analysis of treatment results for oral tongue cancer. Laryngoscope. 2002. V. 112. No. 4. P. 616-625.
- Tang J. A., Rieger J.M, Wolfaardt J.F. A review of functional outcomes related to prosthetic treatment after maxillary and mandibular reconstruction in patients with head and neck cancer. Int J.Prosthodont. 2008. V. 21. No. 4. P. 337-354.
- Wohlschlaeger A. Prevention and treatment of mucositis: a guide for nurses. J Pediatr Oncol Nurs. 2004. V. 21. No. 5. P. 281-287.
- Vera-Llonch M., Oster G., Hagiwara M., Sonis S. Oral Mucositis in Patients Undergoing Radiation Treatment for Head and Neck Carcinoma. Cancer. 2006. V. 106. No. 2. P. 329-336.


