Оценка возможности использования хрена обыкновенного (Armoracia rusticana) при консервировании папоротника
Автор: Хижняк Сергей Витальевич, Мучкина Елена Яковлевна, Демиденко Галина Александровна
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технология продовольственных продуктов
Статья в выпуске: 11, 2020 года.
Бесплатный доступ
Цель исследования - оценить возможность использования хрена обыкновенного (Armoracia rusticana) как антимикробного средства для увеличения срока хранения папоротника, консервированного методом засола. В модельных экспериментах использовали ранее выделенные авторами культуры галофильных архей, вызывающие порчу соленого папоротника. Культуры выращивали аэробно на жидкой питательной среде при оптимальной температуре с добавлением измельченного корня или измельченных листьев хрена обыкновенного. Стартовый титр культур перед внесением хрена был равен 2 · 107 клеток/мл, что в 10 раз превышает максимальную зафиксированную численность указанных галофильных архей в соленом папоротнике. Контролем служили культуры тех же архей без добавления хрена. Установлено, что и листья, и корень хрена обыкновенного снижают численность галофильных архей. В зависимости от органов хрена обыкновенного, используемых в качестве антимикробной добавки, и от вносимой дозы численность популяции архей снижается на 45-93 %. Антимикробный эффект носит временный характер. После первоначального падения численности популяция архей переходит к экспоненциальному росту за счет выживших клеток. Дополнительные эксперименты показали, что возобновление роста связано не с адаптацией архей к антимикробным веществам хрена, а с исчезновением этих веществ в питательной среде. Листья хрена обыкновенного обладают существенно более высокой антимикробной активностью в отношении галофильных архей, чем корень. Предложены математические модели для прогнозирования длительности антимикробного эффекта и снижения численности популяции галофильных архей в зависимости от дозы вносимого хрена. Модели демонстрируют высокое соответствие экспериментальным данным (коэффициенты детерминации R2 равны 0,992-0,999).
Папоротник соленый, галофильные археи, хрен обыкновенный, антимикробная активность
Короткий адрес: https://sciup.org/140250559
IDR: 140250559 | УДК: 664.8 | DOI: 10.36718/1819-4036-2020-11-232-239
Текст научной статьи Оценка возможности использования хрена обыкновенного (Armoracia rusticana) при консервировании папоротника
Введение. Консервирование растительного сырья является одним из важнейших технологических процессов сохранения свойств его и качества. Ранее нами было показано, что консервированный путем засола в насыщенном солевом растворе папоротник-орляк (Pteridium aquilinum (L.) Kuhn) подвержен микробиологической порче. Агентом, вызывающим порчу, являются археи семейства Halobacteriaceae, способные к росту в средах, содержащих до 360 г/л хлорида натрия (что соответствует насыщенному раствору) [1, 2]. Таким образом, даже применение насыщенных солевых растворов при консервировании не предотвращает развитие упомянутых микроорганизмов, что ведет к снижению качества соленого папоротника при транспортировке и хранении. В этой связи нами была проверена возможность использования хрена обыкновенного (Armoracia rusticana G. Gaertn., B. Mey. & Scherb.) в качестве дополнительного антимикробного средства при консервировании папоротника методом засола. Выбор хрена обыкновенного в качестве вспомогательного консерванта был обусловлен тем, что данный вид является природным источником антимикробных веществ [3–5]; распространен и доступен для массового производства; дешевый в применении.
Кроме этого, хрен обыкновенный является популярным культурным растением, так как его листья и корни используются в кулинарии и медицине (традиционной и народной). В состав хрена входят: витамины (А, С, РР, группы В), минералы (натрий, железо, фосфор, калий, медь, сера и другие), углеводы, белки, жиры, эфирное масло, клетчатка, органические кислоты, смолистые вещества, фитонциды. Его анти-оксидативная активность обусловлена наличием в его составе глюкосинолатов, придающих овощу своеобразный аромат. Их активность усиливается при его обработке.
Цель исследования : изучение возможности использования хрена обыкновенного в качестве натурального антимикробного средства для продления срока хранения соленого папоротника-орляка.
Задачи : изучение влияния корней и листьев хрена на динамику численности культуры гало-фильных архей, вызывающих порчу соленого папоротника; анализ зависимости антимикробного эффекта вегетативных органов хрена обыкновенного от их дозировки.
Объекты и методы исследования . Объектом исследования являлись листья и корни свежесобранного хрена обыкновенного. Тест-объектом служила накопительная культура экстремально галофильных архей, выделенных из засоленного папоротника производства ООО «Курагинское промыслово-охотничье хозяйство».
Археи выращивали на жидкой среде следующего состава, г/л: пептон ферментативный – 9,0; гидролизат казеина – 8,0; дрожжевой экстракт – 3,0; натрия гидроортофосфат – 2,0; натрия хлорид – 300,0; pH среды – 7,2±0,2. Эксперименты проводили в пробирках емкостью 5 мл, в которые вносили по 1 мл культуры с начальным титром 2·107 клеток/мл. В опытных вариантах в культуры вносили измельченные листья или корни хрена обыкновенного в дозировке 50; 100; 150 и 200 мг/мл. Контролем служила культура без внесения хрена. Инкубацию пробирок проводили аэробно при температуре +35 °С во влажной камере для предотвращения высыхания культур. Подсчет численности клеток архей проводили методом прямого счета с использованием фазово-контрастной микроскопии с периодичностью от 8 до 24 ч в зависимости от динамики роста культуры.
Результаты исследования. В дозировке 200 мг/мл культуры корень хрена обыкновенного полностью подавляет рост культуры и вызывает снижение численности клеток в соответствии с эмпирической моделью:
П = —, (1)
Т+Я! ' '
где n - численность клеток; т - продолжительность культивирования; a 0 и a 1 – коэффициенты.
После подбора коэффициентов методом наименьших квадратов коэффициент детерминации R2 = 0,999698, т. е. модель демонстрирует практически полное совпадение с экспериментальными данными (рис. 1). Падение численности архей в присутствии корня хрена происходит за счет отмирания клеток. Тем не менее, даже при максимальном падении численности в культуре присутствуют живые клетки, в том числе – делящиеся (рис. 2).
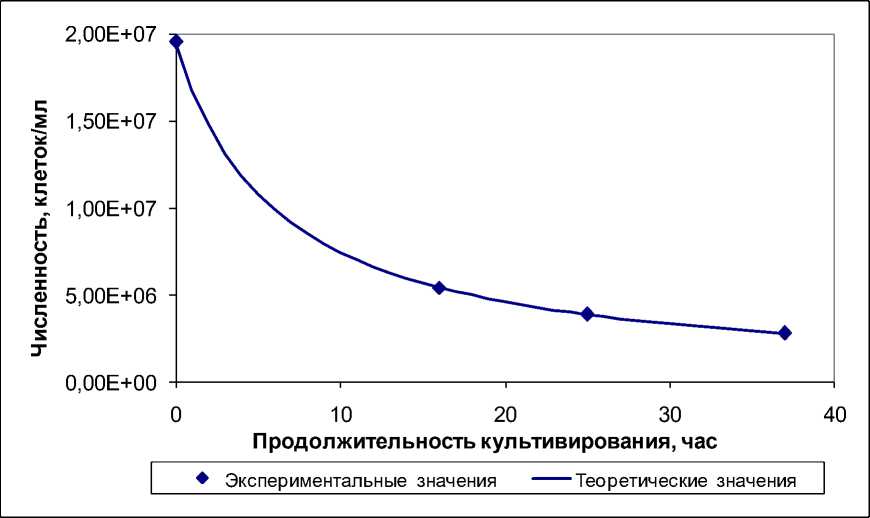
Рис. 1. Динамика численности галофильных архей в присутствии 200 мг/мл корня хрена обыкновенного
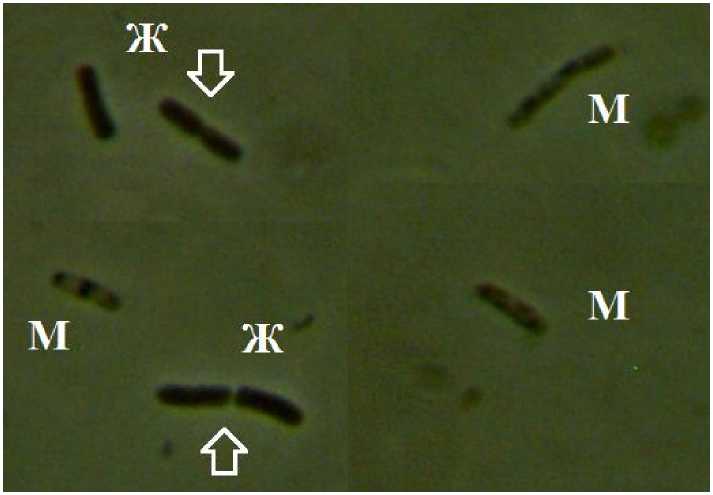
Рис. 2. Живые (Ж) и мертвые (М) клетки культуры архей в присутствии 200 мг/мл корня хрена обыкновенного (стрелками показаны делящиеся клетки )
Между 50-м и 60-м ч культивирования в присутствии корня хрена численность жизнеспособных клеток галофильных архей достигает минимального значения, соответствующего 12 % от исходного титра. Однако при дальнейшем культивировании культура возобновляет экспоненциальный рост за счет выживших клеток (рис. 3).
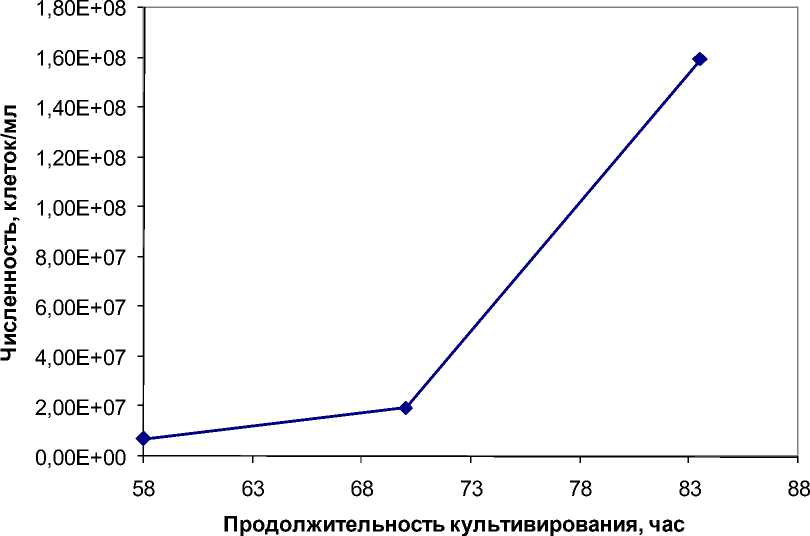
Рис. 3. Динамика численности галофильных архей в присутствии 200 мг/мл корня хрена обыкновенного после 58-го часа культивирования
Важно отметить, что зафиксированная на стадии восстановления численности максимальная удельная скорость роста галофильных архей (0,225 ч-1) соответствует максимальной удельной скорости роста, зафиксированной в контрольных вариантах (от 0,217 до 0,255 ч-1). Это свидетельствует о полном исчезновении антимикробной активности корня хрена обыкновенного в отношении указанных микроорганизмов после 50–60 ч инкубирования.
Дополнительные эксперименты показали, что исчезновение антимикробной активности корня хрена обыкновенного не связано с адаптацией культуры к входящим в состав корня ан- тимикробным соединениям. Так, при пересадке на свежую среду с внесением свежего корня хрена обыкновенного, динамика численности культуры, выращенной в присутствии 200 мг/мл корня хрена обыкновенного, идентична аналогичной динамике культуры, ранее не инкубировавшейся в присутствии корня хрена.
Динамика численности изучаемых архей при внесении меньших количеств измельченного корня хрена (50; 100 и 150 мг/мл) соответствует динамике, наблюдающейся при внесении 200 мг/мл. После фазы снижения численности культуры наступает фаза экспоненциального (либо близкого к экспоненциальному) роста (рис. 4).
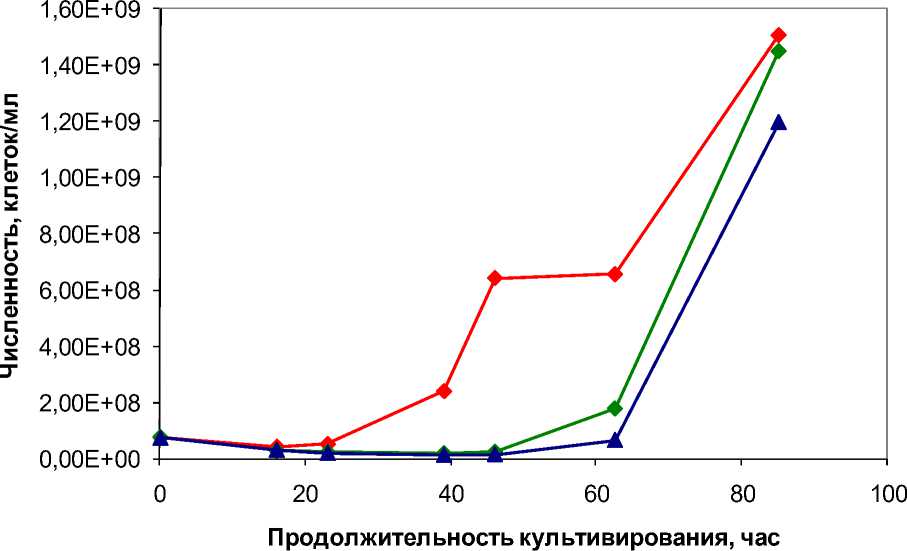
50 мг/мл 100 мг/мл 150 мг/мл
Рис. 4. Динамика численности галофильных архей в присутствии 50; 100 и 150 мг/мл корня хрена обыкновенного
Однако период антимикробного действия с практически линейно зависит от количества уменьшением дозировки сокращается, причем внесенного корня хрена (рис. 5).
продолжительность антимикробного действия
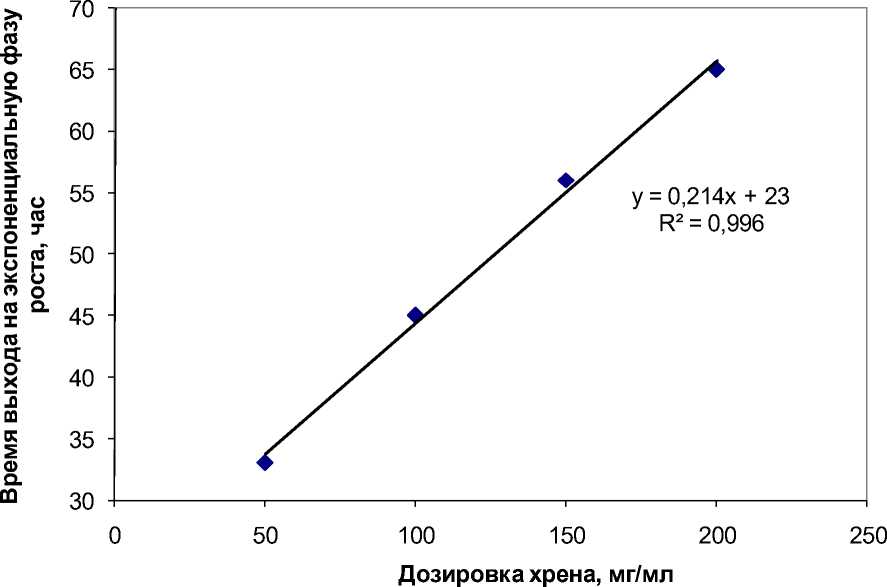
Рис. 5. Продолжительность антимикробного действия корня хрена обыкновенного в отношении галофильных архей в зависимости от дозировки
Учитывая, что в фазу антимикробной активности численность клеток галофильных архей снижается согласно уравнению (1), а продолжительность упомянутой фазы линейно зависит от дозы внесенного корня хрена, зависимость максимального снижения численности клеток от дозы внесенного корня хрена может быть описана уравнением
,
где n – численность клеток к исходному значению, %; C – дозировка хрена, мг/мл; b 0 , b 1 и b 2 – коэффициенты.
После подбора коэффициентов методом наименьших квадратов данное уравнение дает очень высокое совпадение расчетных значений с экспериментальными данными (R2 = 0,992) (рис. 6).
Антимикробный эффект листьев хрена обыкновенного был существенно сильнее, чем эффект корня. Так, при внесении 200 мг/мл листьев фаза антимикробной активности продолжалась примерно на 100 ч дольше, чем при использовании такой же дозировки корня, а падение численности галофильных архей было более глубоким – до 7 % от первоначального титра. Тем не менее, как и в случае с корнем, фаза антимикробной активности сменялась фазой экспоненциального роста, во время которой удельная скорость роста не отличалась от аналогичного показателя для контрольных вариантов.
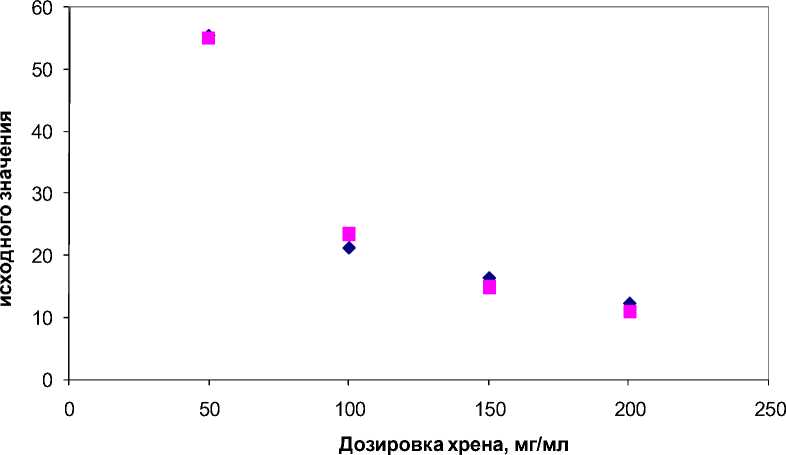
♦Экспериментальные значения ■ Теоретические значения
Рис. 6. Влияние дозировки корня хрена обыкновенного на максимальное снижение численности галофильных архей в фазе антимикробной активности
Выводы. Корень и листья хрена обыкновенного проявляют ярко выраженный антимикробный эффект в отношении галофильных архей, вызывающих порчу соленого папоротника-орляка. Однако этот эффект носит временный характер и при длительном культивировании исчезает, а культура архей возобновляет экспоненциальный рост за счет выживших клеток, доля которых варьирует от 7 до 55 % в зависимости от типа (листья или корни) и количества внесенного растительного материала.
Листья хрена обыкновенного обладают существенно более высокой антимикробной активностью в отношении изучаемых галофиль-ных архей, чем корни. Это проявляется в существенно (в три раза) более продолжительном периоде антимикробного действия и более глубоком падении процента жизнеспособных клеток при использовании листьев в сравнении с аналогичными показателями при использовании корня в той же дозировке.
Следует учитывать, что исследования антимикробной активности хрена обыкновенного проводились на культурах, имеющих экстремально высокий начальный титр (2·107 клеток/мл), инкубирующихся на богатой питательной среде при оптимальной температуре (+35 °С). В то же время при консервировании папоротника методом засола состав субстрата и температура хранения существенно менее благоприятны для развития галофильных архей, а их максимальный зафиксированный нами титр (2,6·106 кле-ток/мл) на порядок ниже, чем в обсуждаемых экспериментах.
С учетом сказанного можно ожидать, что при засоле папоротника антимикробный эффект хрена обыкновенного будет существенно выше, чем в модельных экспериментах. В этой связи листья хрена можно рекомендовать для производственных испытаний в качестве средства, увеличивающего срок хранения продукции за счет подавления развития экстремально гало-фильных архей.
Список литературы Оценка возможности использования хрена обыкновенного (Armoracia rusticana) при консервировании папоротника
- Хижняк С.В., Демиденко Г.А., Мучкина Е.Я. Микрофлора консервированной растительной продукции при использовании насыщенного рассола в качестве консерванта // Вестник КрасГАУ. 2015. № 11 (110). С. 120-124.
- Хижняк С.В., Янова М.А., Мучкина Е.Я., Демиденко Г.А. Влияние концентрации соли на скорость роста экстремально галофильных архей // Известия высших учебных заведений. Сер. Пищевая технология. 2016. № 1 (349). С. 34-37.
- Зелепуха С.И. Антимикробные свойства растений, употребляемых в пищу. Киев: Наукова думка, 1973. 193 с.
- Лизоцим Armoracia rusticana: аминокислотный состав, форма макромолекулы / Н.К. Черно, Г.В. Крусир, О.В. Севастьянова [и др.] // Харчова наука i технологiя. 2010. № 1. С. 31-34. URL: http://nbuv.gov.ua/UJRN/Khnit_2010_1_12.
- Schaechter M. Desk Encyclopedia of Microbiology. New York: Academic Press, 2009. 1276 p.


