Оптимизация состава питательной среды пробиотического штамма B. subtilis Ga24 - продуцента кормовых ферментов
Автор: Мухаммадиев риШ.С., Валиуллин Л.Р., Мухаммадиев риН.С., Мухаммадиева А.С., Сайфуллин А.С., Глинушкин А.П.
Статья в выпуске: 2 т.250, 2022 года.
Бесплатный доступ
Работа посвящена исследованию оптимизации состава питательной среды для повышения продукции кормовых ферментов штаммом B. subtilis GA24. Наибольшее повышение активности ксиланаз и протеаз бациллы отмечали при внесении в среду ксилана в концентрации 1,0 % и пептона в концентрации 0,75 % (9,9±0,3 и 51,3+1,3 Ед/мл, соответственно). Дальнейшее изучение способности данного штамма к продукции кормовых ферментов открывает перспективу создания биопрепарата, объединяющего свойства пробиотика и кормового фермента, для птицеводства.
Ксиланазы, протеазы, бактерии вида bacillus subtilis
Короткий адрес: https://sciup.org/142234475
IDR: 142234475 | УДК: 577.151.5:
Текст научной статьи Оптимизация состава питательной среды пробиотического штамма B. subtilis Ga24 - продуцента кормовых ферментов
Эффективность отрасли сельского хозяйства, специализирующей на промышленном производстве яиц и мяса птицы, обусловливается многими факторами, основным из которых является полноценное кормление со сбалансированным рационом питания и усвояемость питательных веществ кормов [1, 8]. В рацион сельскохозяйственной птицы преимущественно включают семена зерновых и зернобобовых культур, представляющие собой главные источники питательных соединений и энергии. Тем не менее, они в своем составе содержат антипитательные факторы – некрахмалистые полисахариды, которые способны ухудшать перевариваемость корма, снижать его конверсию, а также негативно воздействовать на кишечную микробиоту, определяющих здоровье и продуктивность птицы, качество получаемой от них продукции [8, 12].
Для противодействия негативным свойствам структурных полисахаридов современные подходы безопасного кормления птицы включают применение биологически активных средств на основе экзогенных ферментов и микроорганизмов, действие которых нацелено на восполнение энзимной активности пищеварительных секретов желудочно-кишечного тракта и нормализацию микробного кишечного баланса животных [12, 14]. Вследствие этого данные биопрепараты следует рассматривать в качестве альтернативы стимуляторам роста и продуктивности (кормовым антибиотикам) сельскохозяйственных животных.
В последнее время наибольший интерес представляют пробиотические штаммы споровых бактерий вида Bacillu s subtilis , которые способны активно секретировать широкий спектр внеклеточных ферментов гидролитического действия (ксиланаз, целлюлаз, амилаз, пектиназ, фитаз, протеаз и липаз) в связи с перспективами создания на их основе энзимно-пробиотических комплексов [5, 6]. Так, способностью продуцировать гидролитические ферменты характеризуется пробиотический штамм B. subtilis 945, составивший основу добавки к корму бацелл [2]. Различные штаммы B. subtilis – продуценты экстрацеллюлярных гидролаз изучаются как основа препаратов, которые направлены на снижение вязкости содержимого желудочно-кишечного тракта сельскохозяйственных птиц и ингибирования роста вызывающих некротический энтерит Clostridium perfringens [8].
Эффективность процесса расщепления структурных полисахаридов индивидуальными штаммами микроорганизмов, главным образом, обусловлена уровнем активности образуемых ими гидролазных комплексов [2, 7]. В связи с этим энзимологами постоянно проводятся исследования, ориентированные на поиск наиболее продуктивных микробных штаммов и разработку эффективных стратегий повышения образования ими кормовых ферментов.
Цель исследования – оптимизация состава питательной среды для повышения продукции кормовых ферментов глубинной культуры B. subtilis GA24.
Материал и методы исследований. В работе применяли пробиотический штамм B. subtilis GA24 из коллекции микроорганизмов Всероссийского научноисследовательского института фитопатологии (ФГБНУ ВНИИФ). Культуру бациллярного штамма поддерживали пересевами на мясопептонной агаризованной среде (МПА). Хранение бациллы осуществляли в пробирках со скошенной питательной средой при температуре 4°C, пересев – через 6-8 недель.
Пробиотический штамм B. subtilis GA24 выращивали на жидкой минеральной питательной среде [7, 9]. В качестве индукторов синтеза кормовых ферментов использовались ксиланаза и пептон. Исследуемый продуцент культивировали в конической колбе на качалке (180 об./мин) в аэробных условиях при 36°C в течение 36 ч. Биомассу бациллы отделяли путем центрифугирования (10 тыс. g) в течение 8 мин [10]. Культуральный супернатант применяли для оценки ее на активность ксиланаз и протеаз.
Установление активности ксиланазы пробиотического штамма проводили согласно калориметрическому методу, который основан на определении восстанавливающих углеводов, образующихся при их воздействии на субстрат ксилан [11, 12]. При этом за единицу гидролазной активности принимали определенное количество ферментов, которое в стандартных условиях катализирует процесс расщепления субстрата с образованием 1 мкмоли восстанавливающих сахаров. Активность протеазы устанавливали согласно универсальной методике с применением в качестве субстрата казеина [8]. При этом за 1 единицу активности фермента принимали определенное его количество, катализирующее отщепление 1 мкмоль тирозина в опытных условиях. Гидролазную активность ферментов выражали в Ед./мл.
Статистическую обработку экспериментальных данных проводили стандартным методом вариационной статистики с использованием программы Microsoft Office Excel 2010.
Результат исследований. Согласно современным представлениям, продукция внеклеточных ферментов в условиях глубинного культивирования микроорганизмов представляет собой процесс, регуляция которого обусловлена источниками их питания [9, 12]. При этом химическая природа источников, их соотношение в культуральной среде способны оказывать существенное влияние на уровень и спектр (состав) синтезируемых микроорганизмами экзоферментов. Анализ данных литературы показывает, что лучшими источниками углеродного и азотного питания, которые могут способствовать наибольшей секреции ксиланаз и протеаз штаммами споровых бактерий вида Bacillu s subtilis , служат ксилан и пептон [9, 13]. В связи с этим, нами были проведены исследования влияния различных концентраций вышеуказанных углерод- и азотсодержащего субстратов на синтез кормовых ферментов пробиотического штамма B. subtilis GA24 в условиях его глубинного культивирования.
Результаты исследования показали, что наибольшее повышение активности ксиланаз и протеаз пробиотического штамма B. subtilis GA24 отмечается при внесении в культуральную среду ксилана в концентрации 1,0 % и пептона в концентрации 0,75 % (Таблица 1).
Исследована зависимость динамики накопления кормовых ферментов и микробной биомассы в условиях глубинного культивирования штамма B. subtilis GA24 на среде, содержавшей ксилан 10,0 г/л и пептон 7,5 г/л. Результаты исследования представлены на рисунке 1.
Таблица 1 – Влияние состава культуральной среды на продукцию кормовых ферментов
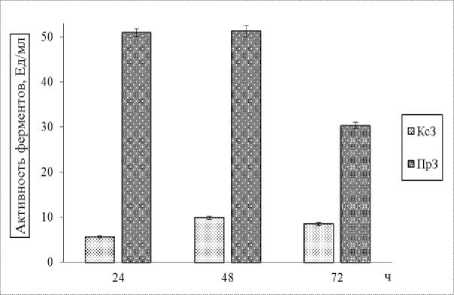
Рисунок 1 – Динамика накопления ксиланаз (КсЗ) и протеаз (ПрЗ) (слева), микробной
пробиотического штамма B. subtilis GA24
|
Ксилан, г/л |
Пептон, г/л |
Активность ксиланаз, Ед/мл |
Активность протеазы, Ед/мл |
|
5,0 |
2,5 |
4,6 ± 0,1 |
30,3 ± 0,7 |
|
5,0 |
5,0 |
5,0 ± 0,1 |
40,5 ± 1,0 |
|
5,0 |
7,5 |
5,3 ± 0,1 |
46,2 ± 1,2 |
|
10,0 |
2,5 |
8,7 ± 0,2 |
33,6 ± 0,8 |
|
10,0 |
5,0 |
9,4 ± 0,2 |
44,9 ± 1,1 |
|
10,0 |
7,5 |
9,9 ± 0,3 |
51,3 ± 1,3 |
*Различия между вариантами статистически значимы (Р<0,05). Установление активности ферментов проводили на первые сутки культивирования биомассы (справа) в условиях глубинного культивирования штамма B. subtilis GA24 на среде, содержавшей ксилан 10,0 г/л и пептон 7,5 г/л (различия между значениями протеазной активности и роста бациллы на 12-е и 24-е ч культивирования не значимы)
Как видно из рисунка, активная секреция протеаз изучаемым штаммом в культуральную среду происходит в первые 12 часов его роста и к 24 часам выращивания достигает значения гидролазной активности (51,3 ± 1,3) Ед/мл. Ферментативная активность ксиланаз возрастала в первые 24 часа выращивания бациллярного штамма, параллельно с повышением выхода микробной биомассы культуры. При этом ксиланазная активность составила (9,9 ± 0,3) Ед/мл.
Результаты нашего исследования согласуются с данными зарубежных авторов, установившие максимальные значения активности ксиланаз в культуральной жидкости бактерий рода Bacillus в конце экспоненциальной фазы и достаточно высокий уровень активности данного фермента во время стационарной фазы роста культуры [13, 14]. В литературе также имеются сведения, что в условиях глубинного выращивания бацилл активное накопление протеолитических ферментов происходит в конце фазы экспоненциального роста [9].
Заключение. Результаты по оптимизации содержания углерод- и азотсодержащего субстратов в условиях глубинного культивирования пробиотического штамма B. subtilis GA24 показали, что наибольшее повышение активности ксиланаз и протеаз бациллы отмечается при внесении в среду ксилана в концентрации 1,0 % и пептона в концентрации 0,75 % - (9,9±0,3) и (51,3±1,3) Ед/мл, соответственно. Дальнейшее изучение способности данного штамма к продукции кормовых ферментов открывает возможности применения его в биотехнологических исследованиях, а также для создания биопрепарата, объединяющего свойства пробиотика и кормового фермента.
Исследование выполнено при поддержке гранта Президента Российской Федерации № МК-2439.2022.5 («Новые подходы с использованием пробиотиков, метабиотиков и бактериальных ферментов для коррекции вызванных действием патогенных факторов микроэкологических нарушений кишечника молодняка сельскохозяйственной птицы»).
Резюме
Список литературы Оптимизация состава питательной среды пробиотического штамма B. subtilis Ga24 - продуцента кормовых ферментов
- Артемьева, Е. А. Определение анатомической активности Биоспорина на штаммах возбудителей особо опасных болезней / Е. А. Артемьева, Л. А. Мельникова, А. П. Родионов, А. К. Галиуллин // Вопросы нормативно- правового регулирования в ветеринарии. – 2021. – № 3. – С. 36-39.
- Валиуллин, Л. Р. Бактерии – антагонисты возбудителей кишечных инфекций и продуценты комплекса целлюлаз как основа для создания добавок, объединяющих функции пробиотика и кормового фермента / Л. Р. Валиуллин, С. Риш. Мухаммадиев, Рин. С. Мухаммадиев [и др.] // Достижения науки и техники АПК. – 2021. – Т. 35. – № 9. – С. 60-66.
- Гибадуллин А. Р. Нормирование биологических контаминантов при выращивании сельскохозяйственных культур, определение острой токсичности микотоксина из группы трихотеценов / А. Р. Гибадуллин // В сборнике: студенческая наука – аграрному производству. материалы 79-ой студенческой (региональной) научной конференции. – Казань. – 2021. – С. 39-43.
- Егоров В. И. Эффективность применения сорбентов при хронической интоксикации цыплят имидаклопридом / В. И. Егоров, Д. В. Алеев, К. Ф. Халикова [и др.] // Ветеринария. –2021. – № 3. – С. 55-58.
- Маланьев А. В. Клинико-гематологические и биохимические показатели крови на фоне отравления цианопиретроидами и лечении / А. В. Маланьев, К. Ф. Халикова, Г. Р. Ямалова [и др.] // Ветеринарный врач. – 2020. – № 5. – С. 46-53.
- Мухаммадиев, Р. С. Ферментативная активность гидролаз штаммов микроорганизмов, перспективных для создания на их основе кормовых добавок и биологических консервантов / Р. С. Мухаммадиев, Р. С. Мухаммадиев, И. Г. Каримуллина [и др.] // Сборник научных трудов национальной научно-практической конференции «Состояние, проблемы иперспективы развития современной науки». – 2021. – С. 127-133.
- Семёнов Э. И. Случаи массового отравления животных, птиц и рыб в некоторых регионах российской федерации и стран СНГ / Э. И. Семёнов, А. М. Тремасова, Л. Е. Матросова, И. Р. Кадиков [и др.] // Ветеринария. – 2021. – № 8. – С. 39-44.
- Феоктистова, Н. В. Биопрепараты микробного происхождения в птицеводстве / Н. В. Феоктистова, А. М. Марданова, М. Т. Лутфуллин [и др.] // Учен. зап. Казан. ун-та. Сер. Естеств. науки. – 2018. – Т. 160 – С. 395-418.
- Хайруллин Д. Д. Влияние увмк "лизунец" на интерьерные показатели молочных коз / Д. Д. Хайруллин, Ш. К. Шакиров, А. Р. Кашаева [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2020. – Т. 243. – № 3. – С. 273-276.
- Abo-State, M. Optimization of cellulase(s) and xylanase production by thermophilic and alkaliphilic Bacillus isolates / M. Abo-State, M. Ghaly, E. Abdellah // American-Eurasian J. Ari. & Environ. Sci. – 2013. – Vol. 13. – № 4. – Р. 553-564.
- Ho, H. L. Xylanase production by Bacillus subtilis using carbon source of inexpensive agricultural wastes in two different approaches of submerged fermentation (SmF) and solid state fermentation (SsF) / H. L. Ho // Journal of Food Processes & Technology. – 2015. – Vol. 6. – № 4. – Р. 1-9.
- Kiarie, E. The role of added feed enzymes in promoting gut health in swine and poultry / E. Kiarie, L. F. Romero, C. M. Nyachoti // Nutr. Res. Rev. – 2013. – Vol. 26. – № 1. – P. 71-88.
- Matos, M. Production of xylanases by Bacillus subtilis E44 under submerged fermentation conditions / M. Matos, A. Valdivia, Z. Rodríguez [et al.] // Cuban J. Agric. Sci. – 2018. – Vol. 52. – № 3. – Р. 329-336.
- Park, Y. H. Application of probiotics for the production of safe and highquality poultry meat / Y. H. Park, F. Hamidon, Ch. Rajangan // Korean J. Food Sci. Anim. Resour. – 2016. – Vol. 36. – № 5. – Р. 567-576.


