Опыт использования лучевой терапиипри BRCA-позитивном раке яичников
Автор: Городнова Татьяна Васильевна, Баранов Сергей Борисович, Тятьков Станислав Александрович, Шевкунов Лев Николаевич, Соколенко Анна Петровна, Котив Христина Богдановна, Имянитов Евгений Наумович, Берлев Игорь Викторович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.16, 2017 года.
Бесплатный доступ
Клетки опухоли с нарушенной функцией генов BRCA 1/2 не способны восстанавливать разрывы двойной цепи ДНК и демонстрируют повышенную чувствительность к различным ДНК-повреждающим агентам.Представлен опыт успешного лечения двух больных распространенным раком яичников, носительниц мутации в гене BRCA1, которые получали лучевую терапию c химиотерапией препаратами платины.В результате лечения был зафиксирован полный клинический ответ. Период до прогрессирования в первом случае составил 11 мес, во втором - 8 мес
Рак яичников, репарация днк, платиносодержащая химиотерапия, лучевая терапия
Короткий адрес: https://sciup.org/140253991
IDR: 140253991 | УДК: 618.11-006.6-056.7-08:615.849.1:575.113 | DOI: 10.21294/1814-4861-2017-16-4-103-107
Текст научной статьи Опыт использования лучевой терапиипри BRCA-позитивном раке яичников
Радиация вызывает нарушение синтеза молекулы ДНК путем разрыва нитей ДНК. После облучения различные молекулярные системы клетки вовлекаются в репарацию этих повреждений. Множество работ посвящено описанию роли генов репарации BRCA 1/2 в формировании ответа на ДНК-повреждающие агенты посредством механизмов гомологичной рекомбинации [1–3]. Опухолевые клетки с нарушенной функцией генов BRCA 1/2 не способны восстанавливать разрывы двойной цепи ДНК и демонстрируют повышенную чувствительность к различным ДНК-повреждающим агентам. Ранее в НИИ онкологии им. Н.Н. Петрова в ряде исследований была доказана высокая эффективность препарата цисплатин, обладающего ДНК-повреждающим эффектом, у больных раком яичников (РЯ) носительниц мутаций в гене BRCA1/2 [4–6]. Учитывая универсальность внутриклеточных механизмов при «недостаточных» функциональных возможностях систем репарации у больных с мутациями, можно предположить, что применение лучевой терапии так же эффективно, как и препараты платины. В то же время клинический опыт свидетельствует о том, что наибольшего прогресса в терапии злокачественных опухолей удалось достичь благодаря сочетанию облучения и химиотерапии (ХТ) [7].
Лучевая терапия у больных эпителиальным РЯ то включалась в комплекс лечебных мероприятий, то вытеснялась системной ХТ [1, 8]. При анализе архивных историй болезни 588 пациенток с эпителиальным РЯ I–IV стадий, проходивших лечение в НИИ онкологии им. Н.Н. Петрова с 2000 по 2015 г., выяснилось, что только 3,2 % больных получали лучевую терапию при рецидиве заболевания. Мы представляем клинические случаи успешного хи-миолучевого лечения локального рецидива у больных РЯ носительниц мутации в гене BRCA1.
Больная О., 46 лет, наблюдалась в НИИ онкологии им. Н.Н. Петрова с мая 2013 г., когда был установлен диагноз распространенного РЯ (T3cNxM0). У пациентки была обнаружена герминальная мутация BRCA1 5382 ins C. С июня по август 2013 г. она получила 3 курса неоадъювантной ХТ – цисплатин в монорежиме 100 мг/м2, после чего 21 августа 2013 г. выполнена оптимальная циторедуктивная операция в объеме экстирпации матки с придатками и оментэктомией. При морфологическом исследовании определена низкодифференцированная аденокарцинома с выраженным лечебным патоморфозом (рис. 1).
После хирургического этапа лечения проведено 3 курса адъювантной ХТ по той же схеме. Длительность безрецидивного периода составила 10 мес. В августе 2014 г. зафиксирован маркерный рецидив заболевания (увеличение СА-125 с 9,7 до 15,8 Ед/мл), при этом инструментальное обследование не выявило очагов опухоли. Появление
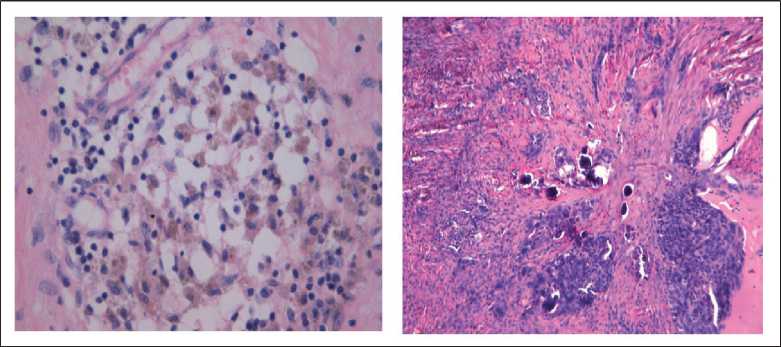
Рис. 1. Микрофото. Выраженный патоморфологический эффект наличия гемосидерофагов, псантомных телец. Окраска гемо-токсилином и эозином. ×30
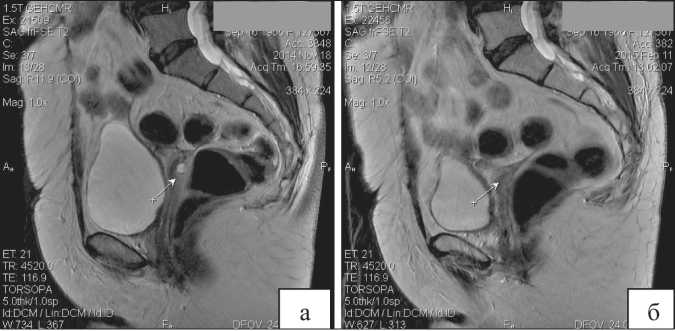
Рис. 2. МРТ органов малого таза с внутривенным контрастированием: а – до начала лечения (стрелкой указан рецидивный узел в малом тазу за культей влагалища); б – после проведенной химиолучевой терапии – полный регресс образования
же местного рецидива заболевания установлено только в ноябре 2014 г., когда при МРТ органов малого таза с внутривенным контрастированием позади культи влагалища было выявлено образование размерами 24×8×31 мм, накапливающее контрастное вещество; данных за наличие асцита и канцероматоза не получено. По данным КТ органов брюшной и грудной полости с внутривенным контрастированием других опухолевых очагов выявлено не было.
С 26.11.2014 по 23.12.2014 проводилась лучевая терапия в режиме обычного фракционирования, СОД в области опухолевого очага – 38 Гр, на фоне которого 1 раз в неделю в качестве радиосенсибилизатора внутривенно вводился цисплатин в дозе 40 мг/м2 (суммарно – 120 мг). По данным контрольной МРТ органов малого таза с внутривенным контрастированием (рис. 2), выполненной через месяц после окончания лучевой терапии, очаг в малом тазу за культей влагалища не определяется. При оценке противоопухолевого эффекта согласно критериям RECIST определена полная регрессия, при этом уровень СА-125 на момент контрольного инструментального обследования составил 9,0 Ед/мл. В ноябре 2015 г. отмечена элевация маркера СА-125 до 137 Ед/мл, при этом по данным КТ брюшной полости и малого таза с внутривенным контрастированием в эпигастральной области, а также по брюшине малого таза определяются солидные узлы от 0,7 до 1,5 см в диаметре. Период до прогрессирования составил 11 мес (рис. 3).
Больная М., 44 лет, наблюдалась в НИИ онкологии им. Н.Н. Петрова с декабря 2009 г., когда был установлен диагноз распространённого рака яичников (T3cNxM0). При молекулярно-генетическом обследовании обнаружена герминальная мутация BRCA1 5382 ins C. С января по июнь 2010 г. пациентке проведено комбинированное лечение (3 курса неоадъювантной ХТ цисплатином, оптимальная циторедуктивная операция и 3 курса послеоперационной ХТ по той же схеме). По данным гистологического исследования опухоль представлена низкодифференцированной аденокарциномой с выраженным патоморфологическим ответом. При динамическом наблюдении период до прогрессирования составил 29 мес. В декабре 2012 г. зафиксирован рост СА-125 от 5,5 до 13,8 Ед/мл). С 20.12.2012 по 20.02.2013 пациентка получила 4 курса ХТ по схеме карбоплатин AUC 6. На этом фоне отмечено снижение СА-125 до 8,5 Ед/мл и отсутствие остаточной опухоли при операции Second look, которая выполнялась 04.10.2013. Пациентка
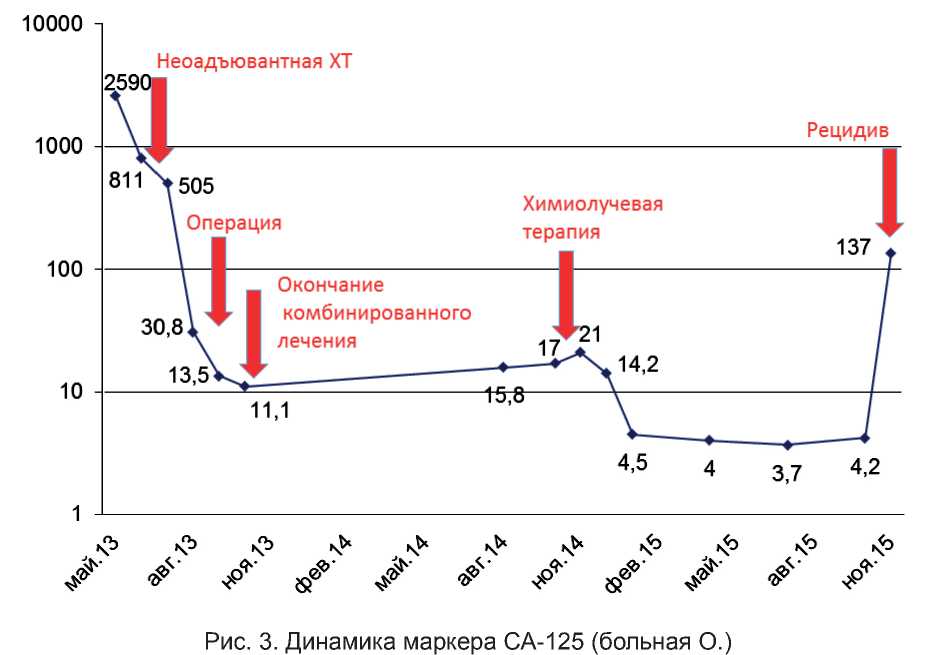
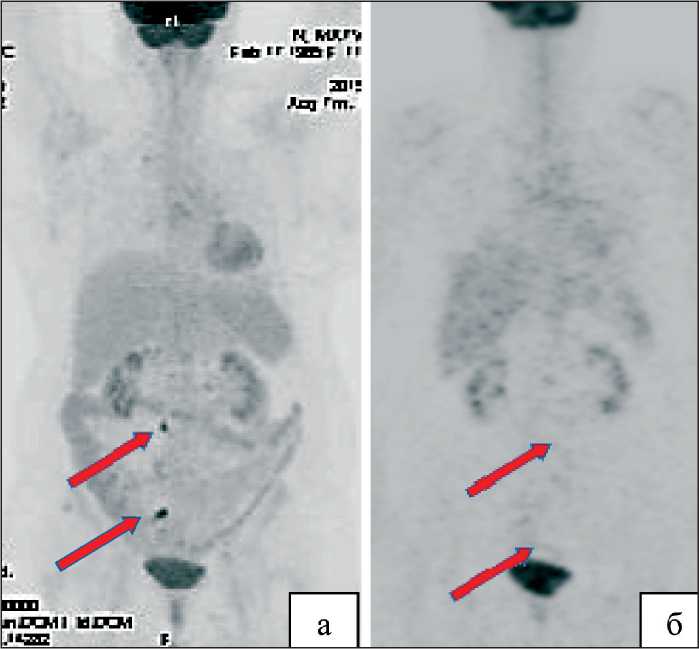
Рис. 4. ПЭТ-КТ:
а – до начала химиотерапии (стрелкой указан рецидивный узел в малом тазу за культей влагалища);
б – после завершения химиолучевой терапии, полная регрессия
находилась под динамическим наблюдением до января 2015 г., когда отмечена элевация СА-125 до 63 Ед/мл. По данным ПЭТ-КТ (27.01.2015): по правой боковой стенке таза определяется образование кистозно-солидного строения, размерами 50×35×39 мм, тесно прилежащее к наружному контуру верхнеампулярного отдела прямой кишки и метастатическое поражение парааортального лимфатического узла. С 04.02.15 по 06.08.15 больная получила 5 курсов ХТ по схеме карбоплатин AUC6 и митомицин 8 мг/м2. Учитывая развитие тромбоцитопении III степени, принято решение о завершении ХТ. Однако по данным лучевых методов обследования сохранялась остаточная опухоль в параортальной и правой подвздошной области. С 30.11.2015 по 25.12.2015 проведен курс дистанционной лучевой терапии на параортальную и правую подвздошную область в режиме обычного фракционирования, СОД в области опухолевого очага – 40 Гр. При контрольном обследовании по данным ПЭТ отмечена полная регрессия опухолевых очагов (рис. 4). Время до прогрессирования составило 8 мес.
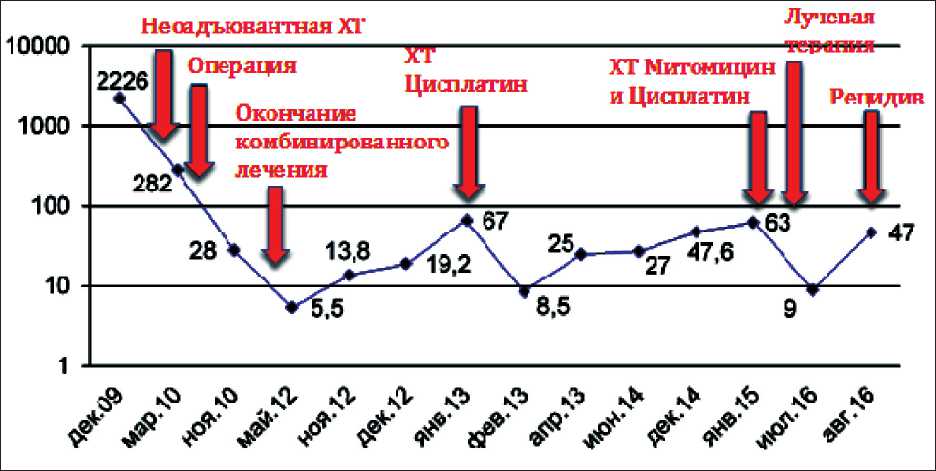
Рис. 5. Динамика маркера СА-125 (больная М.)
Рецидив заболевания и элевация уровня СА-125 до 47 Ед/мл зафиксированы 18.08.2016 (рис. 5). Пациентке выполнено хирургическое вмешательство Second look. При ревизии органов брюшной полости и малого таза данных за увеличение парааор-тальных лимфоузлов и опухолевых узлов за культей влагалища и в правой подвздошной области нет, имеются единичные опухолевые очаги до 0,5 см в брюшной полости – по париетальной брюшине правого фланка, по капсуле печени. Пациентке выполнена интраоперационная гипертермическая химиоперфузия цисплатином.
Список литературы Опыт использования лучевой терапиипри BRCA-позитивном раке яичников
- Dembo A.J. Epithelial ovarian cancer: the role of radiotherapy. Int J Radiat Oncol Biol Phys. 1992; 22 (5): 835-845.
- Kennedy R.D., Quinn J.E., Mullan P.B., Johnston P.G., Harkin D.P. The role of BRCA1 in the cellular response to chemotherapy. J Natl Cancer Inst. 2004; 96 (22): 1659-1668.
- Sigurdsson K. Advanced stage III ovarian carcinoma. Prospective randomized trials comparing radiotherapy and chemotherapy. Acta Obstet. Gynaecol. 1986; 65: 65-67.
- Городнова Т.В., Максимов С.Я., Гусейнов К.Д., Имянитов Е.Н. Оценка эффективности платиносодержащей химиотерапии у больных раком яичников носителей мутаций в гене BRCA 1/2. Вопросы онкологии. 2014; 3: 339-34.
- Gorodnova T.V., Sokolenko A.P., Ivantsov A.O., Iyevleva A.G., Suspitsin E.N., Aleksakhina S.N., Yanus G.A., Togo A.V., Maximov S.Y., Imyanitov E.N. High response rates to neoadjuvant platinum-based therapy in ovarian cancer patients carrying germ-line BRCA mutation. Cancer Lett. 2015; 369 (2): 363-367. DOI: 10.1016/j.canlet.2015.08.028
- Moiseyenko V.M., Chubenko V.A., Moiseyenko F.V., Zhabina A.S., Gorodnova T.V., Komarov Y.I., Bogdanov A.A., Sokolenko A.P., Imyanitov E.N. Evidence for clinical efficacy of mitomycin C in heavily pretreated ovarian cancer patients carrying germ-line BRCA1 mutation. Med Oncol. 2014; 31 (10): 199. DOI: 10.1007/s12032-014-0199-x
- Канаев С.В. Принципы и обоснования химиолучевого лечения злокачественных опухолей. Практическая онкология. 2008; 1: 1-8.
- Нечаева И.Д. Опухоли яичников. Л.: Медицина, 1987.


