Опыт применения гексанового экстракта Serenoa repens (пермиксон) при хронических заболеваниях предстательной железы
Автор: Сивков А.В., Синюхин В.Н., Причепа В.В., Аполихин О.И.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 4, 2018 года.
Бесплатный доступ
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является распространенным заболеванием среди мужчин пожилого возраста, которое сильно влияет на их качество жизни, вызывая симптомы со стороны нижних мочевых путей. В последнее время особое внимание уделяю патогенетической роли хронического воспаления в патогенезе ДГПЖ. В связи с эти продолжается поиск лекарственных средств, обладающих противовоспалительным действием и пригодных для длительного применения. Пермиксон (Permixon) - это гексановый липидостероловый экстракт Serenoa repens, состоящий из смеси свободных и эстерифицированных длинноцепочечных жирных кислот, полипренов и фитостеролов. Он обладает специфичностью и селективностью по отношению к предстательной железе (ПЖ), а благодаря большому количеству ингредиентов, имеет широкий спектр биологической активности. Основными механизмами действия Препарата Пермиксон являются его антиандрогенные (ингибирование активности 5а-редуктазы), проапоптотические, антипроли-феративные и противовоспалительные свойства...
Доброкачественная гиперплазия предстательной железы, симптомы нарушения функции нижних мочевых путей, хронический абактериальный простатит, лечение, пермиксон
Короткий адрес: https://sciup.org/142216914
IDR: 142216914
Текст научной статьи Опыт применения гексанового экстракта Serenoa repens (пермиксон) при хронических заболеваниях предстательной железы
екарственную терапию широко применяют у больных доброкачественной гиперплазией предстательной железы (ДГПЖ). Это заболевание встречается у 15-25% мужчин в возрасте
50 – 65 лет и приводит к выражен- ному снижению качества жизни за счет прогрессирования симптомов нарушения функции нижних мочевых путей (СНМП). Новые данные о патогенезе ДГПЖ в конце ХХ – начале XXI вв. позволили создать ряд эффективных лекарственных препаратов для терапии ДГПЖ/СНМП [1].
Согласно современной точке зрения, при формировании ДГПЖ имеет значение как генетическая предрасположенность, так и дисре-гуляция гормонального обмена и метаболические нарушения, которые приводят к активации гиперпластических процессов в предстательной железе (ПЖ), торможению апоптоза, а также – к выделению целого ряда провоспалительных медиаторов, вызывающих хроническое воспаление [1].
Принцип современной терапии ДГПЖ/СНМП заключается в комплексном воздействии на известные звенья патогенеза. Препаратами выбора считают α1-адреноблока-торы (α1-АБ): доксазозин, теразозин, альфузозин, тамсулозин, силодозин. При наличии т.н. факторов прогрессии ДГПЖ (объем ПЖ > 40 см3) применяют ингибиторы 5α-редуктазы (финастерид, дутастерид), которые при длительной терапии способны привести к уменьшению объема ДГПЖ и снижению СНМП. М-холи-нолитики (оксибутинин, троспиума хлорид, толтеродин, солифенацин, фе-зотеродин) и агонист β3-адренорецеп-торов – мирабегрон чаще используют в комбинации с α1-АБ для купирования проявлений гиперактивного мочевого пузыря при ДГПЖ. Тадала-фил (ингибитор фосфодиэстеразы 5 типа) улучшает симптомы ДГПЖ у больных, страдающих эректильной дисфункцией [2]. По показаниям применяют нестероидные противовоспалительные препараты [3], обсуждается возможность использования антиоксидантов [4]. Однако все эти лекарственные средства обладают целым рядом побочных эффектов и воздействуют только на отдельные фазы патогенеза ДГПЖ.
Медикаментозная терапия ДГПЖ/СНМП – процесс длительный, часто пожизненный, поэтому необходимо использовать лекарственные препараты, которые комплексно оказывают влияние на большинство звеньев патогенеза и обладают оптимальным терапевтическим действием при минимуме побочных эффектов. С другой стороны, комбинированная лекарственная терапия сопряжена со значительным ростом стоимости лечения и снижением комплаентности [5]. Именно поэтому большой интерес вызывают результаты применения препаратов на основе растительных соединений, в том числе экстракты Serenoa repens, которые широко используют в Европе и США для лечения ДГПЖ/ СНМП [6,7]. Наиболее известным и изученным из них является гексановый экстракт – Пермиксон.
ПЕРМИКСОН: ОСНОВНЫЕ СВОЙСТВА
Пермиксон (Permixon, Pierre Fabre Medicament, Франция) – это гексановый липидостероловый экстракт плодов пальмы ползучей
Serenoa repens (Sabal Serrulata, Saw Palmetto), состоящий из смеси свободных и эстерифицированных длинноцепочечных жирных кислот, полипренов и фитостеролов. Он обладает специфичностью и селективностью по отношению к ПЖ, а благодаря большому количеству ингредиентов, имеет широкий спектр биологической активности по отношению к этому органу. Известные механизмы действия препарата Пермиксон основаны на его анти-андрогенных (ингибирование активности 5α-редуктазы), проапоп-тотических, антипролиферативных и противовоспалительных свойствах. В отличие от других ингибиторов 5α-редуктазы этот препарат не влияет на выработку простатспеци-фического антигена (ПСА). Более того, он практически не вызывает побочных эффектов, которые встречаются при использовании синтетических лекарственных средств [8]. В России, как и во всем мире, Пер-миксон зарегистрирован и разрешен к применению как лекарственное средство.
Возможность длительного применения этого нетоксичного препарата стала особенно актуальной в связи с установлением четкой взаимосвязи между хроническим воспалением в ПЖ и образованием ДГПЖ или рака предстательной железы (РПЖ) [9]. Кроме того, в опытах in vitro удалось показать, как на первичных культурах, так и на различных клеточных линиях РПЖ, что Пермиксон воздействует на су-прессирующие механизмы генов воспаления путем активации транскрипционного ядерного фактора каппа (NF-κB), что приводит к торможению роста раковых клеток [10]. Также показано, что препарат оказывает комплексное воздействие на организацию клеточной мембраны клеток РПЖ путем изменения их текучести, что приводит к стимуляции процессов апоптоза и торможению пролиферации [11]. Все это говорит в пользу применения препарата Пермиксон при
ДГПЖ/СНМП, хроническом простатите и изучения возможности его использования для профилактики РПЖ.
В настоящей работе обобщены результаты применения препарата Пермиксон у больных ДГПЖ/ СНМП и хроническим абактериаль-ным простатитом (ХАП) в различных исследованиях, проведенных с участием НИИ урологии.
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ПРЕПАРАТА ПЕРМИКСОН У БОЛЬНЫХ СНМП / ДГПЖ
В НИИ урологии в 1999 году были проанализированы результаты лечения 48 больных ДГПЖ, которые получали Пермиксон по 160 мг дважды в день в течение 12 месяцев [12]. Отмечено уменьшение выраженности симптомов по шкале IPSS с исходных 14,35 до 10,61 балла (-26,1%) через 6 месяцев и до 10,42 (-27,4%) через 12 месяцев лечения. В те же периоды времени средний показатель максимальной скорости мочеиспускания (Qmax) увеличился с 10,62 до 12,60 мл/сек (+18,7%) и до 12,73 мл/сек (+19,9%), соответственно. Индекс качества жизни QOL через 6 месяцев наблюдения снизился с 3,49 до 2,60 баллов (-25,3%), достигнув к концу года 2,49 (-28,7%). Также было зарегистрировано небольшое уменьшение среднего объема ПЖ: на 11,8% – через 6 месяцев и 15,6% – через 12 месяцев. Показатель ПСА не изменился в течение всего периода лечения.
Практический интерес представляют данные о результативности препарата, в зависимости от исходных клинических показателей, в первую очередь IPSS и Qmax. Если до начала исследования среди рес-
Таблица 1. Динамика доли больных в группах с различными показателями IPSS и Qmax до и через 12 мес. лечения препаратом Пермиксон
|
1 |
До лечения |
После лечения |
||
|
IPSS ≤ 18 |
IPSS > 18 |
IPSS ≤ 18 |
IPSS > 18 |
|
|
Qmax ≤ 10 |
37% |
5% |
16% |
– |
|
Qmax > 10 |
56% |
2% |
82% |
2% |
■ IPSS 1-7 ■ IPSS 8-18 ■ IPSS 19-35
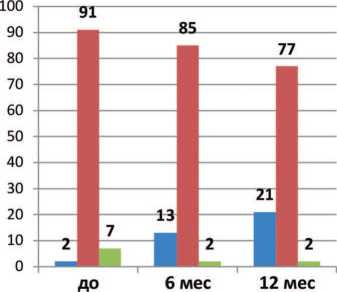
Рис. 1. Доля пациентов (%) с различной выраженностью СНМП по IPSS (%) исходно, через 6 и 12 месяцев лечения препаратом Пермиксон
■ Qmax <10 ■ Qmax 10-15 ■ Qmax >15
Рис. 2. Доля пациентов (%) с различными значениями Qmax (%) исходно, через 6 и 12 месяцев лечения препаратом Пермиксон пондентов практически не было пациентов с IPSS менее 8 баллов и Qmax более 15 мл/с, то уже через 6 месяцев лечения таких пациентов стало 13% и 23%, а через 12 месяцев – 21% и 16%, соответственно (рис. 1,2).
Показательно перераспределение до и после года лечения подгрупп пациентов, сформированных по двум основным критериям: IPSS и Qmax. Отмечено увеличение на 26% доли пациентов с умеренно выраженными СНМП по шкале IPSS и Qmax > 10 мл/с за счет других подгрупп (табл. 1).
Изучение эффективности препарата Пермиксон у больных с различными исходными значениями IPSS и Qmax дало возможность сделать заключение о том, что препарат наиболее результативен у мужчин с умеренной выраженностью симптомов ДГПЖ (IPSS ≤ 18) и умеренными уродинамически-ми нарушениями (Qmax>10 мл/сек) [12].
На следующем этапе изучения препарата Пермиксон нами совместно с группой авторов из других медицинских учреждений было проведено долгосрочное исследование у больных с СНМП, обусловленными ДГПЖ [13]. В него было включено 155 мужчин, которые в течение двух лет получали препарат в капсулах по 160 мг 2 раза в день. Пациенты посещали врача каждые 3 мес. В ходе этих визитов оценивали эффективность препарата, его переносимость, регистрировали побочные явления. Обследование проводили раз в 6 месяцев (визиты V0, V6, V12, V18, V24). Возраст пациентов на момент включения в исследование колебался от 52 до 87 лет (средний возраст – 65,3 года).
Оценку эффективности лечения осуществляли на основе изучения динамики показателей СНМП и качества жизни относительно исходного уровня с использованием шкал IPSS и QOL. До начала лечения (V0) и в точках V6, V12, V18, V24 методом урофлоуметрии (УФМ) определяли скорость мочеиспускания и объем остаточной мочи ультразву- ковым методом. Объем ПЖ измеряли при трансректальном ультразвуковом исследовании (ТРУЗИ).
Заключение о клинической безопасности препарата Пермиксон делали на основании регистрации побочных явлений на протяжении всего исследования: учитывали все нежелательные явления, независимо от того были ли они связаны с изучаемым препаратом. Кроме того, проводили измерения пульса, систолического и диастолического артериального давления. Влияние препарата на сексуальную функцию изучали с помощью опросника MSF-4, который пациент должен был заполнять самостоятельно [13].
Всем больным 1 раз в 6 месяцев выполняли общий и биохимический анализы крови, определяли уровни ПСА, гормонов плазмы крови (тестостерон, дигидротестостерон, А(Δ)-4-андростендион, Зα-5α-андростендиол, андростендион-глюкуронид, эстрадиол, DHEA, DHEA-сульфат, TeBG, лютеинизирующий гормон).
В качестве основного критерия эффективности лечения была определена динамика симптомов по шкале IPSS. При сравнении с исходным значением средний показатель IPSS статистически значимо ( р = 0,001) снизился к моменту первого определения через 6 мес. и продолжал улучшаться до 24-го мес. лечения: с 12,83 + 3,82 (V0) до 8,85 + 4,22 (V6); до 7,93 ± 4,56 (V12) и до 7,53 ± 4,50
(V24) баллов. Относительное уменьшение величины IPSS составило: 31,0% через 6 мес.; 38,6% через 12 мес. и 41,4% через 24 мес. (табл. 2).
В описываемой работе нам удалось продемонстрировать зависимость терапевтического эффекта от исходных показателей выраженности симптомов: легкая степень IPSS 0-7 баллов; умеренная степень IPSS – 8-19 баллов, значительная степень – IPSS 20-35 баллов. Если на момент включения в исследование у подавляющего большинства пациентов (90%) наблюдали умеренную симптоматику, то уже через 6 мес. мужчин с незначительными СНМП стало 40%, а через 12-24 месяцев – примерно 50% (рис. 3).
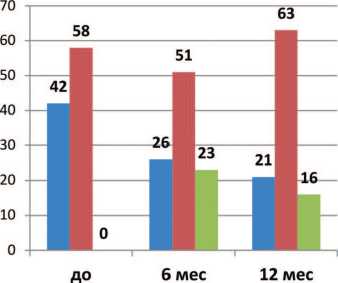
■ IP5S>19 IPSS 8-18 elPSS<7
Рис. 3. Изменение доли пациентов (в %) с различной выраженностью СНМП в различные сроки терапии ДГПЖ препаратом Пермиксон (п = 154)
Таким образом, доля пациентов с умеренными симптомами прогрессивно снижалась в 1-й год лечения и осталась в последующем неизменной до конца исследования, на фоне соответствующего увеличения числа лиц с легкой симптоматикой. Начиная с 6-го месяца лечения улуч-
Таблица 2. Изменение основных клинических показателей при лечении ДГПЖ препаратом Пермиксон
V0 V6 V12 V18 V24 Показатель среднее значение (±m) среднее значение (±m) изменение среднее значение (±m) изменение среднее значение (±m) изменение среднее значение (±m) изменение IPSS (n =154) 12,83 (3,82) 8,85(4,22) -3,98 (3,62) 7,93(4,46) -4,98 (3,88) 7,65 (3,98) -5,24 (4,0) 7,53 (4,5) -5,33 (4,53) QOL (n =154) 3,25 (1,12) 2,45 (1,13) -0,8 (0,97) 2,2 (1,04) -1,09 (1,11) 2,10 (0,91) -1,19 (0,96) 1,95 (0,82) -1,31 (1,05) Qmax мл/c (n =154) 11,75 (5,28) 15,82 (10,12) 4,08 (10,97) 15,06 (12,26) 3,22 (11,7) 12,76 (6,89) 0,94 (8,71) 12,99 (8,80) 1,13 (10,3) Объем мочи, мл (n =154) 235,6 (77,0) 276,9 (120,7) 41,31 (132,1) 250,0 (107,3) 16,72 (129,0) 253,1 (122,3) 17,98 (141,3) 225,0 (93,4) -11,7 (118,7) Объем ПЖ, см3 (n = 154) 39,74 (16,82) 34,06 (14,84) -5,68 (12,42) 33,47 (14,63) -6,44 (13,68) 34,30 (15,60) -6,06 (15,07) 34,47 (15,09) -5,89 (14,96) ПСА, нг/мл (n =154) 2,47 (1,56) 2,56 (1,93) 0,09 (1,65) 2,62 (1,79) 0,18 (1,47) 2,53 (1,62) 0,10 (1,41) 2,57 (2,33) 0,17 (2,18) MSF-4 (n =153) 9,64 (5,3) 9,35 (5,3) -0,29 (1,9) 9,52 (5,3) -0,35 (2,4) 8,71 (5,5) -1,03 (3,4) 8,56 (5,5) -1,21 (3,7) экспериментальная и клиническая урология № 4 2 0 1 8 шение обструктивных (фазы опорожнения) и ирритативных (фазы накопления) симптомов было отмечено у 46-69% пациентов, в зави-
Неполное опорожнение мочевого пузыря
Ноктурия
Необходимость натуживаться /
Слабая струя Императивные
ПОЗЫВЫ
---6 мес 12 мес 24 мес
Рис. 4. Изменение клинических симптомов (в %) на фоне лечения ДГПЖ препаратом Пермиксон (n= 154)
Прерывистое мочеиспускание симости от характера имевшихся у них СНМП (рис. 4).
Статистически значимое ( р <0,001) улучшение показателя качества жизни относительно исходного было зарегистрировано уже к 6-му месяцу: произошло снижение индекса QOL с 3,25 ± 1,12 до 2,45 ±1,13 (т. е. на 0,8 ± 0,97 балла). Эта тенденция сохранялась на протяжении двух лет исследования (табл. 2). Абсолютные изменения соответствовали процентному уменьшению на 24,6% через 6 месяцев; 33,1% – через 12 месяцев и 40,2% – через 24 месяца. Доля пациентов, почувствовавших улучшение качества жизни, прогрессивно возрастала с 58,4 до 77,3% в период от 6 до 24 месяцев лечения.
Данные урофлуометрии свидетельствовали об увеличении максимальной скорости потока мочи по сравнению с исходным значением в каждой точке определения. После среднего увеличения на 3,31 мл/с в течение 1-го года лечения Qmax оставалась выше исходных значений на 1,01-1,24 мл/с до конца исследования. Абсолютные изменения, наблюдавшиеся в 4 последовательных временных точках, соответствовали процентному увеличению: на 34,64% (V6); 28,17% (V12); 8,60% (V18) и 10,55% (V24) (табл. 2). После исключения из анализа па- циентов с «выпадающими» значениями изучаемых показателей оказалось, что скорректированные значения изменений Qmax через 18 и 24 мес. существенно выше: 2,32 и 2,8 мл/с, соответственно, по сравнению общей выборкой. Кроме того, через 6 месяцев зарегистрировано статистически значимое увеличение объема мочеиспускания на 17,53%.
Объем ПЖ пациентов уменьшился в среднем на 14,29% через 6 мес. лечения и подобное уменьшение (от -13,26 до -15,78%) сохранялось в течение всего периода наблюдения (табл. 2). Интегральное уменьшение объема ПЖ, в той или иной степени зарегистрировано почти у 80% пациентов.
В ходе исследования не было выявлено статистически значимого изменения среднего уровня общего ПСА в плазме крови (2,47 ± 1,56 нг/мл) по отношению к исходному показателю. В точках V6, V12, V18 и V24 средние значения ПСА соответственно составили: 2,56 ± 1,93; 2,62 ± 1,79; 2,53 + 1,62 и 2,57 + 2,33 нг/мл (табл. 2).
Прогрессивное уменьшение баллов шкалы MSF-4, соответствующее улучшению сексуальной функции, наблюдали на протяжении двух лет исследования, эти изменения были статистически значимыми через 18 и 24 мес. по сравнению с показателем до начала терапии ( р <0,001).
Не удалось выявить достоверных изменений уровней гормонов в плазме крови, а также других гематологических и биохимических параметров в каждой точке оценки. Также не отмечено никаких изменений жизненно-важных показателей.
У 5,8% респондентов (n = 9) зарегистрировали 10 нежелательных явлений, наиболее частыми из которых были сердечно-сосудистые расстройства (4 из 10). Лечение было прервано у трех пациентов (1,9%) в связи с развитием серьезных нежелательных явлений, из которых только одно (аллергическая реакция), возможно, было связано с приемом препарата. Летальных случаев зарегистрировано не было.
УРОДИНАМИЧЕСКИЕ ЭФФЕКТЫ ПРЕПАРАТА ПЕРМИКСОН
Комбинированное уродина-мическое исследование (КУДИ) является объективным методом оценки фаз накопления и опорожнения мочевого пузыря и основным методом диагностики инфравезикаль-ной обструкции у больных ДГПЖ / СНМП [14]. Существует небольшое число работ, в которых КУДИ является критерием оценки эффективности препаратов растительного происхождения у больных ДГПЖ [15].
У 20 больных ДГПЖ в возрасте от 58 до 75 лет (средний возраст 65,7 лет), которые принимали Пермик-сон не менее 6 месяцев, до и после лечения методом КУДИ было изучено функциональное состояние мочевого пузыря, изменение основных уродинамических параметров и выраженность инфравезикальной обструкции (ИВО) [16].
Накопительную функцию мочевого пузыря изучали с помощью цистометрии наполнения. Основными параметрами были: максимальная цистометрическая емкость (MCC), значение давления детрузора при максимальном наполнении мочевого пузыря (Pdet), наличие или отсутствие гиперактивности детрузора. К проявлениям гиперактивности были отнесены непроизвольные сокращения детрузора с повышением детрузорного давления более 15 см вод. ст. в фазе накопления.
Эвакуаторную фазу оценивали по результатам УФМ и исследования отношения давление/поток, где учитывали максимальную скорость мочеиспускания (Qmax), среднюю скорость мочеиспускания (Qave), объем выделенной мочи (VV), давление детрузора при максимальной скорости мочеиспускания (Рdet/Qmax), сократительную способность детрузора (слабая, нормальная, сильная), степень ИВО по номограмме Schafer (от 0 до V степени), объем остаточной мочи (PVR).
Каждому пациенту КУДИ проводили дважды с интервалом в 6 месяцев (24 недели). На основании характера изменения уродинамиче-ских показателей до и после лечения пациентов разделили на три группы: с положительной динамикой ( n = 8); без динамики ( n = 8); с от-рица-тельной динамикой ( n = 4).
Результаты КУДИ пациентов первой группы выявили положительную динамику функционального состояния мочевого пузыря и снижение степени ИВО. У них отмечено увеличение максимальной и средней скоростей мочеиспускания, объема мочеиспускания и макси-
Таблица 3. Результаты КУДИ у пациентов с улучшением уродинамических показателей (n = 8)
|
Параметры |
До лечения |
После лечения |
Изменение (%) |
|
Qmax, мл/с |
8,8 |
11,0 |
+ 25,0 |
|
Qave, мл/с |
3,7 |
4,3 |
+ 16,2 |
|
VV, мл |
201 |
318 |
+ 58,2 |
|
PVR, мл |
55 |
50 |
- 9,1 |
|
MCC, мл |
195 |
375 |
+ 92,3 |
|
Сократительная способность детрузора |
Нормальная |
Нормальная |
|
|
Pdet / Qmax, см вод. ст. |
55,6 |
46,6 |
- 16,2 |
|
Степень обструкции по Schafer |
III-IV |
II, III |
Таблица 4. Основные характеристики морфологических изменений в ткани предстательной железы при лечении препаратом Пермиксон
|
Показатель |
Основная группа |
Контрольная группа |
||
|
абс. |
% |
абс. |
% |
|
|
Гистологическая форма ДГПЖ: - нарастание фиброзной ткани |
18 |
60,0 |
3 |
23,1 |
|
- отсутствие изменений |
11 |
36,7 |
9 |
69,2 |
|
- нарастание железистой ткани |
1 |
3,3 |
1 |
7,7 |
|
Изменения эпителия - развитие атрофии |
27 |
90,0 |
8 |
61,5 |
|
- отсутствие изменений |
2 |
6,7 |
4 |
30,8 |
|
- рост пролиферативной активности |
1 |
3,3 |
1 |
7,7 |
|
Стромально-паренхиматозное соотношение - нарастание |
28 |
93,3 |
8 |
61,5 |
|
- без изменений |
– |
- |
3 |
23,1 |
|
- уменьшение |
2 |
6,7 |
2 |
15,4 |
|
Воспалительная реакция - уменьшение лимфогистиоцитарной инфильтрации |
16 |
53,3 |
4 |
30,8 |
|
- отсутствие изменений |
9 |
30,0 |
3 |
23,1 |
|
- нарастание лимфогистиоцитарной инфильтрации |
5 |
16,7 |
6 |
46,1 |
мальной цистометрической емкости, а также снижение градиента давления детрузора при Qmax и степени обструкции по Schafer в среднем на одну степень. При этом сократительная способность детрузора и объем остаточной мочи достоверных изменений не претерпели. Последнее может быть связано с исходно небольшим объемом остаточной мочи в этой группе (табл. 3). У одного из пациентов первой группы имевшиеся изначально непроизвольные сокращения детрузора в фазе накопления при проведении контрольного КУДИ зарегистрированы не были.
У пациентов второй группы достоверного изменения уродина-мических параметров не зарегистрировано, а в третьей – наблюдали их некоторое ухудшение.
МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ ТКАНИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ БОЛЬНЫХ ДГПЖ ПРИ ЛЕЧЕНИИ ПРЕПАРАТОМ ПЕРМИКСОН
На группе из 49 больных ДГПЖ, средний возраст которых был равен 68,3 года, продолжительность заболевания – 3,7 лет, проведено изучение влияния препарата Пермиксон на ткань ПЖ. В основную группу путем рандомизации вошли 36 пациентов, которые принимали Пер-миксон по 160 мг 2 раза в сутки в течение не менее 3-х месяцев (средняя продолжительность лечения – 7,2 месяцев). Контрольную группу составили 13 мужчин, находившихся такое же время под динамическим наблюдением и не получавших какого-либо лечения по поводу ДГПЖ [17].
До и после курса терапии препаратом Пермиксон (или периода наблюдения) пациентам выполнили трансректальную мультифокальную биопсию ПЖ из 6-12 точек под УЗИ наведением. Показанием для ее проведения стало выявленное изначально повышение содержания ПСА сыворотки крови от 4,0 до 10,0 нг/мл (среднее значение – 6,0 нг/мл). Двум больным контрольные морфологические исследования были выполнены по результатам оперативного лечения – трансуретральной резекции предстательной железы (ТУР ПЖ). Сравнительный морфологический анализ ткани ПЖ проведен 30 больным основ-ной группы (6 – отказались от повторной биопсии) и всем контрольным пациентам. Обобщенные результаты представлены в таблице 4.
В результате исследования достоверно подтверждено позитивное действие препарата на течение ДГПЖ. Так, у большинства пациентов получавших Пермиксон, в био-птатах наблюдали увеличение присутствия фиброзной ткани (60,0%), в отличие от контрольной группы, где доминирующей тенденцией было сохранение имеющейся морфо-архитектоники органа (69,2%).
экспериментальная и клиническая урология № 4 2 0 1 8
На фоне применения препарата Пермиксон у подавляющего большинства пациентов (90,0%) зарегистрировано нарастание атрофии эпителия, в отличие от 3,3%, у которых наблюдали увеличение пролиферативной активности. В контрольной группе у 61,5% больных также имело место нарастание атрофии и у 7,7% – ирост пролиферативной активности. Кроме того, в контрольной группе у трети пациентов изменения пролиферативной активности в ПЖ выявлено не было.
Созвучно этим процессам, в группе пациентов, получавших изучаемый препарат, отмечено увеличение стадийности развития пролиферативных центров по классификации НИИ урологии [18] с II-III до IVV, причем расчетный индекс пролиферативной активности эпителия снизился на 32% ( р = 0,0001).
Нарастание относительного присутствия доли фиброзной ткани в ПЖ и атрофических процессов в эпителии на фоне приема препарата Пермиксон ожидаемо сказалось на величине стромально-паренхиматозного соотношения: в основной группе оно достоверно увеличилось у подавляющего (93,3%) большинства пациентов с 3,28 (0,25-9,61) до 5,22 (1,20-10,67) или на 59% (р=0,0002). Эта же тенденция прослежена и в контрольной группе, но у меньшего числа пациентов (61,5%) и в меньшей степени: увеличение стромально-паренхиматозного соотношения составило лишь 18%, что оказа- лось статистически недостоверным (p = 0,36). Показательно, что градиент нарастания этого коэффициента в каждом конкретном случае у мужчин, принимавших Пермиксон, был зна- чительно выше, чем у пациентов
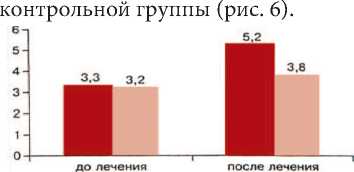
основная группа. контроль
Рис. 5. Изменение стромально-паренхиматозного соотношения у больных основной и контрольной групп при лечении ДГПЖ препаратом Пермиксон
В группе пациентов, которым проводили терапию препаратом Пермиксон, выявлена тенденция снижения степени выраженности воспалительной реакции в ткани ПЖ. У 53,3% пациентов основной группы отмечено уменьшение воспаления в ткани ПЖ, у 30,0% – отсутствие изменений и лишь у 16,7% – нарастание площади, занимаемой лимфогистиоцитарным инфильтратом. В контрольной группе имела место обратная зависимость: увеличение выраженности продуктивного воспаления у 46,1% больных.
Значительно сложнее сделать заключение о влиянии препарата Пермиксон на простатическую интраэпителиальную неоплазию (ПИН). С учетом особенности критериев включения пациентов в исследование и показаний к биопсии ПЖ, простатическая дисплазия различной степени была обнаружена у 30 пациентов основной группы и всех 13 – контрольной1. Оказалось, что у большинства больных принимавших Пермиксон, частота и степень дифференцировки ПИН снизились, в то время как у мужчин контрольной группы, в подавляющем большинстве случаев, либо повысились, либо остались на том же уровне. Так, в основной группе понижение степени ПИН зарегистрировано у 18 больных (60,0%), отсутствие изменений – у 8 (26,7%) и повышение – у 4 (13,3%). Ни у одного из пациентов контрольной группы снижения степени дифференцировки ПИН отмечено не было. У 9 из них (69,2%) выявлено нарастание степени ПИН и у 4 (30,8%) – отсутствие изменений.
Таким образом, можно сделать вывод о том, что применение препарата Пермиксон приводит к снижению пролиферативной активности железистых структур и атрофии эпителия ПЖ. Препарат вызывает достоверное увеличение стромальнопаренхиматозного соотношения, уменьшение воспалительной реакции в ткани ПЖ и, возможно, влияет на течение простатической дисплазии.
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ПРЕПАРАТА ПЕРМИКСОН У БОЛЬНЫХ ХРОНИЧЕСКИМ АБАКТЕРИАЛЬНЫМ ПРОСТАТИТОМ
НИИ урологии инициировал открытое мультицентровое исследование эффективности и безопасности препарата Пермиксон у пациентов с хроническим абактериаль-ным простатитом (ХАП). Согласно протоколу в исследование было включено 120 пациентов, которые 6 месяцев принимали Пермиксон по 320 мг/сут (180 мг 2 раза в день) в режиме монотерапии, а в течение последующих 6 месяцев – находились под динамическим наблюдением [19].
На этапах отбора в исследование и динамического наблюдения все пациенты прошли стандартизированное обследование, включавшее: изучение анамнеза, клинический осмотр, пальцевое ректальное исследование ПЖ, оценку симптомов заболевания в баллах по шкале NIH-CPSI, шкале частоты симптомов, линейной шкале выраженности симптомов, шкале сексуальной функции MSF-4 и качества жизни по шкале QOL.
В обязательном порядке выполняли: 3-стаканную пробу мочи, анализ секрета ПЖ, бактериологический анализ 3-й порции мочи, УФМ с определением остаточной мочи и трансректальную эхографию ПЖ.
В исследование включили мужчин в возрасте 18 – 50 лет с доказанным наличием ХАП (синдром хронической тазовой боли – СХТБ), преимущественно ША типа, длительностью заболевания не менее 6 месяцев, выраженностью симптомов по шкале NIH-CPSI в пункте 3 не менее 3 баллов и в пункте 4 – не менее 4 баллов, при отсутствии роста микрофлоры в 3-й порции мочи (титр <103 КОЕ в 1 мл).
К участию в программе не допускали пациентов, перенесших оперативные вмешательства в области шейки мочевого пузыря, ПЖ или малого таза, лиц с нейрогенной дисфункцией мочевого пузыря, склерозом шейки или камнями мочевого пузыря, раком мочевого пузыря или ПЖ, дивертикулами и другими заболеваниями мочевого пузыря, инфекцией мочевых путей, а также мужчины с отягощенным общесоматическим статусом. Противопоказанием для участия в исследовании являлся систематический прием лекарственных препаратов, влияющих на функцию мочевого пузыря и мочеотделение, а также антибиотиков, анальгетиков и/ или противовоспалительных средств.
Основным критерием эффективности лечения считали динамику суммарного показателя шкалы NIH-CPSI – признанного инструмента оценки симптомов ХАП. Градация полученных результатов была следующей: 0 – 14 баллов – легкая симптоматика; 15 – 29 баллов – умеренная симптоматика; 30 – 43 балла – выраженная симптоматика.
Вторичными критериями были: динамика групповых показателей (боль, дизурия, качество жизни) шкалы NIH-CPSI; динамика показателей частоты и выраженности симптомов при оценке по стандартизированным шкалам в модификации НИИ урологии [20]; изменение состояния сексуальной функции пациентов по шкале MSF-4; изменение числа лейкоцитов в секрете ПЖ или
Таблица 5. Динамика клинических показателей эффективности препарата Пермиксон у больных ХАП
|
Показатель |
До лечения |
Через 6 мес. лечения |
Через 6 мес. наблюдения |
|
NIH-CPSI |
|||
|
- общий |
21,8 ± 4,6 |
13,6 ±3,4 |
9,8 ±3,9 |
|
- боль |
10,6 ± 5,3 |
6,1 ± 3,3 |
5,1 ± 3,1 |
|
- дизурия |
5,3 ± 1,8 |
3,2 ±0,9 |
3,0 ± 1,2 |
|
- качество жизни |
5,2 ± 1,9 |
3,6 ± 1,9 |
1,7 ±0,3 |
|
Шкала выраженности симптомов |
25,8 ± 22,9 |
18,9 ± 12,5 |
10,9 ± 10,8 |
|
Шкала частоты симптомов |
16,6 ± 8,1 |
13,6 ±9,5 |
6,0 ±4,8 |
|
Шкала MSF-4 |
5,4 ± 0,8 |
4,5 ±0,5 |
2,6 ±0,9 |
|
Qmax |
19,5 ± 1,9 |
21,2 ±2,9 |
22,0 ±2,1 |
|
Число лейкоцитов в секрете ПЖ |
24,0 ± 6,2 |
10,7 ±5,4 |
7,9 ±5,9 |
|
Количество баллов по шкале QOL |
4,6 ± 0,6 |
3,3 ± 1,1 |
1,4 ±0,7 |
3-й порции мочи (после массажа ПЖ); изменение Qmax; изменение показателя качества жизни по шкале QOL.
Безопасность препарата оценивали по характеру, частоте и выраженности побочных эффектов.
Отдаленные результаты в соответствии с протоколом исследования удалось проследить у 102 мужчин. Их средний возраст был равен 39,2 ± 5,5 лет, длительность заболевания – 48,1 ± 12,2 месяцев, выраженность симптомов по шкале NIH-CPSI – 21,8 ± 4,6 балла, Qmax – 19,5 ±1,9 мл/с, а объем ПЖ – 25,0 ± 5,2 см3. То есть, для участия в программе были отобраны пациенты относительно молодого возраста, страдающие ХАП в течение нескольких лет, не имеющие нарушений мочеиспускания и клинических признаков ДГПЖ.
Полугодовая терапия препаратом Пермиксон привела к статистически достоверной регрессии симптомов по данным всех использованных стандартизированных шкал (табл. 5).
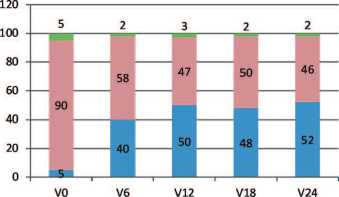
Динамика показателей шкалы NIH-CPSI показала статистически значимое ( р < 0,001) уменьшение как общего балла на 37,6%, так и в пунктах, отражающих боль (NIH1 – вопросы 1-4), дизурию (NIH2 – вопросы 5, 6), качество жизни (NIH3 – вопросы 7-9), что наглядно демонстрирует приведенный рисунок 6.
Препарат способствовал достоверному (р<0,001) снижению вы- раженности боли на 42,4%, дизурии – на 39,6% и улучшению показателя качества жизни – на 30,8%.
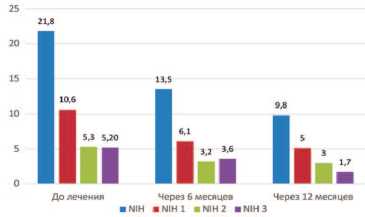
Рис. 6. Динамика симптомов по шкале NIH-CPSI на фоне лечения препаратом Пермиксон
Через 6 месяцев после прекращения приема препарата Пермик-сон наблюдали дальнейшее, но не столь выраженное симптоматическое улучшение: снижение общего показателя NIH-CPSI на 27,4%, а также индексов, отражающих боль – на 16,4%, дизурию – на 6,3% и качество жизни – на 52,8%. Динамика первого и последнего показателей оказалась статистически значимой ( р < 0,001) в отличие от двух других, изменения которых не были достоверны ( р =0,086 и р =0,375).
За весь период лечения и наблюдения уменьшение общего балла NIH-CPSI составило 55,0%, в том числе показателей, отражающих боль, дизурию и качество жизни – на 51,9%, 43,4% и 67,3%, соответственно. На этапе лечения наиболее выраженной динамике подверглись показатели, отражающие боль и дизурию, а в период наблюдения – показатель качества жизни.
Дополнительное применение шкалы частоты симптомов и линейной визуальной шкалы (ВАШ) выраженности симптомов дало возможность более детально оценить клинический эффект препарата [21]. Во всех контрольных точках исследования было отмечено статистически достоверное уменьшение частоты симптомов: через 6 месяцев – на 18,1% ( р = 0,03) и на 55,9% к 12 месяцу наблюдения ( р <0,001). Суммарное уменьшение частоты симптомов составило 63,8%.
Изучить влияние препарата на выраженность симптомов ХАП помогла линейная визуально-аналого- вая шкала. Через 6 месяцев приема препарата Пермиксон было зарегистрировано достоверное снижение выраженности симптомов, в среднем, на 33,7%, а в дальнейшем – еще на 42,3% (р < 0,001). В целом, в ходе исследования отмечено уменьшение выраженности симптомов на 61,7%.
Шкала IPSS не является специфичной для ХАП. Анализ исходных данных свидетельствовал, что у большинства пациентов отсутствовали выраженные симптомы нарушения функции нижних мочевых путей: исходный показатель IPSS был равен всего 3,9 балла. Поэтому этот инструмент из дальнейшего анализа был исключен.
Исходно не было также отмечено существенных нарушений мочеиспускания по данным уроф-лоуметрии: Qmax составила в среднем 19,5 мл/с. Несмотря на это, через 6 месяцев лечения было зарегистрировано ее увеличение до 21,2 мл/с, или на 8,7%, а через 6 месяцев наблюдения – до 22,8 мл/с, или еще на 7,5%. За все время исследования увеличение Qmax составило 16,9% ( р < 0,001).
Если до начала лечения в секрете ПЖ пациентов регистрировали выраженную воспалительную реакцию, а среднее число лейкоцитов в поле зрения было равно 24,4, то через 6 месяцев терапии препаратом Пермиксон этот показатель снизился до 10,7 (-56,1%), а за период наблюдения – до 7,9 (-26,2%). Указанные изменения оказались статистически достоверны ( р <0,001 и р <0,01, соответственно). Общее уменьшение числа лейкоцитов в секрете ПЖ было равно 67,6% ( р <0,001).
Состояние сексуальной функции относится к факторам, оказывающим значительное влияние на качество жизни мужчины и оценку безопасности лечения. В настоящем исследовании была применена анкета MSF-4, отражающая по 5-балльной шкале уровень интереса к сексу, качество эрекции, оргазма и эякуляции, причем уменьшение показателя свидетельствует об улуч- шении состояния больного [22]. Этот параметр изменялся достаточно медленно. После 6 месяцев терапии достоверной динамики его значений выявлено не было: 5,4 и 4,8 балла, соответственно (11,1%; р = 0,860). Однако через год зарегистрировано уменьшение показателя MSF-4 до 2,6 баллов (-51,8%; р< 0,001). Эта тенденция оказалась неслучайной и наблюдалась практически во всех центрах, принявших участие в исследовании. Каких-либо побочных эффектов связанных с лечением, выявлено не было.
И наконец, на фоне позитивной динамики симптомов отмечено достоверное ( р <0,001) улучшение показателя качества жизни QOL: с исходных 4,6 балла до 3,3 через 6 месяцев лечения (-28,3%) и до 1,4 балла через 1 год наблюдения (-69,6%). Последний факт подтверждает длительный и стойкий эффект, достигнутый у больных ХАП при лечении препаратом Пермик-сон.
ЗАКЛЮЧЕНИЕ
Итак, НИИ урологии обладает опытом участия в клинических исследованиях эффективности и безопасности препарата Пермиксон, с участием 372 больных ДГПЖ / СНМП и ХАП.
Лечение препаратом в дозе 320 мг/сут облегчало симптоматику при ДГПЖ, на что указывает устойчивое и статистически значимое улучшение показателей IPSS и QOL – основных критериев эффективности. Также было продемонстрировано позитивное его влияние на параметры мочеиспускания (величину Qmax) и сексуальной функции по шкале MSF-4. Полученные данные в целом соответствуют результатам опубликованного в 2018 году R.Vela-Navarrete и соавт. систематического обзора и метаанализа 27 рандомизированных и наблюдательных клинических исследований применения препарата Пермиксон при ДГПЖ и СНМП [23].
Резюме:
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является распространенным заболеванием среди мужчин пожилого возраста, которое сильно влияет на их качество жизни, вызывая симптомы со стороны нижних мочевых путей. В последнее время особое внимание уделяю патогенетической роли хронического воспаления в патогенезе ДГПЖ. В связи с эти продолжается поиск лекарственных средств, обладающих противовоспалительным действием и пригодных для длительного применения.
Пермиксон (Permixon) – это гексановый липидостероло-вый экстракт Serenoa repens, состоящий из смеси свободных и эстерифицированных длинноцепочечных жирных кислот, полипренов и фитостеролов. Он обладает специфичностью и селективностью по отношению к предстательной железе (ПЖ), а благодаря большому количеству ингредиентов, имеет широкий спектр биологической активности. Основными механизмами действия Препарата Пермиксон являются его антиандрогенные (ингибирование активности 5α-редуктазы), проапоптотические, антипроли-феративные и противовоспалительные свойства. Пермиксон не влияет на выработку простатспецифического антигена и не вызывает побочных эффектов.
НИИ урологии обладает опытом участия в клинических исследованиях эффективности и высоком профиле безопасности препарата Пермиксон с участием около 400 больных.
Результаты применения препарата Пермиксон у больных СНМП / ДГПЖ. Исследования проведены на 400 больных ДГПЖ/СНМП (симптомы нижних мочевых путей) и хроническим абактериальным простатитом (ХАП). Показано, что лечение препаратом в дозе 320 мг/сут облегчало симптоматику при ДГПЖ, на что указывает устойчивое и статистически значимое улучшение показателей IPSS и QOL – основных критериев эффективности.
Уродинамические эффекты препарата Пермиксон. Было продемонстрировано позитивное его влияние на параметры мочеиспускания – величину Qmax и сексуальной функции по шкале MSF-4. С использованием метода КУДИ зарегистрированы положительные изменения показателей уродинамики у 40% больных: увеличение скорости мочеиспускания, объема мочеиспускания, максимальной цистометрической емкости, снижение градиента Pdet / Qmax и степени обструкции по Schafer.
Морфологические изменения ткани предстательной же-
Список литературы Опыт применения гексанового экстракта Serenoa repens (пермиксон) при хронических заболеваниях предстательной железы
- Lee CL, Kuo HC. Pathophysiology of benign prostate enlargement and lower urinary tract symptoms: Current concepts. Ji Yi Xue Za Zhi 2017;29(2):79-83 DOI: 10.4103/tcmj.tcmj_20_17
- Van Asseldonk B, Barkin J, Elterman DS. Medical therapy for benign prostatic hyperplasia: a review. Can J Urol 2015; 22 (Suppl 1):7-17.
- Kahokehr A, Vather R, Nixon A, Hill AG. Non-steroidal antiinflammatory drugs for lower urinary tract symptoms in benign prostatic hyperplasia: systematic review and meta-analysis of randomized controlled trials. BJU Int 2013;111(2):304-311 DOI: 10.1111/j.1464-410X.2012.11559.x
- Minciullo PL, Inferrera A, Navarra M, Calapai G, Magno C, Gangemi S. Oxidative stress in benign prostatic hyperplasia: a systematic review. Urol Int 2015; 94:249-254 DOI: 10.1159/000366210
- Barron R, Campbell UA. Online survey of benign prostatic hyperplasia treatment and compliance. J Med Econ 2007;10(1):1-15. https://doi.org/10.3111/200710001015
- Cornu JN, Cussenot O, Haab F, Lukacs B. A widespread population study of actual medical management of lower urinary tract symptoms related to benign prostatic hyperplasia across Europe and beyond official clinical guidelines. Eur Urol 2010;58:450-6 DOI: 10.1016/j.eururo.2010.05.045
- Lukacs B, Cornu JN, Aout M, Tessier N, Hodee C, Haab F, et al. Management of lower urinary tract symptoms related to benign prostatic hyperplasia in real-life practice in France: a comprehensive population study. Eur Uro 2013;64:493-501. doi:10.1016/j.eururo.2013.02.026
- Habib, FK. Serenoa repens: the scientific basis for the treatment of benign prostatic hyperplasia. Eur Uro Suppl 2009;8(13):887-893 DOI: 10.1016/j.eursup.2009.11.005
- Gandaglia G, Zaffuto E, Fossati N, Cucchiara V, Mirone V, Montorsi F, et al. The role of prostatic inflammation in the development and progression of benign and malignant diseases. Curr Opin Urol 2017, 27:99-106 DOI: 10.1097/M0U.0000000000000369
- Silvestri I, Cattarino S, Agliano AM, Nicolazzo Ch, Scarpa S, Salciccia S, et al. Effect of Serenoa repens (PermixonW) on the expression of inflammation-related genes: analysis in primary cell cultures of human prostate carcinoma. J Inflamm (Lond) 2013;10:11 DOI: 10.1186/1476-9255-10-11
- Petrangeli E, Lenti L, Buchetti B, Chinzari P, Sale P, Salvatori L, et al. Lipido-Sterolic Extract of Serenoa repens (LSESr, Permixon) treatment affects human prostate cancer cell membrane organization. J Cell Physiol 2009;219: 69-76 DOI: 10.1002/jcp.21648
- Сивков А.В. Пермиксон: механизм действия, клиническая эффективность и место в лечении ДГПЖ. В кн.: Доброкачественная гиперплазия предстательной железы. . М.; 1999. 117-133.
- Пытель Ю.А., Лопаткин Н.А., Гориловский Л.М., Винаров А.З, Сивков А.В., Медве-дев А.А. Результаты долгосрочного применения препарата Пермиксон у больных с симптомами нарушения функции нижних мочевых путей, обусловленными доброкачественной гиперплазией предстательной железы. Урология 2004;2:3-7.
- Gravas S, Cornu JN, Drake MJ, Gacci M, Gratzke C, Herrmann TRW, et al. EAU Guide-lines. Management of non-neurogenic male LUTS. URL: http://uroweb.org/guideline/treatment-of-non-neurogenic-male-luts/].
- Gerber GS, Zagaja GP, Bales GT, Chodak GW, Contreras BA. Saw palmetto (Serenoa repens) in men with lower urinary tract symptoms: effects on urodynamic parameters and voiding symptoms. Urology 1998;51(6):1003-1007
- Медведев А.А. Экстракты Serenoa repens в лечении больных доброкачественной гиперплазией предстательной железы: дис.. канд. мед. наук. М., 2001. 1-146 c.
- Сивков А.В., Кудрявцев Ю.В., Медведев А.А., Разумов С.В., Кочетов С.А. Морфологические изменения в ткани предстательной железы больных с доброкачественной гиперплазией предстательной железы при лечении препаратом Пермиксон. Урология 2004;(5):10-16.
- Руководство по урологии. . М.: Медицина, 1998, Т.3. С. 368-522.
- Лопаткин Н.А., Аполихин О.И., Сивков А.В., Аляев Ю.Г., Комяков Б.К., Журавлев В.Н и др. Результаты мультицентрового исследования экстракта Serenoa repens (Пермиксон) у больных хроническим абактериальным простатитом. Урология 2007;(5):1-7
- Plosker GL, Brogden RN. Serenoa repens (Permixon). A review of its pharmacology and therapeutic efficacy in benign prostatic hyperplasia. Drugs Aging. 1996;9(5):379-95 DOI: 10.2165/00002512-199609050-00008
- Ощепков В.И., Дарий Е.В., Сивков А.В. Стандартизированная оценка симптомов хронического простатита. В кн.: Вопросы андрологии в урологии. М.; 2000. C. 100-109
- Marquis P, Marrel A. Reproducibility and clinical and concurrent validity of the MSF-4: a four-item male sexual function questionnaire for patients with benign prostatic hyperplasia. Value Health 2001;4 (4):335-43 DOI: 10.1046/j.1524-4733.2001.44021.x
- Vela-Navarrete R., Alcaraz A., Rodrigues-Antolin A., Minana Lopez B, Fernandez-Gomez JM, Angulo JC, et al. Efficacy and safety of a hexanic extract of Serenoa repens (Permixon) for the treatment of lower urinary tract symptoms associated with benign prostatic hyperplasia (LUTS/BPH): systematic review and meta-analysis of randomized controlled trails and observational studies. BJU Int 2018;122(6): 1049-1065. doi: 10.1111/bju.14362
- Al-Shukri SH, Deschaseaux P, Kuzmin IV, Amdiy RR. Early urodynamic effects of the lipido-sterolic extract of Serenoa repens (Permixon) in patients with lower urinary tract symptoms due to benign prostatic hyperplasia. Prostate Cancer Prostatic Dis 2000;3(3):195-199 DOI: 10.1038/sj.pcan.4500477
- Maccagnano C, Brigant A, Teillac P, Schulman C, Francesco Montorsi et al, A Critical Analysis of Permixon™ in the Treatment of Lower Urinary Tract Symptoms Due to Benign Prostatic Enlargement Eur Urol Suppl 2006;5(4): 430-440. doi: https://doi.org/10.1016/j.eursup.2006.02.006
- Tewari AK, Stockert JA, Yadav SS, Yadav KK, Khan I. Inflammation and prostate cancer. Chapter 3. in Cell and Molecular biology of prostate cancer. . Springer Inter-national Publishing AG: 2018, p. 41-65.].
- Latil A, Pétrissans MT, Rouquet J, Robert G de la Taille A. Effects of hexanic extract of serenoa repens (permixon® 160 mg) on inflammation biomarkers in the treatment of lower urinary tract symptoms related to benign prostatic hyperplasia. Prostate 2015;75(16):1857-1867 DOI: 10.1002/pros.23059
- Gravas S., Samarinas M., Zacharouli K., Tzortis V., Koukoulis G., Melekos M. The effect ex-tract of Serenoa repens on prostatic inflammation: results from a randomized biopsy study. World J Urol 2018 Jul 19 DOI: 10.1007/s00345-018-2409-1
- Reisiigi AE, Pointner J, Obwexer S, Djavan B. Chronic prostatitis/chronic pelvic pain syndrome recurrence after initial effective phytotherapeutic treatment. J Urol 2005;173(4):30 DOI: 10.1016/S0022-5347(18)34376-3
- Giulianelli R, Pecoraro S, Sepe G, Leonardi R, Gentile BC, et al. Multicentre study on the efficacy and tolerability of an extract of Serenoa repens in patients with chronic benign prostate conditions associated with inflammation. Arch Ital Urol Androl 2012;84(2):94-8.


