Опыт работы по изучению темы «Химические свойства солей» в курсе химии средней школы
Автор: Ярматов М.О., Ибрагимова Ж.А., Абдырахманова Ж.С., Ганыжан Кызы З., Полотов И.Ж.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Педагогические науки
Статья в выпуске: 5 т.10, 2024 года.
Бесплатный доступ
Школьный курс химии способствует формированию мировоззренческих идей, мыслительных навыков и творческих способностей учащихся. Цель - определение содержания темы «Химические свойства солей» в курсе химии в средней школе. Преподаватель показывает демонстрационные опыты, отражающие свойства солей, и предлагает учащимся написать молекулярные, полные и сокращенные ионные уравнения реакций солей. Таблица растворимости помогает учащимся понять течение реакций замещения, которые заканчиваются образованием растворимых солей. Выясняя влияние металлов на соли, ученики делают вывод, о том, что те металлы, которые не реагируют с водой, вытесняют металлы, находящиеся в правой части порядка, из растворов их солей.
Курс химии, средняя школа, графические формулы
Короткий адрес: https://sciup.org/14130147
IDR: 14130147 | УДК: 378.14 | DOI: 10.33619/2414-2948/102/84
Текст научной статьи Опыт работы по изучению темы «Химические свойства солей» в курсе химии средней школы
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 378.14
В обучении темы нужно обратить внимание на основополагающие моменты и основные виды работы: фронтальный опрос в виде беседы, игра, демонстрация химических реактивов, работа с дидактическими карточками; оборудование: таблицы «Химические элементы», «Кислоты и соли», «Растворимость кислот, оснований и солей в воде»; химические реактивы «Соли», дидактические карточки с заданиями [1].
Изучение предмета химии должно способствовать приобретению следующих навыков: работа с лабораторным оборудованием и учебными пособиями; разработка теоретического материала для подготовки к семинарам; оформление самостоятельных работ по темам в виде рефератов или научных докладов на семинарах; использование полученных знаний в практике обучения учеников [2].
Имея в основе систему химических научных и методических идей, школьный курс химии должен иметь и систему мировоззренческих идей. При отборе идей и положений нужно учесть такие их показатели, как тесная связь с содержанием учебного предмета; проявление в ряде изучаемых химических процессов; необходимость для глубокого и верного понимания существенности этих явлений; возможность применения при дальнейшем изучении материала в качестве метода анализа и оценки новых фактов; возможность использование для создания представлений об общих закономерностях явлений природы [3].
Теоретическую основу курса элементарной химии 8 класса составляют атомномолекулярные исследования; периодический закон Д.И. Менделеева и периодическая система химических элементов. Знакомя школьников с веществами, например, кислород, углекислый газ, вода, мы сообщаем им, что они состоят из молекул [4].
Базовые схемы (конспекты) и особенно их совместное построение со студентами способствует развитию у них навыков обобщения знаний и логического мышления, знания становятся осмысленными и цельными [5].
В курсе химии средней школы в VIII классе тема «Соли» преподается в разделе «Основные классы неорганических соединений и химические реакции между ними». Учащиеся изучают нахождение солей в природе, их классификацию, номенклатуру и способы создания графических формул:
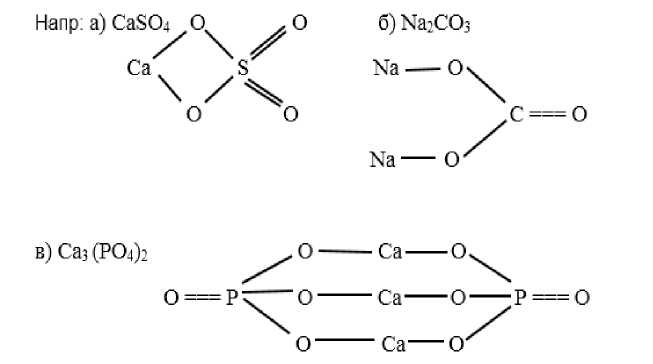
Осваиваются понятия о методах получения солей из кислот, кислотных оксидов, солей, физических и химических свойствах и их использовании. Эти понятия обобщены в разделе «Теория электролитической диссоциации» курса химии IX класса, где знания, учащихся о солях и их химических свойствах завершаются на гораздо более высоком теоретическом уровне.
Материалы и методы исследования
Учитывая особенности материалов, изложенных в учебниках, мы применяем известный методический подход к изучению химических свойств солей, т.е. преподаватель показывает демонстрационные опыты, отражающие свойства солей, и предлагает учащимся написать молекулярные, полные и сокращенные ионные уравнения реакций. Концепции и выводы уточним письменно для доступности Соль (р) + основание (р).
Учащиеся пишут уравнения реакций, проводя эксперименты по осаждению. Например,
Na 2 SO 4 +Ba (OH) 2 = BaSO 4 ↓ + 2NaOH
2Na++SO 4 2- + Ba2+ +2OH- =BaSO 4 ↓ + 2Na+ + 2OH-
Ba2+ + SO 4 2- = BaSO 4 ↓
Результаты и обсуждение
Чтобы создать проблемную ситуацию, мы продемонстрируем и обсудим взаимно необратимые реакции, например, K 2 SO 4 + 2NaOH = 2KOH + Na 2 SO 4. С помощью опытов с написанными уравнениями, с использованием таблицы растворимости убеждаем учащихся, что в реакциях обмена между солями и основаниями, если одно из взаимодействующих веществ плохо растворимо или нерастворимо, реакция не пойдет до конца, например, Cu2+ SO 4 2- + Fe(OH) 3 ≠
Для установления полной уверенности сравним растворимость гидроксида меди и первичного основания, например:
Fe(OH) 3 Cu(OH) 2
-
1, 9*10-10 2, 4*10-7
На следующем этапе мы демонстрируем эксперимент, в котором выпадает в осадок кремниевая кислота, например:
SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓
SiO 3 2- + 2H+= H 2 SiO 3 ↓
Учащиеся определяют реакцию солей и кислот с образованием осадка и пишут уравнение соответствующей реакции. Они также сравнивают полученные знания о реакциях между растворами солей и оснований с реакциями между солями и кислотами. Чтобы лучше понять эту разницу, продемонстрируем реакции, в которых выделяется газообразный продукт в результате взаимодействия растворимых солей с сильными кислотами:
CaCO 3 +2HCL = CaCl 2 +H 2 O+CO 2 ↑
CaCO 3 +2H+ = Ca2+ +H 2 O+CO 2 ↑
Учащиеся записывают на доске и в тетради следующее итоговое уравнение Соль (н) + кислота (с). Отсюда учащиеся могут написать, что сероводородный газ можно получить из водорастворимого сульфида железа (II) сильной кислотой:
FeS+2HCl = FeCl 2 + H 2 S↑
Основным понятием, которое следует здесь рассмотреть, является формирование представления о том, что металлы свинец, медь, ртуть и серебро в ряду напряжений металлов образуют кислот растворимые сульфиды:
Pb(NO 3 ) 2 +H 2 S = PbS ↓ +2HNO 3
(ос) CD
Pb2+ +H 2 S =PbS ↓ + 2H+
Показано, что образующийся осадок сульфида свинца нерастворим в азотной кислоте и других кислотах, образующихся в результате реакции. Из этого делаем вывод. Если осадок соли не растворяется в воде и образующейся кислоте, водные растворы солей взаимодействуют со слабыми кислотами: Соль (р) + кислота (сл).
Учащиеся делают вывод о реакциях замещения растворами солей и записывают уравнение реакции следующим образом:
CaCl 2 +Na 2 CO 3 = CaCO 3 ↓ + 2NaCl
CaCl 2 + Na 2 CO 3 = CaCO3 ↓ + 2NaCl
Ca2++ CO 3 2-=CaCO 3
Учитель проводит демонстрационный опыт с малорастворимыми солями, одной из первых солей.
CaCl 2 + Na 2 CO 3 = CaCO 3 +2NaCl
Ca2++ CO 3 2-=CaCO 3
А используя таблицу растворимости, учащиеся поймут, что такие реакции замещения заканчиваются образованием растворимой соли. Выясняя влияние металлов на соли, они делают четкий вывод, что только те металлы, которые не реагируют с водой, вытесняют металлы, находящиеся в правой части порядка, из растворов их солей. В закрепляющей части урока рекомендуется применение схем, закрепляющих знания учащихся о химических свойствах и видах солей в ходе урока (Рисунок)
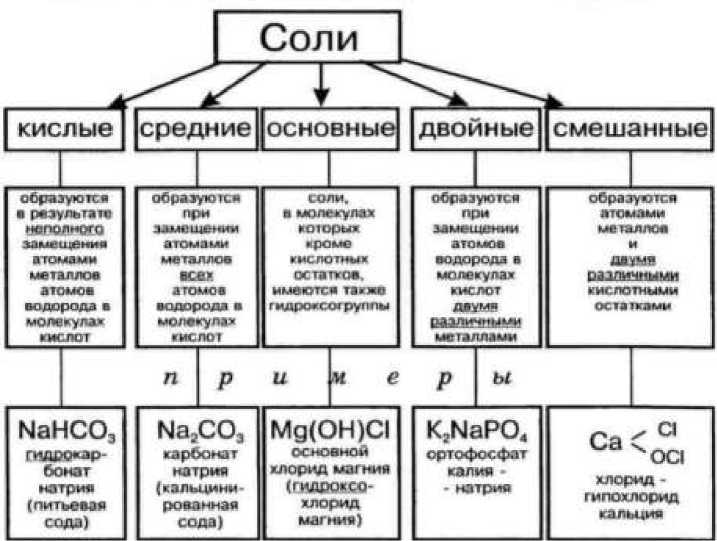
Рисунок. Схема для закрепления знаний учащихся по теме «Соли».
Данные занятия позволяют учащимся уметь описывать химические свойства всех солей самостоятельно, от общих до частных знаний. Сделанные на основе данного анализа выводы в дальнейшем могут быть применены в случаях преподавания других химических соединений.
Список литературы Опыт работы по изучению темы «Химические свойства солей» в курсе химии средней школы
- Нелюбина Е. Г. Особенности изучения темы "Соли как производные кислот и оснований" в школьном курсе химии // Парадигма. 2019. №3. С. 130-137. EDN: WCZKNU
- Юсупова Б. А. Методика преподавания химии в школе // Мировая наука. 2020. №3 (36). С. 586-588. EDN: WLMIZR
- Синеок Н. П. Формирование научного мировоззрения в преподавании химии // Территория науки. 2018. №3. С. 41-48. EDN: YMRGOL
- Ярматов М. О., Умарова Н. Б., Аширбекова М. А., Осмонова А. А., Абдырахманова Ж. C. Строение веществ в курсе химии средней школы и методика обучения первоначальным представлениям о структуре // Бюллетень науки и практики. 2023. Т. 9. №3. С. 391-394. DOI: 10.33619/2414-2948/88/49 EDN: VFVQOB
- Ярматов М. О., Аширбекова М. А., Абдырахманова Ж. С., Сарымсакова А. Т., Ганыжан кызы З., Абдуллаева Ж. Д. Методика создания справочных конспектов при обобщении знаний в естественнонаучном образовании // Бюллетень науки и практики. 2023. Т. 9. №7. С. 379-384. DOI: 10.33619/2414-2948/92/53 EDN: KUFFJE


