Основные меры по организации фармацевтической продукции в Республике Казахстан
Автор: Датхаев У.М., Устенова Г.О., Жакипбеков К.С., Батырбекова А.С.
Журнал: Вестник Алматинского технологического университета @vestnik-atu
Рубрика: Техника и технологии
Статья в выпуске: 4 (100), 2013 года.
Бесплатный доступ
В данной статье рассмотрены основы организации фармацевтического производства при реализации Государственной Программы по развитию фармацевтической промышленности в Республике Казахстан. При создании методологии организации производства необходимо учитывать такие факторы, как помещение, оборудование, персонал, технология, сырье, номенклатура продукции, менеджмент и маркетинг, которые, в свою очередь, влияют на процесс внедрения GMP на фармацевтических предприятиях Республики Казахстан. Для оценки надежности всех элементов производственного цикла, а также детальной подготовки и планирования различных этапов и стадий необходимо придерживаться алгоритма организации фармацевтического производства.
Фармацевтика өндірісі, өндірісті ұйымдастыру, алгоритм
Короткий адрес: https://sciup.org/140205008
IDR: 140205008 | УДК: 615.014(574)
Текст статьи Основные меры по организации фармацевтической продукции в Республике Казахстан
Кіріспе
Қазақстан Республикасының Үкіметі-мен 2010 жылы тамыз айында Қазақстан Республикасының фармацевтика өнеркәсiбiн дамыту жөнiндегi 2010-2014 жылдарға арналған бағдарламасы бекітілген болатын. Бағдарламаның басты міндеті – инвестиция-лық жобаларды іске асыру шеңберінде жұмыс істеп тұрған өндірістерді жаңғырту және жаңа фармацевтикалық кәсіпорындарды салу. Қазақстан Республикасының Денсаулық сақтау Министрілігінің шешімі бойынша 2014 жылдың аяғына дейін фармацевтика өнеркәсібінің барлық кәсіпорындарында (GMP) «Тиісті өндірістік тәжірибе» халықаралық сапа стандарттарын енгізу қаралған. Бұл стандартты енгізу барысында қазіргі заманғы технологиялар базасында фармацевтикалық және медициналық өнімнің импорт алмастыруы үшін жағдайлар жасау міндеттелген [1].
GMP ережелері жалпы басқаруды, өнеркәсіптік үдерісті ұйымдастыруды және производство, организация производства, production, algorithm, GMP.
бақылауды жүргізу тәртібін бекітіп, заманауи өндірісті жүргізудің тәжірибелік ережелерін бекітеді.
Зерттеу нысандары және әдістері
Қазіргі таңда бұл ережелер негізінде көптеген мемлекеттерде фармацевтика өндірісін дамыту мақсатында сәйкесінше құжаттар мен стандарттар бекітіліп, фарма-цевтикалық өнімдердің өндіру процесін жүргізу мен регламенттеу жасалынған [2].
Қазақстан Республика Халықаралық GMP «Тиісті өндірістік тәжірибе» стандар-тына көшуді 2008 жылдан бастаған болатын. GMP талаптарына сай жасалынған барлық үлгілердің негізінде бір ғана қағида жатыр. Оның басты міндеті – өндіріліп жатқан дәрілік препараттардың қауіпсіздігін қамта-масыз ету, тиімділігі мен сапасын арттыру болып табылады.
GMP талаптарына жаһанды түрде өту – бұл дәрілік заттардың сапасын қамтамасыз етудің бірте-бірте жоспарлы-кезеңмен жүретін процесі. Бұл жүйе дәрілік заттарды
өндірудің барлық сатысында, әр бөлек кезеңінде (этап, процедура) GMP талаптары мен ережелері шегінде жүзеге асырылады. Сарапшылардың ұйғарымы бойынша, GMP стандарттарына көшу өндірушіге екі жақты пайда алып келеді. Біріншіден, ел ішіндегі сапалы өнімінің тиімділігін жарнамалауды, екіншіден мемлекеттің экспортты әлуетін жYзеге асыруды камтамасыз emegi. [ 3 ]
Фармацевтика саласының GMP ережелеріне көшу – фармацевтика өнеркәсі-бінің құрылысын толық қайта жүргізілуін, «Таза бөлме» дайындауды, технологиялық құрал-жабдықтарды жаңғыртуды және жаңа сапа жүйесін ұйымдастыруды талап ететін күрделі, көп қаражатты қажет ететін міндет болып саналады.
Қазіргі кездегі Қазақстандық фармацевтика өнеркәсіптеріне дамыған елдердің GMP әдіснамаларын ендіру халықаралық сарапшылар қызметінің қымбат коммерция-лық бағасына байланысты қол жетімсіз болып тұр. Сонымен қатар, технологиялық процестердің ерекшеліктеріне байланысты дәрілік заттардың өндірісі туралы бірнеше мәселелер мамандармен техникалық тапсырмалар аясында айқындалуда. Әлбетте, қалыптасқан жағдайда технология құпия-лылығы айтарлықтай маңызды болып табылады. Сондықтан отандық мамандармен сапасы мінсіз дәрілік заттарды шығару мақсатында фармацевтикалық өндірісті ұйымдастырудың өзіндік методологиясын иелену қажеттілігі туындайды [4].
Нәтижесі және оны талқылау
Жоғарыда айтылғандарды ескере оты-рып, халықаралық талаптарға сай фармацевтика өндірісін ұйымдастыру тәртібінің әдістемелік амалын жасауға байланысты мәселе туындайды.
Өндірісті ұйымдастырудың әдісна-масын жасау кезінде Қазақстан Респуб-ликасының фармацевтика өнеркәсібіне GMP талаптарын енгізу үрдісіне ықпалын тигізетін ғимарат, құрал-жабдықтар, қызметкерлер, технология, шикізат, өнімнің номенкла-турасы, менеджмент пен маркетинг сияқты факторларды ескеру қажет [5].
Өндірістік циклдің барлық элемент-терінің беріктілігін бағалау үшін, сонымен қатар әр түрлі кезеңдер мен сатыларды жан- жақты дайындау мен жоспарлау үшін фармацевтикалық өндірісті ұйымдастырудың алгортимін ұстану қажет (Сурет 1). Барлық жоспарланған жұмыстар қолданыстағы нормативті құжаттарға сәйкес белгілі бір реттілікпен ұйымдастырылуы керек. [4]
Жалпы алғанда ТМД елдерінің фармацевтика нарығы тізбекті заңдылықтың кешіктірілмелі қалыптасуына орай жүзеге асырылуына қарамастан, салыстырмалы түрде жақсы дамып келе жатқанын атап өткен жөн. Көп мемлекеттердің реттеу жүйесі компиляция бойынша ерекшеленеді, және де өзінде кеңес дәуірінен қалған элементтер мен шетел стандарттарымен үндестірілген блоктарды үйлестіреді. [6].
Бүгінде анық болып тұрғандай, жоғары бәсекелестік жағдайында отандық фармацевтика өнімдерін өндірушілердің өздерінің барлық өндірістік қуаттылықтарын жаһанды модерназиясын жүргізбейінше және GMP тиісті өндірістік тәжірибе стандарттарына өтпейінше тұрақты дамуы мүмкін еместігі анық болып тұр. Бұл ретте мемлекеттің белсенді ат салысу қажеттілігі айқындалуда.
Фармацевтика саласын дамытудағы мемлекеттік саясатты жүзеге асыру үшін институционалды, инфрақұрылымды және инвестициялық дамыту шараларын, және де Қазақстан Республикасының мемлекеттік фармацевтика саласын жалпы жүйелік дамытуды талап етеді. Ішкі және сыртқы нарықта отандық фармацевтика өнімдерін өндірушілердің бәкелестікке қабілеттілігін жоғарлатудағы мемлекеттік қолдаудың негізгі шаралары GMP стандарттарын өндіріске енгізуді, дәрілік заттарды мемлекеттік тіркеу мен сертификациялау жүйесін дамытуды, тиісті сападағы дәрілік препараттардың қол жетімділігін қамтамасыз етуді, отандық дәрілік заттарды өндіруде инновациялық технологиялық шешімдермен алмасуды немесе енгізуді, жаңа фармацевтика өндірісінің құрылысын салуда және жұмыс істеп тұрған өндірістің модернизациясын жүргізуде мемлекеттің қатысуын және қолдауын, фармацевтика саласында кадр әлеуетін білім беру жүйесін реформалау негізінде және шетелдік компаниялармен, мамандармен тығыз байланыс жасау арқылы жоғарлатуды қарастырады (Сурет 2).
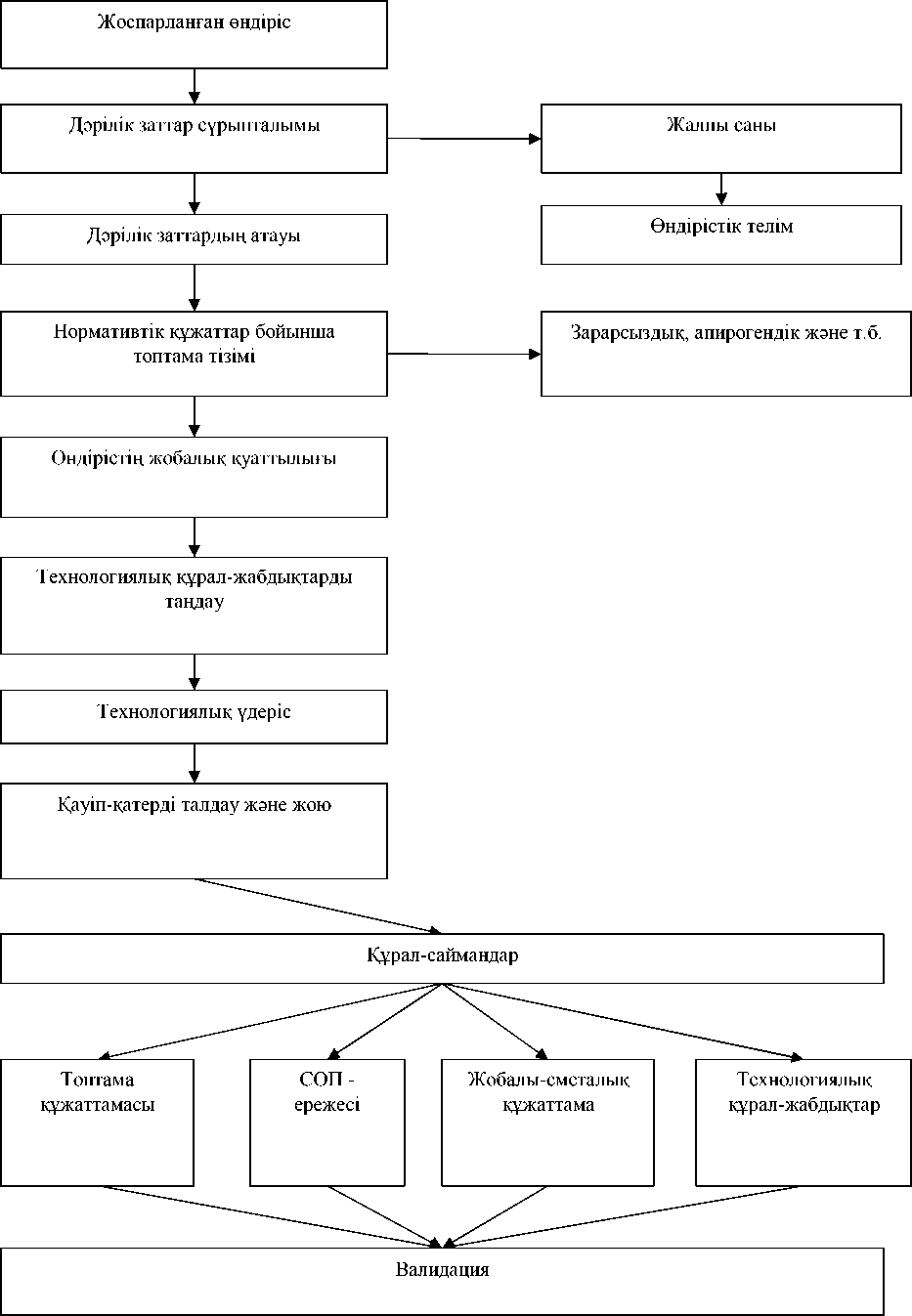
Сурет 1 – Фармацевтикалық өндірісті ұйымдастырудың алгоритмі.
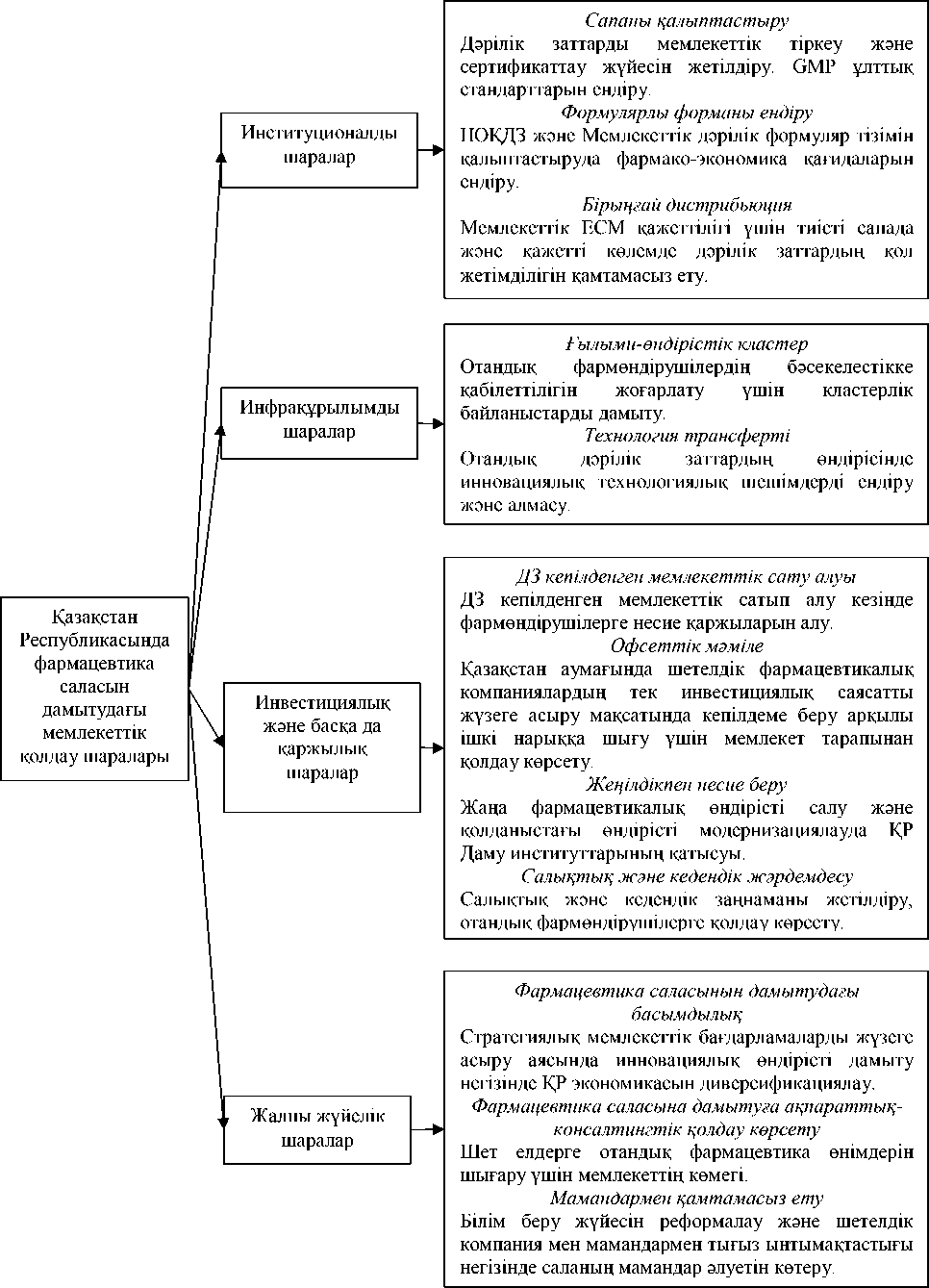
Сурет 2 – Отандық фармацевтика саласын мемлекеттік қолдау көрсетудің негізгі шаралары
Қорытынды
Қорыта келгенде, фармацевтикалық өндірісті ұйымдастырудың алгортимін ұстану арқылы мемлекеттік бағдарламаны жүзеге асыру барысында инвестициялық климатты жақсартуға, өнім сапасының жоғарлауына, отандық фармацевтика өнімдерін өндіру-шілердің бәсекелестігін дамытуға жағдай жасалады. Осы ретте фармацевтикалық өндірісті ұйымдастырудың әдістемелік тәсілдемесі мен кестесі жасалынуы тиіс, техникалық үдерістің қауіп-қатерін талдау мақсатында стартегиялық тәсілдемесін, өндірістің мастер-файлын жасау алгоритмін қалыптастыру қажет.
ӘДЕБИЕТТЕР ТІЗІМІ
-
1. Қазақстан Республикасының Үкіметінің 2010 жылдың 4 тамызындағы Өкімі «Қазақстан
Республикасының 2010-2014 жылға арналған фармацевтикалық өнеркәсіпттерді дамыту бойынша бағдарламасы».
-
2. Атажанова Г.А. Об организации производства эфирных масел по стандартам GMP // Фармацевтический бюллетень. – 2011. – №5-6. – С. 46-55.
-
3. Грыглевич В. АО «Химфарм» - новые горизонты казахстанской фармацевтической отрасли // Главный врач. – 2012. – №1(1). – С. 64-65.
-
4. Итжанова Х.И. Алгоритм организации фармацевтического производства // Фармацевтический бюллетень. – 2011. – №3-4. – С. 74-78.
-
5. Павелковская Г.П. К вопросу внедрения GMP на фармпроизводствах Республики Казахстан // Фармацевтический бюллетень. – 2011. – №3-4. – С. 31-34.
-
6. Султанов С.Е. Своя таблетка сердцу ближе // Фармацевтический бюллетень. – 2007. – №7,8. – С. 18.
Список литературы Основные меры по организации фармацевтической продукции в Республике Казахстан
- Қазақстан Республикасының Үкiметiнiң 2010 жылдың 4 тамызындағы Өкiмi «Қазақстан Республикасының 2010-2014 жылға арналған фармацевтикалық өнеркәсiпттердi дамыту бойынша бағдарламасы».
- Атажанова Г.А. Об организации производства эфирных масел по стандартам GMP//Фармацевтический бюллетень. -2011. -№5-6. -С. 46-55.
- Грыглевич В. АО «Химфарм» -новые горизонты казахстанской фармацевтической отрасли//Главный врач. -2012. -№1(1). -С. 64-65.
- Итжанова Х.И. Алгоритм организации фармацевтического производства//Фармацевтический бюллетень. -2011. -№3-4. -С. 74-78.
- Павелковская Г.П. К вопросу внедрения GMP на фармпроизводствах Республики Казах-стан//Фармацевтический бюллетень. -2011. -№3-4. -С. 31-34.
- Султанов С.Е. Своя таблетка сердцу ближе//Фармацевтический бюллетень. -2007. -№7,8. -С. 18.


