Особенности аллельного полиморфизма некоторых генов системы гемостаза у больных с тромбозом глубоких вен, осложненным тромбоэмболией легочной артерии
Автор: Капустин С.И., Сидорова Ж.Ю., Шмелева В.М., Карпич С.А., Дрижун Ю.С., Каргин В.Д., Солдатенков В.Е., Попаян Л.П.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.13, 2017 года.
Бесплатный доступ
Венозные тромбозы (ВТ) по-прежнему являются серьезной медико-социальной проблемой.Значительная часть тромботических эпизодов в системе нижней полой вены сопровождается развитием тромбоэмболии легочной артерии(ТЭЛА), что определяет актуальность поискафакторов риска этого жизнеугрожающего осложнения. В данной работе изучена роль аллельного полиморфизма 16-ти генов, вовлеченных в регуляцию гемостаза, в увеличении риска возникновения ТЭЛА у больных с тромбозом глубоких вен (ТГВ). Установлены генетические варианты(генотипы и их сочетания), характерные для пациентов с ТГВ, осложненным ТЭЛА. Показано,что генетически обусловленная склонность к повышенной активации тромбоцитарного звена гемостаза является важным фактором риска ТЭЛА,особенно, при сочетании с аллельными вариантами, ассоциированными с эндотелиальной дисфункцией. Анализ “ген-генных взаимодействий”обнаружил значительные различия в спектрегенетических вариантов, увеличивающих риск развития ТЭЛА у больных с ТГВ, являющихся носителями мутации в гене фактора II или V. Полученные данные свидетельствуют о существенном влиянии генетической вариабельности компонентов, вовлеченных в регуляцию функциональной активности гемостаза, на особенности клинического течения ВТ, в частности, риск возникновения ТЭЛА.
Венозный тромбоз, тромбофилия, ген, полиморфизм, фактор риска
Короткий адрес: https://sciup.org/170172519
IDR: 170172519
Текст научной статьи Особенности аллельного полиморфизма некоторых генов системы гемостаза у больных с тромбозом глубоких вен, осложненным тромбоэмболией легочной артерии
Введение. Несмотря на все достижения современной медицины, тромбоэмболические заболевания по-прежнему остаются ведущей причиной смертности и инвалидизации в индустриально развитых странах. Частота возникновения венозных тромбозов (ВТ) в общей популяции составляет 1-2 случая на тысячу населения ежегодно. Одной из важнейших особенностей ВТ является гетерогенность его клинических проявлений. Более 90% тромботических эпизодов локализуются в системе нижней полой вены, основная их часть протекает бессимптомно и обнаруживается лишь впоследствии, при развитии хронической венозной недостаточности, тромбоэмболии легочной артерии (ТЭЛА), и, к сожалению, достаточно часто на аутопсии [ 1 ]. Фатальная ТЭЛА является первым и единственным проявлением в 10-20% случаев ВТ и занимает третье место в общей структуре причин внезапной смерти [2, 3]. Установление факторов риска (ФР) ТЭЛА у больных с тромбозом глубоких вен (ТГВ) представляется чрезвычайно актуальной задачей.
В настоящее время особое место в патогенезе ВТ отводится повышенной склонности индивида к развитию тромбоза или тромбофилии. Данное состояние может быть обусловлено как генетическими, так и приобретенными факторами [4]. К числу классических форм наследственной тромбофилии относятся дефицит естественных антикоагулянтов, мутации в генах факторов II и V свертывания крови, которые обнаруживаются, в целом, у 25-50% больных с ВТ [5]. Следует, однако, признать, что молекулярные аспекты патогенеза ВТ остаются недостаточно изученными. В связи с общепринятой концепцией полигенной предрасположенности к тромбозу, в последние годы особый интерес уделяется изучению аллельного полиморфизма генов важнейших компонентов, вовлеченных в регуляцию функциональной активности гемостаза [6, 7]. Несмотря на интенсивный поиск новых молекулярных детерминант НТ, данные о роли большей части известных генетических вариантов в развитии ВТ остаются весьма противоречивыми. Сложившаяся ситуация во многом объясняется многофакторной природой ВТ и сложным характером взаимодействия генетических и экзогенных ФР, лежащих в основе или провоцирующих развитие патологических сдвигов в системе гемостаза [8]. В то же время, публикации, в которых проводится анализ подобных взаимодействий, весьма немногочисленны. К сожалению, упомянутая выше гетерогенность клинических проявлений ВТ также, как правило, не принимается во внимание авторами, работающими в области молекулярной эпидемиологии ВТ. Отсутствие исследований, направленных на установление коррелятивных связей между особенностями клинического течения тромботического процесса и наличием определенных маркеров в генотипе пациента, оставляет нерешенным целый ряд вопросов относительно целесообразности диагностики тех или иных генетических вариантов в клинической практике.
В данной работе, на основании комплексного анализа аллельного полиморфизма 16-ти генов, ассоциированных с дисфункцией плазменного и тромбоцитарного звеньев гемостаза, а также сосудистой стенки, определены генетические варианты, увеличивающие риск развития ТЭЛА у больных с ТГВ.
Материалы и методы. Обследуемую группу составили 420 больных с тромбозом глубоких вен в системе нижней полой вены (210 мужчин и 210 женщин, средний возраст 40,4 ± 12,2 года), находившихся в 2000-2016 гг. на стационарном или амбулаторном лечении в ФГБУ РосНИИГТ ФМБА России и проживающих в Северо-Западном регионе России. Критериями отбора больных являлись наличие в анамнезе объективно доказанного эпизода ТГВ, а также отсутствие в анамнезе эпизодов артериального тромбоза, иных проявлений артериальной патологии (ишемическая болезнь сердца, облитерирующий атеросклероз сосудов нижних конечностей, цереброваскулярные заболевания), онкологических и гематологических заболеваний. Для подтверждения диагноза ТГВ использовалось ультразвуковое допплерографическое ангиосканирование, у пациентов с ТЭЛА проводились обзорная рентгенография органов грудной клетки, электрокардиографическое исследование, по показаниям — перфузионная сцинтиграфия или/и ангиография легких. В 303 (72,1%) случаях клинико-инструментальное обследование не выявило признаков ТЭЛА (подгруппа “изолированный ТГВ”), тогда как у 117 (27,9%) пациентов ТГВ осложнился развитием ТЭЛА (подгруппа “ТГВ+ТЭЛА”).
Образцы геномной ДНК выделяли из лейкоцитов периферической крови по методу S. A. Miller et al. [9]. Идентификацию аллельных вариантов осуществляли на основе полимеразной цепной реакции (ПЦР) с последующим рестрикционным анализом и/или разделением продуктов в полиакриламидном геле. В работе изучен аллельный полиморфизм 16-ти различных генов:
-
1) гены, кодирующие компоненты плазменного звена гемостаза (факторы I, II, V, XII сверты-
- вания крови, тканевой активатор плазминогена — ТРА, ингибитор активатора плазминогена типа I — PAI-1);
-
2) гены, кодирующие компоненты тромбоцитарных рецепторов, опосредующих процессы адгезии и агрегации кровяных пластинок (гликопротеины la, Iba, Ша, тромбоцитарный рецептор АДФ — P2Y12);
-
3) гены компонентов, вовлеченных в патогенез эндотелиальной дисфункции (метилентетрагидрофолат редуктаза — MTHFR, аполипопротеин Е — АроЕ, эндотелиальная синтаза оксида азота — eNOS, ангиотензиноген — AGT, ангиотензин превращающий фермент — АСЕ, рецептор ангиотензина II первого типа — ATGR1).
Частоты встречаемости (ЧВ) аллелей и генотипов определяли прямым подсчетом. При проведении анализа “ген-генных взаимодействий” оценка статистической значимости “неравновесия по сцеплению” между изученными ДНК-полиморфизмами осуществлялась с помощью программ “GenePop” и “GDA”, доступных в Интернете. Анализ ассоциативных связей внутри генотипических сочетаний, а также оценку степени различий в частоте встречаемости аллелей, генотипов и межгенных комбинаций между исследуемыми группами проводили с помощью точного критерия Фишера. Для расчета коэффициента “отношения шансов” (OR) с 95 % доверительным интервалом (CI) и ^-значения использовался статистический пакет GraphPad Prism, версия 2 (GraphPad Software Inc., San Diego, USA).
Результаты и обсуждение. При анализе распределения генотипов было обнаружено более чем 10-кратное увеличение доли гомозиготных носителей варианта “P2Y12 Н2” гена тромбоцитарного рецептора АДФ в подгруппе “ТГВ+ТЭЛА” (3.4% против 0.3% у пациентов с изолированным ТГВ, OR=10.7, 95% CI: 1.2-97.0; р = 0.023). Вариабельность гена P2Y12 была впервые описана Р. Fontana et al. в 2003 году [10]. Авторы идентифицировали пять вариантов ДНК-полиморфизма, четыре из которых находятся в полном неравновесном сцеплении и образуют два гаплотипа — Н1 и Н2. Было также показано, что у здоровых лиц носительство гаплотипа Н2 коррелирует с увеличением максимальной агрегации тромбоцитов в ответ на стимуляцию 2мкМ АДФ, а также с уменьшением внутриклеточной концентрации цАМФ [10]. Несколько позже эта же группа ученых сообщила, что гаплотип Н2 гена P2Y12 является ФР тромбоза периферических артерий [11]. Полученный нами резуль тат свидетельствует о существенном увеличении риска ТЭЛА, как осложнения ТГВ, при наличии генетически обусловленной склонности к АДФ-зависимой гиперактивации тромбоцитов.
В группе “ТГВ+ТЭЛА” было выявлено почти двукратное снижение доли носителей мутации FV Leiden (10.3% против 19.5% среди пациентов с изолированным ТГВ, OR=0.5, 95% CI: 0.2-0.9; р = 0.029). Подобный феномен нередко отмечался и другими авторами [12, 13], хотя причины его до сих пор остаются неясными. Возможным объяснением более низкой ЧВ аллеля “FV 1691А” у больных ТГВ, перенесших ТЭЛА, являются специфические для этого генетического варианта молекулярные механизмы образования тромба, способствующие его более прочной фиксации на поверхности сосудистой стенки. Таким образом, наличие Лейденской мутации способно, по крайней мере, в определенных случаях, оказывать протективное влияние на риск развития ТЭЛА. При этом обратной стороной “благоприятного” эффекта мутантного аллеля гена фактора V может быть усиление локальных гиперкоагуляционных процессов, приводящих к повторным эпизодам ТГВ [14]. Интересное предположение относительно причины снижения доли носителей мутации FV Leiden у пациентов с ТГВ, осложненным ТЭЛА, высказали О. Bjorgell et al. [15]. По их мнению, для носителей этого генетического варианта является нехарактерным развитие тромбоза илеофемораль-ного сегмента, наиболее часто сопровождающегося эмболизацией ветвей легочных артерий. Однако результаты наблюдений пациентов с ВТ в хирургической клинике РосНИИГТ, напротив, свидетельствуют о высокой (более 75%) доле тромбозов проксимальных венозных магистралей у больных с мутацией в гене фактора V [ 16].
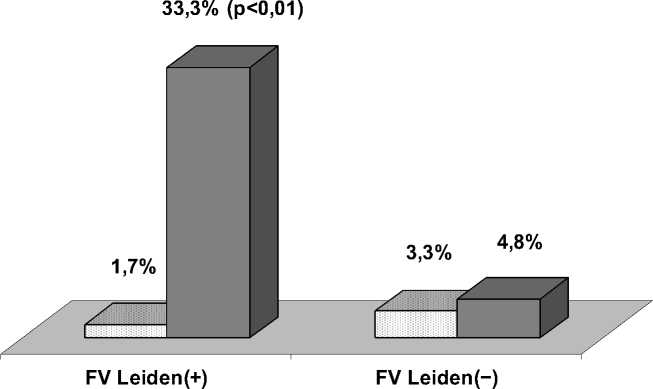
Несмотря на снижение ЧВ варианта FV Leiden в группе “ТГВ+ТЭЛА”, были выявлены генетические варианты, сочетание которых с указанной мутацией увеличивает риск развития этого грозного осложнения у пациентов с ТГВ. Одновременное носительство аллеля “MTHFR677T”, а также генотипов “FI -455GA”, “FXII 46СТ” и “AGT 704ТС” наблюдалось почти в 20 раз чаще у больных с FV Leiden из группы “ТГВ+ТЭЛА” (33.3% против 1.7% у носителей данной мутации с изолированным ТГВ, OR=29.0, 95% CI: 2.9-293.1; р = 0.002) (рис. 1). В то же время, при сравнении индивидов с нормальным генотипом фактора V, данная комбинация встречалась среди больных, перенесших ТЭЛА, практически с такой же частотой, что и у пациентов с неос- ложненным ТГВ (4.8% против 3.3%, соответственно, OR=1.5, 95% CI: 0.5^.6; р = 0.54). Таким образом, увеличение риска развития ТЭЛА в случае одновременного носительства протром-ботических вариантов генов MTHFR, ангиотен-зиногена, факторов I и XII является характерным именно для больных ТГВ с Лейденской мутацией. В группе “ТГВ+ТЭЛА” обнаружено более чем 10-кратное увеличение ЧВ генотипического сочетания “FV 1691GA / MTHFR677T(+) / FI
-455GA / FXII 46СТ / AGT 704TC” (3.4% против 0.3% у пациентов с изолированным ТГВ, OR=10.7, 95% CI: 1.2-6.7; р = 0.023). Можно сделать предположение, что редкая встречаемость одновременного носительства аллелей “MTHFR677T”, “FI -455А”, “FXII 46Т” и “AGT 704С” является одним из объяснений более низкой частоты возникновения ТЭЛА у больных ТГВ с вариантом FV Leiden, чем, например, у пациентов с мутацией в гене протромбина.
□ Изолированный ТГВ □ ТГВ+ТЭЛА
Рис. 1. Частота встречаемости комбинации “MTHFR677T(+) /FI-455GA /FXII 46СТ/AGT 704TC” при различных проявлениях ВТ в зависимости от наличия мутации FVLeiden.
Доля носителей мутации “FII 20210G/A” была существенно выше в группе “ТГВ+ТЭЛА” (12.0% против 7.3% у лиц с неосложненным ТГВ, OR=1.7, 95% CI: 0.9-3.5; р = 0.12), однако данное различие не достигало пределов статистической значимости. Тем не менее, анализ “ген-генных взаимодействий” позволил выявить факторы, сочетание с которыми увеличивает риск развития ТЭЛА у больных ТГВ с мутацией в гене протромбина. Среди них — гетерозиготный генотип “P2Y12 Н1/Н2” тромбоцитарного рецептора АДФ, а также носительство аллеля “АроЕ Е4”. Сильная положительная ассоциация между носительством мутации в гене фактора II и генотипом “P2Y12 Н1/Н2”, обнаруженная в группе “ТГВ+ТЭЛА”, обусловила высокую статистическую значимость отличия ЧВ соответствующей межгенной комбинации у этих больных от таковой у лиц с изолированным ТГВ (7.8% против 1.7%, соответственно, OR=5.0, 95% CI: 1.6-15.3; р = 0.004). Генотип “P2Y12 Ш/ Н2” наблюдался у 9/13 (69.2%) пациентов с му тацией в гене протромбина, перенесших ТЭЛА, по сравнению с 5/22 (22.7%) в группе больных с изолированным ТГВНК (OR=7.7, 95 % CI: 1.6-35.8;р = 0.012).
В группе “ТГВ+ТЭЛА” также наблюдалась положительная ассоциация между генотипом “FII 20210GA” и носительством аллеля “АроЕ Е4”, следствием которой явилось 5-кратное увеличение среди этих больных доли лиц с комбинацией указанных генетических вариантов (5.1% против 1.0 % у пациентов с изолированным ТГВНК, OR=5.5, 95% CI: 1.3-22.0; р = 0.016). Вариант “АроЕ Е4” обнаруживался среди лиц с мутацией “FII 20210G/A” более чем в 3 раза чаще в группе больных, перенесших ТЭЛА, чем у индивидов с неосложненным ТГВ (42.9% против 13.6%, соответственно). Наконец, полученные данные свидетельствовали о кооперативном эффекте аллеля “АроЕ Е4” и генотипа “P2Y12 Н1/Н2” в отношении увеличения риска развития ТЭЛА у больных с мутацией в гене протромбина. Генотипическое сочетание из трех вариантов — гено- типов “FII 2021 OGA”, “P2Y12 Н1/Н2” и аллеля “АроЕ Е4”, наблюдалось исключительно в группе пациентов, перенесших ТЭЛА (4.3% против 0.0% у лиц с неосложненным ТГВ, OR=29.7, 95% CI: 1.6-541.4; р = 0.002). Таким образом, можно предположить, что основными факторами риска развития ТЭЛА у больных ТГВ с мутацией в гене протромбина являются наличие АроЕ-опосредованных изменений сосудистой стенки, а также генетически обусловленная склонность к АДФ-зависимой гиперактивации тромбоцитов. Вероятно, взаимодействие этих двух фенотипов способствует флотации тромба, сформировавшегося в условиях повышенного уровня фактора II в плазме.
Координированное участие механизмов, вовлеченных в патогенез эндотелиальной дисфункции и активацию тромбоцитарного звена гемостаза, в формировании риска развития ТЭЛА у больных с ТГВ, по-видимому, является характерным не только для случаев носительства мутации в гене протромбина. Подтверждением этому могут служить и другие межгенные комбинации, специфические для подгруппы “ТГВ+ТЭЛА”. Сочетание генотипа “МТН-FR677TT”, предрасполагающего к повышению уровня гомоцистеина, с носительством аллеля “GpIIIa 1565С” наблюдалось в 5 раз чаще среди пациентов с ТГВ, осложненным ТЭЛА (5.1 % против 1.0% у индивидов с изолированным ТГВ, OR=5.4, 95% CI: 1.3-22.0; р = 0.016). Кроме того, в подгруппе “ТГВ+ТЭЛА” отмечалась сильная положительная ассоциация между генотипом “MTHFR677TT” и носительством аллеля “АроЕ Е4” (OR=5.3, 95% CI: 1.7-16.2; р = 0.004). В результате, увеличение у этой части больных ЧВ “тройной” межгенной комбинации, включающей генотип “MTHFR677TT”, а также носительство аллелей “GpIIIa 1565С” и “АроЕ Е4”, характеризовалось высоким уровнем статистической значимости (4.3 % против 0.3 % в группе лиц с изолированным ТГВ, OR=13.5, 95% CI: 1.6-116.7; р = 0.007). Положительная ассоциация между генотипом “MTHFR677TT” и носительством аллеля “АроЕ Е4”, обнаруженная в группе больных, перенесших ТЭЛА, по всей видимости, отражает важную роль гомоцистеин-опос-редованных процессов перекисного окисления липидов в развитии патологических изменений сосудистой стенки [17, 18].
Особого внимания заслуживает более чем двукратное увеличение в группе “ТГВ+ТЭЛА” доли лиц, являющихся одновременными носителями генотипов “AGT 704ТС”, “FI -455GA”, а также аллелей “PAI-1-675 4G” и “АСЕ D” (19.7% против 8.6% среди больных с неосложненным ТГВ, OR=2.6, 95% CI: 1.4-4.8; р = 0.004). Помимо высокой статистической значимости выявленного различия, эта межгенная комбинация интересна отсутствием в ее составе генетических вариантов, ассоциированных с изменением функциональной активности тромбоцитарного звена гемостаза. Вероятным патогенетическим механизмом ТЭЛА, обусловленным указанным генотипическим сочетанием, является PAI-1-зависимый гипофибринолиз, опосредованный активацией ренин-ангиотензиновой системы (РАС), при одновременном увеличении уровня фактора I в плазме. Нельзя также исключать, что негативный эффект гиперактивации РАС в данном случае связан с ее непосредственным участием в нарушении тромборезистентности сосудистой стенки. Наконец, весьма важным моментом является довольно высокая распространенность межгенной комбинации “AGT 704ТС / FI -455GA / PAI-1-675 4G(+) / АСЕ D(+) ” среди пациентов с ВТ, что позволяет говорить о несомненной ценности ее выявления в клинической практике для прогнозирования риска развития ТЭЛА у больных с ТГВ.
Таким образом, полученные в ходе проведенного исследования данные свидетельствуют о существенном влиянии генетической вариабельности компонентов, вовлеченных в регуляцию функциональной активности гемостаза, не только на риск развития ВТ, но и на особенности его клинического течения. Расширение спектра анализируемых полиморфизмов ДНК, их комплексная оценка с учетом “ген-генных взаимодействий”, выявление наиболее опасных протромботических генотипов и их комбинаций на доклиническом этапе с целью прогнозирования риска развития ТГВ и ТЭЛА могут сыграть решающую роль на пути снижения частоты возникновения ВТ в популяции. Полученные результаты могут служить очередным доказательством перспективности внедрения методов молекулярной диагностики изученных полиморфизмов ДНК в широкую клиническую практику.
Список литературы Особенности аллельного полиморфизма некоторых генов системы гемостаза у больных с тромбозом глубоких вен, осложненным тромбоэмболией легочной артерии
- Gathof B. S., Picker S. M., Rojo J. Epidemiology, etiology and diagnosis of venous thrombosis // Eur. J. Med. Res. 2004. Vol. 9. P. 95-103.
- Heit J. A., Silverstein M. D., Mohr D. N. et al. The epidemiology of venous thromboembolism in the community // Thromb. Haemost. 2001. Vol. 86. P. 452-463.
- Кириенко А. И., Мишнев О. Д., Цициашвили М. Ш., Агафонов В. Ф. Проблема послеоперационных венозных тромбоэмболических осложнений в хирургической практике // Ангиология и сосудистая хирургия. 2003. Т. 9, № 1. С. 61-65.
- Баркаган З. С. Клинико-патогенетические варианты, номенклатура и основы диагностики гематогенных тромбофилий // Проблемы гематологии. 1996. № 3. C. 5-15.
- De Stefano V., Rossi E., Paciaroni K., Leone G. Screening for inherited thrombophilia: indications and therapeutic implications // Haematologica. 2002. Vol. 87. P. 1095-1108.
- Lane D. A., Grant P. J. Role ofhemostatic gene polymorphisms in venous and thrombosis arterial disease // Blood. 2000. Vol. 95. P. 1517-1532.
- Zoller B., Garcia de Frutos P., Hillarp A., Dahlback B. Thrombophilia as a multigenic disease // Haematologica. 1999. Vol. 84. P. 59-70.
- Samama M. M., Dahl O. E., Quinlan D. J. et al. Quantification of risk factors for venous thromboembolism: a preliminary study for the development of a risk assessment tool // Haematologica. 2003. Vol. 88. P. 1410-1421.
- Miller S. A., Dykes D. D., Polesky H. F. A simple salting out procedure for extracting DNA from human nucleated cells // Nucl. Acid. Res. 1988. Vol. 16. P. 1215-1218.
- Fontana P., Dupont A., Gandrille S. et al. Adenosine diphosphate-induced platelet aggregation is associated with P2Y12 gene sequence variations in healthy subjects // Circulation. 2003. Vol. 108. P. 989-995.
- Fontana P., Gaussem P., Aiach M. et al. P2Y12 H2 haplotype is associated with peripheral artery disease. A case-control study // Circulation. — 2003. — Vol. 108. — P. 2971-2973.
- Margaglione M, Brancaccio V, De Lucia D. et al. Inherited thrombophilic risk factors and venous thromboembolism: distinct role in peripheral deep venous thrombosis and pulmonary embolism // Chest. 2000. Vol. 118. P. 1405-1411.
- Martinelli I., Cattaneo M., Panzeri D. et al. Low prevalence of factor V: Q506 in 41 patients with isolated pulmonary embolism // Thromb. Haemost. 1997. Vol. 77. P. 440-443.
- Perrier A. Deep vein thrombosis and pulmonary embolism. A single disease entity with different risk factors? // Chest. 2000. Vol. 118. P. 1234-1236.
- Bjorgell O., Nilsson P. E., Nilsson J. A. et al. Location and extent of deep vein thrombosis in patients with and without FV: R506Q mutation // Thromb. Haemost. 2000. Vol. 83. P. 648-651.
- Каргин В. Д., Блинов М. Н., Капустин С. И. и др. Особенности профилактики и лечения тромбозов при наследственных тромбофилиях: Пособие для врачей. СПб.: Изд-во СПбГМУ, 2003.
- Smith J. D., Miyata M., Poulin S. E. et al. The relationship between apolipoprotein E and serum oxidation-related variables is apolipoprotein E phenotype dependent // Int. J. Clin. Lab. Res. 1998. Vol. 28. P. 116-121.
- Voutilainen S., Morrow J. D., Roberts L. J. et al. Enhanced in vivo lipid peroxidation at elevated plasma total homocysteine levels // Arterioscler. Thromb. Vasc. Biol. 1999. Vol. 19. P. 1263-1266.


