Особенности ассоциативного симбиоза на примере интестинальной бактериофлоры радужной форели (Parasalmo mykiss walbaum)
Автор: Сидорова Н.А., Кучко А.А.
Журнал: Принципы экологии @ecopri
Рубрика: Оригинальные исследования
Статья в выпуске: 4 (50), 2023 года.
Бесплатный доступ
Изучение особенностей ассоциативного симбиоза выполнено на примере кишечной бактериофлоры трех возрастных групп радужной форели, выращенной в условиях садкового содержания в акватории Ладожского озера. Для описания структуры ассоциативного симбиоза кишечника форели использованы методы микробиологического анализа и полногеномное секвенирование по Сенгеру. Для выявления значимости различных таксонов бактерий в ассоциативном симбиозе выполнена серия экспериментов по сокультивированию и оценка жизнеспособности ассоциантов. В результате микробиологического анализа и генотипирования описано 310 видов бактерий, принадлежащих к 37 родам. Благодаря сравнительному изучению состава интестинальной микрофлоры обнаружено, что в возрастной группе 1+ доминируют фирмикутные бактерии, а в возрастных группах 2+ и 3+ - протеобактерии. К константным таксонам отнесены представители 11 родов, для которых описана последовательная смена доминантных, субдоминантных и минорных микросимбионтов в зависимости от возрастной группы форели. Для возрастной группы 1+ очередность смены таксонов состояла из последовательности Eubacterium > Bacteroides > Micrococcus > Proteus > Fusobacterium, для возрастной группы 2+ Bacillus > Propionibacterium > Bacteroides > Fusobacterium > Citrobacter, а для возрастной группы 3+ Bacillus > Proteus > Flexibacter > Campylobacter > Cetobacterium. В результате эксперимента по сокультивированию кишечной бактериофлоры однолетних и двухлетних особей форели описан взаимостимулирующий эффект между ассоциантами, о чем свидетельствуют высокие значения оптической плотности культурального раствора, длительный линейный характер роста, постоянство скорости накопления биомассы и достижение большого числа жизнеспособных клеток в ассоциации.
Ассоциативный симбиоз, доминанты, субдоминанты, интенстинальная бактериофлора, минорные микросимбионты, радужная форель
Короткий адрес: https://sciup.org/147242326
IDR: 147242326 | УДК: 579.26:579.262 | DOI: 10.15393/j1.art.2023.14342
Текст научной статьи Особенности ассоциативного симбиоза на примере интестинальной бактериофлоры радужной форели (Parasalmo mykiss walbaum)
Симбиоз у рыб встречается повсеместно и, согласно современной интерпретации, не всегда предполагает наличие специализированных облигатных связей между партнерами (Helfman et al., 2009; Немцева, 2015). Благодаря достижениям в области симбиологии, в литературе все чаще стал встречаться термин «ассоциативный симбиоз» (Проворов, 2001), а микроорганизмы, обитающие на поверхности и во внутренних средах растительных и животных организмов, рассматриваются как представители «ассоциативного симбиоза» (Чёрная, 2017). Согласно первоисточникам (Лобакова, 2006; Бухарин и др., 2007; Яценко-Степанова, Немцева, 2009), к основным компонентам ассоциативного симбиоза относятся макропартнер или хозяин, доминантный симбионт и минорные микросимбионты с функциями, отвечающими за формирование и стабильность существования симбиотических отношений. Функции в основном связаны с биосинтезом широкого спектра метаболитов, с иммунологическими, эволюционными и экологическими процессами (Bordenstein et al., 2015; Woodhams et al., 2020). В составе интестинальной микрофлоры рыб ассоци-анты на уровне кишечника обеспечивают относительное постоянство, что во многом зависит от колонизационной резистентности организма хозяина и от многообразных биологических характеристик микроорганизмов. Это способность к адгезии за счет взаимодействия лектинов с гликопротеинами и гликолипидами эпителиальных клеток кишечника или пищевых субстратов, колонизационная активность, конкуренция за питательный субстрат, антагонистическая активность, способность к биопленкообра-зованию и созданию на уровне желудочно-кишечного тракта специализированных микробных сообществ. В свою очередь колонизация бактериями пищеварительного тракта зависит от pH среды в кишечнике, перистальтики, содержания желчных кислот и пищеварительных ферментов, иммунного ответа хозяина на бактериальную инвазию, а также от присутствия автохтонных бактерий и выраженных антагонистов, способных к биосинтезу антибиотикоподобных соединений (Hansen, Olafsen, 1999; Ringo et al., 2003). В исследованиях, посвященных ассоциативным микроорганизмам (Minich et al., 2020а, б; Riiser et al., 2020), указывается также на важность экзогенных и эндогенных факто- ров, которые существенно влияют на качественное и количественное разнообразие микрофлоры кишечника рыб. К экзогенным относят особенности водоемов, биоразнообразие микрофлоры воды, рацион питания, а к эндогенным, связанным с организмом хозяина, особенности генетики, физиологии и иммунитета.
Установлено, что среди представителей ассоциативного симбиоза у рыб преобладают аэробные и факультативноанаэробные виды (Ringo, Birkbeck, 1999). Доминируют виды родов Aeromonas, Acinetobacter, Achromobacter, Bacillus, Bacteroides, Citrobacter, Corynebacterium, Cytophaga / Flexibacter, Enterobacter, Eikenella, Escherichia, Flavobacterium, Hafnia, Klebsiella, Listeria, Micrococcus, Moraxella, Propionibacterium, Proteus, Pseudomonas, Serratia, Staphylococcus (Austin, 2002). В составе интестинальной аутофлоры рыб обнаружено присутствие молочнокислых бактерий Lactobacillus casei, L. paracasei subsp. paracasei, L. brevis, L. fermentum , которые, по мнению некоторых авторов, не являются доминантными, но тем не менее относятся к важным компонентам микрофлоры кишечника за счет способности продуцировать органические кислоты, перекись водорода, широкий спектр бактериоцинов, подавляющих рост патогенных и условно-патогенных видов бактерий (Jankauskiene, 2000). При изучении роли бактерий рода Lactobacillus в развитии защитных механизмов у рыб обнаружено, что в зимний период численность лактобактерий в составе микрофлоры кишечника не изменяется, а частота встречаемости основного доминанта L. casei может увеличиваться в разы (Jankauskiene, 2000).
Радужная форель относится к традиционным объектам исследований в аквакультуре. Считается, что разнообразие кишечной микрофлоры у представителей вида особенно велико (Sugita et al., 1992, 1997). Бактерии в составе интестинальной микрофлоры кишечника отвечают за колонизационную резистентность ЖКТ форели, обладают прямой антагонистической активностью и способны подавлять возможную персистенцию условных патогенов, а также контролировать взаимодействие доминантных видов с другими представителями ассоциативного симбиоза ЖКТ радужной форели (Izvekova et al., 2007). Перечисленные свойства ассоциантов чрезвычайно важны для понимания закономерностей формирования ассоциативного симбиоза на примере интестинальной ми- крофлоры, описания бактериальных механизмов колонизационной резистентности ЖКТ рыб с акцентом на последующую разработку альтернативных форм пробиотических препаратов с комплексным воздействием на аллохтонную микрофлору. С учетом того, что снижение колонизационной резистентности организма форели часто сопровождается воспалительными процессами в ЖКТ, проблема исследования ассоциативного симбиоза ЖКТ рыб считается актуальной еще и потому, что открывает новые способы диагностики инфекций объектов аквакультуры и контроля микроэкологических нарушений различной этиологии. Вышеизложенное явилось основанием для формулировки цели настоящего исследования, связанного с изучением особенностей ассоциативного симбиоза радужной форели, – описание структуры и выявление значимости отдельных представителей ассоциативного симбиоза интестинальной бактериофлоры форели разных возрастных групп.
Материалы
Для изучения структуры сообщества интестинальной аутофлоры обследовано 36 особей радужной форели Parasalmo mykiss (Walbaum, 1792) семейства лососевые Salmonidae, род лососи Salmo Linne в возрасте 1+, 2+ и 3+, выращенных в условиях форелевого хозяйства, расположенного в акватории Ладожского озера. В каждой возрастной группе микробиологический анализ был выполнен для 12 особей форели. Исследования проведены в июле – августе 2023 г., на момент исследования форель содержалась в условиях садкового разведения согласно технологическим требованиям, указанным в Руководстве по ветеринарно-санитарному контролю (2018). Все эксперименты с рыбой выполнены в соответствии с международным этическим стандартом, изложенным в Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в других научных целях, а также согласно требованиям, указанным в Приказе Министерства здравоохранения СССР от 12.08.1977 № 755 «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных» и других нормативных документах, включая заключение Комитета по этике в области исследований на животных Петрозаводского государственного университета от 7 мая 2020 г. № 274.
Методы
Для изучения состава интестинальной аутофлоры форели в стерильных условиях отбирали образцы кишечника и для неселективного накопления бактерий помещали в среду первичного обогащения следующего состава, г/л: пептон – 10. 0; NaCl – 5.0; Na2HPО4*12Н2О – 9.0; КН2РО4 – 1.5. Чистые штаммы пересевали на скошенный агар для получения биомассы клеток, необходимой для идентификации по фенотипическим признакам согласно Bergeyʼs Manual of Systematic Bacteriology (2001). При микроскопическом анализе основных морфологических признаков применяли методы окраски по Граму, Бурри – Гинсу и Пешкову. С помощью питательных сред общего, элективного и дифференциально-диагностического назначения (Гисса, Кларка, Кесслера, кровяного агара, висмут-сульфит агара, Плоскирева, Левина и др.) исследовали культуральные, биохимические и физиологические свойства микроорганизмов (Методы общей бактериологии, 1983; Методические указания..., 1998). Для полногеномного секвенирования выделенных бактерий использовали метод Сенгера (Sanger et al., 1977). Генотипирование выполняли с помощью набора реактивов BigDyeTerminatorv.3.1 (AppliedBiosystems, Inc., USA) на генетическом анализаторе ABIPRIZM 3730 (AppliedBiosystems, Inc., USA) согласно инструкциям производителя.
Для выявления значимости различных таксонов бактерий в ассоциативном симбиозе выполнена серия экспериментов по совместному культивированию доминантных, субдоминантных и минорных микросимбионтов. В эксперименте участвовали только константные таксоны. Согласно методам количественной оценки доминирования в экологических сообществах (Баканов, 2005), к константным относили таксоны, обнаруженные в более 50 % проб интестинальной микрофлоры, к второстепенным – 25–50 %, к случайным – меньше 25 %. Отобранные таксоны сокультивировали на питательной среде, содержащей 3.4 г панкреатического гидролизата рыбной муки и 5.4 г хлористого натрия. Доза вносимого инокулята составляла 5 % от объема питательной среды. Сокультивирование выполняли на бактериальном биореакторе RTS-1C (BioSan Ltd., Латвия) при температуре 37 ± 0.1 °С. Характер взаимоотношений между бактериями в ассоциации оценивали по достижению максимальных значений оптической плотности
(OD) культурального раствора и жизнеспособности ассоциантов. OD измеряли в режиме реального времени при длине волны 850 нм и точности измерения ± 0.3 OD. Жизнеспособность бактерий оценивали по способности к росту на агаризованной питательной среде с ферментативным гидролизатом. Для этого бульонную культуру исследуемых бактерий в объеме 1 мл смешивали с 9 мл стерильного солевого раствора и выполняли серию разведений от 10-1 до 10-10. Для получения статистически значимых результатов из последних трех разведений 0.1 мл культурального раствора диспергировали в чашках Петри с агаризованной питательной средой. Посевы инкубировали при 38 °С в течение 48 часов, после чего подсчитывали количество колоний. Результаты выражали в колониеобразующих единицах в 1 мл среды (КОЕ/мл) (Луста, Фихте, 1990). Полученные данные обрабатывали статистически с использованием программ Exel 2003 и Statistica 6.0 для Windows XP.
Результаты
В результате микробиологического анализа и генотипирования из интестинальной микрофлоры радужной форели было выделено и идентифицировано 310 видов, принадлежащих к домену / Domain Bacteria, 5 филу-мам / Phylum, 12 классам / Class, 14 порядкам / Order, 27 семействам / Family и 37 родам / Genus. Выполнен сравнительный анализ интестинальной микрофлоры в зависимости от возраста форели, результаты которого представлены на гистограмме с группировкой (рис. 1). При сравнительном анализе структурных особенностей сообщества обнаружено, что с увеличением возраста происходит существенное изменение качественного и количественного состава кишечной бактериофлоры. Так, в составе интестинальной микрофлоры однолеток доминировали фир-микутные бактерии (44.7 %), а в возрастных группах 2+ и 3+ - протеобактерии. Встречаемость протеобактерий у двухлеток достигала 36.4 %, а у трехлеток возрастала до 55.8 %.
Согласно рекомендациям (McGrady-Steed et al., 1997) для оценки объективной функциональной значимости представителей ассоциативного симбиоза в эксперименте по сокультивированию были отобраны таксоны выше видового ранга (род), как более стабильные таксономические единицы (Яценко-Степанова, Немцева, 2009). Из 45 родов отобрано 11 представителей константных ( Bacillus, Bacteroides, Campylobacter,
Cetobacterium, Citrobacter, Eubacterium, Flexibacter, Fusobacterium, Micrococcus, Propionibacterium, Proteus ). Встречаемость остальных представителей (34 рода) в сообществе изменялась от 2.4 до 46.7 %, поэтому они были исключены из эксперимента по со-культивированию.
Матрица эксперимента по сокультивиро-ванию представлена в табл. 1.
В зависимости от возраста форели для отобранных таксономических единиц выявлена общая закономерность в смене последовательности доминантных, субдоминантных и минорных микросимбионтов. Для возрастной группы 1+ очередность смены таксонов состояла из последовательности Eubacterium > Bacteroides > Micrococcus > Proteus > Fusobacterium, для возрастной группы 2+ Bacillus > Propionibacterium > Bacteroides > Fusobacterium > Citrobacter, а для возрастной группы 3+ Bacillus > Proteus > Flexibacter > Campylobacter> Cetobacterium . Характерным оказалось стабильное замещение доминантов рода Eubacterium на Bacillus в составе интестинального сообщества форели возрастных групп 1+ и 2+, выпадение представителей рода Micrococcus из кишечной бактериофлоры старших возрастных групп, исключение бактероидов и фузобак-терий из кишечной бактериофлоры возрастной группы 3+ и замещение их на Flexibacter , Campylobacter и Cetobacterium . Также обнаружено полное выпадение представителей гнилостной микрофлоры рода Proteus из микрофлоры кишечника форели в возрасте 2+.
Результаты по сокультивированию ассоци-антов приведены на типовых графиках RTS-1C (рис. 2–4). Обнаружено, что ассоцианты в составе бактериофлоры кишечника форели в возрасте 1+ и 2+ обладали взаимостиму-лирующим эффектом (см. рис. 2, 3). Для них прослеживается последовательная смена фаз клеточного роста, в течение которых оптическая плотность культурального раствора вырастала от 0.4 до 1.6-2.2 OD и сохранялась на высоком уровне в течение 160 ч культивирования. Максимальная плотность микробной культуры была зарегистрирована для возрастной группы 1+ (2.2 OD), где ассоциация интестинальной микрофлоры кишечника состояла из доминантных родов Eubacterium и Bacteroides , субдоминантов Micrococcus и Proteus и минорных микросимбионтов рода Fusobacterium . В данном варианте эксперимента плотность клеток в ассоциации достигла своего максимума к 3-м суткам культивирования и далее сохра-
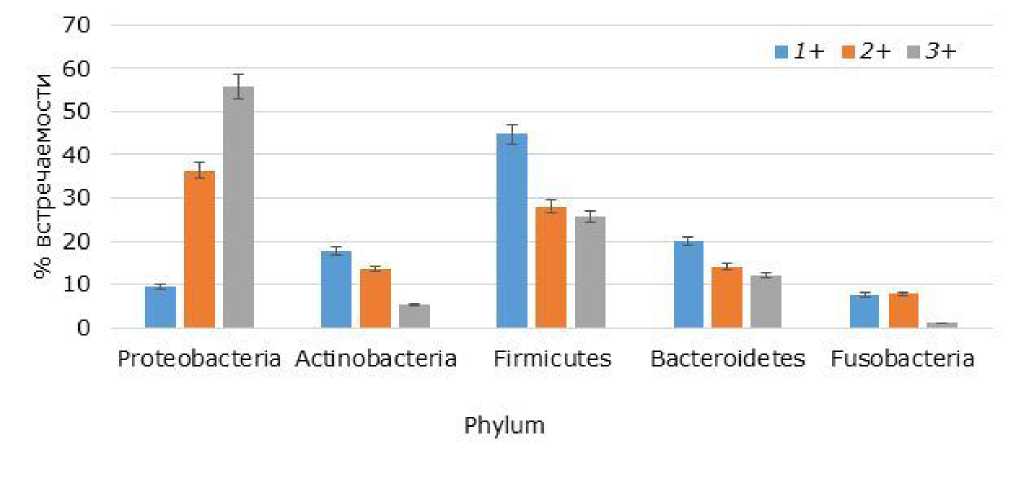
Рис. 1. Структура интестинальной микрофлоры форели исследуемых возрастных групп
Fig. 1. The structure of the intestinal microflora of trout of the studied age groups
Таблица 1. Представители ассоциативного симбиоза интестинальной микрофлоры радужной форели исследуемых возрастных групп
Возраст исследуемых групп форели
Результаты оценки жизнеспособности ассоциантов, полученные по данным со-культивирования в ферментере в зависимости от структуры ассоциативного симбиоза и возраста форели, представлены в табл. 2. Максимальное количество жизнеспособных бактериальных клеток выявлено в эксперименте по изучению жизнеспособности ассо-циантов кишечной бактериофлоры форели в возрасте 1+. Средние значения численно- сти бактероидов в ассоциации достигали 7.2 ± 1.9 х 108 КОЕ/мл, эубактерий - 6.5 ± 2.1 х 106 КОЕ/мл, а микрококков - 2.8 ± 1.1 х 104 КОЕ/мл. Количество жизнеспособных клеток протея и фузобактерий оставалось на уровне 1.4–4.6 ± 1.2 × 102 КОЕ/мл. Характерно, что по сравнению с возрастной группой форели 1+, количество жизнеспособных бактероидов в кишечнике форели в возрасте 2+ существенно снизилось до 4.9 ± 1.3 × 103 КОЕ/ мл, количество фузобактерий практически не изменилось, а наибольшее число жизнеспособных клеток пришлось на представителей родов Bacillus (5.4 ± 1.3 × 104 КОЕ/мл) и Propionibacterium (1.2 ± 1.1 × 104 КОЕ/мл). В варианте с ассоциативным симбиозом бактериофлоры кишечника форели в возрасте 3+ после субкультивирования жизнеспособность сохранили только представители трех родов из пяти. Это бациллы, протей и кам-пилобактер. Средние значения численности бацилл в ассоциации не превышали 1.5 ± 1.1 × 102КОЕ/мл, протея – 2.1 ± 1.3 × 104КОЕ/мл, а кампилобактерий – 2.4 ± 1.3 × 102 КОЕ/мл.
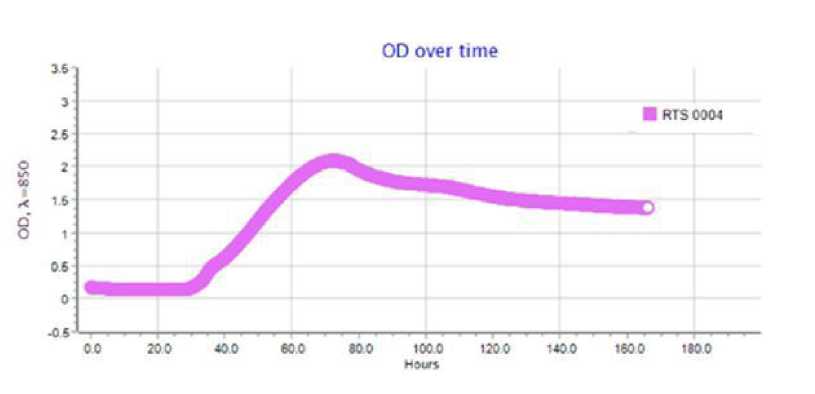
Рис. 2. Типовой график по сокультивированию бактерий в составе интестинальной бактериофлоры радужной форели в возрасте 1+
Fig. 2. A typical schedule for the co-culture of bacteria in the intestinal bacterioflora of rainbow trout aged 1+
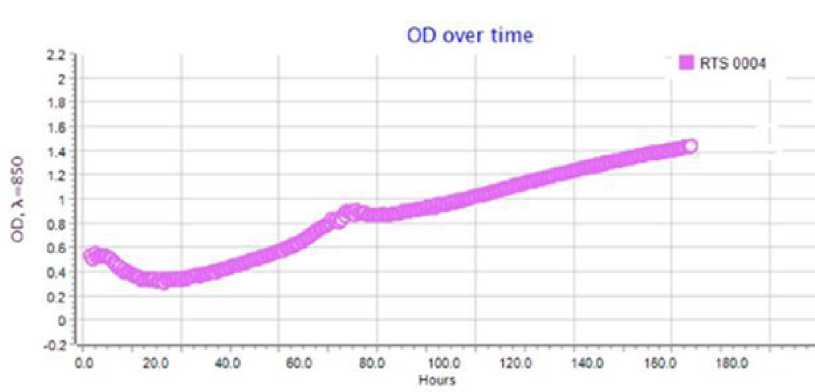
Рис. 3. Типовой график по сокультивированию бактерий в составе интестинальной бактериофлоры радужной форели в возрасте 2+
Fig. 3. A typical schedule for the co-culture of bacteria in the intestinal bacterioflora of rainbow trout aged 2+
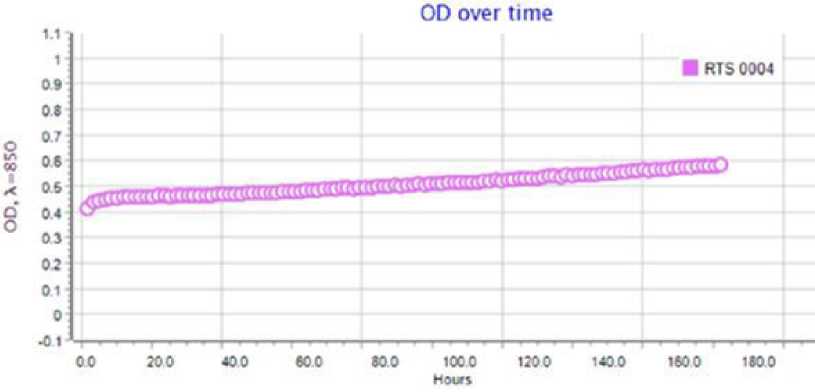
Рис. 4. Типовой график по сокультивированию бактерий в составе интестинальной бактериофлоры радужной форели в возрасте 3+
Fig. 4. A typical schedule for the co-culture of bacteria in the intestinal bacterioflora of rainbow trout aged 3+
Таблица 2. Жизнеспособность бактерий в составе интестинальной бактериофлоры радужной форели
|
Структура ассоциативного симбиоза |
||
|
Количество жизнеспособных клеток (КОЕ/мл), возраст форел |
и 1+ |
|
|
Eubacterium |
Bacteroides Micrococcus Proteus |
Fusobacterium |
|
6.5 ± 2.1×106 |
7.2 ± 1.9 х 108 2.8 ± 1.1 х 10 4 1.4 ± 1.2 х 102 |
4.6 ± 1.2 × 102 |
|
Количество жизнеспособных клеток (КОЕ/мл), возраст форели 2+ |
||
|
Bacillus |
Propionibacterium Bacteroides Fusobacterium |
Citrobacter |
|
5.4 ± 1.3×104 |
1.2 ± 1.1 × 104 4.9 ± 1.3 × 103 6.8 ± 1.6 × 102 |
2.1 ± 1.1 × 102 |
|
Количество жизнеспособных клеток (КОЕ/мл), возраст форели 3+ |
||
|
Bacillus |
Proteus Flexibacter Campylobacter |
Cetobacterium |
|
1.5 ± 1.1×102 |
2.1 ± 1.3 х 104 0 2.4 ± 1.3 х 102 |
0 |
Список литературы Особенности ассоциативного симбиоза на примере интестинальной бактериофлоры радужной форели (Parasalmo mykiss walbaum)
- Баканов А. И. Количественная оценка доминирования в экологических сообществах // Количественные методы экологии и гидробиологии. Тольятти: СамНЦ, 2005. С. 37–67.
- Бухарин О. В., Лобакова Е. С., Немцева Н. В., Черкасов С. В. Ассоциативный симбиоз . Екатеринбург: УрО РАН, 2007. 264 с.
- Лобакова Е. С. Ассоциативная симбиология на примере растительных симбиозов // Вестник Московского университета. Сер. 16. Биология. 2006. № 4. С. 9–16.
- Луста К. А., Фихте Б. А. Методы определения жизнеспособности микроорганизмов . Пущино: ОНТИ НЦБИ, 1990. 186 с.
- Методические указания по лабораторной диагностике псевдомонозов рыб . М.: Министерство сельского хозяйства и продовольствия РФ, 1998. 16 с.
- Методы общей бактериологии / Под. ред. Ф. Герхарда. Т. 1. М.: Мир, 1983. 340 с.
- Немцева Н. В. Симбиотические взаимодействия гидробионтов и их использование для оценки экологического состояния водоемов в системе мониторинга // Вестник Оренбургского государственного университета. 2015. № 10 (185). С. 229–231.
- Проворов Н. А. Генетико-эволюционные основы учения о симбиозе // Журнал общей биологии. 2001. Т. 62. С. 472–495.
- Руководство по ветеринарно-санитарному контролю племенных рыбоводных хозяйств . М.: Изд-во ФГБНУ «Росинформагротех», 2018. 52 с.
- Чёрная Л. В. Особенности желудочного пищеварения у жвачных животных // Научное обозрение. Биологические науки. 2017. № 2. С. 153–156.
- Яценко-Степанова Т. Н., Немцева Н. В. Структурная организация фитопланктонного сообщества водоемов с позиций концепции ассоциативного симбиоза // Вестник ОГУ. 2009. № 12 (106). С. 71–76.
- Austin B. The Bacterial Microflora of Fish // Sci. World J. 2002. № 2. Р. 558–572.
- Bergeyʼs Manual of Systematic Bacteriology. New York: Springer Science & Business Media, 2001. 1388 р.
- Bordenstein S. R., Theis K. R. Host Biology in Light of the Microbiome: Ten Principles of Holobionts and Hologenomes // PLoS Biol. 2015. № 13 (8). Р. 202–226.
- Izvekova G. I., Izvekov E. I., Plotnikov A. O. Symbiotic Microflora in Fishes of Different Ecological Groups // Biology Bulletin. 2007. Vol. 34, № 6. Р. 610–618.
- Hansen G. H., Olafsen J. A. Bacterial Interactions in Early Life Stages of Marine Cold Water Fish // Microbiol. Ecol. 1999. Vol. 38. P. 1–26.
- Helfman G. S., Collette B. B., Facey D. E., Bowen B. W. The diversity of fishes. Second Edition. Malaysia: Vivar Printing, 2009. Р. 217–284.
- Jankauskiene R. Defence Mechanisms in Fish: Lactobacillus Genus Bacteria of Intestinal Wall in Feeding and Hibernating Carps // Ekologija (Vilnius). 2000. № 1. Р. 3–6.
- McGrady-Steed J., Harris P. M., Morin P. J. Biodiversity regulates ecosystem predictability // Nature. 1997. Vol. 390. Р. 162–165.
- Minich J. J., Petrus S., Michael J. D., Michael T. P., Knight R., Allen E. E. Temporal, Environmental, and Biological Drivers of the Mucosal Microbiome in a Wild Marine Fish // Scomber japonicus. mSphere. 2020а. № 5 (3). Р. 123–134.
- Minich J. J., Poore G. D., Jantawongsri K., Johnston C., Bowie K., Bowman J., et al. Microbial Ecology of Atlantic Salmon (Salmo salar) Hatcheries: Impacts of the Built Environment on Fish Mucosal Microbiota // Appl. Environ. Microbiol. 2020б. № 86 (12). Р. 207–211.
- Riiser E. S., Haverkamp T. H. A., Varadharajan S., Borgan O., Jakobsen K. S., Jentoft S., et al. Metagenomic Shotgun Analyses Reveal Complex Patterns of Intra- and Interspecific Variation in the Intestinal Microbiomes of Codfishes // Appl. Environ. Microbiol. 2020. № 86 (6). Р. 106–113.
- Ringo E., Birkbeck T. H. Intestinal microflora of fish andfry: A review // Aquac Res. 1999. № 30 (2). Р. 73–93.
- Ringø E., Olsen R.E., Mayhew T. M., Myklebust R. Electron Microscopy of the Intestinal Microflora of Fish // Aquaculture. 2003. Vol. 227. P. 395–415.
- Sanger F., Nidclen S., Coulson A. R. DNA sequencing with chain-remmanng inhibitors // Proc. Natl. Acad. Sc. USA. 1977. № 84. Р. 5463–5467.
- Sugita H., Shen K. Z., North R. A. 5-Hydroxytryptamine is a fast excitatory transmitter at 5-HT, receptors in rat amygdala // Fish. Sci. 1992. № 8. Р. 199–203.
- Sugita H., Shibuya K., Hanada H., Deguchi Y. Anti-bacterial Abilities of Intestinal Microflora of River Fish // Fish. Sci. 1997. Vol. 63, № 3. Р. 378–383.
- Woodhams D. C., Bletz M. C., Becker C. G., Bender H. A., Buitrago-Rosas D., Diebboll H., et al. Host-associated microbiomes are predicted by immune system complexity and climate // Genome Biol. 2020. № 21 (1). Р. 23.


