Особенности COVID-19-ассоциированной коагулопатии в реальной клинической практике
Автор: Малинова Л.И., Красникова В.В., Кривец А.С., Раджабов Х.М., Фурман Н.В., Решетников А.А., Долотовская П.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Кардиология
Статья в выпуске: 3 т.17, 2021 года.
Бесплатный доступ
Цель: сравнительный анализ состояния системы гемостаза у больных коронавирусной инфекцией (COVID-19), госпитализированных в отделение реанимации (ОР). Материал и методы. Проведен ретроспективный анализ медицинской документации больных COVID-19 (n=105) в ОР «ковидного госпиталя»: результаты общего анализа крови и скрининговых глобальных коагулологических тестов, рутинно проводимых при госпитализации в стационар (активированное парциальное тромбоплатиновое время (АПТВ), протромбиновый индекс, международное номализованное отношение, уровень фибриногена). Результаты. У пациентов с COVID-19 умеренной и тяжелой степени тяжести выявлены половые различия, касающиеся уровня гемоглобина (значимо более низкий у женщин) и частоты тромбоцитопении (чаще у мужчин, p=0,032). Отмечены умеренной силы отрицательные связи между продолжительностью госпитализации и количеством лейкоцитов (R=-0,410; p=0,037), количеством тромбоцитов (R=-0,402; p=0,046) при поступлении в ОР. У пациентов со среднетяжелым и тяжелым течением COVID-19 выявлено повышение уровня фибриногена при нормальном или умеренно сниженном количестве тромбоцитов и умеренное повышение протромбинового времени и АПТВ. Заключение. Выделены основные параметры COVID-19-ассоциированной коагулопатии в реальной клинической практике: повышение уровня фибриногена при нормальном или умеренно сниженном количестве тромбоцитов, умеренное повышение протромбинового времени и АПТВ. Коагулопатия, ассоциированная с COVID-19, имеет половые различия, что отчасти определяет специфику клинического течения заболевания у мужчин и женщин.
COVID-19, коагулопатия, реальная клиническая практика.
Короткий адрес: https://sciup.org/149138151
IDR: 149138151 | УДК: 616-005.6+616.24-005.6
Текст научной статьи Особенности COVID-19-ассоциированной коагулопатии в реальной клинической практике
1 Введение. Пандемия COVID-19, объявленная ВОЗ 11 марта 2020 г., существенно изменила жизнь всего населения земного шара. За последние 20 лет зарегистрированы две крупные вспышки коронавирусной инфекции: тяжелый острый респираторный коронавирус (SARS-CoV или SARS) в 2003 г. и ближневосточный респираторный синдром (MERS) в 2012 г. По сравнению с перечисленными инфекциями COVID-19 характеризуется более высокой частотой тромботических событий, чем можно было бы ожидать у инфекционных больных или пациентов в критическом состоянии [1].
SARS-CoV-2 представляет собой одноцепочечный РНК-вирус, который характеризуется булавовидными белками (S), выступающими из поверхности вириона, что придает ему вид короны на электронных микроскопических изображениях. Первый этап инфекционного процесса включает связывание субъединицы S1 с рецептором клетки-хозяина, которым является ангиотензинпревращающий фермент 2 (АПФ-2). К настоящему времени известно, что протеазы могут расщеплять субъединицы S-белка, и фактор Ха вносит существенный вклад в этот процесс [2].
Лимфопения является достаточно частой находкой у пациентов с COVID-19 [3-5]. Снижение количества CD4+ и CD8+ Т-лимфоцитов, вероятно, обусловлено усилением апоптоза Т-клеток в результате цитокинового шторма, а также прямым цитопа-тическим эффектом [6]. Снижение количества CD4+ Т-лимфоцитов может интенсифицировать воспалительный ответ, что, в свою очередь, ухудшает адаптивный иммунный ответ из-за неадекватной помощи Т-клеток вирусоспецифическим цитотоксическим CD8+ Т-лимфоцитам. Таким образом, формируется
гипервоспалительное состояние, которое, наряду с повреждением альвеолярной ткани, инициирует тромботический процесс. В литературе эта взаимосвязь получила название иммунотромбоза или тром-бовоспаления.
К настоящему времени предполагается, что активация свертывания крови при COVID-19 инициируется высвобождением тканевого фактора из поврежденных цитокинами альвеолярных эндотелиальных клеток [7]. С другой стороны, активируется процесс, ассоциированный с нейтрофильными внеклеточными ловушками (NET). NET накапливают различные биоактивные молекулы, которые имеют способность стимулировать активацию фактора XII. NET также содержат протеазы, которые способны инактивировать эндогенные антикоагулянты и, следовательно, усугублять прокоагулянтное состояние. Подобная активация каскада свертывания крови неминуемо приводит к значительному образованию тромбина и распространенному тромбозу. Однако многие клинические находки при ведении больных с COVID-19 остаются не расшифрованными. Так, выявленные многими авторами половые различия заболеваемости и смертности при COVID-19 до настоящего времени остаются не вполне изученными [8].
Выяснение особенностей и патогенетических механизмов развития коагулопатии при COVID-19, определение оптимальных методов ее лечения и профилактики является актуальной проблемой, стоящей в настоящее время перед врачами практически всех медицинских специальностей.
Цель: провести сравнительный анализ состояния системы гемостаза у больных коронавирусной инфекцией (COVID-19), госпитализированных в отделение реанимации (ОР).
Материал и методы. Проведен анализ медицинской документации (медицинская карта стационарного больного, форма 003/у) 105 больных верифицированным COVID-19, госпитализированных в отделение реанимации и интенсивной терапии (ОРИТ) «ковидного госпиталя», развернутого на базе городской клинической больницы, выписанных с выздоровлением или улучшением (март – июнь 2020 г.).
Для выявления наиболее характерных сдвигов в состоянии системы гемостаза в исследование включались пациенты со среднетяжелым и тяжелым течением COVID-19. Спектр клинико-лабораторных тестов определялся возможностями лечебного учреждения и включал результаты расширенного анализа крови, скорость оседания эритроцитов, скрининговые глобальные коагулологические тесты: активированное парциальное тромбоплатиновое время (АПТВ/АЧТВ), протромбиновый индекс (ПТИ), международное нормализованное отношение (МНО) и уровень фибриногена. Оценка способов лечения/ профилактики тромботических осложнений осуществлялась с использованием частотного анализа. Исследование опиралось на данные пациентов, выписавшихся с улучшением. Для интегральной характеристики клинического течения заболевания применяли длительность госпитализации (в днях).
Для статистического анализа использовали пакет IBM SPSS Statistics, v. 23. Непрерывные количественные переменные описаны как медиана и интерквартильный размах (Me [LQ; UQ]). Для проверки статистических гипотез использовали критерии Манна – Уитни, Краскела – Уоллиса ANOVA и χ2 Пирсона. Альтернативная гипотеза принималась при уровне p<0,05. Все тесты были двусторонними. Оценка корреляционных связей проводилась с использованием теста Спирмена и Кендалла.
Результаты. В подавляющем большинстве включенные в исследование пациенты были зрелого и пожилого возраста: 63 (58; 72) лет. В сформированной выборке женщины встречались чаще. Как правило, в сформированной выборке фиксировалась двусторонняя полисегментарная пневмония. В свете известных эпидемиологических особенностей неудивительна высокая частота коморбидных заболеваний, из которых на первом месте была артериальная гипертензия: 75,8% (табл. 1).
Среди лиц, включенных в исследование, отмечалось практически равное соотношение пациентов
Таблица 1
Исходные параметры пациентов с COVID-19, вовлеченных в исследование, %
|
Параметр |
Значение |
% |
|
Мужской |
36,4 |
|
|
Пол |
Женский |
63,6 |
Поражение легких
|
Односторонняя пневмония |
24,2 |
|
|
Объем поражения легких |
Двусторонняя пневмония |
75,8 |
|
Долевая пневмония |
18,2 |
|
|
Полисегментарная пневмония |
81,8 |
Коморбидности
|
Нет |
36,4 |
|
|
ИБС |
Перенесенный в течение предыдущего года ИМ |
6,1 |
|
Хронический коронарный синдром (другие, кроме перенесенного ИМ, варианты) |
57,6 |
|
|
Артериальная гипертензия |
Нормотоник |
24,2 |
|
Артериальная гипертензия |
75,8 |
|
|
Сахарный диабет |
Нет нарушений углеводного обмена |
75,8 |
|
Сахарный диабет |
24,2 |
|
|
Варикоз / ТГВ |
Нет признаков / не переносил (-ла) |
93,9 |
|
Варикоз / ТГВ |
6,1 |
Интегральная клиническая характеристика
|
Тяжесть состояния |
Средняя степень тяжести |
57,6 |
|
при поступлении |
Тяжелое состояние |
42,4 |
|
Проводимая антитромботическая терапия |
||
|
Не назначались |
18,2 |
|
|
Антикоагулянты |
НФГ |
6,1 |
|
Эноксапарин натрия |
75,8 |
|
|
Антиагреганты |
Не назначались АСК |
81,8 18,2 |
П р и м еч а н и е : ИБС – ишемическая болезнь сердца; ТГВ – тромбоз глубоких вен; НФГ – нефракционированный гепарин; АСК – ацетилсалициловая кислота.
Таблица 2
Скрининговые параметры системы гемостаза, оцениваемые в отделении интенсивной терапии у пациентов с COVID-19 среднетяжелого и тяжелого течения
|
Параметр |
Медиана |
Нижний квартиль |
Верхний квартиль |
|
Эритроциты, *1012/л |
4,38 |
4,03 |
4,70 |
|
Гемоглобин, г/л |
132,0 |
123,0 |
142,0 |
|
Лейкоциты, *106/л |
6,60 |
5,37 |
8,40 |
|
Тромбоциты, *109/л |
164,0 |
130,0 |
239,0 |
|
СОЭ, мм/ч |
29,0 |
17,0 |
38,0 |
|
Фибриноген, г/л |
3,30 |
2,40 |
4,00 |
|
ПТИ, % |
88,6 |
80,7 |
95,7 |
|
МНО, ед. |
1,14 |
1,04 |
1,29 |
|
АПТВ, сек |
30,0 |
24,9 |
34,3 |
П р и м еч а н и е : СОЭ – скорость оседания эритроцитов; ПТИ – протромбиновый индекс; МНО – международное нормализованное отношение; АПТВ – активированное парциальное тромбоплатиновое время.
средней степени тяжести и находящихся в тяжелом состоянии при поступлении (табл. 2), при этом в среднем длительность госпитализации составила около четырех недель: 26 (20; 28) дней. В составе медикаментозной терапии у подавляющего большинства использовали низкомолекулярный гепарин (НМГ) – эноксапарин натрия (75,8%). Обратила на себя внимание низкая (у 50%) частота использования антиагрегантов у больных, в течение года до настоящей госпитализации перенесших инфаркт миокарда (ИМ), во всех случаях использовали препараты ацетилсалициловой кислоты.
В целом в сформированной выборке определяемые в реальной клинической практике скрининговые параметры, позволяющие так или иначе характеризовать состояние системы гемостаза, не привлекали особого внимания, за исключением показателя СОЭ (логично высокий уровень в целом по выборке) и тенденции к «мягкой», небольшой тромбоцитопении.
Однако при сопоставлении параметров гемограммы у женщин и мужчин больных COVID-19 в зависимости от исходной тяжести состояния выявлены гендерные различия (рис. 1). У женщин отмечалась тенденция к снижению уровня гемоглобина, дости-
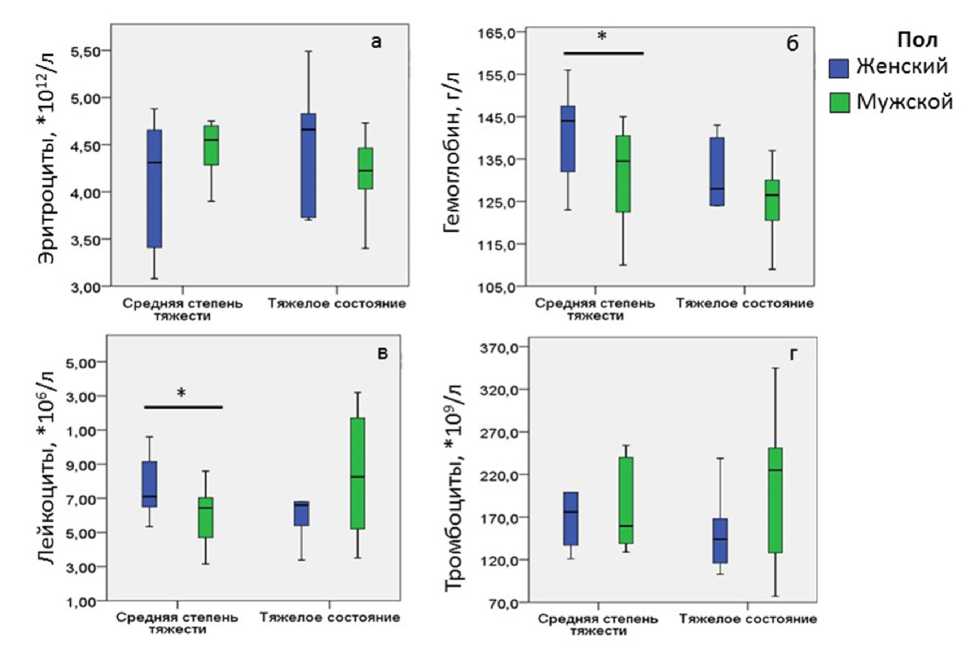
Рис. 1. Сопоставление параметров гемограммы у женщин и мужчин с COVID-19 в зависимости от исходной тяжести состояния:
а – уровень эритроцитов; б – уровень гемоглобина; в – уровень лейкоцитов; г – уровень тромбоцитов; * – p<0,05
гающая степени статистической значимости среди пациентов средней степени тяжести. Если для мужчин оказалось характерным снижение уровня лейкоцитов с нарастанием степени тяжести, то у женщин такая тенденция отсутствовала. В целом независимо от исходного состояния у пациентов мужского пола достоверно чаще (p=0,032) встречалась тромбоцитопения (с уровнем тромбоцитов менее 150*109/л), особенно у больных с исходно тяжелым состоянием. В то же время у женщин отмечался более широкий «разброс» значений, что при проверке статистической гипотезы об уровне тромбоцитов не позволило выявить статистически достоверных различий.
Любопытным оказалось сопоставление скрининговых параметров состояния системы гемостаза и СОЭ у женщин и мужчин с COVID-19 в зависимости от исходной тяжести состояния. Для женщин было свойственно более значимое повышение СОЭ при исходно тяжелом состоянии. Однако если посмотреть на уровень фибриногена, то оказывается, что именно женщины в тяжелом состоянии характеризуются минимальными значениями фибриногена. Таким образом, возникает вопрос о значении диспропорции грубо- и мелкодисперсных белков в ускорении оседания эритроцитов у пациентов с COVID-19. Отметим, что в этой же группе (женщины с тяжелым течением COVID-19) уровень гемоглобина также был минимальным, т.е. можно исключить влияние «тяжелых эритроцитов». Интерес вызвали также различия по уровню АПТВ у мужчин и женщин в зависимости от исходной степени тяжести: именно для мужчин в отличие от женщин было характерно нарастание АПТВ с утяжелением состояния (от среднетяжелого к тяжелому), в то время как никаких существенных различий по ПТИ выявить не удалось.
Как уже отмечалось, для исследования использовались данные пациентов, выписавшихся с улучшением, поэтому единственным прогностическим маркером в дальнейшем стала продолжительность госпитализации, которая, в свою очередь, определялась соотношением скорости процессов рекон-валесценции и тяжести патологических изменений, обусловленных инфекционным процессом. Установлены умеренной силы отрицательные корреляционные связи между параметрами «продолжительность госпитализации» и «количество лейкоцитов» (R=-0,410; p=0,037); «продолжительность госпитализации» и «количество тромбоцитов» (R=-0,402; p=0,046).
Выявить влияние используемой дозы антикоагулянта или вида антитромботической терапии на длительность госпитализации в данном исследовании не удалось.
Обсуждение. Основной находкой проведенного исследования, по-видимому, следует считать половые различия изученных маркеров коагулопатии в сформированной выборке пациентов с COVID-19. По состоянию на текущий момент их (маркеров коагулопатии) изучение при COVID-19 вряд ли можно считать исчерпывающим. Есть данные, что больные COVID-19, как правило, имеют повышенный уровень фибриногена, но степень повышения не зависит от
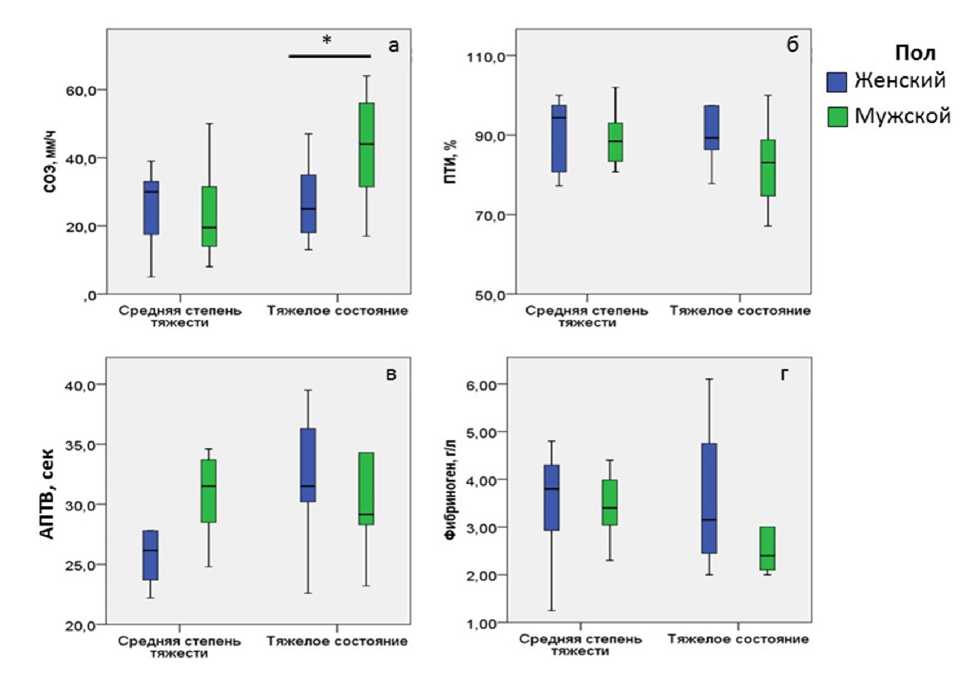
Рис. 2. Сопоставление скрининговых параметров состояния системы гемостаза и СОЭ у женщин и мужчин с COVID-19 в зависимости от исходной тяжести состояния: а – СОЭ; б – протромбиновый индекс; в – активированное частичное тромбопластиновое время; г – уровень фибриногена; * – p<0,05
тяжести заболевания [9], при этом активность антитромбина также может быть снижена у пациентов с COVID-19, но в пределах нормы (>80%). Удлинение протромбинового времени (ПВ) или АПТВ продемонстрировано в ряде исследований, но при этом стоит указать на определенные противоречия [9-11]. Так, например, получены данные, что у пациентов, умерших от COVID-19, ПВ было удлинено примерно на 2 секунды по сравнению с выжившими, что вряд ли имеет клиническое значение. Полученные нами показатели, с одной стороны, не противоречат литературным данным, а с другой — объясняют, вероятно, существующие противоречия именно за счет половых различий.
Хотя, по существующим данным, у большинства больных COVID-19 количество тромбоцитов не отклоняется от физиологической нормы, есть несколько сообщений о тромбоцитопении, как правило легкой [12, 13]. В метаанализе девяти исследований показано, что количество тромбоцитов было ниже примерно на 31*109/л в тяжелых случаях по сравнению с нетяжелыми и примерно на 48*109/л ниже у умерших по сравнению с выжившими [14].
В нашем исследовании мягкая тромбоцитопения чаще встречалась у мужчин с тяжелым течения заболевания, причем степень снижения тромбоцитов, вероятно, отражает их «рекрутирование» в легочные или системные тромбы. Возникновение и тяжесть тромбоцитопении связаны с более высокой смертностью у пациентов с COVID-19 [15, 16]. Можно предположить именно этот механизм в основе более высокой смертности у мужчин с COVID-19 [17].
Иммунная функция тромбоцитов к настоящему времени достаточно хорошо изучена. Тромбоциты привлекаются к области эндотелиального повреждения, вызванного цитокинами, где активируются. В процессе их активации из α-гранул высвобождаются фактор 4 тромбоцитов и нейтрофил-активирующий пептид 2, которые участвуют в рекрутинге и активации моноцитов и нейтрофилов. Дополнительно активированные тромбоциты служат важным источником про-воспалительного ИЛ-1β, и через P-селектин принимают участие в привлечении нейтрофилов. У пациентов с COVID-19 часто наблюдается выраженная гипоксия, особенно при тяжелом течении болезни. Гипоксия запускает экспрессию специальных факторов, которые могут потенциировать тромбообразование, непосредственно активируя белки свертывания и тромбоциты, увеличивая экспрессию тканевого фактора, подавляя эндогенные защитные функции, в частности повышение уровня ингибитора активатора плазминогена-1 (PAI-1) и ингибирование протеина S [18].
Воспалительная реакция и активация свертывания крови возникают при ряде тяжелых инфекций и не являются уникальными для COVID-19. В условиях физиологической нормы коагуляционный ответ уравновешивается «работой» фибринолитической системы. Этот естественный механизм запускается тканевым активатором плазминогена (t-PA) и активатором плазминогена урокиназного типа (u-PA). В литературе высказывается предположение, что прокоагулянтный потенциал у больных COVID-19 является результатом взаимодействия SARS-CoV-2 с АПФ-2 [19]. Связывание SARS-CoV-2 с АПФ-2 вызывает подавление активности фермента и, как следствие, увеличение количества AT II. Ангиотензин II индуцирует экспрессию PAI-1 в эндотелиальных клетках, что напрямую ингибирует действие t-PA и u-PA [20]. Таким образом, у больных COVID-19 происходит сдвиг к гипофибринолизу и тромбозу из-за избыточного AT II и последующего увеличения PAI-1.
Поскольку у всех госпитализированных больных COVID-19 должна проводиться профилактика тромботических осложнений, то расшифровка механизма тромбоцитопении представляет определенные трудности. С одной стороны, снижение количества тромбоцитов менее 100*109/л может означать переход пациента в состояние коагулопатии потребления, когда прекращение антикоагулянтной терапии может ухудшить тромботический потенциал пациента. С другой стороны, при использовании антикоагулянтов у пациентов с COVID-19 следует также учитывать вероятность гепарин-индуцированной тромбоцитопении, особенно у пациентов, получающих НФГ (в нашей выборке 6,1% пациентов получали НФГ). В то же время на фоне тяжелого инфекционного процесса с гипертермией нельзя исключить прямое угнетающее воздействие на тромбоцитопоэз, в частности угнетение тромбопоэтин-чувствительности.
В связи с изложенным особое внимание следует уделять времени и скорости снижения количества тромбоцитов. Учитывая ретроспективный характер нашего исследования, оценка динамики параметров тромбоцитов была нецелесообразна априори, однако важное значение имело время с момента манифестации заболевания до момента проведения гематологического теста. Поскольку у всех вовлеченных в исследование пациентов этот промежуток был сопоставим с временем жизни тромбоцита и поскольку коагулопатия потребления возникает довольно поздно в ходе инфекции SARS-CoV-2 и характерна для тяжелого течения заболевания, именно ее формирование представляется наиболее вероятным в случае тромбоцитопении у наших пациентов.
Судя по большинству опубликованных в последнее время исследований, существенная доля пациентов с COVID-19 имеет повышенный уровень фибриногена, что не вполне согласуется с коагулопатией потребления. Отсутствие устойчивой умеренной и тяжелой тромбоцитопении и скромные изменения по протромбиновому индексу, выявленные в сформированной выборке, также не свидетельствуют о том, что ДВС-синдром является частым осложнением у пациентов с COVID-19.
Заключение. В результате проведенного исследования выделены основные параметры COVID-19-ассоциированной коагулопатии в реальной клинической практике: повышение уровня фибриногена при нормальном или умеренно сниженном количестве тромбоцитов и умеренное повышение ПВ и АПТВ. Полученные данные позволили заключить, что формирование и течение коагулопатии при COVID-19 имеют половые различия, во многом определяют специфику клинического течения заболевания, и, по-видимому, в конечном счете его прогноз.
Существующие рекомендации по ведению пациентов с COVID-19 расходятся по ряду вопросов, таких как оптимальная профилактическая доза антикоагулянта, продолжительность профилактики и использование фибринолитиков. Результаты описываемого исследования подчеркивают необходимость различия подходов к проведению тромбопрофилак-тики у мужчин и женщин, больных COVID-19, однако вопросы оптимизации антитромботической терапии таких пациентов с учетом половых особенностей коагулопатии несомненно нуждаются в дальнейшем самом серьезном исследовании.
Список литературы Особенности COVID-19-ассоциированной коагулопатии в реальной клинической практике
- Giannis D, Ziogas IA, Gianni P. Coagulation disorders in coronavirus infected patients: COVID-19, SARS-CoV-1, MERSCoV and lessons from the past. J Clin Virol 2020; 127: 104362.
- Belen-Apak FB, Sarialioglu F. The old but new: can unfractionated heparin and low molecular weight heparins inhibit proteolytic activation and cellular internalization of SARS-CoV-2 by inhibition of host cell proteases? Med Hypotheses 2020; 142: 109743.
- Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med 2020; 180: 934-43.
- Guan W, Ni Z, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med 2020; 382: 1708-20.
- Liao D, Zhou F, Luo L, et al. Haematological characteristics and risk factors in the classification and prognosis evaluation of COVID-19: a retrospective cohort study. Lancet Haematol 2020; 7: e671-8.
- Tan L, Wang Q, Zhang D, et al. Lymphopenia predicts disease severity of COVID-19: a descriptive and predictive study. Signal Transduct Targeted Therapy 2020; 5: 1-3.
- Jackson SP, Darbousset R, Schoenwaelder SM. Thromboinflammation: challenges of therapeutically targeting coagulation and other host defense mechanisms. Blood 2019; 133: 906-18.
- Haitao T, Vermunt JV, Abeykoon J, et al. COVID-19 and Sex Differences: Mechanisms and Biomarkers. Mayo Clin Proc 2020; 95 (10): 2189-203. DOI: 10.1016/j.mayocp.2020.07.024.
- Han H, Yang L, Liu R, et al. Prominent changes in blood coagulation of patients with SARS-CoV-2 infection. Clin Chem Lab Med 2020; 58: 1116-20.
- Spiezia L, Boscolo A, Poletto F, et al. COVID-19-related severe hypercoagulability in patients admitted to intensive care unit for acute respiratory failure. Thromb Haemost 2020; 120: 998-1000.
- Panigada M, Bottino N, Tagiabue P, et al. Hypercoagulability of COVID-19 patients in intensive care unit: A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost 2020; 18: 1738-42.
- Terpos E, Ntanasis-Stathopoulos I, Elalamy I, et al. Hematological findings and complications of COVID-19. Am J Hematol 2020; 95: 834-47.
- Fan BE, Chong VCL, Chan SSW, et al. Hematologic parameters in patients with COVID-19 infection. Am J Hematol 2020; 95: E131-E134.
- Lippi G, Plebani M, Henry BM. Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: a meta-analysis. Clinica Chimica Acta 2020; 506: 145-8.
- Llitjos J-F, Leclerc M, Chochois C, et al. High incidence of venous thromboembolic events in anticoagulated severe COVID-19 patients. J Thromb Haemost 2020; 18: 1743-6.
- Yang X, Yang Q, Wang Y, et al. Thrombocytopenia and its association with mortality in patients with COVID-19. J Thromb Haemost 2020; 18: 1469-72.
- Asirvatham ES, Sarman CJ, Saravanamurthy SP, et al. Who is dying from COVID-19 and when? An Analysis of fatalities in Tamil Nadu, India. Clinical Epidemiology and Global Health 2021; 9: 275-9. Doi: 10.1016/j.cegh.2020.09.010.
- Schulman S. COVID-19, prothrombotic factors and venous thromboembolism. Semin Thromb Hemost 2020. DOI: 10.1055/s-0040-1710337.
- Kwaan HC. Coronavirus disease 2019: the role of the fibrinolytic system from transmission to organ injury and sequelae. Semin Thromb Hemost 2020; May 9. DOI: 10.1055/s- 0040-1709996.
- Vaughan DE, Lazos SA, Tong K. Angiotensin II regulates the expression of plasminogen activator inhibitor-1 in cultured endothelial cells: A potential link between the renin-angiotensin aldosterone system and thrombosis. J Clin Invest 1995; 95: 995-1001.


