Особенности гастроинтестинальных поражений при пищевой аллергии у детей дошкольного возраста
Автор: Сазанова Н.Е., Шабунина Е.И., Галова Е.А., Хохлова Н.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-1 т.24, 2009 года.
Бесплатный доступ
В статье представлена клинико-функциональная, иммунологическая, морфологическая и иммуногистохимическая характеристика поражений верхнего отдела ЖКТ у детей дошкольного возраста с атопическим дерматитом и кожно-гастроинтестинальными проявлениями пищевой аллергии (ПА). Установлены высокая частота воспалительного процесса в слизистой оболочке (СО) желудка и ДПК, сочетанный характер их поражения, преобладание диффузных форм гастрита и дуоденита, частое вовлечение в воспалительный процесс тонкой кишки с нарушением ее функционального состояния. Доказан аллергический генез воспалительного процесса в СО при гастроинтестинальных поражениях у детей с атопическим дерматитом и кожно-гастроинтестинальной формой ПА с участием преимущественно IgE-опосредуемого механизма. Об этом свидетельствовали выраженная тканевая эозинофилия по всей глубине СО с инфильтрацией эозинофилами эпителия, особенности тучноклеточной популяции, резкое нарастание в СО IgE-плазмоцитов с преобладанием их над IgG-клетками. На органном и тканевом уровнях показано, что аллергический воспалительный процесс в гастродуоденальной СО у детей с ПА протекает на фоне сниженного уровня местной иммунологической и неспецифической защиты
Пищевая аллергия, дети, гастроинтестинальные поражения, морфометрия, аллергическое воспаление, иммуногистохимия
Короткий адрес: https://sciup.org/14919137
IDR: 14919137 | УДК: 616.33-002.2:616.342-002:616-053.4
Текст научной статьи Особенности гастроинтестинальных поражений при пищевой аллергии у детей дошкольного возраста
E-mail: Galova75@mail.ru
ОСОБЕННОСТИ
ГАСТРОИНТЕСТИНАЛЬНЫХ ПОРАЖЕНИЙ ПРИ ПИЩЕВОЙ АЛЛЕРГИИ
У ДЕТЕЙ ДОШКОЛЬНОГО ВОЗРАСТА
ФГУ «НИИ детской гастроэнтерологии Росмедтехнологий», г. Нижний Новгород
Механизмы формирования этих заболеваний наименее изучены у детей младшего возраста. Имеющиеся в литературе немногочисленные исследования свидетельствуют о ранней их манифестации и хронизации, этиологической многофакторности и патогенетической неоднородности, склонности к ре-цидивированию и прогрессированию, недостаточной эффективности лечения [6, 7, 8, 9, 10].
рованием хронической органной патологии [14, 15, 16, 17].
В свете указанного целью работы явилось изучение клинико-функциональных, иммунологических и морфологических особенностей гастроинтестинальных поражений у детей дошкольного возраста с различными формами ПА.
МАТЕРИАЛ И МЕТОДЫ
Под наблюдением находилось 137 детей 3-6 лет с ПА, представленной у 104 больных атопическим дерматитом (группа АД), у 33 – кожно-гастроинтестинальной формой (группа ПА).
С учетом возможности вовлечения тощей кишки в аллергический воспалительный процесс при ПА у части больных выполнена еюноскопия с биопсией СО тощей кишки. Одновременно оценивалось функциональное состояние тонкой кишки по ее абсорбционной способности (проба с Д-ксилозой) и уровню гидролиза лактозы (стандартный лактозотеларт-ный тест), у ряда пациентов исследовалось содержание в сыворотке крови эссенциального микроэлемента цинка (метод атомно-абсорбционной спектроскопии) как показателя, снижение которого может в определенной мере отражать степень морфофункциональных нарушений в ДПК и тощей кишке, где преимущественно всасывается цинк.
Диагностика ПА включала сбор аллергологического анамнеза, анализ пищевого дневника, проведение элиминационно-провокационных проб, кожное тестирование, определение в сыворотке крови специфических IgE- и IgG-антител к пищевым белкам (ИФА), уровня общего IgE (ИФА).
Оценка иммунологического статуса проводилась по общепринятым показателям гуморального и клеточного иммунитета. Состояние местной защиты определялось по содержанию иммуноглобулинов А, М, G и SIgA в дуоденальном содержимом методом простой радиальной иммунодиффузии по Манчини и по активности лизоцима желудочного и дуоденального соков нефелометрическим методом В.Г. Доро-фейчук (1968).
Обработка цифрового материала результатов исследования проводилась с использованием пакетов компьютерных программ Statistica 6.0 for Windows ХР и «Биостат» в соответствии с общепринятыми современными методами статистического анализа. При сравнении полученных данных пользовались критерием Стъюдента. Проверка нормальности распределения проводилась методом Шапиро-Уилка. Описательная статистика признака включала среднюю арифметическую (M), стандартную ошибку средней (m).
Нулевые гипотезы отвергались при достигнутом уровне значимости соответствующего статистического критерия р<0,05, что принято в биологии и медицине.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как показали клинические исследования, у детей с атопическим дерматитом аллергический процесс на коже носил характер распространенного, преимущественно (90,4%) среднетяжелого течения, в стадии обострения или неполной ремиссии и проявлялся в виде специфических элементов и очагов эритематозно-сквамозного и лихеноидного характера, приуроченных к типичным местам локализации и сопровождавшихся зудом различной интенсивности. Формирование АД у большинства больных (72%) происходило в первой половине года. Наследственная отягощенность по аллергии имела место у 64,8% обследованных, а частота гастродуоденальной патологии у родственников в семейном анамнезе составила 21%.
По данным скарификационных кожных проб с пищевыми аллергенами, сенсибилизация к различ- ным пищевым белкам выявлена в 90% случаев: к куриному яйцу (64,2%), мясу курицы (58,9%), коровьему молоку (58,9%), рыбе (41,1%), цитрусовым (41,1%). У 71,2% больных определялись повышенные титры специфических IgE-антител, в том числе к яичному белку (58,6%), коровьему молоку (48,6%), рыбе (27,1%), пшенице (27,1%), цитрусовым (25,7%).
Диагностически значимые титры IgG-антител к пищевым белкам также выявлялись у большинства больных (85%), наиболее часто к коровьему молоку и его фракциям (77,1%) и глиадину (47,2%), реже – к сое (37,1%) и овальбумину (34,4%).
Уровень общего IgE (203±30,8 МЕ/мл) значительно превышал возрастную норму (20±3,3 МЕ/мл, Р=0,0001), при этом IgE-гипериммуно-глобулине-мия определялась у 93,2% пациентов и отличалась стойкостью в процессе динамического наблюдения.
Таким образом, результаты аллерготестов свидетельствовали о ведущей роли ПА в генезе аллергодерматоза у больных изучаемой группы и об участии в пищевых аллергических реакциях наряду с IgE-, IgG-опосредуемых механизмов.
В группе больных с кожно-гастроинтестинальной формой ПА ведущими проявлениями аллергии являлись эпизодически возникающие кожные изменения в виде ограниченных очагов эритематозносквамозного поражения, зудящих сыпей, отеков Квинке, аллергической крапивницы. Для больных этой группы было характерно наличие в анамнезе ранних симптомов аллергического поражения кожи: у 72,6% пациентов в первые месяцы жизни имели место проявления младенческой формы АД.
Наряду с этим у большинства пациентов (90%) наблюдались гастроинтестинальные проявления ПА, манифестировавшие также в основном на первом году жизни и, как правило, совпадавшие с периодами обострения кожного аллергического процесса: дис-кинетические расстройства со стороны кишечника (поносы, запоры или их чередование) – 65,5%, тошнота, рвота, метеоризм – 35%, болевой абдоминальный синдром, нередко по типу кишечных колик – 38,2%. Первые проявления ПА, как и у детей с АД, были связаны чаще всего с введением в питание коровьего молока и молочных продуктов, реже – соков, овощных и фруктовых пюре. Семейный анамнез больных данной группы характеризовался высокой частотой не только аллергических (63%), но и заболеваний гастродуоденальной системы (59,4%), а также наличием у трети пациентов наследственной отягощенности одновременно по аллергии и патологии пищеварительного тракта.
По данным кожного тестирования, пищевая сенсибилизация выявлялась в 96,2% случаев, при этом частота положительных проб с отдельными пищевыми аллергенами не отличалась от таковой у детей с АД. Диагностически значимые титры специфических IgG-антител определялись у 84% пациентов, как и при АД, наиболее часто к коровьему молоку 23
и его фракциям (79%) и глиадину (50%). Уровень общего IgE (115,5±13,47 МЕ/мл) в 4 раза превышал возрастную норму (Р=0,0001), при этом повышенные показатели имели место у 100% обследованных.
Наряду с IgE-гипериммуноглобулинемией характерными особенностями иммунного статуса у больных обеих групп являлось умеренное снижение содержания CD3-клеток (53,54±0,56% и 54,26±0,82% против 65,25±0,73% в норме, Р=0,0001 и Р=0,0001) и дисбаланс иммунорегуляторных клеток с дефицитом CD8 (15,09±0,48% и 14,58±0,68% против 25,7±0,54% в норме, Р=0,0001 и Р=0,0001) и повышенным значением ИРИ (2,97±0,11 и 3,02±0,14 при норме 1,54± 0,03, Р=0,0001 и Р=0,0001), что отражало наличие у пациентов атопической гиперчувствительности, лежащей в основе как аллергического поражения кожи, так и ассоциированного с ним воспалительного процесса в гастродуоденальной слизистой.
Изменения гуморального иммунитета у больных обеих групп также были аналогичными: умеренное снижение IgA (0,87±0,11 г/л и 0,88±0,10 г/л против 1,26±0,1 г/л у здоровых, Р=0,014 и Р=0,009), повышение IgM (1,22±0,04 г/л и 1,25±0,05 г/л против 0,87±0,08 г/л, Р=0,0001 и Р=0,0001) при нормальном среднем значении IgG (10,50±0,36 г/л и 11,15± 0,60 г/л). Увеличение концентрации IgE и IgM сопровождалось повышением ЦИК более чем у половины обследованных (163,3±8,2 мкг/мл и 186,6± 12,5 мкг/мл против 115,0±1,7 мкг/мл, Р=0,0001 и Р=0,0001).
Наряду с яркими проявлениями аллергодерматоза для детей с АД при поступлении в клинику была характерна нерезкая выраженность клинических проявлений со стороны ЖКТ: болевой синдром отсутствовал у 33% больных, а диспепсические расстройства и нарушения характера стула, преимущественно в виде запоров, отмечались лишь у трети пациентов (35,5%), нерезкая пальпаторная болезненность живота в пилородуоденальной зоне – менее чем у половины детей. Признаки хронической интоксикации выявлялись в 49% случаев, физиче-
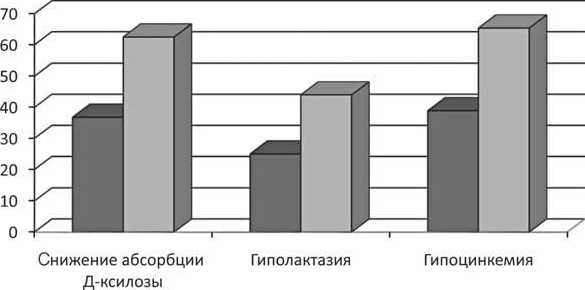
■ АД ОПА
Рис. 1. Частота нарушений функционального состояния тонкой кишки у детей с различными формами ПА (в %).
* – различия между группами статистически значимы (Р=0,029)
ское развитие у большинства детей (84,5%) не нарушалось.
Для больных с ПА была характерна более яркая, чем при АД, клиника гастроинтестинального поражения с высокой частотой и выраженностью болевого (88%) и диспепсического (67%) синдромов, нарушениями стула (70%) с одинаковой частотой разжижения и склонности к запорам, пальпаторной болезненностью в пилородуональной зоне у двух третей пациентов, изменением кислотообразования у 50% больных с преобладанием повышенной продукции.
Установлена более высокая по сравнению с АД частота нарушения функционального состояния тонкой кишки: недостаточность гидролиза лактозы у 44% пациентов, снижение всасывания Д-ксилозы, преимущественно в проксимальном отделе тонкой кишки (62,5%), дефицит цинка в сыворотке крови (65%), что косвенно могло свидетельствовать о более выраженных структурных изменениях СО ДПК и большей частоте вовлечения в воспалительный процесс тощей кишки у детей с кожно-гастроинтестинальными проявлениями ПА по сравнению с АД.
Выполненная у 27 пациентов эндоскопия тощей кишки обнаружила явления еюнита у половины детей с АД, преимущественно эритематозного, и в 95% случаев у пациентов с ПА с одинаковой частотой субатрофических и эритематозных поражений.
Аналогичный характер изменений СО выявлен при гистологии еюнобиоптатов у 27 больных. Гистологическая картина хронического еюнита имела место у всех обследованных. Преобладающей формой поражения был диффузный еюнит (71,4% и 70%), который у трети больных сочетался с субатрофией ворсинок.
Результаты морфометрического исследования биоптатов у 83 больных с АД и 31 ребенка с ПА подтвердили наличие в СО всех отделов гастродуоденальной области выраженного воспалительного процесса, о чем свидетельствовали увеличение в эпителии межэпителиальных лимфоцитов, а в собственной пластинке – повышение клеточной плотности инфильтрата и всех клеточных форм, ответственных за воспаление, особенно незрелых и зрелых плазматических клеток, макрофагов, нейтрофилов, в меньшей степени – лимфоцитов. Характерной особенностью инфильтрата было значительное увеличение эозинофильных гранулоцитов, что сочеталось с постоянным нахождением в эпителии межэпителиальных эозинофилов (МЭЭ), которые в норме не встречаются. Так, в СО ДПК содержание эозинофилов в собственной пластинке ворсинок у больных изучаемых групп составило 520±58 и 489±51 при норме 171±61 клеток на 1 мм2 (Р=0,0001 и Р=0,0001), а в межкриптальном пространстве – 444±47 и 440± 34 клеток на 1 мм2 при норме 102±57, Р=0,0001 и Р=0,0001. Одновременно обнаруживалось накопле- ние МЭЭ в ворсинках (1,89±0,17% и 2,03±0,22%, Р=0,0001 и Р=0,0001) и в криптах (1,53±0,11% и 1,32±0,12%, Р=0,0001 и Р=0,0001). Наличие выраженной тканевой эозинофилии по всей глубине СО ДПК с высоким содержанием МЭЭ отражало участие аллергического (атопического) механизма в ее поражении. Аналогичные результаты были получены при морфометрическом анализе биоптатов СО тощей кишки.
Аллергический генез поражения гастродуоденальной СО подтверждался и результатами исследования у 62 больных АД и 27 детей с ПА тучноклеточной популяции. Общее количество тучных клеток в СО ДПК у больных обеих групп более чем в 2 раза превышало показатели нормы (765±17% и 630±26% против 304±41%, Р=0,0001 и Р=0,0001), при АД это повышение было более существенным (Р=0,0001). Значительно увеличенным оказался и процент дегранулированных форм тучных клеток без статистически значимой разницы в группах (66±1,7% и 64,6±3% против 26,2±3,1%), а постоянной находкой было наличие у больных распадающихся форм клеток. По данным Т.П. Дюбковой (1992), наличие последних в СО является отражением высокой функциональной активности тучных клеток и весьма характерно для хронического гастродуоденита у детей с аллергодерматозами [20].
При иммуногистохимическом исследовании СО ДПК у 53 детей отмечено (табл. 1), что у больных обеих групп имеет место значительное повышение количества плазмоцитов, синтезирующих иммуноглобулины всех классов, что свидетельствовало об активации местной иммунной реакции гуморального типа. Наиболее существенным было увеличение IgE-плазмоцитов, которое наблюдалось у всех пациентов, а среднее содержание этих клеток превышало показатели здоровых при АД в 13 раз, а при ПА – в 10 раз.
Изменялось соотношение клеток: удельный вес плазмоцитов, продуцирующих основной защитный белок – IgA, снижался в 2 раза, несмотря на увеличе-
Таблица 1
Иммуногистохимические показатели СО ДПК у больных изучаемых групп (М ± т)
|
Показатели кл. на 1 мм2 |
Неизмененная СО ДПК (n=9) |
Дети с АД (n=42) |
Дети с ПА (n=11) |
Р 1-2 |
Р 1-3 |
р Р 2-3 |
|
1 |
2 |
3 |
||||
|
Клетки, продуцирующие IgA |
567±53 (58,1%) |
1150±51 (36,5%) |
1098±61 (39,3%) |
0,0001 0,01 |
0,0001 |
– |
|
Клетки, продуцирующие IgM |
293±31 (30,1%) |
777±38 (24,6%) |
781±96 (28,0%) |
0,0001 |
0,0001 |
– |
|
Клетки, продуцирующие IgG |
66±12 (6,8%) |
574±44 (18,2%) |
434±76 (15,5%) |
0,0001 |
0,0001 |
0,011 |
|
Клетки, продуцирующие IgE |
49±15 (5,0%) |
654±31 (20,7%) |
479±66 (17,2%) |
0,0001 |
0,0001 |
0,0001 |
Р – достигнутый уровень значимости критерия различий между группами.
ние абсолютного числа этих клеток; напротив, процентное содержание IgG-плазмоцитов, осуществляющих вторую линию защиты, повышалось в 2,5 раза, а доля IgE-клеток возрастала у больных обследуемых групп в 4 и 3,5 раза. Соотношение среднего числа IgE- и IgG-плазмоцитов было более 1, в то время как в неизмененной СО оно не превышает 0,74; данный факт свидетельствовал о преобладающем местном синтезе иммуноглобулинов класса Е над IgG-антителами.
Значительное повышение абсолютного и относительного числа IgE-плазмоцитов наряду с выраженной тканевой эозинофилией по всей глубине СО, накопление в эпителии МЭЭ, а также особенности тучноклеточной популяции подтверждали аллергический генез воспалительного процесса в гастродуоденальной зоне с участием преимущественно IgE-опосредуемого механизма.
Известно, что непременное условие вовлечения ЖКТ в патологический процесс при аллергии – снижение его барьерной функции. Ведущим фактором местного иммунитета является секреторный IgA, осуществляющий основную защиту СО от пищевых, бактериальных и иных антигенов. Доказано, что SIgA способен блокировать реакции реагинового типа на поверхности эпителия СО ЖКТ.
Проведенное нами у 46 больных изучение содержания SIgA в эпителиальных клетках СО ДПК обнаружило уменьшение его концентрации в эпителии у большинства больных (70%) без статистически значимой разницы в группах, что проявлялось уменьшением яркости специфического свечения. С учетом повышенного абсолютного числа IgA-плазмоцитов в собственной пластинке СО это снижение, очевидно, было обусловлено недостаточным синтезом SC-компонента в эпителиоцитах, что подтверждалось при исследовании SIgA в дуоденальном соке.
Концентрация SIgA в соке ДПК у больных обеих групп была статистически значимо снижена по сравнению со здоровыми (0,153±0,013 г/л и 0,121± 0,016 г/л против 0,195±0,020, Р=0,0001 и Р=0,0001), наиболее значимо в группе детей с ПА (Р=0,012), где отмечалась и большая по сравнению с АД частота сниженных показателей SIgA (88,8% против 58%, Р=0,005).
Одновременно был установлен сниженный уровень неспецифической защиты пищеварительных секретов. Так, лизоцимная активность дуоденального сока в группах больных составила 33,5±1,62% и 37,4±2,83% против 58,5±3,1% у здоровых (Р=0,0001 и Р=0,0001), а активность лизоцима желудочного сока, изученная в динамике секреторного процесса, была снижена во всех порциях сока без статистически значимой разницы в группах. Наиболее низкие показатели лизоцимной активности выявлялись в стимулированной порции желудочного секрета (45±3% и 44,8±3,52% против 72,9±1,1% у здоровых, Р=0,001 и Р=0,001).
Морфометрический анализ клеток, осуществляющих неспецифическую тканевую защиту, также выявил сниженное их содержание в СО ДПК у больных обеих групп. Так, количество клеток Панета составило соответственно 2,32±0,12 и 2,26±0,19 против 3,9±0,2 клеток на крипту в норме (Р=0,0001 и Р=0,0001). Одновременно у больных обеих групп было снижено количество бокаловидных клеток в ворсинках (8,13±0,25% и 8,29±0,49% против 10,23± 1,29% в норме, Р=0,00001 и Р=0,0256) и в криптах (13,66±0,39% и 15,03±0,87% против 18,68±2,03% в норме, Р=0,00001 и Р=0,0115).
Таким образом, проведенные исследования показали, что у детей с ПА аллергический воспалительный процесс в верхних отделах пищеварительного тракта протекает на фоне сниженного уровня местной иммунологической и неспецифической защиты, что доказано на органном и тканевом уровнях.
ВЫВОДЫ
Список литературы Особенности гастроинтестинальных поражений при пищевой аллергии у детей дошкольного возраста
- Заболеваемость органов пищеварения у детей в Ставропольском крае/И.В. Катаев [и др.]//Актуальные проблемы абдоминальной патологии у детей: материалы XIV Конгресса детских гастроэнтерологов России (Москва, 13-15 марта 2007 г.). -Москва, 2007. -С. 25-26.
- Ямолдинов Р.Н. Возрастная структура заболеваний органов пищеварения у детей/Р.Н. Ямолдинов//Актуальные проблемы абдоминальной патологии у детей: материалы XIV Конгресса детских гастроэнтерологов России (Москва, 13-15 марта 2007 г.). -Москва, 2007. -С. 43-44.
- Щербаков П.Л. Вопросы педиатрической гастроэнтерологии./П.Л. Щербаков//Русский медицинский журнал. -2003. -Т. 11, №3. -С. 107-113.
- Гончар Н.В. Взгляд на проблему хронического гастродуоденита у детей спустя 30 лет/Н.В. Гончар, М.И. Соколова//Актуальные проблемы абдоминальной патологии у детей: материалы юбилейного XV Международного конгресса детских гастроэнтерологов России и стран СНГ (Москва, 18-20 марта 2008 г.). -Москва, 2008. -С. 126-127.
- Бурлацкая А.В. Структура заболеваемости верхних отделов желудочнокишечного тракта у детей г. Краснодара по данным детского стационара//А.В. Бурлацкая, Л.В. Карпенко, Н.В. Левицкая/Актуальные проблемы абдоминальной патологии у детей: материалы XIII Конгресса детских гастроэнтерологов России (Москва, 21-23 марта 2006 г.). -Москва, 2006. -С. 104-105.
- Лаврова А.Е. Клиническое значение нарушений содержания цинка и их коррекция у детей с гастродуоденитом при пищевой аллергии: диссертация … канд. мед. наук/Лаврова Алла Евгеньевна. -Н. Новгород, 1998. -167 с.
- Наринская Н.Н. Особенности клиники и течения хронических болезней верхних отделов пищеварительного тракта при пищевой аллергии у детей: автореф. дис....канд. мед. наук: 14.00.09./Наринская Надежда Николаевна. -Москва, 2004. -24 с.
- Этиологическая характеристика основных типов хронического гастрита у детей/Г.В. Волынец [и др.]//Русский медицинский журнал. Детская гастроэнтерология и нутрициология. -2005. -Т. 13. -№18. -С. 1208-1215.
- Состояние гастродуоденальной слизистой у детей раннего и дошкольного возраста/Н.В. Авдеева [и др.]//Актуальные проблемы абдоминальной патологии у детей: материалы XIV Международного конгресса детских гастроэнтерологов России (Москва, 13-15 марта 2007 г.). -Москва, 2007 -С. 166-167.
- Сазанова Н.Е. Механизмы формирования и клинические варианты хронических заболеваний желудка и двенадцатиперстной кишки у детей дошкольного возраста: дис… докт. мед. наук: 14.00.09./Сазанова Наталья Евгеньевна. -Н. Новгород, 2002. -436 с.
- Балаболкин И.И. Атопия и аллергические заболевания у детей/И.И. Балаболкин//Педиатрия. -2003. -№6. -С. 1-6.
- Распространенность пищевой аллергии у детей Молдовы/Л.В. Василос [и др.]//Вопросы детской диетологии. -2005. -Т.3, №1: Актуальные вопросы абдоминальной патологии у детей: материалы XII Конгресса детских гастроэнтерологов России (Москва, 2005 г.). -Москва, 2005. -С. 64-65.
- Ревякина В.А. Пищевая аллергия у детей. Современные аспекты/В.А. Ревякина, Т.Э. Боровик//Российский аллергологический журнал. -2004. -№2. -С. 71-77
- Mucosal pathology of the foregut associated with food allergy and recurrent abdominal pains in children/J Kokkonen [et al.]//Acta Paediatrica. -2001. -January, Vol.90, Issue 1. -P. 16-21.
- Nowak-Wegrzyn A. Food protein-induced enterocolitis syndrome/Nowak-Wegrzyn A, Muraro A.//Curr Opin Allergy Clin Immunol. 2009. -Aug; 9(4):371-7.
- Bonй J. Allergic proctocolitis, food-induced enterocolitis: immune mechanisms, diagnosis and treatment./Bonй J [et al.]//Allergol Immunopathol (Madr). -2009 Jan-Feb. -37(1). -P. 36-42.
- Баранов А.А. Гастроинтестинальная пищевая аллергия у детей/А.А. Баранов, И.И. Балаболкин, О.А. Субботина. -М., 2002.
- Корсунский А.А. Хеликобактериоз и болезни органов пищеварения у детей/А.А. Корсунский, П.Л. Щербаков, В.А. Исаков-М.: ИД Медпрактика, 2002. -168 с.
- Ganza-Zandzou P.S. Natural Outcome of Helicobacter pylori Infection in Asymptomatic Children: A Two-year Follow-up Study/P.S. Ganza-Zandzou [et al.]//Pediatrics. -1999. -V. 104. -№2. -P. 216-221.
- Дюбкова Т.П. Состояние желудка и двенадцатиперстной кишки у детей с аллергическими заболеваниями кожи: Автореферат дис. … к.м.н./Т.П. Дюбкова. -Минск, 1992. -23 с.


