Особенности иммунореактивности ВЛКРС-инфицированных коров
Автор: Масленников Н.Н., Усольцев К.В., Шангараев Р.И., Зиннатов Ф.Ф., Якупов Т.Р.
Статья в выпуске: 2 т.258, 2024 года.
Бесплатный доступ
В статье описываются результаты исследования сывороток крови методом ИФА и ПЦР в целях изучения особенностей иммунореактивности, инфицированных вирусом лейкоза крупного рогатого скота. Результаты ПЦР подтверждают отсутствие в пробах генетического материала микобактерий, однако все пробы в ИФА на обнаружение микобактериальных антител, показали положительные результаты. Представленные результаты исследований позволяют заключить как о возможной детерминантной общности антигенов и микобактерий, так и об изменениях в иммунореактивности организма коров, инфицированных ВЛКРС.
Лейкоз, антитела, ифа, пцр, влкрс, микобактерии
Короткий адрес: https://sciup.org/142241028
IDR: 142241028 | УДК: 619:616.002.5-07.636.2 | DOI: 10.31588/2413_4201_1883_2_258_119
Текст научной статьи Особенности иммунореактивности ВЛКРС-инфицированных коров
Ассоциативное течение лейкозной инфекции с вирусными и бактериальными инфекциями, в том числе с туберкулезом крупного рогатого скота представляет серьёзную проблему при проведении диагностических мероприятий. Открытым остается вопрос и о возможности реакций на туберкулин у скота, инфицированного с ВЛКРС. Несмотря на то, что для борьбы с этими инфекциями предлагаются самые современные высокоэффективные методики и технологии, в научной литературе встречаются утверждения разнопланового характера. Если одни выявляют прямую связь между уровнем инфицированности ВЛКРС и реагированием животных на туберкулин, то другие утверждают, что крупный рогатый скот с диагнозом на лейкоз по гематологическим показателям, а также инфицированный ВЛКРС, как правило, не реагируют на туберкулин [2, 3]. Причинами таких утверждений, несомненно, являются как сложная антигенная структура микобактерий, у которых выявляется множество антигенов общих для всех групп микобактерий [4, 6], так и неоднородность, перекрестная реактивность, постоянное изменение титров и спектров антител, соотношения между свободными и связанными антителами к ВЛКРС у инфицированных животных с развитием инфекционного процесса [5].
Целью данной работы было определение влияния BLV инфекции на иммунореактивность организма и выявление перекрестно реагирующих антител в ИФА с микобактериальными антигенами.
Материал и методы исследований. Исследовали пробы сывороток крови и молока от инфицированных ВЛКРС коров на выявление противомикобактериальных антител иммуноферментным методом. Иммуноферментный анализ ставили по стандартной методике в твердофазном неконкурентном варианте. Для обнаружения противотуберкулезных антител применяли липополисахаридные антигены M. bovis , M. avium и M. sctochomogenes .
Постановку ПЦР проводили с целью обнаружения ДНК M. bovis и провирусной ДНК ВЛКРС. Детекция результатов ПЦР, осуществлялась в режиме реального времени на стадии «отжига» праймеров по оптическому каналу ROX.
Результат исследований. Всего исследовано методом ИФА 300 проб сывороток крови, полученные из разных хозяйств Республики Татарстан. Все исследуемые сыворотки крови были РИД положительными. 95,6 % (287) проб в ИФА на обнаружение противолейкозных антител показали положительные результаты. Все пробы положительные по
ИФА на лейкоз крупного рогатого скота были исследованы на обнаружение противотуберкулезных антител. В результате у 73,8 % (212) проб обнаружены специфические антитела на микобактериальные антигены, в т.ч. у 60 проб против одного, у 123 – против двух и у 29 проб против всех трех видов микобактериальных антигенов. Методом случайной выборки из всех трех групп отобрали пробы сывороток крови для дальнейшего исследования методом ПЦР на лейкоз (провирусная ДНК Bovine leukemia virus) и туберкулез (M. bovis). Всего исследовано 24 пробы.
Предварительно образцы сыворотки крови были осаждены при 13000 об/мин в течение 10 мин. Выделение ДНК проводили из осадка после центрифугирования посредством набора «ДНК-сорб В» (Интерлабсервис) согласно инструкции производителя.
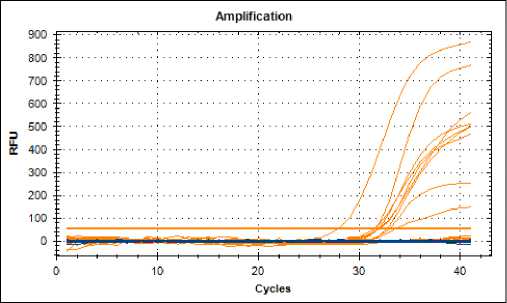
Рисунок 1 – График амплификации провирусной ДНК ВЛКРС по каналу ROX
Таблица 1 – Результаты ИФА ПЦР проб сывороток крови
|
№ п/п |
ИФА |
ПЦР на ВЛКРС |
ПЦР на микобактерии |
||
|
M. bovis |
M. avium |
M. sctoc. |
|||
|
1 |
+ |
+ |
+ |
+ |
– |
|
2 |
– |
– |
+ |
+ |
– |
|
3 |
+ |
+ |
+ |
+ |
– |
|
4 |
+ |
– |
+ |
+ |
– |
|
5 |
– |
– |
+ |
+ |
– |
|
6 |
– |
+ |
+ |
+ |
– |
|
7 |
– |
– |
+ |
+ |
– |
|
8 |
+ |
– |
+ |
+ |
– |
|
9 |
– |
+ |
– |
+ |
– |
|
10 |
– |
+ |
– |
+ |
– |
|
11 |
– |
+ |
– |
+ |
– |
|
12 |
+ |
+ |
– |
– |
– |
|
13 |
– |
– |
+ |
– |
– |
|
14 |
+ |
+ |
+ |
+ |
– |
|
15 |
+ |
+ |
– |
+ |
– |
|
16 |
+ |
+ |
+ |
+ |
– |
|
17 |
– |
+ |
+ |
+ |
– |
|
18 |
– |
+ |
+ |
+ |
– |
|
19 |
– |
– |
+ |
+ |
– |
|
20 |
+ |
– |
– |
+ |
– |
|
21 |
– |
– |
+ |
– |
– |
|
22 |
+ |
– |
– |
+ |
– |
|
23 |
+ |
+ |
+ |
+ |
– |
|
24 |
+ |
+ |
+ |
+ |
– |
Постановка ПЦР на лейкоз выполнялась по следующему протоколу. Приготовление ПЦР-смесей (1 образец)
осуществляли по представленной ниже прописи: 2 мкл 10-ти кратного ПЦР-буфера, 2 мкл 2,5 мМ раствора нуклеозидтрифосфатов, 2 мкл 25 мМ раствора магния хлорида, по 1 мкл 10 рМ прямого (5’-ggcaccgggtctcgcaagtatg-3'), обратного (5'-cggttaggctggtcatgtggcc-3')
праймеров и олигонуклеотидного зонда типа TaqMan (ROX- aaacactacgacttgcaatcttacaggccgac-RTQ2) (праймеры и зонд патент RU 2644233 C2), 1 мкл Taq-полимераза (5 ед.акт./мл), 10 мкл исследуемого образца ДНК.
Для идентификации M. bovis методом ПЦР-РВ были использованы праймеры (IS1081_Forward – ggctgctctcgacgttcatc, IS1081_Reverse -cgctgattggaccgctcat) и олигонуклеотидный зонд (IS1081_Probe – FAM- ctgaagccgacgccctgtgc-MGBNFQ), разработанные Duffy SC et al (7). Результаты исследований отображены в таблице 1 и на рисунке 1.
Результаты ПЦР подтверждают отсутствие в пробах генетического материала микобактерий, однако все пробы по ИФА на обнаружение микобактриальных антител, показали положительные результаты с коэффициентом равным двум или более при разведении 1:200.
Из 24 исследуемых образцов, представленных в таблице, в шести пробах обнаружены антитела против всех трёх микобактериальных антигенов; в семи – против M. bovis и M. sctochomogenes , в двух – против M. bovis и M. avium , в трёх - M. avium и M. sctochomogenes, в 11 образцах обнаружены антитела против отдельных антигенов – M. bovis (три пробы), M. avium (три пробы) и M. sctochomogenes (пять проб).
Три пробы (№ 12, 13, 21) в ПЦР на ВЛКРС были отрицательные.
Заключение. Представленные результаты исследований позволяют заключить как о возможной детерминантной общности антигенов и микобактерий, так и об изменениях в иммунореактивности организма коров, инфицированных ВЛКРС. Общеизвестно, например, что у инфицированных животных наступает иммунологическая толерантность – индуцированное отсутствие иммунного ответа на конкретный антиген при сохранении иммунореактивности на прочие антигены. Иванов О.В. отмечает, что инфицирование организма ВЛКРС приводит к нарушению регулирования иммунной системы хозяина как на клеточном (поражение В-лимфоцитов, части Т-лимфоцитов, моноцитов), так и на гуморальном уровне (дефицит IgM, IgA).
Безусловно, для дальнейших утверждений требуются более глубокие исследования, однако, неоспоримым является то, что при проведении диагностических мероприятий на лейкоз и туберкулез крупного рогатого скота необходимо учитывать эпизоотическую ситуацию по этим инфекциям.
Список литературы Особенности иммунореактивности ВЛКРС-инфицированных коров
- Иванов, О. В. Качество серологической диагностики - гарантия оздоровления стада от лейкоза крупного рогатого скота / О. В. Иванов, О. Ю. Иванова // Farm Animals. - 2014. - № 3. - С. 26-29. EDN: SNQPLL
- Магер, С. Н. Биологическая характеристика потомства здоровых и больных лейкозом коров, и ассоциативное развитие лейкоза и туберкулеза у животных / С. Н. Магер // Автореферат диссертации на соискание д.б.н., Новосибирск, 2006. EDN: NNZFWB
- Сорокина, А. И. Изучение влияния инфицированности вирусом лейкоза и гельминтозов на проявление аллергических туберкулиновых реакций у крупного рогатого скота / А. И. Сорокина // Автореферат диссертации на соискание кандидата ветеринарных наук, Благовещенск, 2000. EDN: QDDALL
- Якупов, Т. Р. Молекулярногенетические и иммунохимические методы в диагностике, индикации и идентификации возбудителей туберкулеза и лейкоза крупного рогатого скота / Т. Р. Якупов // Автореферат дисс. д.вет.н. -Казань, 2011. - 49 с. EDN: QFMBJV
- Якупов, Т. Р. Новые подходы в диагностике лейкоза крупного рогатого скота / Т. Р. Якупов // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. - 2010. - Т. 204. - С. 342-347. EDN: NUPSRB
- Alok C. Characterization of the Antigenic Heterogeneity of Lipoarabinomannan, the Major Surface Glycolipid of Mycobacterium tuberculosis and Complexity of Antibody Specificities toward This Antigen / C. Alok, P. Deendayal.
- Duffy, S. C. Development of a Multiplex Real-Time PCR Assay for Mycobacterium bovis BCG and Validation in a Clinical Laboratory.MicrobiolSpectr / S. C. Duffy, M. Venkatesan, S. Chothe [et all.] // Spectrum.01098-21. Epub. - 2021. Sep 8.


