Особенности клинического течения, диагностики и лечения гастроинтестинальных стромальных опухолей
Автор: Иванов Юрий Викторович
Журнал: Клиническая практика @clinpractice
Рубрика: Мнение эксперта
Статья в выпуске: 1 (9), 2012 года.
Бесплатный доступ
В работе кратко изложены современные сведения об этиологии, особенностях клинической картины, диагностики и лечения гастроинтестинальных стромальных опухолей. Указаны основные факторы, определяющие прогноз течения заболевания. Особое внимание уделено иммуногистохимическому методу диагностики и новой молекулярно-направленной терапии при данном виде опухолей. Приведено клиническое наблюдение успешной операции у больной с гигантской гастроинтестинальной стромальной опухолью желудка, прорастающей в соседние органы и ткани.
Гастроинтестинальная стромальная опухоль, операция, иматиниб, сунитиниб
Короткий адрес: https://sciup.org/14338419
IDR: 14338419
Текст научной статьи Особенности клинического течения, диагностики и лечения гастроинтестинальных стромальных опухолей
Принципы диагностики GIST, лечения и оценки его эффективности активно обсуждаются на протяжении последних лет [1, 4, 5]. В 2005 г. были впервые опубликованы рекомендации международного консенсуса, принятого ведущими специалистами Европы, Японии, Австралии. Согласно этим рекомендациям, диагноз GIST должен быть установлен морфологически до начала лечения (хирургического или лекарственного).
Установление диагноза GIST при анализе биопсийного материала затрудняет тот факт, что опухоль может иметь различную гистологическую картину в пределах одного образца и меняться на фоне терапии [6].
Гистологически выделяют следующие типы GIST ЖКТ [3, 6]: веретеноклеточный тип (70%) – с палисадообразными структурами, мономорфными ядрами округлой или сигарообразной формы; эпителиоидный тип (20%) – при наличии клеток округлой или полигональной формы со светлой цитоплазмой и светлыми ядрами; илеоморфный тип (10%) – с выраженным полиморфизмом, высокой митотической активностью. Реже встречаются: перстневидно-клеточный, мезотелиомоподобный и онкоцитарный типы.
Дифференциальный диагноз GIST необходимо проводить с истинной лейомиосаркомой, лейомиомой, шваномой, злокачественной меланомой и фиброматозом [2, 3, 7]. Иммуногистохимическое исследование позволяет подтвердить диагноз GIST путем исключения других опухолей ЖКТ. Примерно 95% GIST имеют положительную реакцию с антителами к экстрацеллюлярному эпитопу KIT – CD ("Cluster of Differentiation") 117 [3].
Небольшие образования чаще всего не дают клинических симптомов и обычно являются случайными находками при проведении эндоскопических исследований или лапаротомии.
Нередко GIST диагностируется в ходе экстренных операций, связанных с перфорацией органа или кровотечением. Бессимптомное течение GIST отмечается в 20% случаев. В 2050% наблюдаются боли в животе без четкой локализации. Развитие острых кровотечений из различных отделов ЖКТ диагностируют в 50%, а непроходимость – в 10-30% случаев. Среди других симптомов наиболее часто встречаются: увеличение живота в объеме, анемия, слабость, потеря массы тела, тошнота, рвота, пальпируемые опухолевые массы. Но перечисленные признаки не являются строго патогномоничными и могут быть присущи опухолям ЖКТ любого гистогенеза [5, 6].
Рациональный диагностический алгоритм при подозрении на GIST включает: ультразвуковое исследование (УЗИ), в том числе эндосо-нографию; компьютерную томографию (КТ) с контрастированием для определения стадии опухолевого процесса и планирования объема хирургического лечения; магнитно-резонансную томографию (МРТ) при подозрении на GIST, особенно локализованных в прямой киш- ке; эндоскопическую диагностику (ФГДС, ФКС); рентгенологическое исследование ЖКТ; позитронно-эмиссионную томографию (ПЭТ) для оценки эффекта терапии, для выявления метастазов в кости, плевру, легкие, мягкие ткани, лимфатические узлы и при подозрении на рецидив [1].
Ведущим методом лечения GIST, позволяющим надеяться на полное выздоровление, является хирургический. Стандарт операции – радикальное удаление опухолевых очагов единым блоком с морфологически негативными краями резекции (R0). По мнению большинства авторов [1, 5], попытка радикального хирургического лечения или циторедуктивной операции показана даже при местно-распространенном процессе, с вовлечением соседних органов и тканей.
В качестве примера, демонстрирующего возможность успешного хирургического лечения гигантских гастроинтестинальных стромальных опухолей с инвазией в соседние органы, можно привести следующее собственное клиническое наблюдение.
Больная Е., 64 лет, поступила в отделение хирургии 30.04.2011 г. c жалобами на постоянное чувство тяжести в животе, периодические боли в левом подреберье, тошноту, общую слабость, похудание на 18 кг за последние 3 месяца.
В анамнезе: варикозная болезнь нижних конечностей, хроническая венозная недостаточность II ст., желчно-каменная болезнь, хронический калькулезный холецистит. Аллергоанамнез не отягащен.
Объективный статус при поступлении. Состояние удовлетворительное. Рост 168 см, вес – 53 кг. Кожные покровы бледные. Лимфатические узлы, доступные пальпации, не увеличены. Дыхание везикулярное, ослаблено в нижних отделах слева, хрипов нет. ЧД – 18/мин. Гемодинамика стабильная, ЧСС – 76/мин, АД – 130/80 мм рт.ст. Язык влажный. Живот увеличен в объеме, ассиметричен за счет объемного образования, расположенного в эпигастрии и левом подреберье, мягкий, без перитонеальных явлений. Объемное образование плотной консистенции, безболезненное и не смещаемое при пальпации. Перистальтика выслушивается, признаков асцита нет. Физиологические отправления не нарушены.
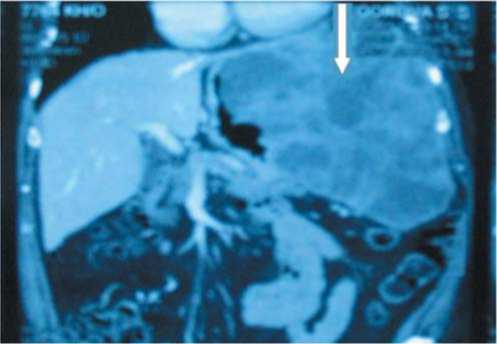
Рис. 1. КТ-брюшной полости с контрастированием. GIST занимает все левое поддиафрагмальное и подреберное пространство (отмечено стрелкой), деформируя и смещая соседние органы и ткани.
Ангиографическое исследование по висцеральной программе от 16.05.2011 г. Заключение: левосторонний нефроптоз, биартериаль-ное кровоснабжение левой почки, дополнительная артериальная сеть из 11 межреберной артерии и левой нижней диафрагмальной артерии в проекции левого плеврального синуса с венозным сбросом в легочную вену. Чревный
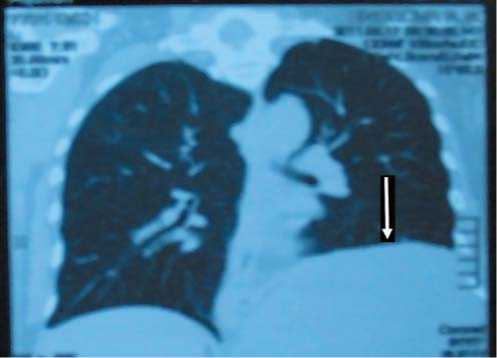
Рис.. 2. КТ-органов грудной клетки. Высокое расположение и деформация левого купола диафрагмы (отмечено стрелкой).
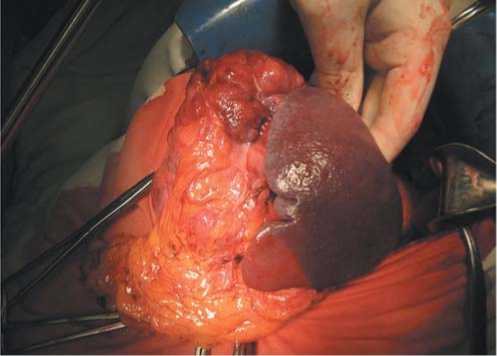
Рис. 3. Операционное поле. Этап мобилизации верхнего полюса опухоли с селезенкой и хвостом поджелудочной железы.
ствол проходим, отхождение висцеральных ветвей типичное.
Несмотря на высокий риск оперативного вмешательства, учитывая гигантские размеры опухоли, компрессию соседних органов брюшной полости, болевой синдром, истощение, на консилиуме с участием онкологов от 21.05.2011 г. решено попытаться выполнить циторедуктивную операцию – удаление по возможности всего новообразования с последующим проведением курсов химиотерапии препаратом гли-век в дозе 400 мг/сут.
С целью коррекции анемии перед операцией были перелиты 2 дозы эритроцитарной массы, уровень гемоглобина вырос до 112 г/л. К операции заготовлена донорская эритроцитарная масса и плазма крови, подготовлен аппарат для интраоперационной реинфузии крови (Cell Saver).
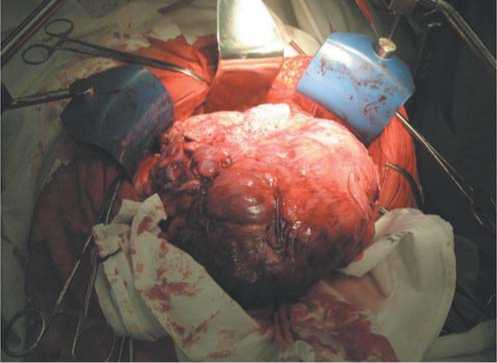
Рис. 4. Операционное поле. Полностью мобилизованная единым блоком опухоль с частью левого купола диафрагмы, хвостом поджелудочной железы и селезенкой.
Операция закончена дренированием левой плевральной (1 дренаж) и брюшной (3 дренажа) полостей (рис. 5, 6).
Суммарная кровопотеря во время операции составила 2200 мл, интраоперационо возвращено 1500 мл. Продолжительность операции составила 3 часа 50 минут.
В послеоперационном периоде проводилась инфузионная, антибактериальная, анальгетическая терапия, перевязки. Течение послеоперационного периода без осложнений. Швы сняты на 12 сутки. В удовлетворительном состоянии выписана 6.06.2011 г. на амбулаторное лечение с рекомендациями хирурга и онколога. Начат курс химиотерапии препаратом гливек по рекомендованной схеме 400 мг/сут.
Обследована в январе 2012 г.: признаков рецидива заболевания нет, продолжает прием гливека.
Показатель числа рецидивов заболевания у пациентов с локальным заболеванием составляет 35%, в то время как у пациентов с местнораспространенным заболеванием этот показатель достигает 90% после резекции. Печень является наиболее частым местом метастазирования опухоли, в половине всех случаев возникают местные рецидивы заболевания, в 15% случаев – экстраабдоминальное прогрессирование. 5-летняя выживаемость после хирургической резекции у пациентов значительно варьирует. Например, в исследовании MDACC из 197 пациентов, наблюдаемых в 1957-1997 гг., только 99 были подвержены резекции, при этом показатель 5-летней выживаемости составил 48%; в других исследованиях показатели 5-летней выживаемости варьировали от 35 до 65% [4, 6].
В случае нерезектабельной опухоли медиана выживаемости пациентов коротка и составляет от 10 до 21 мес.
Прогноз течения заболевания после резекции определяют различные факторы, а именно: размер опухоли, митотический индекс, локализация.
В течение длительного времени методы лечения при метастатических и рецидивных GIST были чрезвычайно ограничены. Результаты лечения пациентов с GIST кардинально изменились с 2000 г., после внедрения в клиническую практику иматиниба (Гливека) – специфического ингибитора тирозинкиназной активности c-Kit-рецептора. Основным механиз-
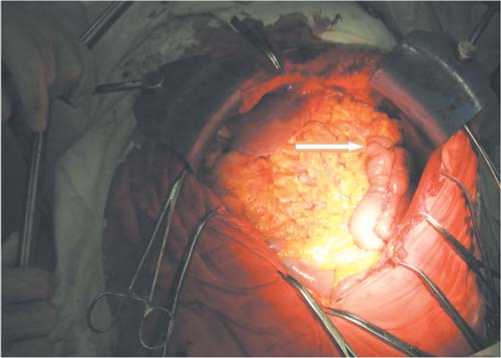
Рис. 5. Вид операционного поля после завершения реконструктивного этапа - наложения эзофаго-эюно анастомоза (отмечено стрелкой).
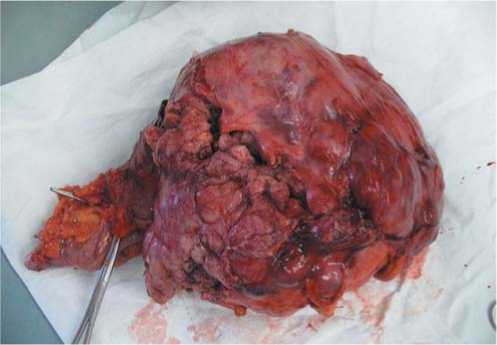
Рис. 6. Внешний вид удаленного макропрепарата.
мом действия иматиниба является блокирование связывания АТФ с ферментами, что приводит к ингибированию активности киназ. Иматиниб принимается внутрь, пожизненно, обладает низкой токсичностью. Общая эффективность лечения при распространенных формах заболевания составляет порядка 50-60%, стабилизация процесса наблюдается у каждого 3-го больного [1].
Другой препарат, сунитиниб (Сутент) – низкомолекулярный ингибитор тирозинкина-зы, способный поражать сразу несколько молекул, в частности рецепторы фактора роста эндотелия сосудов (VEGFR), рецепторы тромбоцитарного фактора роста (PDGFR), а также тирозинкиназы Kit и Flt3 [15, 19]. Больным с GIST сунитиниб назначают в случае неэффективности (2-я линия) или непереносимости терапии иматинибом. Обобщая доступные в настоящее время данные, можно сказать, что но- вое направление лекарственного лечения – многоцелевая (multitarget) терапия молекулярного действия – имеет большой потенциал к развитию [1, 3].
В связи с этим, на современном этапе развития хирургии, при постоянном совершенствовании хирургической техники и оборудования, а также анестезиолого-реанимационной службы, стало возможным выполнение обширных, комбинированных операций у боль- ных с GIST, которые еще недавно считались инокурабельными.
Таким образом, диагностика, лечение и исход у пациентов с GIST претерпели значительные изменения за последние 10 лет благодаря открытию молекулярных механизмов, приводящих к развитию опухоли. Несомненно, наряду с совершенствованием хирургических методов лечения, разработка новых препаратов позволит улучшить прогноз жизни при GIST.
Список литературы Особенности клинического течения, диагностики и лечения гастроинтестинальных стромальных опухолей
- Blay J.Y., Bonvalot S., Casali P. et al. for the GIST Consensus Meeting Panelists. Consensus meeting for the management of gastrointestinal stromal tumors. Report of the GIST Consensus Conference of 20-21 March 2004, under the auspices of ESMO. Ann Oncol. 2005. Vol.16. P.566-78.
- Demetri G.D., van Oosterom A.T., Garrett C.R. et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet. 2006. Vol.368. P.1329-38.
- Heinrich M.C., Maki R.G., Corless C.L. et al. Primary and secondary kinase genotypes correlate with the biological and clinical activity of sunitinib in imatinib-resistant gastrointestinal stromal tumor. J Clin Oncol. 2008. Vol.26. P.5352-59.
- Dewar A.L., Cambareri A.C., Zannettino A.C. et al. Macrophage colony-stimulating factor receptor c-fms is a novel target of imatinib. Blood. 2005. Vol.105. P.3127-32.
- Joensuu H. Gastrointestinal stromal tumor (GIST). Ann Oncol. 2006. Vol.17 (suppl. 10). Р.280-6.
- Cohen M.H., Johnson J.R., Pazdur R. Full acknowledgement of application (STI571; Gleevec) Clin Cancer Res. 2005. Vol.11. P.12-19.
- Orosz Z., Tornoczky T., Sapi Z. Gastrointestinal stromal tumors: aclinicopathologic and immunohistochemical study of 136 cases. Pathol Oncol Res. 2005. Vol.11. P.11-21.


