Особенности некоторых биологических свойств монокультур бактерий родов Enterobacter spp., Citrobacter spp., Serratia spp., Proteus spp. и их совместно сокультивируемых вариаций
Автор: Габидуллин Ю.З., Суфияров Р.С., Габидуллин З.Г., Суфиярова Р.З., Зайнуллина М.Г.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 1 т.13, 2013 года.
Бесплатный доступ
Штаммы бактерий рода Enterobacter spp., Citrobacter spp., Serratia spp. и Proteus spp., выделенные от больных с инфекционными процессами различной локализации, при совместном сокультивировании чаще проявляли высокую адгезивную, гемолитическую (α-, энтеро-, тиолзависимой гемолизин), лецитиназную, ДНК-азную, активности и LT-энтеротоксигенность, чем их монокультуры.
Инфекционный процесс, факторы патогенности, плазмиды
Короткий адрес: https://sciup.org/147153105
IDR: 147153105 | УДК: 616.9-022.7:579.842.1/2.083.1
Текст научной статьи Особенности некоторых биологических свойств монокультур бактерий родов Enterobacter spp., Citrobacter spp., Serratia spp., Proteus spp. и их совместно сокультивируемых вариаций
Введение. В последние годы повсеместно наблюдается увеличение удельного веса инфекционных заболеваний, вызванных ассоциациями условно-патогенных грамотрицательных бактерий [11, 12]. Данные инфекции человека характеризуется выраженным клиническим полиморфизмом, связанным с одновременным воздействием нескольких этиологических агентов, каждый из которых имеет в своем арсенале комплекс факторов патогенности [9, 14].
Особенности межмикробных взаимоотношений могут существенно влиять на формы и течение инфекционного процесса.
Исходя из вышеизложенного, целью наших исследований явилось сравнительное изучение некоторых биологических свойств моно- и сокульви-руемых вариаций бактерий родов Enterobacter spp., Citrobacter spp., Serratia spp., Proteus spp., выделенных при инфекционных процессах различной локализации.
Материалы и методы. В качестве материала для исследования использовали 57 штаммов бактерий родов Enterobacter spp., 61 штамм Citro-bacter spp., 55 штаммов Serratia spp. и 52 штамма Proteus spp., выделенных от больных с гнойновоспалительными, кишечными и урологическими заболеваниями, а также по 10 штаммов, изолированных от практически здоровых людей. Согласно поставленной цели мы создали 28 вариаций со-культивируемых бактерий рода Enterobacter spp.+ Citrobacter spp. (Е+С), 26 вариаций сокультиви-руемых штаммов Enterobacter spp.+ Serratia spp. (Е+S), 23 вариации Citrobacter spp.+ Serratia spp. (C+S), 26 вариаций сокультивируемых штаммов Serratia spp.+ Proteus spp.(S+P).
Адгезивную активность изучали с помощью реакции гемагглютинации на эритроцитах цыпленка (Габидуллин З.Г. и соавт. Авторское свидетельство № 1312098, 1987 г.) [4].
Мы определяли α-гемолитическую активность на средах, содержащих эритроциты 0(І) группы крови человека. Уровень гемолитической активности определяли по количеству гемолизированных эритроцитов. При этом все штаммы условно делили на 4 группы: в первую группу относили культуры высокой гемолитической активности, которые вызывали гемолиз от 70 до 100 % эритроцитов, во вторую – культуры средней активности, которые вызывали гемолиз от 40 до 70 % эритроцитов, в третью – культуры слабой гемолитической активности, которые вызывали гемолиз от 2 до 40 % эритроцитов, и в четвертую – культуры неактивные, которые не вызывали или вызывали гемолиз не более 2 % эритроцитов.
Изучение ДНК-азной активности нами было проведено по методу C.D. Jeffries и др. (1957) [11].
При этом культуры считали высокоактивными при наличии зоны просветления вокруг колоний радиусом 5–8 мм (+++), средней активности – 3–5 мм (++), слабоактивными – 2–3 мм (+) и неактивными – 1 мм (–).
Изучение лецитиназной активности проводили на желточной среде Г.Н. Чистовича (1960) [7]. При этом считали высокоактивными при наличии вокруг колонии суточной агаровой культуры радужного венчика диаметром 5–7 мм и отметили в виде (+++), средней активности 3–5 мм (++), слабой активности 2–3 мм (+) и неактивными – при отсутствии венчика 1 мм и менее (–).
J. Albesa и др. [8], L.J. Barbers и др. [9] показали, что бактерии кишечной группы синтезируют отличающийся от α-гемолизина тиолзависимый гемолизин, который в той или иной степени обуславливает патогенный потенциал возбудителя.
Исходя из этого, нами была изучена способность синтезировать тиолзависимый гемолизин на кровяном агаре, содержащий цистеин и эритроциты кролика у монокультур штаммов Enterobac- ter spp., Citrobacter spp., Serratia spp., Proteus spp. и у их сокультивируемых вариаций: (E+C), (C+S), (E+S), (S+P).
Определение ЛТ-энтеротоксигенности у монокультур штаммов Enterobacter spp., Citrobacter spp., Serratia spp., Proteus spp. и у их сокультивируемых вариаций: (E+C), (C+S), (E+S), (S+P), проводили на изолированной петле тонкого кишечника кролика и в тесте «отека лап» мышей, по методу Ю.П. Вартанян с соавт. [3].
Изучение конъюгативной передачи Ent-плазмид проводили на селективной среде, содержащей определенные антибиотики по чувствительности и резистентности донорных и реципи-ентных культур.
Изучение морфологии проводили с помощью оптического и электронного микроскопа (JEM-100B, Япония) с ускоряющим напряжением 15,80 кВ. Съемку проводили при инструментальном увеличении 15–30 тыс. раз.
Результаты. При постановке реакции гемагглютинации с эритроцитами цыпленка Д-маннозо-чувствительную (MS) реакцию гемагглютинации из 57 монокультур Enterobacter spp. 23 (40 %) давали положительную, а Д-маннозорезистентную (MR) – 14 (25 %). Из 61 штамма Citrobacter spp., 55 культур Serratia spp., 52 штаммов Proteus spp. MS-реакцию гемагглютинации с эритроцитами цыпленка давали 24 (39,4 %) штамма Citrobacter spp. и 20 (36,6 %) Serratia spp., 18 (43,6 %) культур Proteus spp., а MR-реакцию 17 (27,8 %), 16 (29 %), 15 (29,2 %) штаммов соответственно.
При изучении адгезивной активности штаммов бактерий родов Enterobacter spp., Citrobac-ter spp. и Serratia spp., Proteus spp., выделенных от здоровых людей, было выявлено по 1 штамму, обладающему слабой MS и MR активностью.
Сравнительное изучение адгезивной активности совместно сокультивируемых штаммов (E+C), (E+S), (C+S),(S+P) показало наличие у сокульти-вируемых вариаций (E+C) – MS 58 % (16 из 28 вариаций) у (E+S) – 57,4 % (15 из 26 вариаций), у (C+S) – 61 % (14 из 23 вариаций), у (S+P) – 53,85 % (14 из 26 вариаций). Аналогичные данные были получены при изучении их способности давать MR – реакцию гемагглютинации с эритроцитами цыпленка. Так, вариации (E+C) в – 43 % (12 из 28 случаев), у (E+S) – 42,1 % (11 из 26), у (C+S) – 39 % (9 из 23) и у (S+P) – 50 % (13 из 26) давали положительную MR-реакцию.
При электронной микроскопии было выявлено, что клетки совместно сокультивируемых вариаций в большом количестве плотно прилипали к эритроцитам цыпленка (более 15), тогда как количество прилипающих клеток у монокультур составляло не более 10 на единичный эритроцит.
Одновременно нами было обнаружено, что клетки Enterobacter spp., дающие MR-реакцию с эритроцитами цыпленка, имели реснички длиной от 110 до 430 нм и шириной 4,5–5,5 нм, Citrobacter spp. длиной от 110 до 420 нм и шириной 5–5,4 нм, Serratia spp. длиной от 100 до 380 нм и шириной 3– 4,3 нм, Proteus spp. длиной от 110 до 380 нм и шириной 3,8–4,6 нм. Большинство бактериальных клеток исследуемых условнопатогенных энтеробактерий, не способных давать РГА, не имели реснички или имели их в небольшом количестве.
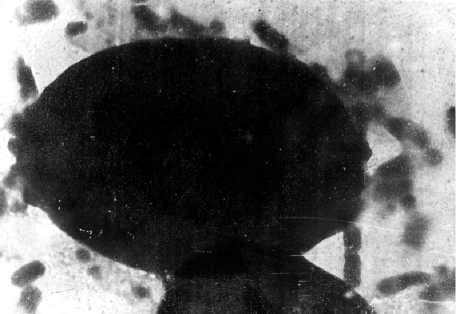
Рис. 1. Совместно сокультивируемые штаммы УПЭ с высокой адгезивной активностью
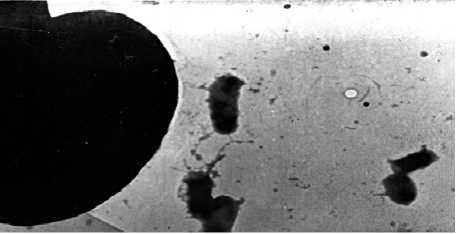
Рис. 2. Адгезивная активность монокультур УПЭ
Исследования α-гемолитической активности монокультур Enterobacter spp., Citrobacter spp., Serratia spp., Proteus spp. показали, что из 57 монокультур Enterobacter spp. α-гемолитическую активность проявляли 12 (21 %) штаммов, среди которых высокую активность проявляли 4 (30 %), среднюю 6 (55 %) и слабую активность 2 (15 %). Из 61 монокультуры Citrobacter spp. 13 (22,8 %) штаммов обладали α-гемолитической активностью, среди которых 3 (23,1 %) проявляли высокую, 4 (30,7 %) среднюю и 6 (46,7 %) слабую активность. Из 55 культур Serratia spp. α-гемоли-тическую активность проявляли 11 штаммов (20 %), среди которых 3 (27,2 %) проявляли высокую, 4 (36,6 %) среднюю и 4 (36,6 %) слабую активность; из 52 монокультур Proteus spp. α-гемо-литическую активность проявляли 11 штаммов (21,1 %), среди которых 3 (27,2 %) проявляли высокую, 3 (27,2 %) среднюю и 5 (45,6 %) слабую активность. Штаммы Enterobacter spp., Citrobac-ter spp., Serratia spp., Proteus spp. изолированные от здоровых людей значительно чаще проявляли слабую α-гемолитическую активность и составляли менее 10 % культур.
Проблемы здравоохранения
В следующей серии опытов нами было проведено изучение α-гемолитической активности совместно сокультивируемых штаммов: (E+C), (C+S), (E+S), (S+P).
При этом частота встречаемости α-гемолити-ческой активности была значительно выше чем у монокультур: в частности у (E+C) – 39,2 % (11 из 28), у (E+S) – 38,4 % (10 из 26), у (C+S) – 34,7 % (8 из 23), у (S+P) – 42,3 % (11 из 26). В дальнейшем проводили изучение наличие тиолзависимого гемолизина на твердой питательной среде, содержащей цистеин и эритроциты кролика.
Результаты исследования показали, что из 57 штаммов монокультур Enterobacter spp. 24 (40,3 %) проявляли способность синтезировать тиолзави-симый гемолизин, среди которых 5 (20,8 %) обладали высокой, 10 (41 %) – средней и 9 (37,5 %) – слабой, тогда как среди культур, изолированных от здоровых людей, только один штамм обладал средней тиолзависимой гемолитической активностью. Из 61 монокультуры Citrobacter spp. 28 (45,9 %) синтезировали тиолзависимый гемолизин, среди которых 9 (32,1 %) проявляли высокую, 13 (46,4 %) среднюю, 6 (21,4 %) слабую активность. Из монокультур, изолированных от практически здоровых людей, одна культура проявляла слабую тиолзави-симую гемолитическую активность. Из 55 монокультур Serratia spp. тиолзависимой гемолитической активностью обладали 19 (34,5 %) штаммов, среди которых 7 (36,8 %) высокой, 7 (36,8 %) средней и 5 (26,3 %) слабой активностью. Из 10 культур, выделенных от здоровых людей, 2 (20 %) обладали слабой активностью.
Из 52 монокультур Proteus spp. 26 (50 %) синтезировали тиолзависимый гемолизин, среди которых 9 (34,6 %) проявляли высокую активность, 13 (50 %) среднюю, 4 (15,4 %) слабую активность. Тогда как при совместном сокультивировании штаммов: (E+C) – 16 (57,4 %) из 28 синтезировали тиолзависимый гемолизин, среди которых 7 (43,7 %) проявляли высокую, 8 (50 %) – среднюю и 1 (16,25 %) – слабую активность; из 26 вариаций (E+S) – 18 (69,2 %) синтезировали тиолзависимый гемолизин, среди которых 8 (44,4 %) проявляли высокую, 9 (56 %) – среднюю, 1 (5,5 %) – слабую активность, из 23 вариаций (C+S) – 17 (73,9 %) синтезировали тиолзависимый гемолизин, среди которых 8 (47 %) – высокой, 8 (47 %) – средней и 1 (5,8 %) слабой активности, из 26 вариаций (P+S) – 18 (69,2 %) синтезировали тиолзависимый гемолизин, среди которых 8 (44,4 %) – высокой, 7 (38,9 %) – средней и 3 (16,7 %) слабой активности.
Учитывая важную роль гемолизинов в патогенезе бактериальных инфекций, в последние годы многие исследователи отмечают особую роль гемолизинов, обуславливающих развитие диарейных инфекций, – так называемых энтерогемолизинов.
Как показали наши исследования, среди используемых Enterobacter spp., Citrobacter spp., Ser-ratia spp., Proteus spp. энтерогемолитическая ак- тивность выявлена только у культур, изолированных при диарейных инфекциях, тогда как штаммы, выделенные от больных с гнойно-воспалительными, урологическими заболеваниями, не проявляли энтерогемолитической активности.
Сравнительный анализ энтерогемолитической активности монокультур и сокультивируемых штаммов, изолированных при диарейных инфекциях, показал, что монокультуры бактерий родов Enterobacter spp., Citrobacter spp., Serratia spp. и Proteus spp. в 1,5 раза реже проявляли высокую и в 2 раза чаще слабую энтерогемолитическую активность, чем их совместно сокультвируемые вариации.
Исследования ДНК-азной активности культур Enterobacter spp. показали, что из 57 культур Ente-robacter spp. ДНК-азной активностью обладал 21 (36,8 ± 6,3 %) штамм, среди которых высокую активность проявляли 6 (28,5 %), среднюю 7 (33,3 %) и слабую 8 (8,38 %). Из 61 культуры Citrobacter spp. 20 (39,7 ± 6,2 %) штаммов обладали ДНК-азной активностью, среди которых 4 (20 %) проявляли высокую, 8 (40%) среднюю и 8 (40 %) слабую активность. Из 55 культур Serratia spp. ДНК-азной активностью обладали 19 штаммов (34,5 ± 6,4 %), среди которых 5 (26,3 %) проявляли высокую, 7 (36,8 %) среднюю и 7 (36,8 %) слабую активность. Из 52 культур Proteus spp. ДНК-азной активностью обладали 16 (30,7 ± 6,2 %) штаммов, среди которых 5 (31,3 %) проявляли высокую, 6 (37,4 %) среднюю и 5 (31,3 %) слабую активность. Из 10 штаммов Enterobacter spp., изолированных от здоровых людей, один проявлял среднюю, среди Citrobacter spp. – 1 слабую и по 2 штамма Serratia spp. и Proteus spp., соответственно, слабую активность.
В следующей серии опытов нами было проведено изучение ДНК-азной активности совместно сокультивируемых вариаций. При этом частота встречаемости ДНК-азной активности была значительно выше, чем у монокультур: в частности из 28 вариаций (E+C) – 14 (50 ± 9,4 %) (Р < 0,05), из 26 вариаций (E+S) – 15 (57,7 ± 9,6 %) (Р < 0,05), из 23 вариаций (C+S) – 16 (69,5 ± 9,6 %) (Р < 0,05), из 26 вариаций (P+S) – 15 (57,7 ± 9,6 %) (Р < 0,05) обладали ДНК-азной активностью. Необходимо отметить, что штаммы бактерий родов Enterobacter spp., Citrobacter spp., Serratia spp., Proteus spp. при совместном сокультивировании значительно чаще проявляли высокую и среднюю ДНК-азную активность: в частности (E+C) – из 14 вариантов, обладающих ДНК-азной активностью, проявляли высокую – 7(50 %), среднюю – 6 (42,8 %) и слабую – 1 (7,1 %) активность; из 15 ДНК-азно положительных вариантов (E+S) – обладали высокой 8 (53,3 %), средней 6 (40 %) и слабой 2 (13,3 %); из 16 ДНК-азно положительных вариантов (C+S) обладали высокой – 7 (43,7 %), средней 7 (43,7 %) и слабой 2 (12,5 %) активностью; из 15 ДНК-азно положительных вариантов (P+S) – проявляли высокую 7 (46,7 %), среднюю 6 (40 %) и слабую 2 (13,3 %) активность.
Исследование лецитиназной активности монокультур Enterobacter spp., Citrobacter spp., Serra-tia spp., Proteus spp. показало, что из 57 штаммов Enterobacter spp. лецитиназной активностью обладали 13 (22,8 ± 5,5 %), среди которых высокую активность проявляли 4 (30,76 %) штамма, 5 (38,4 %) среднюю и 4 (30,76 %) слабую активность. Из 61 штамма Citrobacter spp. 25 (40,9 ± 6,2 %) обладали лецитиназной активностью, среди которых высокую активность проявляли – 8 (32 %), среднюю – 9 (36 %) и 8 (32 %) – слабую активность. Из 55 культур Serratia spp. лецитиназную активность проявляли 25 (45,4 ± 6,5 %), среди которых высокоактивными были 9 (36 %), среднеактивными 10 (40 %) и слабоактивными 7 (24 %). Из 52 культур Proteus spp. лецитиназную активность проявляли 25 (48,08 ± 6,4 %), среди которых высокоактивными были 8 (32 %), среднеактивными 10 (40 %) и слабоактивными 7 (28 %).
В дальнейшем изучали изменение лецитиназной активности при совместном сокультивирова-нии (E+C), (E+S), (C+S), (P+S). При этом частота встречаемости лецитиназной активности была значительно выше, чем у монокультур: в частности, из 28 вариаций (E+C) обладали лецитиназной активностью 17 (60,7 ± 9,2 %) (Р < 0,05), из 26 вариаций (E+S) – 16 (61,5 ± 9,5 %) (Р < 0,05), из 23 вариаций (C+S) – 15 (65,2 ± 9,9 %) (Р < 0,05), и из 26 вариаций (P+S) – 16 (61,5 ± 9,5 %) (Р < 0,05) обладали лецитиназной активностью.
По данным некоторых исследователей, бактерии рода Proteus в природе существуют в виде трех диссоциативных форм: роящиеся (Н), нестабильно нероящиеся и стабильно нероящиеся О-формы [4].
В частности, в исследованиях Н.Н. Гибазова [5] показано, что нестабильно нероящиеся О-фор-мы по сравнению с роящимися Н- и стабильно нероящимися О-формами чаще проявляют факторы патогенности и функции донорной клетки при скрещивании с универсальным реципиентом (E. Coli К12, G 62, RifR). Исходя из вышеизложенного, мы проводили совместное сокультивирова-ние бактерий родов Serratia spp Enterobacter spp., Citrobacter spp., с роящимися Н-, нестабильно и стабильно нероящимися О-формами бактерий рода Proteus. Было обнаружено значительное увеличение вышеперечисленных факторов патогенности и Lt энтеротоксигенности при совместном сокульти-вировании бактерий Serratia spp., Enterobacter spp., Citrobacter spp. с нестабильно нероящимися О-формами по сравнению с роящимися Н- и стабильно нероящимися О-формами бактерий рода Proteus.
Сравнительное изучение энтеротоксигенности монокультур и их совместно культивируемых вариаций на моделях «изолированная петля тонкого кишечника кролика» и «отек лап» мышей показало, что монокультуры штаммов бактерий родов
Enterobacter spp., Citrobacter spp., Serratia spp., Proteus spp. в опытах «петля тонкого кишечника кролика» давало накопление жидкости и соотношение (V/L), составившее не более 1,0–1,1. А при введении совместно сокультивируемых вариаций наблюдалась картина накопления экссудата в просвете тонкой кишки, отличающаяся от монокультур, что проявлялось значениями (V/L) 1,2–1,3 и более. Опыты на «отеке лап» мышей показали, что из 57 монокультур Enterobacter spp. 6 (10,5 %), из 61 Citrobacter spp. 6 (9,8 %), из 55 Serratia spp. 5 (9,09 %), из 52 Proteus spp. 6 (11,5 %) давали положительный отек лап от 1,0 до 1,1. Из 28 вариаций (E+C) – у 7 (25 %), из 26 вариаций (E+S) – у 7 (26,9 %), из 23 вариаций (C+S) – у 5 (21,7 %), из 26 вариаций (P+S) – у 7 (26,9 %) разница между опытными и контрольными лапками была от 1,0 до 1,3. Для выяснения природы генетического детерминанта, контролирующего продукцию Lt энтеротоксина, брали штаммы, дающие в опытах «отек лап» мышей более 95 мг, и петлю тонкого кишечника (V/L) – 1,1 и более, и изучали профиль их плазмидной ДНК. При этом на форэграмме штаммов, дающих «отек лап» мышей 95 мг и более, дающих положительную дилятацию тонкого кишечника кролика (V/L) – 1,1 и более, обнаруживали в 7 % случаях клоны плазмидой массой 60 МД. В дальнейшем проводили сокультивирование этих штаммов и изучали профиль их плазмидной ДНК. При этом нами было выявлено увеличение клонов, несущих плазмиды, массой 60 МД до 14–15 %, что указывало на возможность конъюга-тивной передачи мобильных генетических детерминант, контролирующих продукцию некоторых факторов патогенности, в частности LT-энтеротоксина.
Таким образом, полученные результаты дают нам основание полагать, что при совместном со-культивировании Enterobacter spp. + Citrobacter spp., Enterobacter spp. + Serratia spp., Citrobacter spp. + Serratia spp., Proteus spp. + Serratia spp. происходит повышение адгезивной, гемолитической (α-, эн-теро, тиолзависимый гемолизин), лецитиназной, ДНК-азной активности и LT-энтеротоксигенности по сравнению с их монокультурами, что, возможно, связано с взаимоиндуцирующим действием продуктов жизнедеятельности вышеперечисленных бактерий, а также конъюгативной передачей мобильных генетических элементов, детерминирующих некоторые факторы патогенности, что необходимо учитывать при оценке этиологической значимости вышеперечисленных родов бактерий и целенаправленной профилактике и лечении заболеваний, вызванных ассоциацией этих бактерий. Значительное увеличение факторов патогенности при совместном сокультивировании нестабильно нероящимися О-формами бактерий рода Proteus (по сравнению с роящимися Н и стабильно нероя-щимися О-формами) с Citrobacter spp., Enterobac-
Проблемы здравоохранения
ter spp., Serratia spp. указывает на настоятельную необходимость проведения специальных исследований, направленных на выяснение механизма передачи факторов патогенности от нестабильно нероящихся О-форм бактерий рода Proteus к Citro-bacter spp., Enterobacter spp., Serratia spp.
Список литературы Особенности некоторых биологических свойств монокультур бактерий родов Enterobacter spp., Citrobacter spp., Serratia spp., Proteus spp. и их совместно сокультивируемых вариаций
- Азнабаев, Г.К. Биологические свойства бактерий рода Citrobacter, выделенных при моно-и ассоциированных бактериальных инфекциях: автореф. дис.. канд. мед. наук/Г.К. Азнабаев. -Оренбург, 2003. -23 с.
- Бондаренко, В.М. Термостабильные энтеротоксины условно-патогенных представителей Enterobacteriaceae/В.М. Бондаренко, А.Р. Мавзютов, З.Г. Габидуллин//Журн. микробиологии, эпидемиологии и иммунологии. -1998. -№ 3. -С. 104-107.
- Габидуллин, З.Г. Биологическая характеристика штаммов Proteus, выделенных при инфекционных процессах различной локализации: автореф. дис.. д-ра мед. наук/З.Г. Габидуллин. -Саратов, 1990. -32 с.
- Гибазов, Н.Н. Сравнительная характеристика некоторых морфологических и биологических особенностей диссоциативных форм бактерий рода Proteus: автореф. дис. канд. мед. наук/Н.Н. Гибазов. -Оренбург, 2012. -21 с.
- Отек лап белых мышей - тест для оценки активности энтеротоксинов Escherichia coli // Ю.П. Вартанян, М.К. Северцева, О.И. Введенская и др. //Бюл. эксп. биол. и медицины. - 1978. - № 2. - С.150-152.
- Хуснутдинова, Л.М. Межбактериальные взаимодействия на слизистой оболочке миндалин человека: автореферат дисс. канд. мед. наук/Л.М. Хуснутдинова. -Оренбург,2004. -24 с.
- Чистович, Г.Н. Патогенез стафилококковых инфекций/Г.Н. Чистович. -Л.: Медицина, 1961. -С. 96-99.
- A tiol-activated hemolysin in gram-negative bacteria/J. Albesa, L.J. Barberis, M.C. Pajaro et al.//Can. J. Microbiol. -1985. -Vol. 31. -P. 297-300.
- Bacteremia due to extended-spectrum beta-lactamase-producing Escherichia coli in the CTX-M era: a new clinical challenge/J. Rodriguez-Bano, M.D. Navarro, L. Romero et al.//Clin. Infect. Dis. -2006. -Vol. 43 (11). -P. 1407-1414.
- Distribution, organization, and ecology of bacteria in chronic wounds/К. Kirketerp-Moller, Р.О. Jensen, М. Fazli et al.//J. Clin. Microbiol. -2008. -Vol. 46 (8). -P. 2717-2722.
- Jeffries, C.D. Rapid metod for determining the activity of microorganisms on nuclear acids/C.D. Jeffries, D.F. Holtman, D.G. Gus//J. of Bacteriology-1957. -Vol. 73, № 4. -P. 590-591.
- Microscopic and physiologic evidence for biofilm-associated wound colonization in vivo/S.C. Davis, C. Ricotti, A. Cazzaniga et al.//Wound Repair. Regen. -2008. -Vol. 16 (1). -P. 23-32.
- Molecular weight determination and partial characterization of Klebsiella pneumonia haemolysins/L.J. Barbers, A.J. Eraso, M.C. Pajaro and J. Albesa//Can. J. Microbiol. -1986. -Vol. 32. -Р. 884-885.
- Mulet, X. Azithromycin in Pseudomonas aeruginosa Biofilms: Bactericidal Activity and Selection of nfxB Mutants/X. Mulet, M.D. Macia, A. Mena et al.//Antimicrob. l Agen. Chemother. -2009. -Vol. 53 (4). -P. 1552-1560.
- Schaberg, D.R. Major trends in the microbial etiology of nosocomial infection/D.R. Schaberg, D.H. Culvr, R.P. Gaynes//Am. J. Med. -1991. -Vol. 91. -№3. -Р. 72.
- Weir, T.L. Interactions between plants and an opportunistic human pathogen, Pseudomonas aeruginosa: dis. Ph. D./T.L. Weir. -Colorado State University, 2008. -177p.


