Особенности нуклеофильного присоединения высших линейных и разветвленных аминов к акрилонитрилу
Автор: Казанцев Олег Анатольевич, Ширшин Константин Константинович, Есипович Антон Львович, Жиганов Иван Валентинович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.8, 2016 года.
Бесплатный доступ
Проведено сравнение нуклеофильного присоединения высших первичных аминов С8-С14 линейного и разветвленного строения к С=С-связи акрилонитрила в метаноле. Для фракций разветвленных аминов определено влияние температуры, соотношения реагентов и их концентрации на выход продуктов цианэтилирования.
Высшие первичные амины, акрилонитрил, метанол, цианэтилирование
Короткий адрес: https://sciup.org/147160363
IDR: 147160363 | УДК: 547.233.1: | DOI: 10.14529/chem160301
Текст научной статьи Особенности нуклеофильного присоединения высших линейных и разветвленных аминов к акрилонитрилу
Одной из тенденций в современной нефте- и газодобыче является необходимость повышения эффективности мероприятий по борьбе с различными видами коррозии трубопроводов и оборудования. Причиной этого является все более высокое содержание сернистых примесей во многих добываемых нефтях и природных газах. В качестве ингибиторов коррозии в промысловой химии широкое распространение получили различные производных высших линейных аминов [1]. В частности, в работах [2–4] было показано, что высокую эффективность в качестве ингибиторов коррозии на газовых месторождениях, характеризующихся высоким содержанием сероводорода, проявляют алкиламинопропионитрилы, получаемые взаимодействием различных высших линейных аминов (например, диоктиламина) с нитрилом акриловой кислоты (НАК). Одним из важных для промышленного использования преимуществ таких ингибиторов являются мягкие условия их синтеза с высокими выходами по реакции цианэтилирования аминов. В то же время в ряде работ показано, что различные производные высших разветвленных аминов более эффективно ингибируют коррозию в некоторых углеводородных системах по сравнению с производными линейных аминов [5, 6]. Для пропионитрильных производных некоторых разветвленных аминов также показана высокая эффективность в качестве ингибиторов коррозии [7].
Ранее для низших первичных и вторичных аминов было показано [8–11], что скорость реакции их цианэтилирования (уравнение 1) снижается по мере возрастания длины и степени разветвлённости алифатического радикала.
RNH 2 + H 2 C=CHCN → RNHCH 2 CH 2 CN (1)
I
Для высших разветвленных первичных аминов – трет-нониламина, трет-додециламина и трет-пентадециламина – в работах [12, 13] описано их взаимодействие с эквимольными количествами НАК в отсутствие растворителей, а также в присутствии добавок воды или смесей воды с солюбилизатором (диметилформамидом, диметилацетамидом, β-трет-бутиламино- пропионитрилом, β,β|-иминодипропионитрилом) при температуре 78-89 °С. При этом конверсии реагентов по реакции (1) не превышали 66,5 %.
Целью данной работы было сравнение активности в реакции (1) высших разветвленных и линейных аминов в метаноле и определение условий достижения высоких конверсий при использовании промышленных фракций высших первичных разветвленных аминов. В качестве ос- новного растворителя использовался метанол. Это было обусловлено тем, что нуклеофильное присоединение аминогрупп по двойной связи НАК может значительно ускоряться протонодонорными веществами различных классов [8], а метанол является доступным и относительно дешевым протонодонорным растворителем, который широко применяется на нефтяных и газовых промыслах [14]. Проведенные нами предварительные эксперименты подтвердили, что при температуре 25 °С реакция присоединения исследуемых высших первичных разветвленных аминов протекает в 2–3 раза быстрее в метаноле по сравнению с проведением реакции в ацетонитриле, диметилформамиде или в отсутствие растворителя.
Экспериментальная часть
В работе использовались н -октиламин (нОА) и трет -октиламин (тОА) фирмы «Aldrich», НАК марки «Ч» (ГОСТ 11097-73), промышленные фракции разветвленных аминов марок «Тет-
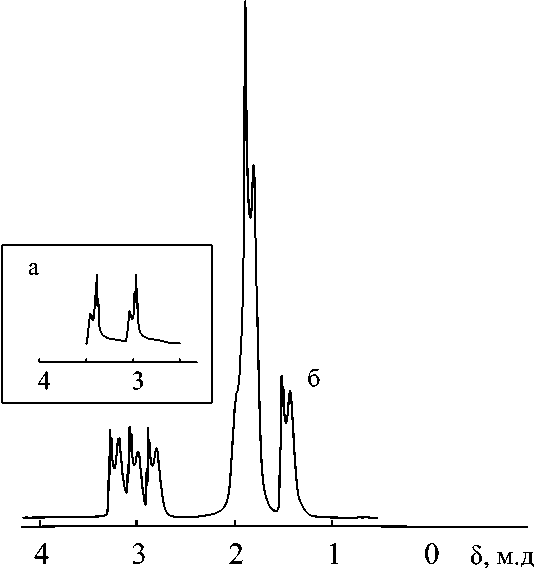
Рис. 1. Фрагменты спектров ЯМР 1Н продуктов взаимодействия НАК с тОА (а) или нОА (б). Т=50 °С. Растворитель CH 3 OD
ракс-03» (РА-9) и «Тетракс-04» (РА-12) производства ОАО «Дзержинское оргстекло» (ТУ ТУ2413-032-55856863-2004). РА-9 содержит набор изомерных разветвленных амины фракции С9 – С12, имеющие по два заместителя при α-углеродном атоме; РА-12 являются аналогичными аминами фракции С12 – С14.
Реакцию присоединения высших аминов к НАК проводили при мольных соотношениях реагентов от 2:1 до 1:2 и температуре 25–82 °С. Протекание реакции цианэтилирования в исследуемых системах было подтверждено методом ЯМР-спектроскопии реакционных смесей при проведении реакции в дейтерометаноле. На рис. 1 в качестве примера показаны фрагменты спектров продуктов взаимодействия НАК с тОА (а) или нОА (б), которые соответствуют сигналам групп C H 3 -C (1,35-1.55 м.д.), C-C H 2 -C (1,65-2,10 м.д.) R-C H 2 -N (2,70-2,90 м.д.), N-C H 2 -CH 2 -CN (2,903,15 м.д.), -C H 2 -CN (3,15-3,50 м.д.). Спектры ЯМР 1H получали при температуре 25 °С на спектрометре «Agilent 400/DDR2» при резонансной частоте 400 MHz.
Анализ количественного состава реакционных смесей проводили методом газовой хроматографии с использованием хроматографа «Хромос ГХ-1000» и капиллярной колонки VertiBond 1701 (длина 60 м, внутренний диаметр 0,25 мм, толщина плёнки – 0,25 мкм) в программируемом режиме: температура термостата колонок в течение 8 мин составляла 70 °С, затем поднималась до 200 °С, температура испарителя – 200 °С, температура детектора – 200 °С; в качестве газа-носителя использовался гелий.
Обсуждение результатов
При цианэтилировании первичных аминов необходимо учитывать, что образующиеся вторичные амины (I) способны присоединяться по С=С-связи не вступившего в реакцию НАК с получением аминодипропионитрила (II) [15]:
RNHCH 2 CH 2 CN + H 2 C=CHCN → RN(CH 2 CH 2 CN) 2 (2) II
Специально проведенный эксперимент показал, что при использовании нОА, двукратного избытка нитрила и температуры 50 °С (5 ч) конверсия исходного амина составила 95,7 %, в то время как конверсия НАК – 76,3 %. Следовательно, кроме эквимольного расхода нитрила и исходного амина по реакции (1), 26 % НАК пошло на образование продукта аминодипропионитрила по реакции (2). Типичная хроматограмма реакционной смеси представлена на рис. 2.
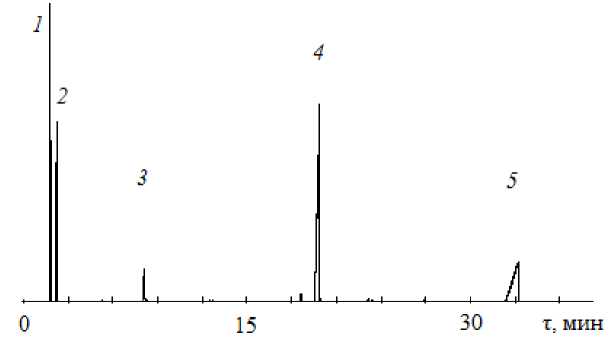
Рис. 2. Хроматограмма реакционной смеси при следующих условиях реакции: [нОА] 0 : [НАК] 0 = 1:2; содержание СН 3 ОН 40 % масс.; 50 °С; 5 ч.
Сигналы: СН 3 ОН (1), НАК (2), нОА (3), продукт I (4), продукт II (5)
При и спол ьзован ии э к ви м ольных количеств нОА и НАК или при замен е н ОА н а и с с ле д уе мы е в раб оте р а зв е тв ле нн ые а ми ны появление продукта диприсоединения н е н а б л ю д а лось. По э тому в д а льн е й ш и х ра с ч е та х у ч итывалось только протекание реакции (1). Для с ра в н е н и я ре ак ц и он н ой с п ос об н ост и в ы с ш и х первичных линейных и разветвленных амин ов были п ров е д е ны сра в н ительн ы е оп ыт ы с ис п ользов а н и е м нОА и тОА (рис. 3). В первом случае уже за 30 мин при температуре 25 °С дос ти гала с ь 95 % -ная конверсия реагентов, в то время как во втором случае за 5 ч она с о с та в и ла 52 % , а п ри пов ы ш е н и и те мперат уры д о 65 °С – 69 %.
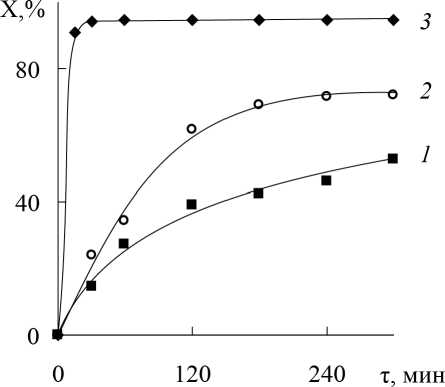
Рис. 3. Зависимость конверсии (X, %) тОА (1, 2) и нОА (3) от времени (t, мин). [Амин] 0 :[НАК] 0 = 1:1; содержание СН 3 ОН 40% масс.; Т= 25 °С (1, 3), 65 °С (2)
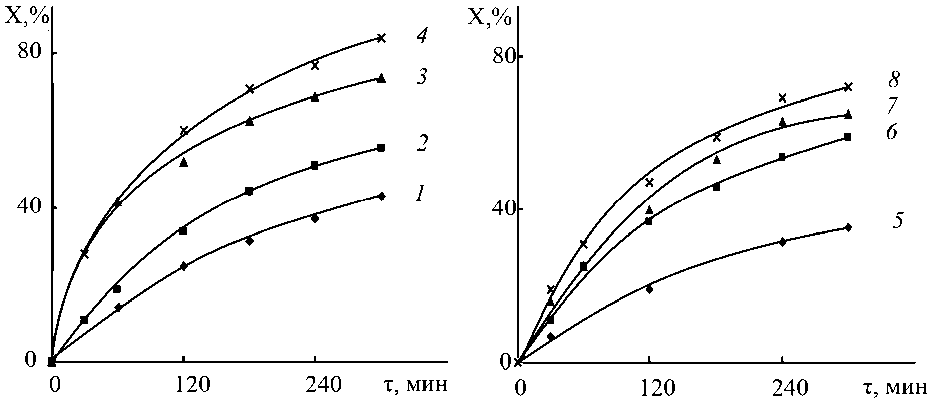
Да лее б ыли п ров е де н ы с ери и экспериментов по присоединению фракций а ми н ов Р -9 и Р-12 к АН п ри э к в и мольн ых с оо тн ош е н иях реагентов или избытке амина и варьиров а н и и температуры и к он цен т рац ий ре аген т о в в ме та н ол е . На рис . 4 , а и 5 представлены данные, показывающие в л и я н и е с од е р жа н и я ме тан ола н а кинетику реакции при использовании амин ов Р А -9, на рис. 4, б и в табл. 1 – ан а логи чные э к с п е ри ме н ты с у ча с ти ем а ми н ов Р -12. Для аминов РА-9 при повыше н и и с о д е ржа ни я ме тан ола с 10 до 40 % конверсия за 5 ч возрастает с 40 до 74 %; для амина РА-12 – с 35 д о 69 % . К ром е зн а ч и те льн ого ускорения реакции (1) по мере возрастани я с од е р жа н и я ме та н ол а в ре а к ц и он ных с ме сях, и з п олу че н н ых результатов следует также, что при повышении мо л е к у лярн ой ма с с ы и с п о л ьзу е мых высших разветвленных аминов их активнос ть в ре а к ц и и ц и а н э ти л иров а н и я ( п ри э к в и мольн ом соотношении с НАК) снижается, но незначит е льн о.
б)
а)
Рис. 4. Зависимость конверсии НАК (X, %) от времени (t, мин) при взаимодействии с РА-9 (а) и РА-12 (б). [Амин] 0 :[НАК] 0 = 1:1; содержание СН 3 ОН, % масс.: 10 (1, 5), 20 (2, 6, 8), 30 (3, 4, 7);
Т, °С: 65 (1, 2, 3, 5, 6, 7), 82 (4, 8)
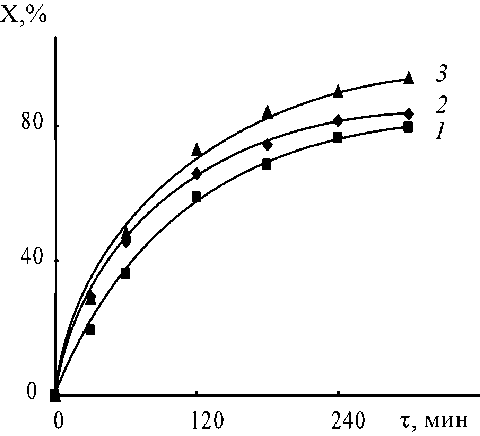
Рис. 5. Зависимость конверсии НАК (X, %) от времени ( τ , мин) при взаимодействии с РА-9 при 65 °С. [Амин] 0 : [НАК] 0 = 1:1 (1, 2), 2:1 (3); содержание СН 3 ОН, % масс.: 40 (1, 3), 50 (2)
Таблица 1
Конверсия НАК в реакции с РА-12 при изменении соотношения реагентов, содержания метанола и температуры
|
№ |
РА-12 НАК |
Т, °С |
Метанол, % масс. |
Конверсия, % |
|||||
|
0,5 ч |
1 ч |
2 ч |
3 ч |
4 ч |
5 ч |
||||
|
1 |
0,5* |
65 |
40 |
39 |
43 |
69 |
82 |
88 |
93 |
|
2 |
1,0 |
65 |
40 |
25 |
34 |
47 |
57 |
62 |
69 |
|
3 |
1,5 |
65 |
40 |
27 |
40 |
57 |
64 |
73 |
78 |
|
4 |
2,0 |
65 |
40 |
27 |
46 |
60 |
72 |
76 |
84 |
|
5 |
2,0 |
65 |
20 |
17 |
26 |
41 |
53 |
63 |
70 |
|
6 |
2,0 |
75 |
20 |
21 |
39 |
59 |
72 |
80 |
83 |
* Дана конверсия аминов.
Добиться роста скорости реакции (1) можно также повышением температуры, хотя влияние этого фактора является менее значительным. Так, при 20%-ной концентрации спирта конверсия РА-9 за 5 ч составила 56 % при температуре 65 °С и 62 % – при температуре 75 °С (соотношение реагентов 1:1). Если температуру поднять еще выше, то можно добиться и более значительного прироста скорости (см., например, рис. 4, кр. 4 и 8). Однако необходимо учитывать, что при повышении температуры при практическом применении исследуемой реакции существенно возрастут энергозатраты на конденсацию паров метанола (температура кипения 64,7 °С) и НАК (77 °С) с последующим их возвратом в реакционную зону.
Еще одним вариантом повышения конверсии является использование начального избытка одного из реагентов. На рис. 5 (кр. 1 и 3) показано, что увеличение начального соотношения РА-9 : НАК с 1,0 до 2,0 повышает конверсию за 5 ч (65 °С) с 74 до 84 %. В случае РА-12 эти показатели составили соответственно 69 и 84 % (табл. 1, № 2 и № 4), а 1,5-кратный избыток амина дал промежуточный результат – 78 % (№ 3). Можно попутно отметить, что при значительном избытке амина разница в реакционной способности двух фракций аминов практически нивелируется. При использовании начального двукратного избытка НАК была достигнута более высокая конверсия по сравнению с вариантом аналогичного избытка РА-12 – 93 % против 84 % (табл. 1, № 1 и № 4).
Сочетание роста температуры и начального избытка амина дает, как и следовало ожидать, более значительное увеличение конверсии по сравнению с действием одного фактора. Так, для цианэтилирования РА-12 при 20%-ном содержании метанола повышение соотношения амин : НАК с 1,0 до 2,0 при одновременном росте температуры с 65 до 75 °С дает прирост конверсии 14 % (табл. 1, № 2 и № 6). Следует отметить, что такого же результата (увеличение конверсии на 14 %) можно добиться, если вместо повышения температуры ввести в реакционную смесь больше метанола (табл. 1, № 5 и № 4). Аналогичные выводы следуют и из анализа других данных, полученных для обеих фракций аминов и представленных на рис. 4, 5 и в табл.1.
Таким образом, полученные данные показали, что при использовании промышленных фракций высших первичных разветвленные аминов можно достигать высоких выходов продуктов в реакции (1), что открывает хорошие перспективы получения эффективных ингибиторов коррозии на основе цианэтилированных производных таких аминов.
Статья подготовлена по результатам НИР, проводимой в рамках выполнения государственного задания №10.1686.2014/К Минобрнауки России.
Список литературы Особенности нуклеофильного присоединения высших линейных и разветвленных аминов к акрилонитрилу
- Kelland, M.A. Production chemicals for the oil and gas industry. Second edition/M.A. Kelland. -CRC Press, Taylor & Francis Group, 2014. -412 p DOI: 10.1201/b16648
- Мельников, В.Г. Защита от коррозии оборудования в газовой промышленности/В.Г. Мельников. -М.: ООО «ИРЦ Газпром», 1999. -66 с.
- Фролова, Л.В. Исследование механизма защитного действия некоторых производных аминов в минерализованных средах, содержащих сероводород/Л.В. Фролова, К.М. Алиева, В.М. Брусникина//Защита металлов. -1985. -Т. 21, № 6. -С. 926-930.
- Аминопроизводные сим-триазина как добавки к турбинным маслам для ингибирования сероводородной коррозии/В.И. Келарев, В.Г. Спиркин, О.Г. Грачёва, И.А. Голубева//Нефтехимия. -1999. -Т. 39, № 3. -С. 221-225.
- Патент 5030385 США. Process of inhibiting corrosion/L. Philip. -09.07.1991.
- Патент 2034932 РФ. Ингибитор сероводородной коррозии/А.В. Болдырев, В.И. Киркач, Н.А. Мизина, Е.С. Хохлова, У.А. Мамедов, А.Г. Базанов. -10.05.1995.
- Патент 3230173 A США. Method and compositions for inhibiting corrosion/J.D. Spivack. -18.01.1966.
- Суминов, С.И. Нуклеофильное присоединение аминогруппы к активированной двойной углерод-углерод связи/С.И. Суминов, А.Н. Кост//Успехи химии. -1969. -Т. 38. -Вып. 11. -С. 1933-1963.
- The catalytic effect of water on cyanoethylation of t-carbinamines/K. Taylor, W. Selcer, P. Montgomery, R. Hughes//J. Am. Chem. Soc. -1959. -V. 81. -P. 5333-5335 DOI: 10.1021/ja01529a023
- t-Carbinamines, RR|R||CNH2 II. Cyanoalylations and related reactions/L. Luskin, M. Culver, G. Gantert, W. Craig//J. Am. Chem. Soc. -1956. -V. 78. -P. 4042-4044 DOI: 10.1021/ja01597a049
- Fulmer, R.W. Cyanoethylation of Fatty Amines Using Acidic Ion Exchange Catalysis/Fulmer//Journal of organic chemistry. -1962. -V. 27. -I. 11. -P. 4115-4116 DOI: 10.1021/jo01058a544
- Патент 2982781 А США. Process for producing beta-aminonitriles and-beta-aminoesters/R.A. Hudges, P.D. Montgomery. -02.05.1961.
- Патент 2982782 A США. Process for producing beta-aminonitriles and beta-aminoesters/W.H. Selcer. -02.05.1961.
- Грунвальд, А.В. Использование метанола в газовой промышленности в качестве ингибитора гидратообразования и прогноз его потребления в период до 2030 г./А.В. Грунвальд//Нефтегазовое дело. -2007. -№ 2. -URL: http://ogbus.ru/authors/Grunvald/Grunvald_1.pdf.
- Буцкус, П.Ф. β-Элиминирование в ряду β-замещенных пропионовых кислот/П.Ф. Буцкус, Г.И. Денис//Успехи химии. -1966. -Т. 35, вып. 11. -С. 1999-2019.


