Особенности строения и расположения плаценты у пациенток с мезенхимальной дисплазией
Автор: Кудинова Е.Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.27, 2012 года.
Бесплатный доступ
Изучены особенности строения и расположения плаценты у 850 беременных женщин с недифференцированными формами мезенхимальной дисплазии (МД) - 524 пациентки и без МД - 326 пациенток. Морфофункциональное состояние плаценты у женщин с недифференцированными формами МД имело особенности, характеризующие недостаточность приспособительных возможностей фетоплацентарного комплекса. Незрелость ворсин и признаки инфицирования плаценты у пациенток с МД сочетались с высокой частотой низкого прикрепления плаценты в полости матки, что неблагоприятно сказывалось на функционировании фетоплацентарного комплекса.
Мезенхимальная дисплазия, плацентарная патология
Короткий адрес: https://sciup.org/14919795
IDR: 14919795 | УДК: 616007.17-055.25:611.018.2+618.175:612.661:572.7:618.36
Текст научной статьи Особенности строения и расположения плаценты у пациенток с мезенхимальной дисплазией
В последнее время внимание многих исследователей привлечено к особенностям функционирования плаценты у женщин с аномалиями развития и дисфункциями сердечно-сосудистой системы (пролапс митрального клапана, вегето-сосудистые дисфункции, нарушения сердечного ритма). Итогом нарушения структуры и функции плаценты является недостаточный рост и развитие плода. Информация о состоянии плаценты в результате гистологической экспертизы позволяет уточнить пато- физиологические механизмы формирования акушерских осложнений у матери и перинатальных отклонений у плода [13]. Известно, что носительство протромбогенных аллельных полиморфизмов у женщин обусловливает склонность как к формированию тромбозов, так и к неудачам беременности [2, 9–11]. Возникающие гемореологические нарушения при осложнениях беременности проявляются в виде обширных кровоизлияний и тромбозов межворсинчатого пространства плаценты, гиповаскуляризации ворсин, очагов фиброза и массивных отложений кальцификатов [1, 3]. В ответ на ишемию и гипоксию тканей плацента производит значительное количество цитокинов, способствующих активации и дисфункции эндотелия. Z. Parveen и соавт. (2007) установили, что при гипоксии фибробласты стимулируются производить повышенное содержание волокон соединительной ткани с последующим увеличением продукции сосудистого эндотелиального фактора роста и макрофагов, ведущих к ангиогенезу [14]. Известен феномен плацентарной мезенхимальной дисплазии, когда усиление ангиогенеза может играть важную роль в развитии сосудистых мальформаций в плаценте [12, 14]. При этом состоянии постепенно развиваются вторичные нарушения кровообращения, дисбаланс и обеднение васкуляризации в диспла-стических ворсинах. E. Jauniaux и соавт. (1997) обнаружили кистозные полости, расположенные глубоко в плацентарной паренхиме, увеличение толщины плаценты в начале беременности, а также ретрохориальные гематомы, аневризмы и мальформации сосудов наряду с высокой частотой гипотрофии плода у таких пациенток [7]. В исследованиях В.И. Краснопольского, С.В. Новиковой (2007) в плацентах у женщин с МД выявлена редукция межворсинчатого пространства и значительное уменьшение размеров капиллярной сети ворсин, массивные отложения фибриноида и почки роста плаценты, что в конечном итоге приводит к формированию плацентарной недостаточности. По данным И.С. Сидоровой (2007), существенную роль в повреждении эндотелия сосудов и в развитии чрезмерного провоспалительного ответа на беременность (иммунного эндотелиоза) оказывают аутоиммунные механизмы. При этом наблюдается повышенная проницаемость плацентарного барьера в результате инфекций и образование депозитов, содержащих комплемент и иммунные комплексы в эндотелиоцитах и субэндотелиальном слое спиральных артерий, что способствует ангиогенезу [4, 5, 15]. С ранних сроков беременности процесс миграции и инвазии трофобласта регулируется гормонами, факторами роста, цитокинами, адгези-нами и ферментами. Нарушение баланса между анти- и инвазивными факторами в децидуальном слое и возникновение дестабилизации процессов развития сосудистой сети матки во время беременности проявляется изменением глубины распространения трофобласта. Снижение васкуляризации субплацентарной зоны при низком расположении или предлежании плаценты [7] и неполноценная плацентация способствуют возникновению эндоте-лиопатии [1, 3]. Раннее выявление и прогнозирование плацентарных нарушений позволяет провести мероприятия по своевременному улучшению плацентарного кровотока, в связи с чем актуально рассмотрение данного вопроса.
Цель исследования: изучение особенностей строения и расположения плаценты у беременных с недифференцированными формами мезенхимальной дисплазии (МД).
Материал и методы
Изучено течение беременности, особенности морфологического строения плаценты у 850 беременных, проживающих на территории Алтайского края (рис. 1). К критериям включения в группу обследования отнесены наличие недифференцированных форм МД, нарушения менструального цикла (НМЦ) с момента менархе, возраст 18–24 лет. Критериями исключения были определены аномалии развития репродуктивных органов, синдром поликистозных яичников и хромосомные нарушения. Верификация диагноза МД устанавливалась при наличии отягощенной наследственности по дисплазии соединительной ткани, наличии одного большого и одного малого критерия из разных систем органов. При отсутствии семейного анамнеза для диагностики МД определялась заинтересованность не менее трех систем органов: как минимум, два больших критерия и один малый критерий из разных систем. Диагностика фенотипических и локомоторных проявлений МД осуществлялась в ходе клинического обследования пациенток с учетом критериев выраженности дисплазии соединительной ткани [8]. У пациенток групп сравнения во время беременности исследована молекулярно-генетическая структура про-тромбогенных аллельных генов 5,10-метилентетрагидро-фолатредуктазы MTHFR(677T), ингибитора активатора плазминогена 1-го типа PAI-1 (675 5G/4G), фактора V Лейден (Arg506Gln), фактора II протромбина (G20210A).
Эхографическое обследование у беременных проводилось на аппарате “HAWC-2102” путем определения изображения органов малого таза женщины и органов плода в серошкальном В-режиме, оценки ЦДК-кровото-ка и допплерометрии в сосудах маточно-плацентарного русла пациентки и средней мозговой артерии, аорте, артерии пуповины плода в сроки беременности 22–24 и 32–34 недель. Выявление инфекционных возбудителей генитального тракта осуществлялось методом полимераз-
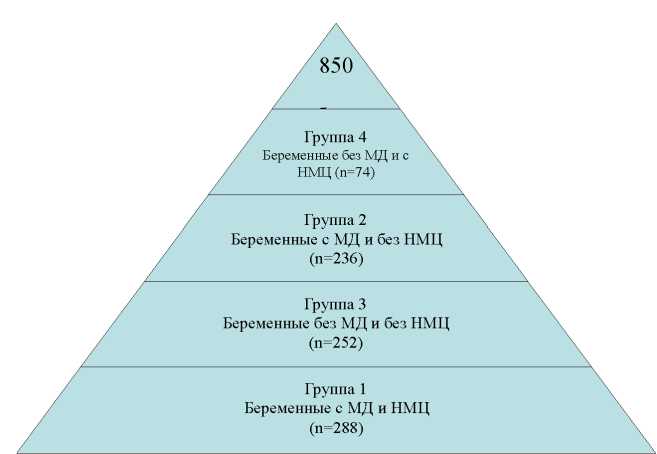
Рис. 1. Дизайн исследования ной цепной реакции. Плаценты женщин, у которых произошли роды в сроке 39-40 недель, исследовали с помощью визуальных и микроскопических методик. Морфологическое исследование последов проводили с использованием гистологического исследования при окраске гематоксилин-эозином. По доминирующему типу строения ворсин диагностировали степень морфологической зрелости плаценты с учетом классификации вариантов незрелости этого органа [1].
Пациенток разделили на четыре группы: 1-я – 288 беременных с недифференцированными формами МД и НМЦ с момента менархе. Вторая группа состояла из 236 беременных с недифференцированными формами МД и физиологическим ритмом менструаций (ФМ) с момента менархе. В 3-ю группу включены 252 беременных с ФМ в анамнезе; 4-я группа состояла из 74 беремен ных с НМЦ в пубертатном анамнезе. Проведение научно-исследовательской работы разработано в соответствии с Хельсинкской декларацией Всемирной ассоциации “Этические принципы проведения научных медицинских исследований с участием человека” с поправками 2000 г. и Правилами клинической практики в Российской Федерации”, утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266. Все лица, участвующие в исследовании, дали информированное согласие на участие в исследовании. Научно-исследовательский проект был утвержден 30.11.2009 г., протокол № 10, и соответствовал этическим стандартам локального биоэтического комитета при ГБОУ ВПО АГМУ Минздравсоцразвития России.. Статистическая обработка полученных данных проводилась с помощью пакета компьютерных программ STATISTICA 7.0. В случаях нормального распределения признаков, а также равенства выборочных дисперсий для сравнения использовали t-критерий Стьюдента. Кроме того, использовались непараметрические статистические критерии. В случае большого объема выборок, когда наблюдаемые величины были выражены в %, использовался Z-критерий для долей (тесты расхождения). Когда наблюдения были представлены частотами, применялся χ-критерий с поправкой Йетса при условии, что частота встречаемости была более 5, либо точный критерий Фишера – при условии, что частота встречаемости была менее 5. За уровень статистической значимости различий принимали значение p<0,05.
Результаты
Каждая третья пациентка 1 и 2-й групп имела синдром вегетативной дисфункции, который рассматривается как обязательный компонент диспластического фенотипа; торакодиафрагмальный синдром в виде деформаций грудной клетки, деформаций позвоночника (сколиозы, кифосколиозы, гиперлордозы); нарушения органов зрения (астигматизм, миопия). Каждая шестая беременная имела варикозную болезнь нижних конечностей. Средний возраст обследованных женщин был идентич-
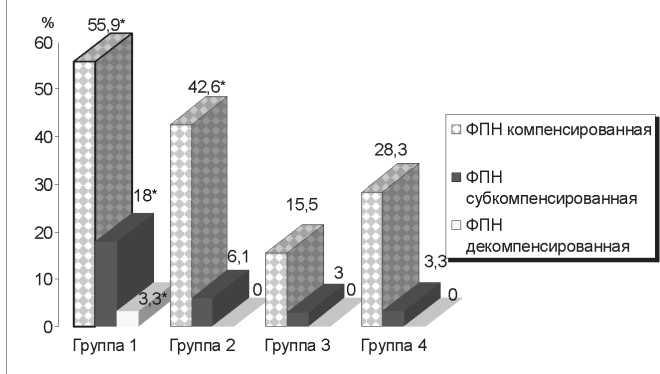
Рис. 2. Частота фетоплацентарной недостаточности (ФПН) у женщин в зависимости от наличия недифференцированных форм МД: * – различия между 1 и 3-й группами, а также 2 и 3-й группами статистически значимы при p<0,001
ным и составил 22,93±3,86 года в 1-й группе, 22,54±3,52 года – во 2-й группе, 22,80±3,16 и 22,46±3,54 года – в 3 и 4-й группах соответственно. Две трети пациенток с недифференцированными формами МД и НМЦ в анамнезе имели отягощенный семейный тромботический анамнез (72,7%) в отличие от пациенток остальных трех групп, у которых частота этого показателя была в три раза ниже и составила 24,8, 23,7 и 27,5% соответственно (p<0,0001).
У каждой второй пациентки с недифференцированными признаками МД установлена компенсированная (рис. 2), у каждой пятой пациентки – суб- или декомпенсированные формы плацентарной недостаточности. Несоответствие фетометрических показателей размеров плода предполагаемому гестационному сроку беременности, отклонения в значениях плацентографии и характере гемодинамики в маточных артериях и сосудах плода явились независимыми критериями подтверждения плацентарной недостаточности. Выявлена лишь слабая корреляционная связь между носительством протромбо-генных аллельных полиморфизмов у пациенток и инволютивно-дистрофическими изменениями и кальцината-ми в плаценте.
В то же время установлено, что у каждой второй беременной с недифференцированными формами МД и НМЦ в анамнезе встречалось более двух дефектов в генах, кодирующих функцию белков свертывания крови в сравнении с меньшим показателем в 2, 3, 4-й группах (табл. 1). Осложненное течение беременности в виде наклонности к тромбозам проявилось у них угрозой выкидыша с формированием ретрохориальной гематомы в ранних сроках беременности, преждевременной отслойкой нормально расположенной плаценты (2,4%) в более поздних сроках беременности (табл. 2). Во 2, 3, 4-й группах данные осложнения беременности выявлялись реже. Кроме того, в периоде плацентации (9–12 недель) более чем у половины пациенток 1-й группы наблюдалось краевое или низкое прикрепление хориона в полости матки, что свидетельствовало о нарушениях в процессах имплантации бластоцисты в результате иммунопатологических и тромбофилических осложнений . При этом частота па-
Таблица 1
Аллельные протромбогенные полиморфизмы: MTHFR (677Т), PAI-1 (-675 5G/4G), мутация фактора V Лейден (Arg506Gln), мутация фактора II (G20210A) у беременных в зависимости от наличия недифференцированных форм МД
|
Частота аллельных полиморфизмов сыворотки крови |
1-я группа (n=121) |
2-я группа (n=49) |
3-я группа (n=46) |
4-я группа (n=26) |
p |
|
Полиморфизм MTHFR (677Т), % |
66,1 |
46,9 |
36,9 |
19,2 |
p1–2<0,02p1–3<0,001p1–4, 2–4<0,0001 |
|
Полиморфизм PAI-1(-675 5G/4G),% |
69,4 |
67,3 |
60,9 |
65,4 |
|
|
Мутация фактора V Лейден (Arg506Gln), % |
11,6 |
2,0 |
4,3 |
0 |
p1–2<0,04 |
|
Фактор II (G20210A),% |
4,1 |
2,0 |
0 |
3,8 |
|
|
Один генетический дефект, % |
42,1 |
55,1 |
39,1 |
69,2 |
p 1–4 , 3–4 <0,01 |
|
Два и более генетических дефекта |
51,2 |
36,7 |
23,9 |
11,5 |
p1–3<0,001p1–4<0,0003p2–4<0,002 |
|
Нормозиготы, % |
6,7 |
8,2 |
37,0 |
19,3 |
p1–3<0,0001,p2–3<0,001 |
Таблица 2
Осложненное течение беременности в ранних сроках у женщин в зависимости от наличия недифференцированных форм МД
|
Осложнения беременности в 1-м триместре |
1-я группа (n=245) |
2-я группа (n=115) |
3-я группа (n=200) |
4-я группа (n=60) |
p |
|
Угроза выкидыша Ретрохориальная |
24,1 |
14,8 |
6,0 |
15,0 |
p1–3<0,0001p2–3<0,009p3–4<0,02 |
|
гематома Аномалии |
7,8 |
1,7 |
0 |
0 |
p1–3<0,0001p1–2<0,02 |
|
расположения плаценты |
67,3 |
33,9 |
33,0 |
23,3 |
p1–3<0,0001p1–4<0,0001 |
тологической плацентации и ретро-хориальной гематомы, по результатам исследования, не зависела от количества протромбогенных полиморфизмов или мутаций в геноме у беременных групп исследования. Эпизоды кровотечений и патологическое прикрепление плаценты были достоверно сопряжены с признаками МД у беременных, которые являлись носительницами протромбогенных полиморфизмов генов белков свертывания крови.
Женщины астенического типа телосложения с миопическим нарушением зрения и пролабированием сердечных клапанов наиболее часто имели во время беременности ретрохо-риальную гематому (табл. 3), что привело в последующем к более выраженному страданию их плодов.
У пациенток с недифференцированными формами МД (у каждой вто рой из 1-й группы и у каждой третьей из 2-й группы) наблюдалась персистирующая бактериально-вирусная инфекция. У женщин без признаков МД инфицирование генитального тракта встречалось в 2,5 раза реже. Серозный хориодецидуит, серозный мембранит, мекониефаги
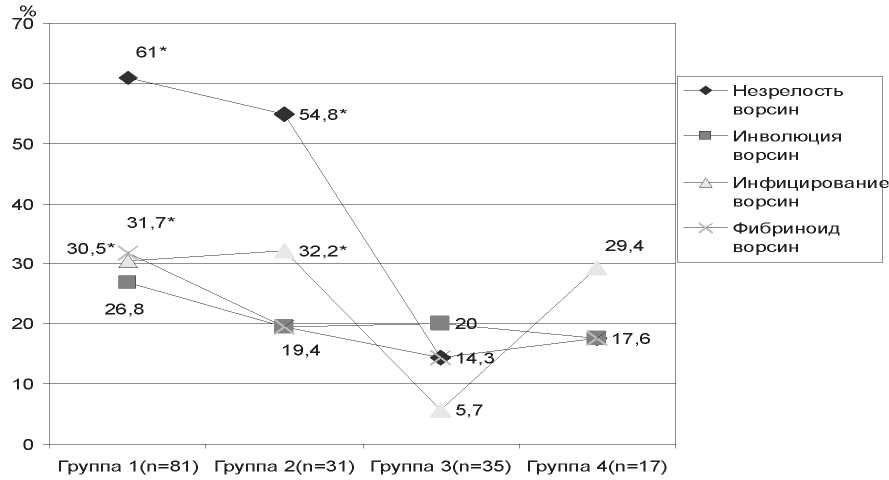
Рис. 3. Характеристика некоторых показателей структуры плаценты у женщин в зависимости от наличия недифференцированных форм МД: * – признак статистически значимых различий. В частоте незрелости ворсин уровень p<0,0001 – между 1 и 3-й группами; а между 1 и 4-й группами – p<0,001. В частоте инфицирования ворсин – между 1 и 3-й, 2 и 3-й группами – p<0,01. В частоте фибриноида ворсин – между 1 и 3-й группами – p<0,01
как признаки инфицирования плаценты и оболочек вирусами и бактериями, в 1, 2 и 4-й группах более чем в пять раз (p<0,001) превышали частоту таковых в 3-й группе (рис. 3). Эти изменения усугубили имеющуюся у беременных с МД плацентарную недостаточность и привели
Таблица 3
Частота встречаемости ретрохориальной гематомы у беременных в зависимости от признаков МД (n=228)
|
Признаки МД |
χ 2 Пирсона |
Отношение правдоподобия (ОП) |
Критерий значимости Фишера, p |
|
Пролабирование клапанов |
4,126 |
0,583 |
0,386 |
|
Астеническая конституция |
2,745 |
2,316 |
0,168 |
|
Миопия |
0,675 |
0,536 |
0,398 |
к более выраженному антенатальному страданию плода. При оценке компенсаторных возможностей плацент у пациенток групп сравнения установлено, что синцитиальные мосты, почки роста в наибольшем количестве встречались у пациенток, не имевших признаков МД (45,7%), в отличие от плацент женщин с МД в 1 и 2-й группах (35,3 и 35,5%). В то же время признаки гиперваскуляризации терминальных ворсин хориона встречались наиболее часто в плацентах у пациенток 1 и 2-й групп (13,6 и 16,1% соответственно) в сравнении с 3 и 4-й группами соответственно (8,5 и 5,8%). При этом у пациенток с МД выявлено истончение покровного хориального синцития (13,6 и 6,5%), свидетельствующее о недостаточном коллагенообразовании в плаценте, а у беременных из 3 и 4-й групп данный признак встречался реже (2,8 и 3,5%).
Участки гиповаскуляризации терминальных ворсин хориона (1,2 и 3,2%) и явления ангиоматоза (3,7 и 3,2%), ангиопатии (8,6 и 3,2%) в плаценте наиболее часто отмечены среди пациенток с МД, тогда как в 3 и 4-й группах таковых признаков не выявлено. Нарушения микроциркуляции в плаценте привели к недостаточному росту плода. “Маловесный для срока беременности” плод с признаками внутриутробной гипоксии наблюдался у женщин с недифференцированными формами МД в 1-й (29,3%, p<0,001) и 2-й (25,8%, p<0,008) группах, что было более чем в 9 раз чаще по сравнению с пациентками, не имеющими признаков МД (2,8%). В 4-й группе частота этого показателя также оказалась статистически значимо меньшей, составив 11,8%. Средние значения веса новорожденных составили менее 2900 г (2513±56 и 2457±49 г в 1 и 2-й группах; 2900±92 и 2835±91 г – в 3 и 4-й группах). В то же время перинатальные потери (мертворождение и ранняя неонатальная смертность), как маркер декомпенсированной фетоплацентарной недостаточности, установлены в 3,3% случаев в группе пациенток с признаками МД и НМЦ в анамнезе.
Различие морфоструктуры плацент проявилось в сокращении площади межворсинчатого пространства у женщин с недифференцированными формами МД. Прирост объема межворсинчатого фибриноида, очаговая фибриноидная альтерация хориального синцития и ди-стелектазы ворсин хориона выявлены в плацентах у каждой второй пациентки с МД на фоне значительного отставания формирования ворсинчатого дерева. Кроме того, у женщин с МД в 3,7% случаев выявлены псевдоинфаркты в плацентах, в остальных группах данные изменения отсутствовали. В плацентах женщин 1 и 2-й групп отмечены нарушения ветвления, созревания ворсин, морфология незрелой плацентарной ткани терминальных и промежуточных ворсин, в то время как в 3 и 4-й группах частота этих изменений была реже (p<0,001).
Обсуждение
Нарушения формирования и функции фетоплацен-тарного комплекса у женщин с недифференцированными формами МД и протромбогенными аллельными полиморфизмами проявляются с ранних сроков беременности. При слабой корреляционной связи между носительством протромбогенных генов и незрелостью и инволютивными изменениями в ворсинах отмечено, что именно сочетание МД с носительством протромбоген-ных аллельных полиморфизмов у беременных обусловило высокую частоту аномалий расположения плаценты, угрозы самопроизвольного выкидыша и ретрохори-альной гематомы. При проводившейся на протяжении беременности комплексной терапии, способствующей улучшению маточно-плацентарного кровотока, у беременных с МД недостаточность компенсаторных механизмов оказалась наиболее выраженной в сравнении с пациентками 3 и 4-й групп. В меньшем количестве у них формировались почки роста в плацентах, чаще наблюдалось диссоциированное созревание ворсин, чередование участков гиперваскуляризации с зонами гиповаскуляризации плаценты. Наибольший прирост объема межворсинчатого фибриноида и появление псевдоинфарктов сочетались у них с уменьшением площади межворсинчатого пространства и отставанием созревания терминальных ворсин в сравнении с пациентками без признаков МД. Гипоперфузия и гипоксия маточно-плацентарного русла на фоне проникновения микробных агентов в плацентарную ткань повлекла за собой у пациенток с МД развитие сосудистой воспалительной реакции и активизации инволютивных процессов, проявившихся увеличением кальцификатов в плаценте. Возникшие гиперкоагуляционные сдвиги в кровотоке беременных женщин с МД и протромбогенными аллельными полиморфизмами реализовались наличием множества инфарктов плаценты и обедненного кровотока в данном органе, что в последующем привело к ограничению роста и веса их плодов, а в 3,3% случаев – к неблагоприятному исходу беременности.
Заключение
Таким образом, плаценты у женщин с недифференцированными формами МД характеризовались признаками первичной (незрелость ворсинчатого дерева к окончанию срока доношенной беременности) и вторичной (воспалительные и инволютивно-дистрофические изменения) хронической плацентарной недостаточности. Краевое или низкое прикрепление хориона к стенкам матки у пациенток с МД и протромбогенными аллельными полиморфизмами явилось структурной основой для развития плацентарной недостаточности субкомпенси-рованной и декомпенсированной формы, что в последующем способствовало ухудшению состояния их детей при рождении.
Список литературы Особенности строения и расположения плаценты у пациенток с мезенхимальной дисплазией
- Милованов А.П. Патология системы матьплацентаплод. -М.: Медицина, 1999. -С. 274-310.
- Момот А.П. Патология гемостаза. -СПб.: ФормаТ, 2006. -209 с.
- Сидельникова В.М. Привычная потеря беременности. -М.: ТриадаХ, 2002. -304 c.
- Сидорова И.С., Макаров И.О. Фетоплацентарная недостаточность: клиникодиагностические аспекты. -М.: ЗнаниеМ, 2000. -127 с.
- Фёдорова М.В. Плацентарная недостаточность//Акушерство и гинекология. -1997. -№ 5. -С. 40-43.
- Краснопольский В.И., Новикова С.В., Савельев С.В. Определение роли коллагена в формировании плацентарной не достаточности//Российский вестник акушерагинеколога. -2007. -№ 5. -С. 17-23.
- Кузьмин В.Н. Фетоплацентарная недостаточность: проблема современного акушерства//Лечащий врач. -2011. -№ 3. -С. 2-7.
- Смольнова Т.Ю., Буянова С.Н., Савельев С.В. Фенотипический симптомокомплекс дисплазии соединительной ткани у женщин//Клиническая медицина. -2003. -№ 8 -С. 42-47.
- Bare S., Poka R., Balogh I. Factor V Leiden as a risk factor for miscarriage and reduced fertility//Aust. N. Z. J. Obstet. Gynecol. -2000, May. -Vol. 40 (2). -P. 186-190.
- Chua B.G., Burrows R.F. Prothrombin G20210A mutation is not associated with recurrent miscarriages//Aust. N. Z. J. Obstet. Gynecol. -2002, April. -Vol. 42 (2). -P. 167-169.
- Grandone E., Margaglione M. Inherited thrombophilia and gestational vascular complications//Best Pract. Res. Clin. Haematol. -2003. -Vol. 16, No. 2. -P. 321-332.
- Jauniaux E., Nicolaides Х., Hustin J. Perinatal function with mesenchymal dysplasia//Placenta. -1997. -Vol. 18. -P. 701-706.
- Lyall F. Mechanisms regulating cytotrophoblast invasion in normal pregnancy and preeclampsia//Aust. N. Z. J. Obstet. Gynecol. -2006, Aug. -Vol. 46, (4). -P. 266-273.
- Parveen Z., TongsonIgnacio J., Fraser C. et al. Placental mesenchymal dysplasia//Arch. Pathol. Lab. Med. -2007, Jan. -Vol. 131 (1). -P. 7.
- Robinson J.S., Seamark R.F., Owens J.A. Placental Function//Aust. N. Z. J. Obstet. Gynecol. -1994, June. -Vol. 34 (3). -P. 240-246.


