Особенности течения CLOCC-синдрома у больной в-лимфобластной лимфомой. Клиническое наблюдение
Автор: Терехова А.Ю., Галицына А.Б., Челмаков А.М., Фалалеева Н.А., Шуваев В.А., Даниленко А.А., Гераськина М.М., Агабабян Т.А., Рипп В.О., Манаенков Д.А., Иванов С.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.24, 2025 года.
Бесплатный доступ
Введение. Синдром цитотоксического поражения мозолистого тела (CLOCC-синдром) представляет собой редкую неврологическую патологию, патогенез которой изучен не в полной мере. CLOCC-синдром, развивающийся у онкологических пациентов, является серьезной сопутствующей патологией, осложняющей лечение основного заболевания. Описание клинического случая. Пациентка Н., 34 года, обратилась в августе 2023 г. в МРНЦ им. А.Ф. Цыба с установленным по месту жительства диагнозом: плазмобластная лимфома IV стадии. Учитывая тяжесть состояния пациентки, незамедлительно была инициирована цитостатическая противоопухолевая терапия в режиме EPOCH с интратекальным введением цитостатиков с целью профилактики нейролейкемии. На фоне манифестировавших в процессе лечения инфекционных осложнений в виде фебрильной нейтропении и энтероколита возникли неврологические расстройства, которые в совокупности с МР-картиной трактовались как CLOCC-синдром. Данные изменения регрессировали в течение нескольких дней в процессе лечения десмопрессином, массивной дегидратационной терапии растворами кристаллоидов и глюкозы. После пересмотра гистологических препаратов биоптата пораженного лимфатического узла с места жительства при проведении морфологического и иммуногистохимического исследований картина соответствовала В-лимфобластной лимфоме, вследствие чего была скорректирована противоопухолевая терапия. Заключение. В качестве причины развития CLOCC-синдрома у этой больной можно предполагать совокупность повреждающего действия цитостатиков на ткани головного мозга и нарушения баланса электролитов.
Онкология, онкогематология, неврология, лимфома, неходжкинская лимфома, CLOCC-синдром
Короткий адрес: https://sciup.org/140309153
IDR: 140309153 | УДК: 616-006.441 | DOI: 10.21294/1814-4861-2025-24-2-169-176
Текст научной статьи Особенности течения CLOCC-синдрома у больной в-лимфобластной лимфомой. Клиническое наблюдение
Синдром цитотоксического поражения мозолистого тела (сytotoxic lesions of the corpus callosum, CLOCC-синдром) представляет собой комплекс неврологических нарушений, обусловленных поражением мозолистого тела. Мозолистое тело состоит из участков белого вещества головного мозга, ответственных за межполушарную коммуникацию и координацию. Анатомически в мозолистом теле различают терминальную пластинку, клюв, ствол, колено и утолщение [1]. Транзиторные поражения мозолистого тела с уменьшением диффузионного сигнала при МРТ впервые зарегистрированы у больных эпилепсией в конце 1990-х – начале 2000-х гг. [2–4]. Позже схожая картина была обнаружена у пациентов, инфицированных ротавирусом, кишечной палочкой, вирусом кори и сальмонеллами [5, 6]. В отличие от первичного поражения мозолистого тела при энцефаломиелите, острой артериальной ишемии, мультиформной глиобластоме и др., CLOCC-синдром является следствием только вторичного поражения мозолистого тела, которое, как правило, обратимо.
Развитие CLOCC-синдрома обусловлено нарушением биохимических процессов в головном мозге, поддерживаемых сложным механизмом взаиморегулирования уровня цитокинов [7, 8]. При травмах, инфекциях и воспалении активизирующиеся макрофаги выделяют цитокины воспаления – интерлейкины IL-1 и IL-6, запуская каскад, который, в свою очередь, приводит к активации моноцитов, также выделяющих IL-1 и IL-6. Поврежденные цитокинами клетки эндотелия сосудов начинают вырабатывать фактор некроза опухоли (TNF-α), усугубляющий течение воспалительного процесса. Кроме того, в результате повреждения клеток эндотелия гематоэнцефалический барьер теряет способность предохранять головной мозг от проникновения ксенобиотиков [9, 10]. Действие IL-6 на астроциты вызывает высвобождение и блокирование обратного захвата глутамата, повышая его концентрацию во внеклеточном пространстве [11]. Одновременно с этим происходит выделение цитокинов макрофагами центральной нервной системы (ЦНС), что еще больше усугубляет патологический процесс. Концентрация внеклеточного глутамата возрастает в десятки раз, что приводит к обратному поступлению воды в астроциты и нейроны и, как следствие, развитию цитотоксического отека [12].
Повышенная уязвимость мозолистого тела по сравнению с другими структурами головного мозга обусловлена тем, что нейроны, астроциты и дендроциты мозолистого тела имеют гораздо большую плотность рецепторов цитокинов, глутамата, активных аминокислот и токсинов [13]. Именно это обстоятельство является причиной избирательного поражения мозолистого тела по сравнению с другими структурами головного мозга [14–16]. К наиболее частым причинам развития CLOCC-синдрома относятся медикаментозная терапия, злокачественные новообразования, инфекционные процессы, субарахноидальные кровоизлияния, метаболические нарушения, травмы головы. Таким образом, CLOCC-синдром является редкой и грозной с точки зрения прогноза патологией, при столкновении с которой крайне важна максимально корректная терапевтическая тактика. Представленный нами клинический случай в полной море отражает этапы лечения, необходимые для разрешения данного состояния.
Описание клинического случая
У больной Н., в возрасте 34 лет, в мае 2023 г. появились боли в области спины. При МРТ органов грудной полости обнаружена лимфаденопатия шейных лимфатических узлов и перелом 12-го грудного позвонка. В августе 2023 г. по месту жительства выполнена биопсия шейного лимфатического узла. Морфо-иммуногистохимическая картина соответствовала плазмобластной лимфоме. Распространенность опухолевого процесса, согласно данным ПЭТ-КТ, включала в себя поражение шейных, внутригрудных, подмышечных, субпекторальных, абдоминальных, забрюшинных лимфатических узлов, почек, щитовидной железы, поджелудочной железы, миокарда, многофокусное поражение костей с остеодеструкцией.
В сентябре 2023 г. больная поступила в отделение лучевой и лекарственной терапии гемобластозов МРНЦ для противоопухолевого лечения. Состояние на момент госпитализации расценивалось как тяжелое, что было обусловлено распространенностью опухолевого процесса и его осложнениями в виде выраженной дыхательной недостаточности, вызванной массивным гидротораксом, симптомами опухолевой интоксикации, выраженным болевым синдромом. Данных за поражение костного мозга по результатам миелограммы и иммунофенотипирования получено не было. Неврологическая симптоматика отсутствовала, менингеальных знаков не обнаруживалось. В биохимическом анализе крови уровни натрия, калия, кальция находились в пределах референсных значений. При исследовании ликвора обнаружен цитоз – 6 кл/мкл. Таким образом, был сформулирован диагноз: плазмобластная лимфома IVА с поражением шейных, внутригрудных, левых подмышечных, левых субпекторальных, абдоминальных и забрюшинных лимфатических узлов, почек, щитовидной железы, поджелудочной железы, миокарда, с многофокусным поражением костей скелета, центральной нервной системы. Незамедлительно было инициировано начало противоопухолевой терапии по схеме EPOCH.
С 23.09.23 по 27.09.23 проведен 1-й цикл химиотерапии. Проведено лечение нейролейкемии, состоявшее из 4 последовательных интратекальных введений цитостатиков (метотрексат – 15 мг, цитарабин – 30 мг) и дексаметазона – 4 мг. Ликвидация цитоза достигнута в результате первого введения противоопухолевых препаратов.
На 6-е сут после завершения цикла состояние пациентки резко ухудшилось. На фоне развившейся нейтропении появилась лихорадка, диарея (до 7 раз в сут), рвота, боли в животе, гипотензия. Диагностированы энтероколит, эрозивно-язвенный эзофагит, подтверждённые эндоскопически. Проводилась антибактериальная терапия ме-ропенемом, ванкомицином. Течение заболевания осложнилось развитием гранулоцитопении IV степени, тромбоцитопении III степени, анемии III степени. Проводилась стимуляция грану-лоцитопоэза с помощью подкожных инъекций филграстима, продолжалась назначенная анти-биотикотерапия, трансфузия тромбоцитарной взвеси и эритроцитарной массы.
На 11-е сут после завершения цикла химиотерапии отмечалось резкое ухудшение состояния в виде нарушения сознания вплоть до оглушения, дезориентации в пространстве и времени, отсутствия критики к собственному состоянию, выраженной ригидности задних мышц шеи, в связи с чем она была переведена в отделение интенсивной терапии. После осмотра неврологом констатировано сочетание PRES-синдрома (синдром задней обратимой энцефалопатии) и осмотического демиелинизирующего синдрома. По данным МРТ головного мозга органической патологии не обнаружено. В крови отмечалось повышение уровня натрия до 180 ммоль/л. С учётом признаков дегидратации состояние было расценено как гиповолемическая гипернатриемия на фоне многократной рвоты. Проводилась массивная инфузионная терапия растворами кристаллоидов и 5 % глюкозы, однако коррекция дефицита жидкости сопровождалась развитием полиурии (6300 мл светлой мочи в сут), сохранялась гипернатриемия (175 ммоль/л). Был заподозрен несахарный диабет центрального генеза. Проводилась терапия десмопрессином, продолжался диагностический поиск причин нарушения.
При контрольной МРТ головного мозга с контрастным усилением, проведенной через сутки, в области валика мозолистого тела был обнаружен участок цитотоксического отека овоидной формы, размерами 0,9×0,9 см, с присущими ему сигнальными характеристиками: повышенный сигнал на последовательности инверсии-восстановления с подавлением сигнала от жидкости (FLAIR – fluid attenuation inversion recovery), сниженный сигнал на Т1-ВИ (Т1-взвешенные изображения), выраженная рестрикция диффузии на диффузионно-взвешенных изображениях (DWI – diffusion-weighted images) и отсутствие накопления контрастного препарата (рис. 1А). В спинномозговой жидкости, взятой в этот же день, цитоз составил 1 кл/мл. На фоне терапии десмопрессином наблюдалось небольшое снижение концентрации натрия (167 ммоль/л), однако нарушение сознания сохранялось. При очередной MPT, проведенной через 2 сут, участок цитотоксического отека в области валика мозолистого тела увеличился до 1,7×1,4×1,2 см, отмечалось также появление участков с аналогичными сигнальными характеристиками в обеих ножках мозжечка и субкортикальных отделах обеих лобных долей (рис. 1Б). Таким образом, у пациентки имелась клиническая картина CLOCC-синдрома, подтвержденного данными МРТ. При исследовании ликвора относительно полиомавирусов ДНК вируса не обнаружена. На 5-й день от развития неврологической симптоматики наступило быстрое восстановление сознания до ясного, вернулась способность ориентирования в пространстве, време- ни, осознание собственной личности. По данным контрольной МРТ через 7 сут определялся регресс участков цитотоксического отека в ножках мозжечка и лобных долях, уменьшение размеров очага в валике мозолистого тела с регрессией признаков рестрикции диффузии и повышением измеряемого коэффициента диффузии (рис. 1В). Учитывая нормализацию клинической картины, МРТ головного мозга в дальнейшем не проводилась. Наблюдалась нормализация уровня натрия (145 ммоль/л).
После пересмотра гистологических препаратов биоптата пораженного лимфатического узла, полученного по месту жительства, при иммуногистохимическом исследовании в клетках опухоли выявлена экспрессия CD10, PAX5, TdT и не выявлена экспрессия CD1a, CD3, CD34, CD7, что соответствовало картине В-лимфобластной лимфомы. Установлен окончательный диагноз: B-лимфобластная лимфома, BIII-иммуновариант, стадия IVA (по Ann-Arbor) с вовлечением шейных, внутригрудных, левых подмышечных, левых суб-пекторальных, абдоминальных и забрюшинных лимфатических узлов, почек, щитовидной железы, поджелудочной железы, миокарда, с многофокусным поражением костей скелета. С учетом
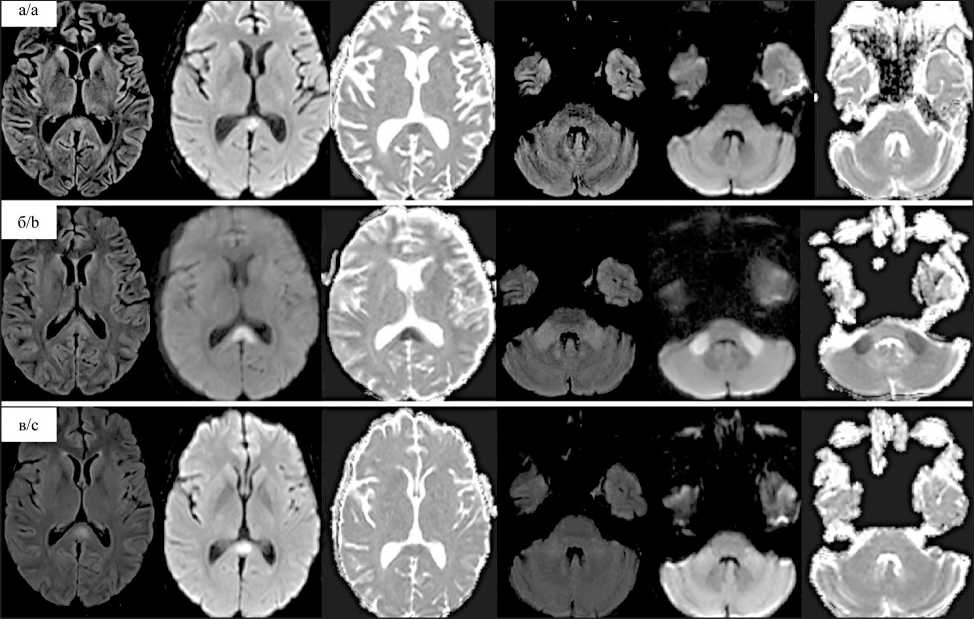
Рис. 1. МРТ-исследование головного мозга: А – первичное МРТ- исследование, при котором визуализируется очаг цитотоксического отека в валике мозолистого тела с умеренной рестрикцией диффузии; Б – исследование через 2 сут: отмечается увеличение размеров очага в валике мозолистого тела, нарастание признаков рестрикции диффузии и появление аналогичных участков в ножках мозжечка; В – контрольное МРТ- исследование через 7 сут на фоне положительной клинической динамики: изменения в ножках мозжечка регрессировали, очаг в мозолистом теле сократился в размерах с частичной регрессией признаков рестрикции диффузии. Примечание: рисунок выполнен авторами
Fig. 1. MRI examination of the brain: A – primary MRI examination, in which the focus of cytotoxic edema in the corpus callosum roller with moderate restriction of diffusion is visualized; B – examination after 2 days: there is an increase in the size of the lesion in the corpus callosum roller, an increase in signs of restriction of diffusion and the appearance of similar areas in the legs of the cerebellum;
С – control MRI examination on day 7 against the background of positive clinical dynamics: changes in the cerebellar pedicles regressed, the focus in the corpus callosum decreased in size with partial regression of signs of restriction of diffusion. Note: created by the authors
диагноза, выраженной клинической картины и прогрессирования заболевания дальнейшее лечение проводилось по схеме Hyper-CVAD/MTX-Ara-C.
Межцикловой период был существенно увеличен в связи с длительной цитопенией. В дальнейшем, 15.01.2024 в гемограмме появились признаки лейкемизации, при исследовании костного мозга среди миелокариоцитов было установлено 80 % патологических В-клеток с иммунофенотипом CD19++CD20-CD45lowCD10+CD38+CD34-TdT-, CD79b-, cyCD79a+, c IgM+, что соответствовало поражению при В-лимфобластной лимфоме. Стремительно нарастали симптомы полиорган-ной недостаточности, что сделало невозможным проведение противоопухолевого лечения, дальнейшее лечение ограничено симптоматической терапией, смерть пациентки наступила от прогрессирования заболевания. В связи с отказом родственников от вскрытия посмертное патологоанатомическое исследование не проводилось.
Обсуждение
Развитие CLOCC-синдрома у данной больной имеет, вероятнее всего, полиэтиологичный генез. Литературные данные свидетельствуют о возможности развития CLOCC-синдрома как на фоне химиотерапии, особенно при интратекальном введении цитостатиков [17], так и при терапии кортикостероидами [18].
Уже первый цикл химиотерапии больной осложнился нейтропенией IV степени, на фоне которой развился энтероколит, сопровождавшийся многократной рвотой и интенсивной диареей. Появление через несколько дней от начала рвоты и диареи неврологической симптоматики было расценено как проявление гиповолемической натриемии вследствие дегидратации. Признаков органического поражения головного мозга по данным МРТ, проведенной на этом этапе, не обнаружено. В литературе описаны случаи развития CLOCC-синдрома на фоне метаболических нарушений с дальнейшим развитием отека мозолистого тела [19–21]. По всей вероятности, патогенетическую роль в этих случаях играет совокупное воздействие меркаптанов, фенолов, жирных кислот и аммиака. Эти вещества вызывают цитотоксическое поражение астроцитов и нейронов, вследствие чего происходит высвобождение цитокинов, стимулирующих повышение уровня глутамата. Появление характерных неврологических симптомов свидетельствует о развивающемся отеке мозолистого тела [19–21]. Необходимо отметить, что при МРТ головного мозга снижение диффузии, отражающее цитотоксический отек, регистрируется только в острой фазе.
Полиурия, развившаяся на фоне инфузионной терапии растворами кристаллоидов и 5 % глюкозы при сохранявшейся гипернатриемии, позволила заподозрить нарушение центральной регуляции баланса жидкости вследствие развития централь- ного несахарного диабета. Появление на 11-е сут после окончания цикла химиотерапии клинических признаков демиелинизирующего синдрома, обнаружение при МРТ отека валика мозолистого тела позволили констатировать наличие CLOCC-синдрома.
Проводившийся нами поиск причин развития CLOCC-синдрома был направлен, прежде всего, на исключение вирусной его этиологии, так как и плазмобластная лимфома, предполагаемая вначале, и В-лимфобластная лимфома часто ассоциируются с ВИЧ-инфицированием. В литературе имеются описания случаев развития демиелинизации с прогрессирующим асимметричным поражением головного мозга при инфицировании JC-вирусом, который часто ассоциируется со СПИД [22]. Схожие МРТ-изменения могут быть обусловлены также прогрессирующей мультифокальной лейкоэнцефалопатией вследствие реактивации ВК-вирусов (полиомавирусы), JC-вируса. Дополнительным основанием для подозрения относительно вирусной этиологии CLOCC-синдрома была существенная лимфоцитопения, развившаяся одновременно с другими цитопениями. Тем не менее ДНК вирусов в ликворе не обнаружено.
Наконец, прогрессирующая демиелинизация была зарегистрирована у пациентки в периоде прерывания противоопухолевого лечения, что позволяло предполагать развитие опухолевой инфильтрации головного мозга, не регистрируемой с помощью МРТ. Связь между развитием CLOCC-синдрома и злокачественными опухолями головного мозга, непосредственно не затрагивающими мозолистое тело, хорошо представлена в литературе [23–25]. Развитие CLOCC-синдрома при опухолях ЦНС обусловлено, вероятно, инфильтрацией злокачественными клетками оболочек мозга, что приводит к выбросу цитокинов в ликвор [23]. Таким образом, у пациентки имелось сочетание центрального несахарного диабета и CLOCC-синдрома. Этиология развития этих двух осложнений противоопухолевой терапии связана, по все вероятности, прежде всего с интратекаль-ным введением метотрексата, что подтверждается имеющимися в литературе данными [26].
Заключение
Развитие CLOCC-синдрома у онкологического больного является редким и серьезным осложнением лечения, вынуждающим вносить существенные коррективы в терапию основного заболевания. Его манифестация проявляется тяжелой симптоматикой с плохо предсказуемым исходом, поэтому ведение пациента с CLOCC-синдромом, протекающим на фоне онкологического заболевания, является очень сложной задачей. В представленном нами клиническом примере продемонстрирована тактика лечения такого больного, которая может оказаться полезной для практикующих врачей-онкологов и гематологов.


