От идиопатического фиброзирующего альвеолита к идиопатическому легочному фиброзу(часть II)
Автор: Аверьянов Александр Вячеславович, Лесняк Виктор Николаевич
Журнал: Клиническая практика @clinpractice
Рубрика: Мнение эксперта
Статья в выпуске: 4 (28), 2016 года.
Бесплатный доступ
Вторая часть аналитического обзора посвящена особенностям клинической картины, течения и диагностики идиопатического легочного фиброза. Большое внимание уделено специфическим симптомам при компьютерной томографии, позволяющим поставить диагноз, не прибегая к биопсии легкого. Обсуждены современные подходы к инвазивной диагностике, перспективы использования криозондов.
Идиопатический легочный фиброз, компьютерная томография высоких раз- решений, криобиопсия
Короткий адрес: https://sciup.org/143164618
IDR: 143164618
Текст научной статьи От идиопатического фиброзирующего альвеолита к идиопатическому легочному фиброзу(часть II)
Идиопатический легочный фиброз – специфическая форма хронической прогрессирующей фиброзирующей интерстициальной пневмонии неизвестной этиологии, встречающаяся преимущественно в пожилом возрасте, ограниченная легкими и ассоциированная с гистологическим и/или рентгенологическим паттерном обычной интерстициальной пневмонии [1].
ИЛФ – наиболее распространенная форма идиопатических интерстициальных пневмоний, составляющая от 50 до 60% случаев в данной группе заболеваний [2]. Эпидемиологические исследования показали, что, например, в американской популяции распространенность ИЛФ колеблется от 14 до 42,7 на 100 000 населения, причем наблюдается повсеместный рост заболеваемости в последние 20 лет [3]. Недавно завершившийся крупный эпидемиологический проект в Канаде выявил распространенность на уровне 41,8, а заболеваемость 18,7 случаев ИЛФ на 100000 населения [4]. Экстраполируя эти данные на российскую популяцию, можно предположить, что в нашей стране не менее 30000 пациентов страдает данным заболеванием. С учетом увеличения продолжительности жизни населения, эксперты признают, что распространенность ИЛФ будет и дальше увеличиваться. Так, в странах Евросоюза ежегодно диагностируется около 40000 новых случаев ИЛФ [5].
Этиология ИЛФ неизвестна, однако факторы риска заболевания хорошо изучены. К ним относятся: курение, генетические факторы, пожилой возраст (средний возраст около 65 лет), контакт с аэрополютантами, гастроэзофагеальная рефлюксная болезнь, и, возможно, латентные инфекции. Сторонники термина «идиопатический фиброзирующий альвеолит» (ИФА) многократно подчеркивали суще- ственно более молодой возраст пациентов ИФА, не достигающий 50-летнего рубежа. Это связано с тем, что к группе ИФА были отнесены пациенты не только с ИЛФ, но и с неспецифической интерстициальной пневмонией (НИП), «омолодившие» общую статистику.
Морфология
Гистологическая картина ИЛФ соответствует хронической обычной интерстициальной пневмонии (ОбИП), характеризующейся преобладанием диффузного хронического поражения легочного интерстиция респираторных отделов легких, с развитием в них воспаления, патологической репарации и фиброза, приводящих к прогрессирующей дыхательной недостаточности. Крайним выражением развития ИЛФ является формирование «сотового легкого», характеризующегося сочетанием интерстициального фиброза и кистозной трансформацией терминальных и респираторных бронхиол и альвеол [1, 6] У большинства больных уже на момент диагностики ОбИП обнаруживаются поздние изменения по типу «сотового легкого».
Микроскопические проявления начальных изменений при ОбИП укладываются в картину межуточного экссудативного и экссудативнопродуктивного воспаления в сочетании с патологической репарацией и рано формирующимся интерстициальным фиброзом (рис. 1-3).
ИЛФ отличается от других ИИП большей выраженностью повреждения, наличием не cтолько хронического воспаления, сколько патологической репарации и склероза интер-стиция респираторных отделов легких с обра- зованием миофибробластических фокусов. При этом обнаруживаются распространенные, мозаично расположенные фокусы поражения среди неизмененной легочной паренхимы [6]. Чем дольше длится заболевание, тем меньшую площадь занимают сохранившиеся участки.
Воспалительный инфильтрат в интерстиции представлен преимущественно лимфогистиоци-тарными элементами, нередко с примесью нейтрофилов, которые в основном локализуются в просвете альвеол. ОбИП отличается присутствием большого количества особого фенотипического варианта альвеолярных макрофагов моноцитоидного типа с наличием первичных лизосом и отсутствием фаголизосом, а также с развитым шероховатым эндоплазматическим ретикуломом и большим количеством полирибосом. Это указывает на отсутствие в них фагоцитарной активности и усиленный белковый синтез [7].
Патогенез: С современных позиций в основе патогенеза ИЛФ лежит хроническое микроповреждение эпителиальных клеток дыхательных путей с нарушением естественной репарации, эпителиально-мезенхимальной трансформацией, пролиферацией фибробластов и миофибробластов, устойчивых к апоптозу, гиперпродукцией коллагена, фибронектина, и их депонированием в экстрацеллюлярном матриксе [8, 9] В отличие от других форм идиопатических интерстициальных пневмоний, интерстициальное воспаление не является ведущим патогенетическим звеном ИЛФ, с чем связаны меньшие успехи в лечении стероидами и цитостатиками, а также характер-
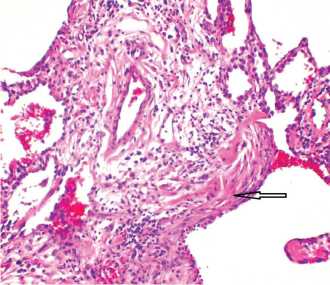
Рис. 1. ИЛФ. Стадия «сотового легкого». Участок склероза интерстиция с миофибробластическим фокусом (стрелка). Окраска гематоксилином и эозином. Х200. (из архива проф.
Е.А. Коган)
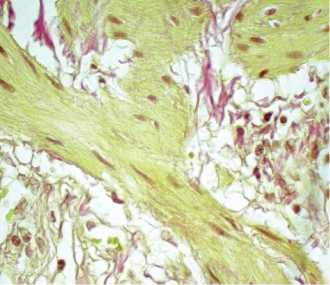
Рис. 2. ИЛФ. Обычная интерсти циаль-ная пневмония. Зона бронхиолоальвеолярной трансформации с пролиферацией миофибробластов и формированием миофибробластичес-кого фокуса (желтого цвета, фуксин-негативный) . Окраска по Ван Гизону. Х200 (из архива проф. Е.А. Коган)
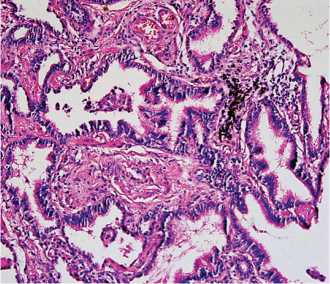
Рис. 3. ИЛФ. Обычная интерстициальная пневмония. Аденоматоз в «сотовом легком» с клетками реснитчатого и цилиндрического эпителия. Окраска гематоксилином и эозином. Х200. (из архива проф. Е.А. Коган)
ная рентгенологическая симптоматика, в которой признаки фиброза преобладают над симптомами интерстициальной инфильтрации.
Клиническая картина и течение заболевания
Среди клинических симптомов ИЛФ преобладают медленно прогрессирующая одышка и непродуктивный кашель, присутствующие у 80-90% пациентов. На более поздних стадиях кашель нередко приобретает продуктивный характер. В зонах, соответствующих «сотовому легкому», очень часто можно выслушать характерную звучную крепитацию на высоте вдоха. Некоторые исследователи считают, что появление такой крепитации у лиц старше 70 лет должно побудить клинициста рассматривать их как потенциальных больных ИЛФ с последующим выполнением КТВР даже при отсутствии иной симптоматики [10]. У 25-50% пациентов встречается симптом «барабанных палочек» и «часовых стекол», причем он может опережать развернутую клиническую картину. Следует иметь ввиду, что на ранних стадиях болезнь может протекать практически бессимптомно. Несмотря на то, что устоявшееся представление об ИЛФ как неуклонно прогрессирующем заболевании с постоянным падением, хотя и с разной скоростью, функциональных параметров действительно относится к большинству случаев, ряд исследований новых антифиброзных препаратов на значительной популяции пациентов продемонстрировали возможность стабильного статуса отдельных больных без каких-либо лекарственных или иных интервенций [11, 12]. И хотя период наблюдения обычно не превышал 18 месяцев, данный феномен следует учитывать при выборе тактики лечения, особенно на ранних стадиях болезни. Риск обострений при ИЛФ у больных с легким или умеренным снижением ФЖЕЛ также невысок. Данные события развиваются не более чем у 10% таких пациентов. Авторитетные эксперты в области изучения ИЛФ считают, что можно выделить несколько вариантов течения болезни – с медленным прогрессированием, когда наблюдается минимальное ежегодное снижение функциональных параметров, либо показатели остаются стабильными на протяжении многих лет; быстро прогрессирующие формы с агрессивным течением и неуклонным нарастанием дыхательной недостаточности и интермиттирующие формы, когда периоды стабильного состояния чередуются с периодами ускоренного падения легочной функции [13]. По-видимому, со временем, будут выделены соответствующие фенотипы ИЛФ по аналогии с фенотипами ХОБЛ с дифференцированным подходом к их лечению. Спонтанных ремиссий при ИЛФ не наблюдается.
С 2007 г. в рамках течения ИЛФ активно обсуждается тема его обострения. Обострение ИЛФ определяет около 40-60% летальности и около 35% случаев госпитализации у пациентов с данным заболеванием [14, 15].
Несмотря на то, что определение обострения ИЛФ и критерии диагноза предполагали его «идиопатический» характер, хорошо известно, что оно может быть спровоцировано вирусными инфекциями, хирургической биопсией легкого, аспирацией, проведением бронхоальвеолярного лаважа [16, 17]. Морфологически при обострении ИЛФ наряду с паттерном ОбИП выявляют картину диффузного альвеолярного повреждения. Современное определение обострения ИЛФ звучит как «острое клинически значимое ухудшение респираторной симптоматики, характеризующееся появлением новых распространенных зон альвеолярного поражения» [18]. На КТВР данное состояние представлено в виде новых двусторонних зон матового стекла и/или консолидации на фоне рентгенологического паттерна ОбИП.
Факторами риска обострения ИЛФ являются, прежде всего, низкие исходные функциональные параметры – ФЖЕЛ, диффузионная способность легких, дистанция 6-минутной ходьбы, а также легочная гипертензия, низкие показатели артериальной оксигенации, присутствие легочной гипертензии, ускоренное падение ФЖЕЛ [19]
Диагноз
В силу недостаточных знаний врачей о данной патологии и не слишком широкой распространенности болезни, даже в условиях развитых стран более 50% случаев ИЛФ вначале расцениваются как иные нозологические формы, причем задержка в постановке точного диагноза обычно составляет 2-3 года [20]. Современная диагностическая концепция ИЛФ предлагает дифференцированный подход к использованию инвазивных и неинвазивных методов диагностики (рис.7). Данный алгоритм на первом этапе предусматривает тщательный сбор анамнеза у пациента, имеющего характерные клинические проявления, с целью исключения других интерстициальных заболеваний легких, обусловленных экзогенными факторами (экзогенный аллергический альвеолит, профессиональ-
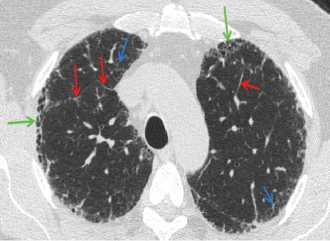
Рис. 4. Ретикулярные изменения у пациента с ИЛФ . Утолщение междольковых перегородок (красные стрелки),утолщение внутридольковых перегородок (синие стрелки); сотовая дегенерация (зеленые стрелки)
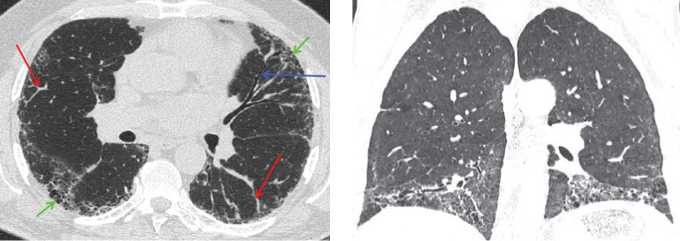
Рис. 6. Сотовая дегенерация с уменьшением объемов нижних долей легких. Справа видны тракционные бронхоэктазы. В верхних отделах ретикулярные изменения выражены незначительно
Рис. 5. Ретикулярные изменения у пациента с ИЛФ. Перибронховаскуляр-ные утолщения (красные стрелки); тракционный бронхоэктаз (синяя стрелка); субплевральная сотовая дегенерация (зеленые стрелки)
ные заболевания, лекарственные препараты), системными заболеваниями соединительной ткани (ревматоидный артрит, системная склеродермия и др.), а также саркоидоза.
Следующим шагом является анализ данных КТВР, с выделением 3-х групп рентгенологических признаков, в разной степени характерных для обычной интерстициальной пневмонии (ОИП) – морфологического субстрата ИЛФ (табл.). К ним относятся – ретикулярные симптомы, сотовая дегенерация и особенности распределения патологических изменений с преобладанием субплевральных и заднебазальных зон. Ретикулярный паттерн включает в себя один или несколько ренгенологических феноменов: утолщение междольковых перегородок; утолщение внутридольковых перегородок, перибронховаскулярные утолщения, трак- ционные бронхоэктазы и «сотовое легкое» (рис. 4, 5) [21]. Рентгенологический признак «сотового легкого» характеризуется образованием мелких тонкостенных прилежащих друг к другу кист, напоминающих медовые соты (рис. 4, 5). Хотя сотовая дегенерация относится к числу ретикулярных признаков, при ИЛФ она выделяется как отдельный, практически атрибутивный симптом, присутствующий даже на ранних стадиях заболевания.
В случае одновременного присутствия у пациента ретикулярных изменений, «сот», преимущественно с субплевральным, базальным расположением, при отсутствии атипичных признаков, диагноз ИЛФ правомочен без гистологического подтверждения (рис. 6). В начальных стадиях ИЛФ ретикулярные симптомы могут быть еще минимальными, что обычно затрудняет однозначную
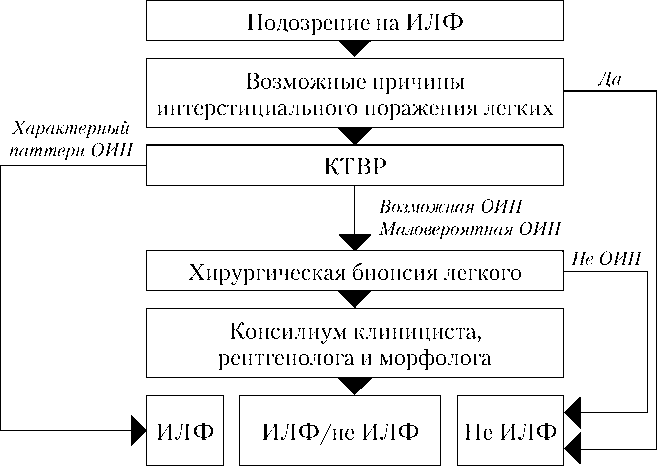
Рис. 7. Алгоритм диагностики при подозрении на ИЛФ [1]
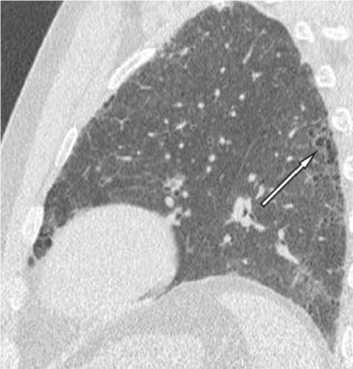
Рис. 8. Начальные проявления ИЛФ у пациента 53 лет. В задних и базальных субплевральных отделах небольшие участки сотовой дегенерации (стрелки)
Таблица
Рентгенологические критерии обычной интерстициальной пневмонии [1]
|
Типичный паттерн ОИП (все 4 признака) |
Возможный паттерн ОИП (все 3 признака) |
Нехарактерный паттерн ОИП (любой из признаков) |
|
Субплевральное, базальное расположение Ретикулярные изменения Участки «сотового легкого» с/без тракционных бронхоэктазов Полное отсутствие нехарактерных для ОИП симптомов (см. 3 столбец) |
Субплевральное, базальное расположение Ретикулярные изменения Полное отсутствие нехарактерных для ОИП симптомов (см. 3 столбец) |
Верхне- или среднедолевая локализация Перибронховаскулярное расположение Распространенные зоны «матового стекла», превышающие зоны ретикулярных изменений Мелкоочаговые изменения (двусторонние, преимущественно в верхних долях), Кисты (множественные, двусторонние, вне зон «сотового легкого») Участки повышенной прозрачности/воздушные ловушки (двусторонние, в 3-х или более долях) Участки консолидации |
трактовку (рис. 8 ), тем более что клинически в таких случаях пациенты не чувствуют одышку.
Отсутствие ключевого симптома — участков «сотового легкого» или их атипичная локализация, требует проведения биопсии легкого. Наличие зон «матового стекла» не противоречит диагнозу ИЛФ, однако в данном случае матовость не доминирует над ретикулярными симптомами и прилежит к местам сотовой дегенерации. Преобладание «матового стекла» над ретикулярными и сотовыми зонами вне периода обострения болезни свидетельствует о доминировании интерстициального воспаления над фиброзом, что делает диагноз ИЛФ менее вероятным. Однако «сморщивание» базальных отделов может приводить к появлению симптома «матового стекла», отражающего в данном случае не интерстициальное воспаление, а снижение воздушности паренхимы легких. Для персистирующего течения ИЛФ нехарактерным является появление очаговых и инфильтративных образований в паренхиме легких. Их присутствие означает либо альтернативный диагноз (например, криптогенная организующаяся пневмония), либо появление новой болезни (рак легкого, пневмония и др.).
При ИЛФ может наблюдаться увеличение внутригрудных лимфоузлов, но их размеры редко превышают 1,5 см [22] (рис.9). Неспецифичной, но и нередкой находкой у пациентов ИЛФ может быть эмфизема легких (рис. 10). По данным V. Cottin и соавт., эмфизема обычно локализована в в/долях, в подавляющем большинстве случаев представлена одновременно центрилобулярной и парасептальной формами, у 54% пациентов также имеются буллы, а у 47% — признаки легочной гипертензии [23].
Рентгенологический диагноз ИЛФ бывает особенно затруднен в период обострения заболевания. При этом наряду с классическими
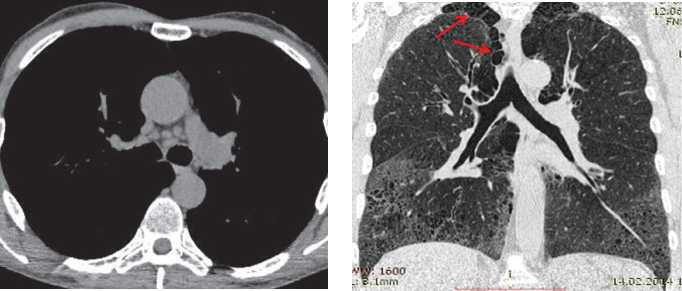
Рис. 9 ИЛФ. Множественные лимфатические узлы бифуркационной и парааортальной групп, не сливающиеся между собой, размерами от 1 до 1,5 см.
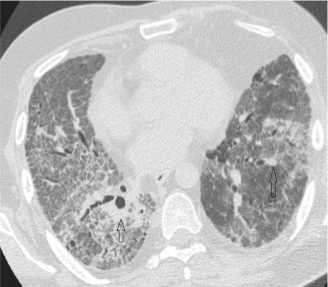
Рис. 11. Обострение ИЛФ. В зонах «сотового легкого» – диффузное «матовое стекло», множественные участки консолидации (стрелки),соответствующие фокусам диффузного альвеолярного повреждения.
Рис. 10. Буллезная эмфизема в верхней доле правого легкого (красные стрелки) у пациента с ИЛФ. Сотовая дегенерация занимает большую часть нижних долей.
симптомами появляются признаки диффузного альвеолярного повреждения, представленные массивными двусторонними зонами «матового стекла» и участками консолидации, часто перекрывающими ретикулярные и сотовые изменения [24] (рис. 11).
Функциональная диагностика: Для оценки функционального статуса и мониторинга течения заболевания используются такие методы, как обычная спирометрия, бодиплетизмография, позволяющая измерить основные объемы легких, исследование диффузионной способности легких и тест с 6-минутной ходьбой. Характерными спирометрическими признаками для ИЛФ, как и других рестриктивных заболеваний легких, является снижение форсированной жизненной емкости легких (ФЖЕЛ или FVC) при сохраненном или незначительно уменьшенном объеме форсированного выдоха за 1 секунду, что приводит к увеличению соотношения ОФВ1/ФЖЕЛ. Также обычно снижаются общая емкость легких (ОЕЛ или TLC) и диффузионная способность легких (DLCO) [1]. Пропорционально тяжести заболевания уменьшается дистанция 6-минутной ходьбы, обычно сопровождающаяся десатурацией. Газовый состав артериальной крови отражает нарушение степени газообмена в легких. Снижение PaCO2 вначале происходит только при физических нагрузках, а в развернутой стадии болезни уже и в покое. Гиперкапния присоединяется в терминальной стадии.
Инвазивная диагностика: Несмотря на то, что длительное время для диагностики ИЛФ использовались такие методы, как клеточный анализ жидкости бронхоальвеолярного лаважа (БАЛ) и трансбронхиальная биопсия легких (ТББЛ), их роль в настоящее время ограничивается кругом пациентов, которым невозможно выполнить видеоторакоскопическую биопсию легкого (ВТСБ) из-за тяжести состояния или высокого риска осложнений [25]. Маленький размер материала и его деформация при щипцовой ТББ часто не позволяют дифференцировать ИЛФ от НИП и экзогенного альвеолита [26]. Ценность данных методов (ТББ, БАЛ) обусловлена не столько
Список литературы От идиопатического фиброзирующего альвеолита к идиопатическому легочному фиброзу(часть II)
- Raghu G, Collard HR, Egan JJ, Martinez FJ, Behr J, Brown KK. et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;15:788-824.
- Kim DS, Collard HR, King TE Jr. Classification and natural history of the idiopathic interstitial pneumonias. Proc Am Thorac Soc. 2006;3:285-292.
- Raghu G, Weycker D, Edelsberg J, Bradford WZ, Oster G. Incidence and prevalence of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2006;174:810-816.
- Hopkins RB, Burke N, Fell C, et al. Epidemiology and survival of idiopathic pulmonary fibrosis from national data in Canada. Eur Respir J. 2016 May 26. pii: ERJ-01504-2015.
- Navaratnam V, Fleming KM, West J, et al. The rising incidence of idiopathic pulmonary fibrosis in the UK. Thorax 2011; 66: 462-467
- Larsen BT, Colby TV: Update for pathologists on idiopathic interstitial pneumonias. Arch Pathol Lab Med, 2012;136:1234-1241.
- Аверьянов А.В., Лесняк В.Н., Коган Е.А. Редкие заболевания легких: диагностика и лечение (под ред. А.В. Аверьянова) М., МИА, 2016, 248 с.
- Fernandez IE, Eickelberg O. New cellular and molecular mechanisms of lung injury and fibrosis in idiopathic pulmonary fibrosis. Lancet 2012; 380(9842): 680-688.
- Loomis-King H, Flaherty KR, Moore BB Pathogenesis, current treatments and future directions for idiopathic pulmonary fibrosis. Curr Opin Pharmacol. 2013 Apr 18. pii: S1471-4892(13)00049-0.
- Cordier JF, Cottin V. Neglected evidence in idiopathic pulmonary fibrosis: from history to earlier diagnosis Eur Respir J. 2013 Oct;42(4):916-23.
- Richeldi L. du Bois RM, Raghu G, et al. Efficacy and Safety of Nintedanib in Idiopathic Pulmonary Fibrosis. New England J Med. 2014;370:2071-2082.
- King T, Bradford W, Castro-Bernardini S, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014; 370: 2083-92.
- Nair GB, Matela A, Kurbanov D, Raghu G. Newer developments in idiopathic pulmonary fibrosis in the era of anti-fibrotic medications Expert Rev Respir Med. 2016 Jun;10(6):699-711. 15 DOI: 10.1080/17476348.2016.1177461
- Natsuizaka M, Chiba H, Kuronuma K, et al. Epidemiologic survey of Japanese patients with idiopathic pulmonary fibrosis and investigation of ethnic differences. Am J Respir Crit Care Med 2014; 190: 773-779.
- Atkins CP, Loke YK, Wilson AM. Outcomes in idiopathic pulmonary fibrosis: a meta-analysis from placebo controlled trials. Respir Med 2014; 108: 376-387.
- Ghatol A, Ruhl AP, Danoff SK. Exacerbations in idiopathic pulmonary fibrosis triggered by pulmonary and nonpulmonary surgery: a case series and comprehensive review of the literature. Lung 2012; 190: 373-380.
- Ryerson CJ, Cottin V, Brown KK, Collard HR. Acute exacerbation of idiopathic pulmonary fibrosis: shifting the paradigm. Eur Respir J. 2015 Aug; 46(2):512-20.
- Collard HR, Ryerson CJ, Corte TJ, et al. Acute Exacerbation of Idiopathic Pulmonary Fibrosis: An International Working Group Report. Am J Respir Crit Care Med. 2016 Aug 1;194(3):265-75. doi: 10.1164/rccm.201604-0801CI.
- Kondoh Y, Taniguchi H, Katsuta T, et al. Risk factors of acute exacerbation of idiopathic pulmonary fibrosis. Sarcoidosis Vasc Diffuse Lung Dis 2010; 27: 103-110.
- Collard HR, Tino G, Noble PW, et al. Patient experiences with pulmonary fibrosis. Respir Med. 2007;101:1350-1354.
- Hansell DM, Bankier AA, MacMahon H, McLoud TC, Müller NL, Remy J. Fleischner society: glossary of terms for thoracic imaging. Radiology 2008; 246:697-722.
- Souza CA, Muller NL, Lee KS, et al. Idiopathic interstitial pneumonias: prevalence of mediastinal lymphnode enlargement in 206 patients. AJR Am J Roentgenol 2006;186: 995-999.
- Cottin V, Nunes H, Brillet PY, et al. Combined pulmonary fibrosis and emphysema: a distinct underrecognised entity. Eur Respir J 2005;26:586-593.
- Akira M, Kozuka T, Yamamoto S, et al. Computed tomography findings in acute exacerbation of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2008; 178: 372-378.
- du Bois RM. An earlier and more confident diagnosis of idiopathic pulmonary fibrosis. Eur Respir Rev. 2012 Jun 1;21(124):141-6.
- Kendall DM, Gal AA. Interpretation of tissue artifacts in transbronchial lung biopsy specimens. Ann Diagn Pathol 2003;7(1):20-24.
- Welker L, Jörres RA, Costabel U, Magnussen H. Predictive value of BAL cell differentials in the diagnosis of interstitial lung diseases. Eur Respir J 2004;24(6):1000-1006.
- Lynch JP 3rd, Huynh RH, Fishbein MC, et al. Idiopathic Pulmonary Fibrosis: Epidemiology, Clinical Features, Prognosis, and Management Semin Respir Crit Care Med. 2016 Jun;37(3):331-57.
- Kondoh Y, Taniguchi H, Kitaichi M, et al. Acute exacerbation of interstitial pneumonia following surgical lung biopsy. Respir Med 2006;100(10):1753-1759.
- Nguyen W, Meyer KC. Surgical lung biopsy for the diagnosis of interstitial lung disease: a review of the literature and recommendations for optimizing safety and efficacy. Sarcoidosis Vasc Diffuse Lung Dis. 2013 Mar; 30(1):3-16.
- Dhooria S, Sehgal I, Aggarwal A, et al. Diagnostic Yield and Safety of Cryoprobe Transbronchial Lung Biopsy in Diffuse Parenchymal Lung Diseases: Systematic Review and Meta-Analysis. Respir Care. 2016 May; 61(5):700-12.


