Ответная реакция культивируемых in vitro клеток Linum grandiflorum Desf. на действие кадмия и глифосата
Автор: Гончарук Е.А., Николаева Т.Н., Назаренко Л.В., Калашникова Е.А., Загоскина Н.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Культуры in vitro
Статья в выпуске: 5 т.53, 2018 года.
Бесплатный доступ
Работ по культуре льна крупноцветкового ( Linum grandiflorum Desf.) in vitro крайне мало и в них преимущественно рассматривается морфогенез, получение эмбриокультуры, резистентность клеточных линий. L. grandiflorum относится к декоративным культурам, подвергающимся воздействию разнообразных стрессовых факторов в условиях города. К их числу относятся поллютанты и гербициды, вызывающие окислительный стресс в растениях. Выполненное нами исследование впервые показывает различия в реакции in vitro культивируемых клеток льна крупноцветкового на действие двух стрессовых факторов - тяжелого металла кадмия и пестицида глифосата (по морфофизиологическим характеристикам и биосинтезу фенольных соединений). Целью работы была оценка ростовой активности каллусной культуры льна крупноцветкового и накопления в ней фенольных соединений, в том числе фенилпропаноидов и флавоноидов, при воздействии токсических агентов. Каллусные культуры выращивали на питательной среде Мурасиге-Скуга с добавлением 2 % сахарозы и 2 мг/л 2,4-дихлорфеноксиуксусной кислоты...
Лен крупноцветковый, каллусная культура, устойчивость, кадмий, глифосат, фенольные соединения, фенилпропаноиды, флавоноиды
Короткий адрес: https://sciup.org/142216600
IDR: 142216600 | УДК: 633.521:581.1:581.4 | DOI: 10.15389/agrobiology.2018.5.938rus
Текст научной статьи Ответная реакция культивируемых in vitro клеток Linum grandiflorum Desf. на действие кадмия и глифосата
Одна из проблем современности — изменение экологической обстановки вследствие активной промышленной и сельскохозяйственной деятельности человека. Происходит техногенное загрязнение окружающей среды различными поллютантами, в том числе тяжелыми металлами (1). К наиболее распространенным относится кадмий, который в 2-20 раз токсичнее для растений, животных и человека, чем другие металлы (2). Cd оказывает негативное действие на процессы фотосинтеза и дыхания, водный режим, минеральное питание, функционирование антиоксидантной системы. Кадмий повреждает светособирающие антенные комплексы фотосистемы I и фотосистемы II (3, 4), конкурирует с ионом аммония, тем самым влияя на азотный метаболизм (5), способствует активации свободно-радикальных процессов (6), изменяет накопление различных антиоксидантов (7, 8). Все это приводит к нарушению естественных растительных сообществ, а у культурных видов — к значительным потерям урожая, обусловленным изменениями в росте и развитии (1).
В современных агроэкологических условиях существует проблема засорения посевов полевых и декоративных культур сорными травами, для решения которой широко применяются гербициды, способные подавлять рост растений (9). К их числу относится глифосат (N-(фосфонометил)-глицин) — послевсходовый неселективный гербицид системного действия, занимающий первое место в мире по производству среди препаратов аналогичного действия (10). Глифосат — уникальный ингибитор ключевого фермента шикиматного пути биосинтеза ароматических соединений 5-енолпирувилшикимат-3-фосфатсинтазы, вследствие чего у растений подавляется синтез белков и вторичных метаболитов фенольной природы, а также отмечается дерегуляция энергетического обмена (11).
Фенольные соединения относятся к веществам вторичного метаболизма, синтезирующимся во всех клетках и тканях растений (12). Они значительно различаются по структуре, химическим свойствам и биологической активности. Их функциональная роль разнообразна и связана с процессами фотосинтеза, дыхания, регуляции ферментативной активности, защиты клеток от стрессовых воздействий (13). Антиоксидантные свойства этих растительных метаболитов обусловлены наличием в их структуре гидроксильных групп, которые легко взаимодействуют со свободными радикалами, тем самым способствуя ингибированию процессов радикально-цепного окисления в условиях стрессовых воздействий (14).
Лен (класс Dicotyledoneae , сем. Linaceae ) — одна из важнейших культур комплексного использования (15). Он характеризуется многообразием видовых групп и разновидностей, что открывает широкие возможности его использования в аграрной, текстильной и фармацевтической промышленности, а также в декоративно-ландшафтном земледелии (16, 17). В последнем случае все успешнее используют однолетний декоративный вид льна Linum grandiflorum Desf. (лен крупноцветковый), у которого хорошо развита вегетативная часть и цветение продолжается до осени (18). Поскольку эту культуру высаживают на городских территориях, где почвы и окружающая среда загрязнены поллютантами, а для борьбы с сорняками применяются различные гербициды, целесообразно изучить ее устойчивость к их воздействию.
Метод культивирования клеток и тканей растений in vitro позволяет исследовать метаболические процессы, а также ответную реакцию клеток на действие стрессовых факторов на более простом по сравнению с интактным растением уровне организации (19, 20). Выращивание льна в культуре in vitro имеет длительную историю. При этом сохранение биоразнообразия, изучение структуры растительных клеток и их устойчивости к стрессовым факторам (21-23) были основными направлениями исследований. Но в целом работ по L. grandiflorum крайне мало, и в них преимущественно рассматриваются вопросы морфогенеза, получения эмбриокультур, изучения резистентности клеточных линий (24, 25).
В настоящем исследовании нами впервые выявлены различия в реакции in vitro культивируемых клеток льна крупноцветкового на действие таких стрессовых факторов, как поллютант (кадмий) и гербицид (гли- фосат). Это проявляется как в морфофизиологических характеристиках, так и при биосинтезе фенольных соединений — веществ с высокой биологической и антиоксидантной активностью.
Целью нашей работы была оценка ростовой активности каллусной культуры льна крупноцветкового и накопления в ней фенольных соединений, в том числе фенилпропаноидов и флавоноидов, а также реакции культуры на действие поллютанта (кадмия) и гербицида (глифосата).
Методика. Каллусные культуры льна крупноцветкового, выращивали на питательной среде Мурасиге-Скуга с добавлением 2 % сахарозы и 2 мг/л 2,4-дихлорфеноксиуксусной кислоты в факторостатной камере (Институт физиологии растений им. К.А. Тимирязева РАН, Россия) при температуре 25 °С, относительной влажности воздуха 70 % и 16-часовом фотопериоде (интенсивность освещения 5000 лк).
При изучении влияния стрессоров в основную питательную среду добавляли кадмий Cd(NO3)2 (60 мкМ), глифосат («Monsanta», Бельгия) (10 мкМ) или кадмий и глифосат одновременно (в тех же концентрациях). Контролем была обычная питательная среда. Каллусные культуры анализировали в конце пассажа (28-е сут культивирования), фиксируя их жидким азотом для последующих биохимических исследований. Учитывали интенсивность роста каллусов и их морфофизиологические характеристики. Содержание воды в каллусных тканях определяли стандартным методом после высушивания до постоянной массы в термостате при 70 °С (26).
Фенольные соединения извлекали 96 % этанолом из замороженного жидким азотом растительного материала при -196 °С. Через 45 мин гомогенат центрифугировали (16000 об/мин, 15 мин) и надосадочную жидкость использовали для спектрофотометрических исследований. Содержание суммы растворимых фенольных соединений определяли с реактивом Фолина-Дениса, флавоноидов — с 1 % раствором AlCl3 при X = 725 нм и X = 415 нм (27). Калибровочные кривые строили по рутину. Количество фенилпропаноидов оценивали прямой спектрофотометрией экстрактов при X = 330 нм, используя кофейную кислоту для построения калибровочной кривой (28).
Для изучения состава фенольного комплекса каллусных культур льна применяли метод тонкослойной хроматографии на пластинках с целлюлозой («Merck KGaA», Германия), растворитель БУВ (н-бутанол + уксусная кислота + вода в соотношении 40:12:28). Предварительную идентификацию фенольных соединений проводили на ультрахемископе DESAGA UVIS («DESAGA», Голландия) по специфической ярко-голубой или синей флуоресценции в УФ-свете при X = 254 нм и X = 366 нм. Для обнаружения фенольных соединений хроматограммы обрабатывали смесью 1 % растворов FeCl3 и K3Fe(CN) 6 (1:1), а также использовали реагент на фенолкарбоновые кислоты (диазотированный п-нитроанилин, с последующей обработкой 20 % раствором Na2CO3) (27).
Эксперименты проводили в 5-кратных биологических и 3-кратных аналитических повторностях. Корреляционный и факторный (ANOVA) анализ осуществляли в программе SigmaPlot 12.3 . В таблицах представлены средние арифметические значения полученных величин (М) и их стандартные ошибки (±SEM). Надстрочные символы обозначают статистическую значимость различий средних значений по тесту Тьюки при p < 0,05.
Результаты . Каллусная культура льна крупноцветкового, выращенная на основной питательной среде, имела преимущественно желтый цвет, хотя некоторые участки были светло-зелеными (рис. 1, А). Это мо-940
жет свидетельствовать о начальных этапах формирования в ней хлоропла- стов, поскольку рост происходил при световом воздействии. О том, что в культурах in vitro формируются эти органеллы, сообщалось в литературе (19). Следует также отметить, что каллусы льна имели рыхлую структуру, низкий прирост в течение всего пассажа и высокую оводненность (табл. 1). Аналогичные характеристики каллусной культуры льна крупноцветко- вого приводились и другими авторами (24).
А
Б
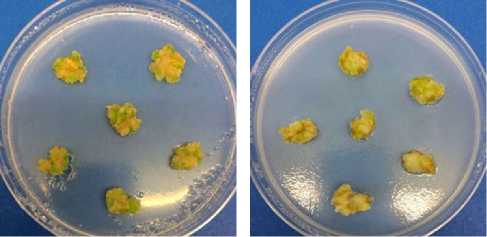
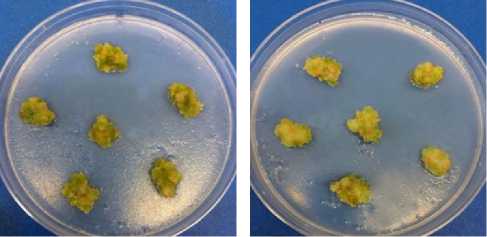
Рис. 1. Внешний вид каллусной культуры льна крупноцветкового ( Linum grandiflorum Desf.), выращенной на основной питательной среде (А) , а также на питательной среде с кадмием (60 мкМ) (Б) , глифосатом (10 мкМ) (В) , кадмием и глифосатом (Г) (возраст 28 сут).
Известно, что в условиях in vitro клетки растений сохраняют многие свойства интактных тканей, в том числе способность к синтезу фенольных соединений (19, 20). По мере роста каллусной культуры льна крупноцветкового содержание суммы фенольных соединений повышалось (см. табл. 1). Наиболее значительные изменения происходили с 6-х по 14-е сут культивирования, когда количество фенольных соединений возрастало в 2,4 раза. Максимальное суммарное содержание отмечали в конце пассажа — в 2,7 раза больше по сравнению с начальными этапами роста (6-е сут). Следовательно, наибольшая интенсивность биосинтеза феноль- ных соединений была приурочена к первой половине цикла роста культуры, что еще раз подтверждает высокую способность молодых клеток растений к образованию этих метаболитов (12).
1. Морфофизиологические и биохимические характеристики каллусной культуры льна крупноцветкового ( Linum grandiflorum Desf.) на основной питательной среде в течение пассажа ( M ±SEM)
|
Показатель |
Возраст культуры, сут |
||
|
6 1 |
14 |
28 |
|
|
Прирост каллусной массы, % |
115±5А |
125±6А |
150±5В |
|
Оводненность, % Суммарное содержание фенольных соединений, |
94,42±0,48А |
97,27±1,24А |
97,254±1,01А |
|
мг-экв. рутина/г сухой массы Содержание фенилпропаноидов, мг-экв. кофейной |
7,43±0,31А |
18,07± 0,92В |
20,23±0,74В |
|
кислоты/г сухой массы |
10,58±0,63А |
24,60±0,65В |
28,97±0,54В |
|
Содержание флавоноидов, мг-экв. рутина/г сухой массы |
2,92±0,74А |
6,56±0,86В |
6,03±0,71В |
|
П р и м е ч а н и е. Надстрочные символы (А, В) обозначают достоверность различий средних значений по тесту Тьюки при p < 0,05. |
|||
Фенилпропаноиды — биогенетически ранние представители фенольных соединений, синтезирующиеся в тканях растений (12). Сообщалось об их накоплении у различных представителей рода Linum (29). Тенденция накопления фенилпропаноидов в каллусах льна крупноцветкового была аналогична таковой для суммы фенольных соединений (см. табл. 1).
Исходя из этого, можно предположить, что они служат основными компонентами фенольного комплекса культур и определяют характер накопления фенольных соединений.
Флавоноиды — одни из наиболее распространенных в растительных тканях представителей фенольного метаболизма (12). Их накопление в культурах каллусов возрастало в первой половине цикла культивирования и к 14-м сут в 2,25 раза превышало аналогичный показатель у 6-суточной культуры. К концу пассажа содержание флавоноидов незначительно снижалось, но оставалось выше, чем в начале пассажа (почти в 2 раза). То есть на завершающих этапах роста культуры, а именно во время стационарной фазы, отмечалась тенденция к уменьшению содержания этих метаболитов, что характерно и для тканей растений (13).
Воздействие таких стрессовых факторов, как кадмий и глифосат, приводит к повышению образования в клетках активных форм кислорода (2, 11). В этих условиях важная роль принадлежит фенольным соединениям — низкомолекулярным компонентам антиоксидантной системы защиты (14, 31). Они способны «прерывать» цепные реакции окисления, вызванные стрессовыми факторами, а также образовывать комплексы с тяжелыми металлами, предотвращая их токсическое действие (1). В связи с этим нашей следующей задачей стало изучение действия кадмия и глифосата на рост каллусных культур льна крупноцветкового, а также накопление в них фенольных соединений, которое оценивалось в конце пассажа, то есть в период их максимального накопления.
2. Морфофизиологические и биохимические характеристики каллусной культуры льна крупноцветкового ( Linum grandiflorum Desf.) на средах с кадмием (60 мкМ) и глифосатом (10 мкМ) ( M ±SEM, возраст 28 сут)
|
Показатель |
Стрессовый фактор |
|
|
кадмий |
глифосат кадмий + глифосат |
|
|
Прирост каллусной массы, % 135±7А 165±8В 150±6В Оводненность, % 97,20±1,01А 95,90±1,01А 97,71±1,12А Суммарное содержание фенольных соединений, мг-экв. рутина/г сухой массы 19,45±0,36А 15,93±0,72А 25,23±0,94В Содержание фенилпропаноидов, мг-экв. кофейной кислоты/г сухой массы 30,22±0,74А 27,68±0,63А 15,46±0,34В Содержание флавоноидов, мг-экв. рутина/г сухой массы 6,38±0,71А 3,48±0,29В 2,77±0,14В П р и м еч а ни е. Надстрочные символы (А, В) обозначают достоверность различий средних значений по тесту Тьюки при p < 0,05. |
||
Каллусная культура, выращенная на питательных средах с добавлением кадмия и глифосата, имела светло-желтый цвет (см. рис. 1, Б-Г). Отмечалось ее незначительное позеленение, но в меньшей степени, чем в контрольном варианте. Кроме того, на поверхности формировались небольшие темно-коричневые участки, что могло свидетельствовать о некротизации клеток, характерной и для других культур in vitro в присутствии кадмия (30). При этом морфофизиологические характеристики каллусов, выращиваемых на среде с глифосатом, были лучше, чем в контрольном варианте. Они оказались более плотными и компактными, желтоватозеленого цвета, с хорошим приростом (табл. 2). Содержание воды в культурах во всех опытных вариантах имело близкие значение, примерно равные таковым в контроле.
Наличие кадмия в среде практически не влияло на биосинтетическую способность каллусных культур (см. табл. 2). Суммарное накопление фенольных соединений, количество фенилпропаноидов и флавоноидов были сходными с аналогичными показателями в контроле (см. табл. 1). По всей видимости, клетки L. grandiflorum устойчивы к действию изученной концентрации металла. Это может быть следствием принадлежности 942
льна к группе растений-аккумуляторов, у которых токсическое действие металла выражено при более высоких концентрациях поллютанта по срав
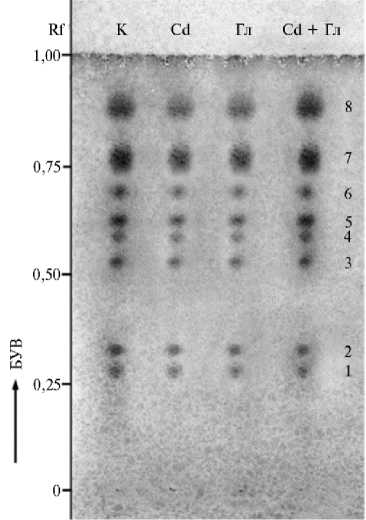
Рис. 2. Хроматографическое разделение этанольных экстрактов из каллусных культур льна крупноцветкого ( Linum grandiflorum Desf.), выращенных на основной питательной среде (К) и на средах с кадмием (Cd) , глифосатом (Гл) и их сочетанием (Cd + Гл) : 1-8 — обнаруженные вещества фенольной природы. Тонкослойная хроматография на пластинках с целлюлозой, состав растворителя (БУВ) — н-бутанол + уксусная кислота + вода (40:12:28). Указаны значения Rf (отношение расстояния, пройденного веществом, к расстоянию, пройденному растворителем).
нению с другими культурами, являющимися преимущественно исклю-чателями, накапливающими тяжелые металлы в корневой системе (1).
Глифосат служит ингибитором одного из ферментов фенольного метаболизма, ответственных за начальные этапы биосинтеза этих вторичных метаболитов (10). При его поступлении в растения в ряде случаев отмечалось уменьшение их накопления (31). В нашем опыте наблюдалась аналогичная тенденция, особенно в отношении флавоноидов (см. табл. 2). Можно предположить, что глифосат ингибировал преимущественно флавоноидный путь биосинтеза фенольных соединений и в значительно меньшей степени — фенил-пропаноидный.
Наиболее выраженное влияние на накопление фенольных соединений в каллусных культурах отмечали при комплексном воздействии кадмия и глифосата. В этом случае значительно возрастало суммарное содержание фенольных соединений на фоне снижения количества фенил-пропаноидов и флавоноидов, что предполагает активацию образования других классов фенольных соединений, в частности лигнанов — соединений фенольной природы, характерных для растений льна (29).
Для понимания особенностей образования фенольных соединений в клетках растений важно изучать не только их содержание, но и состав (12).
3. Состав фенольного комплекса этанольных экстрактов каллусных культур льна крупноцветкового ( Li-num grandiflorum Desf.) в контрольном и всех опытных вариантах (среда Мурасиге-Скуга)
|
¹ фракции |
Rf |
I 1 |
II |
|
1 |
0,28 |
+ |
+ |
|
2 |
0,35 |
+ |
- |
|
3 |
0,53 |
+ |
+ |
|
4 |
0,59 |
+ |
+ |
|
5 |
0,62 |
+ |
+ |
|
6 |
0,70 |
+ |
+ |
|
7 |
0,75 |
+ |
+ |
|
8 |
0,89 |
+ |
+ |
П р и м е ч а н и е. Для разделения использовали тонкослойную хроматографию на пластинках с целлюлозой, растворитель н-бутанол + уксусная кислота + вода (40:12:28). Rf — отношение расстояния, пройденного веществом, к расстоянию, пройденному растворителем, I и II — проявление реактивом соответственно на фенольные соединения и фенилпропаноиды.
Мы использовали метод тонкослойной хроматографии, который не выявил различий в составе комплекса экстрагируемых этанолом фенольных соединений в контрольном и опытных вариантах (рис. 2, табл. 3). Во всех экстрактах присутствовали 8 соединений фенольной природы, из которых три доминировали. Большинство феноль- ных соединений, судя по их подвижности, были конъюгатами фенолкарбоновых кислот — п-оксибензойнаой (соединения 1, 6, 8), п-кумаровой (соединения 3, 7), феруловой (соединение 4) и кофейной (соединение 5) (27). О наличии этих веществ в фенольном комплексе растений льна сообщалось и другими авторами (29, 30). Поскольку тонкослойная хроматография позволяет лишь предварительно оценить состав фенольного комплекса растительных клеток и тканей и не дает полной картины, эти исследования будут в дальнейшем продолжены.
Таким образом, культивируемые в условиях in vitro клетки льна крупноцветкового обладают способностью к образованию фенольных соединений — биологически активных веществ с антиоксидантной активностью, наибольшее накопление которых отмечалось в конце цикла культивирования. Их содержание быстро увеличивалось в первой половине цикла, достигая наибольших значений к концу пассажа, что может служить доказательством важности образования фенольных соединений, в том числе фенилпропаноидов и флавоноидов, в растительных клетках не только в условиях in vivo, но и in vitro. Тяжелый металл кадмий при добавлении в среду культивирования влиял на морфофизиологические характеристики каллусной культуры, однако изменений в накоплении фенольных соединений, включая фенилпропаноиды и флавоноиды, не наблюдалось. Это еще раз подтверждает значительную устойчивость клеток льна к действию тяжелых металлов. Присутствие в среде гербицида глифосата снижало способность культуры льна крупноцветкового к накоплению фенольных соединений, что в большей степени проявлялось в отношении флавоноидов. При комплексном действии двух этих факторов суммарное содержание фенольных соединений в культурах повышалось, а количество фенилпропаноидов и особенно флавоноидов — снижалось, что может быть следствием образования других представителей фенольных соединений. Полученные нами данные еще раз подтверждают видоспецифичность реакции клеток растений на действие стрессовых факторов.
Список литературы Ответная реакция культивируемых in vitro клеток Linum grandiflorum Desf. на действие кадмия и глифосата
- Nagajyoti P.C., Lee K.D., Sreekanth T.V.M. Heavy metals, occurrence and toxicity for plants: a review. Environ. Chem. Lett., 2010, 8(3): 199-216 ( ) DOI: 10.1007/s10311-010-0297-8
- Титов А.Ф., Казнина Н.М., Таланова В.В. Тяжелые металлы и растения. Петрозаводск, 2014.
- Gupta S.D. Metal toxicity, oxidative stress and antioxidative defense system in plants. In: Reactive oxygen species and antioxidants in higher plants. CRC Press, 2010 ( ) DOI: 10.1201/9781439854082-10
- Sade N., del Mar Rubio-Wilhelmi, M., Umnajkitikorn, K., Blumwald, E. Stress-induced senescence and plant tolerance to abiotic stress. J. Exp. Bot., 2017, 69(4): 845-853 ( ) DOI: 10.1093/jxb/erx235
- Hall J.L. Cellular mechanisms for heavy metal detoxification and tolerance. J. Exp. Bot., 2002, 53(366): 1-11 ( ) DOI: 10.1093/jxb/53.366.1
- Сазанова К.А., Башмаков Д.И., Лукаткин А.С. Генерация супероксидного анион-радикала в листьях растений при хроническом действии тяжелых металлов. Труды Карельского научного центра РАН, 2012, 2: 119-124.
- Загоскина Н.В., Зубова М.Ю., Нечаева Т.Л., Живухина Е.А. Действие ионов кадмия на культуру in vitro чайного растения (Camellia sinensis L.). Вiсник Харькiвського нацiонального аграрного унивеситету, 2015, 3(36): 29-37.
- Manquián-Cerda K., Escudey M., Zúñiga G., Arancibia-Miranda N., Molina M., Cruces E. Effect of cadmium on phenolic compounds, antioxidant enzyme activity and oxidative stress in blue berry (Vaccinium corymbosum L.) plantlets grown in vitro. Ecotox. Environ. Safe., 2016, 133: 316-326 ( ) DOI: 10.1016/j.ecoenv.2016.07.029
- Kudsk P., Streibig J.C. Herbicides -a two-edged sword. Weed Res., 2003, 43(2): 90-102 ( ) DOI: 10.1046/j.1365-3180.2003.00328.x
- Жантасов К.Т., Шалатаев С.Ш., Кадирбаева А.А., Алтеев Т.А., Жантасов М.К., Жантасова Д.М., Кочеров Е.Н. Современное состояние и перспективы производства глифосата. Современные наукоемкие технологии, 2014, 12(2): 156-159.
- Свиридов А.А., Шушкова Т.В., Ермакова И.Т., Иванова Е.В., Эпиктетов Д.О., Леонтьевский А.А. Микробная деградация гербицида глифосата. Прикладная биохимия и микробиология, 2015, 51: 183-190 ( ) DOI: 10.7868/S0555109915020221
- Запрометов М.Н. Фенольные соединения. М., 1993.
- Cheynier V., Comte G., Davis K.M., Lattanzio V., Martens S. Plant phenolics: Recent advances on their biosynthesis, genetics, and ecophysiology. Plant Physiol. Bioch., 2013, 72: 1-20 ( ) DOI: 10.1016/j.plaphy.2013.05.009
- Меньщикова Е.Б., Ланкин В.В., Зенков Н.К., Бондарь И.А., Круговых Н.Ф., Труфанкин В.А. Окислительный стресс. Прооксиданты и антиоксиданты. М., 2006.
- Rogers C.M. The systematics of Linum sect. Linopsis (Linaceae). Plant Syst. Evol., 1982, 140(2-3): 225-334 ( ) DOI: 10.1007/bf02407299
- Jhala A.J., Hall L.M. Flax (Linum usitatissimum L.): current uses and future applications. Australian Journal of Basic and Applied Sciences, 2010, 4(9): 4304-4312.
- Титок В., Лемеш В., Хотылева Л. Лен культурный (классификация, ботаническая и хозяйственная характеристика, генетика, биотехнология). Lap Lambert Academic Publishing GmbH&Co, 2012.
- Зеленцов С.В., Мошненко Е.В., Рябенко Л.Г. Современные представления о филогенезе и таксономии рода Linum L. и льна обыкновенного (Linum usitatissimum L.). Масличные культуры. Научно-технический бюллетень Всероссийского научно-исследовательского института масличных культур, 2016, 1(165): 106-121.
- Cells and tissues in culture: methods, biology and physiology/E.N. Willmer (ed.). Elsevier, London, 1966 ( ) DOI: 10.1016/b978-1-4832-3146-4.50006-7
- Gaspar T., Franck T., Bisbis B., Kevers C., Jouve L., Hausman J.F., Dommes J. Concepts in plant stress physiology. Application to plant tissue cultures. Plant Growth Regul., 2002, 37(3): 263-285 ( ) DOI: 10.1023/a:1020835304842
- Поляков А.В. Биотехнология в селекции льна. Тверь, 2010.
- McHughen A. Flax (Linum usitatissimum L.): in vitro studies. In: Legumes and oilseed crops I. Biotechnology in agriculture and forestry, vol. 10/Y.P.S. Bajaj (ed.). Springer, Berlin, Heidelberg, 1990: 502-514 ( ) DOI: 10.1007/978-3-642-74448-8_24
- Гончарук Е.А., Загоскина Н.В. Реакция клеток контрастных по устойчивости сортов льна долгунца (Linum usitatissimum L.) на действие ионов кадмия. Вiсник Харкiвського нацiонального аграрного унiверситету, 2016, 3: 27-38.
- Kulma A., Zuk M., Long S.H., Qiu C.S., Wang Y.F., Jankauskiene S., Szopa J., Preisner M., Kostyn K. Biotechnology of fibrous flax in Europe and China. Ind. Crop. Prod., 2015, 68: 50-59 ( ) DOI: 10.1016/j.indcrop.2014.08.032
- Van Uden W., Pras N., Woerdenbag H.J. Linum species (flax): in vivo and in vitro accumulation of lignans and other metabolites. In: Medicinal and aromatic plants VI. Biotechnology in agriculture and forestry, vol. 26/Y.P.S. Bajaj (ed.). Springer, Berlin, Heidelberg, 1994: 219-244 ( ) DOI: 10.1007/978-3-642-57970-7_15
- Носов А.М. Методы оценки и характеристики роста культур клеток высших растений. Молекулярно-генетические и биохимические методы в современной биологии растений. М., 2011: 386-403.
- Запрометов М.Н. Фенольные соединения и методы их исследования. В сб.: Биохимические методы в физиологии растений. М., 1971: 185-197.
- Khoddami A., Wilkes M.A, Roberts T.H. Techniques for analysis of plant phenolic compounds. Molecules, 2013, 18(2): 2328-2375 ( ) DOI: 10.3390/molecules18022328
- Balasundram N., Sundram K., Samman S. Phenolic compounds in plants and agri-industrial by-products: Antioxidant activity, occurrence, and potential uses. Food Chem., 2006, 99(1): 191-203 ( ) DOI: 10.1016/j.foodchem.2005.07.042
- Загоскина Н.В., Гончарук Е.А., Алявина А.К. Изменения в образовании фенольных соединений при действии кадмия на каллусные культуры, инициированные из различных органов чайного растения. Физиология растений, 2007, 54(2): 267-274.
- Lydon J., Duke S.O. Pesticide effects on secondary metabolism of higher plants. Pestic. Sci., 1989, 25(4): 361-373 ( ) DOI: 10.1002/ps.2780250406


