Параметры цитокинового статуса у больных рассеянным склерозом с коморбидным депрессивным расстройством
Автор: Гольдина Ирина Александровна, Гольдин Борис Глебович, Маркова Евгения Валерьевна, Козлов Владимир Александрович
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 1 (106), 2020 года.
Бесплатный доступ
Введение. Наличие ряда общих иммунологических механизмов патогенеза рассеянного склероза и аффективных расстройств позволяет предположить возможность формирования сопутствующего расстройства настроения у больных рассеянным склерозом, значительно ухудшающего качество жизни и комплаентность пациента. В связи с этим диагностика аффективной патологии у лиц, страдающих рассеянным склерозом, приобретает важное научно-практическое значение. Цель исследования: выявление особенностей цитокинового статуса у больных рассеянным склерозом с коморбидным рекуррентным депрессивным расстройством (F33). Методы. Определение продукции цитокинов в культуральных супернатантах мононуклеарных клеток крови больных проводили методом твердофазного варианта иммуноферментного анализа. Выраженность симптоматики депрессивных нарушений определяли по шкалам депрессии М. Гамильтона и А.Т. Бека, а также при проведении клинического обследования психиатром. Результаты. У больных рассеянным склерозом (G35) с рекуррентным депрессивным расстройством легкой степени (F33.00) в отличие от больных без аффективной симптоматики отмечалась более высокая продукция ИЛ-6...
Рассеянный склероз, рекуррентное депрессивное расстройство, мононуклеарные клетки крови, цитокины
Короткий адрес: https://sciup.org/142223387
IDR: 142223387 | УДК: 616.831-004.4:616.8-008.64:340.631.4:577.175.14-021.4:57 | DOI: 10.26617/1810-3111-2020-1(106)-5-13
Текст научной статьи Параметры цитокинового статуса у больных рассеянным склерозом с коморбидным депрессивным расстройством
Рассеянный склероз ‒ социально значимое полиэтиологическое аутоиммунное заболевание нервной системы с поражением серого и белого вещества мозга в результате формирования очагов воспаления, фиброзирования и глиоза, гибели олигодендроцитов, демиелинизации и деградации аксонов, приводящим к прогрессирующей неврологической дисфункции, когнитивной недостаточности и аффективным расстройствам [1, 2].
Неуклонный рост заболеваемости рассеянным склерозом, необратимость неврологической симптоматики, сопровождающейся стойкой утратой трудоспособности, снижением качества жизни, а также недостаточная релевантность современных диагностических методов, неопределенность и многофакторность механизмов патогенеза определяют актуальность поиска эффективных, патогенетически обоснованных методов диагностики и лечения данного заболевания [3, 4, 5, 6].
Наличие реципрокных взаимоотношений между иммунной и нервной системами, высокая степень коморбидности психических расстройств и иммунной недостаточности, вовлеченность иммунокомпетентных клеток и их биологически активных продуктов в патогенез и терапию аффективных расстройств подтверждает гипотезу о наличии общих для данных патологических процессов иммуноопосредо-ванных механизмов патогенеза [7, 8, 9, 10, 11].
Некоторые единые иммунопатогенетические механизмы описаны при рассеянном склерозе и при депрессии [5, 12, 13, 14, 15, 16, 17], что позволяет предположить возможность формирования сопутствующего аффективного расстройства у лиц с рассеянным склерозом, снижающего качество жизни и комплаентность пациента. В связи с этим диагностика сопутствующей аффективной патологии у лиц, страдающих рассеянным склерозом, приобретает важное научно-практическое значение.
Депрессия, наряду с тревожностью, является наиболее распространенным психическим расстройством при рассеянном склерозе и наблюдается не менее чем у трети больных, по данным различных авторов, в диапазоне от 30,5% до 50%, что значительно превышает ее распространенность в общей популяции [18, 19]. Вклад аффективной симптоматики в качество жизни больного часто остается недооцененным. Выявление у больного сниженного фона настроения, ангедонии, суточных колебаний настроения, суицидальных мыслей, пессимистической или негативной модели мышления и нарушения функциональности, непропорционального степени физической несостоятельности, свидетельствует в пользу наличия у больного рассеянным склерозом депрессивной симптоматики [20].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Выявление особенностей цитокинового статуса у больных рассеянным склерозом с комор-бидным рекуррентным депрессивным расстройством.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлись 90 больных, из них 37 мужчин в возрасте 38,0 (31,0; 47,0) года и 53 женщины в возрасте 39,0 (31,0; 50,0) года, с установленным диагнозом рассеянного склероза (G35), удовлетворяющим критериям W.I. McDonald et al. (2005) в дополненной модификации (2010), c непрерывнопрогредиентным течением, длительностью заболевания 17,0 (14,0; 18,0) года.
Мононуклеарные клетки крови больных выделяли при помощи центрифугирования венозной крови с добавлением гепарина на градиенте плотности фиколла 1,078 г/см3 (Lymphocyte separation medium, ICN Biomedicals Inc.) при 1 500 оборотах/мин в течение 40 минут. Клетки, собранные из интерфазы, отмывали в среде 199, осаждали центрифугированием, ресуспен-дировали в концентрации 20·106/мл в культуральной среде RPMI-1640, содержащей 10% сыворотки крови человека АВ (IV), 10 мМ Hepes, 4·10-5 М 2-меркаптоэтанола, 2 МмL глутамина, 40 мкг/мл гентамицина, и культивировали при 37°С и содержании в атмосфере 5% СО 2 . Определение продукции цитокинов в культуральных супернатантах мононуклеар-ных клеток крови больных проводили методом твердофазного варианта иммуноферментного анализа в соответствии с протоколом, представленным в нашей работе [21].
Выраженность симптоматики аффективных нарушений определяли по шкалам депрессии М. Гамильтона и А.Т. Бека и при проведении клинического обследования врачом-психиатром. Диагноз рекуррентного депрессивного расстройства был установлен на основании клинических критериев МКБ-10. Аффективная симптоматика у этих больных заключалась в нарушении настроения, в основном в сторону угнетения, снижении самооценки и уровня эмоциональной и физической активности с тенденцией к повторяемости, сочетании когнитивно-аффективных симптомов с соматическими проявлениями ‒ вегетативными нарушениями в виде тахикардии, гиперемии кожных покровов, гипергидроза, нарушения сна и аппетита. Отдельные эпизоды подавленного настроения были связаны с физическими или психологическими стрессовыми воздействиями и событиями. У исследованных больных РС рекуррентное депрессивное расстройство легкой степени (РДР ‒ F33.0) характеризовалось повторными эпизодами сниженного настроения, с утратой интересов и способности получать удовольствие, повышенной утомляемостью, нарушением сна, снижением аппетита, сниженной самооценкой и чувством неуверенности в себе, сниженной способностью к сосредоточению и вниманию. У больных РС с РДР средней степени тяжести (F33.1) наблюдалось, наряду с перечисленными выше симптомами, пессимистическое видение будущего, длительность повторных депрессивных эпизодов составляла от 2 недель до нескольких меся- цев, больные испытывали значительные трудности при выполнении социальных обязанностей, текущих домашних дел.
Тяжелое рекуррентное депрессивное расстройство (F33.2) у больных РС характеризовалось повторными эпизодами значительного беспокойства или выраженной двигательной заторможенности, чувством никчемности и вины, потерей самоуважения, неспособностью исполнять профессиональную деятельность, нарушением настроения в сторону угнетения, а также выраженной соматической симптоматикой в виде нарушения сна и пищевого поведения, сопровождающегося снижением массы тела и значительной утомляемостью. Больные испытывали трудности с принятием решений, концентрацией внимания, сосредоточения. Повторные эпизоды депрессивной симптоматики наблюдались на протяжение не менее 2 недель.
Статистическая обработка данных проводилась с использованием пакета программ STA-TISTICA v.10.0 (StatSoft, USA). Результаты представляли в виде медианы и межквартильного интервала Ме (25%; 75%). Для оценки достоверности различий применялся U-критерий Манна–Уитни, связь между степенью выраженности депрессии и продукцией цитокинов оценивали при помощи коэффициента ранговой корреляции Спирмена. Различия считали достоверными при р≤0,05.
РЕЗУЛЬТАТЫ
Наличие симптомов рекуррентного депрессивного расстройства наблюдалось в 93,3% (84 больных) исследованных случаев РС, с непрерывно-прогредиентным типом течения заболевания. В структуре аффективных расстройств преобладало рекуррентное депрессивное расстройство средней степени тяжести (согласно шкалам М. Гамильтона и А.Т Бека: 15,0 (14,0; 17,0) и 22,0 (20,0; 26,0) балла соответственно), которое было диагностировано в 53,6% случаев (45 больных). РДР тяжелой степени (по шкалам М. Гамильтона и А.Т Бека: 20,0 (19,0; 21,0) и 39,0 (33,0; 46,0) балла соответственно), установленное в 26,2% случаев (22 больных). С меньшей частотой наблюдалось РДР легкой степени (по шкалам М. Гамильтона и А.Т. Бека: 10,0 (9,0;11,0) и 14,0 (12,0;17,0) балла соответственно), зарегистрированное лишь в 20,2% (17 больных) исследованных случаев.
Больные рассеянным склерозом с комор-бидным рекуррентным депрессивным расстройством легкой и средней степени тяжести не отличались по показателям общеклинических лабораторных исследований от группы больных без аффективных симптомов. Вместе с тем при тяжелом рекуррентном депрессивном расстройстве отмечалось повышение уровня фибриногена (табл. 1).
Т а б л и ц а 1. Основные показатели общеклинических лабораторных исследований крови больных рассеянным склерозом с коморбидным рекуррентным депрессивным расстройством (М±m)
|
Исследуемый параметр |
Рассеянный склероз с аффективной симптоматикой (n=77) |
Рассеянный склероз без депрессивной симптоматики (n=7) |
||
|
Рекуррентное депрессивное расстройство |
||||
|
легкой степени (n=20) |
средней степени (n=22) |
тяжелой степени (n=45) |
||
|
Гемоглобин, г/л |
132,4 + 3,63 |
121,5 + 2,69 |
122,7 + 2,53 |
136,8 + 2,7 |
|
Эритроциты, 1012/л |
4,39 + 0,04 |
4,34 + 0,09 |
4,4 + 0,08 |
4,22 + 0,09 |
|
Тромбоциты, 109/л |
237,2 + 5,08 |
237,7 + 4,2 |
231,7 + 4,4 |
273,7 + 7,34 |
|
Лейкоциты, 109/л |
8,2 + 0,27 |
8,5 + 0,69 |
8,6 + 0,72 |
8,04 + 0,4 |
|
Сегментоядерные,% |
57,8 + 1,9 |
58,3 + 1,8 |
58,9 + 2,1 |
62 + 1,6 |
|
Палочкоядерные, % |
3,98 + 0,43 |
4,4 + 0,41 |
4,7 + 0,47 |
3,4 + 1,2 |
|
Эозинофилы, % |
3,08 + 0,43 |
2,5 + 0,46 |
2,4 + 0,52 |
2,5 + 0,32 |
|
Базофилы, % |
0,43 + 0,14 |
0,28 + 0,03 |
0,29 + 0,03 |
0,3 + 0,01 |
|
Лимфоциты, % |
40,2 + 1,7 |
41,2 + 1,2 |
41,4 + 1,3 |
41,9 + 1,1 |
|
Моноциты, % |
3,43 + 0,4 |
3,0 + 0,39 |
3,2 + 0,4 |
4,7 + 0,29 |
|
Общий белок, г/л |
73,6 + 1,5 |
71,7 + 0,95 |
72,5 + 0,9 |
72,6 + 1,3 |
|
СОЭ, мм/ч |
17,89 + 2,35 |
17,65 + 1,7 |
18,48 + 1,92 |
14,8 + 2,52 |
|
Фибриноген, г\л |
4,05 + 0,18 |
4,31 + 0,19 |
5,39 + 0,2* |
4,1 + 0,22 |
П р и м е ч а н и е. Достоверность различий с контрольной группой (U-критерий Манна–Уитни): * ‒ p≤0,05.
При изучении показателей цитокинового статуса у больных рассеянным склерозом с ассоциированным рекуррентным депрессивным расстройством различной (легкой, средней, тяжелой) степени тяжести были получены результаты, представленные на рисунке 1.
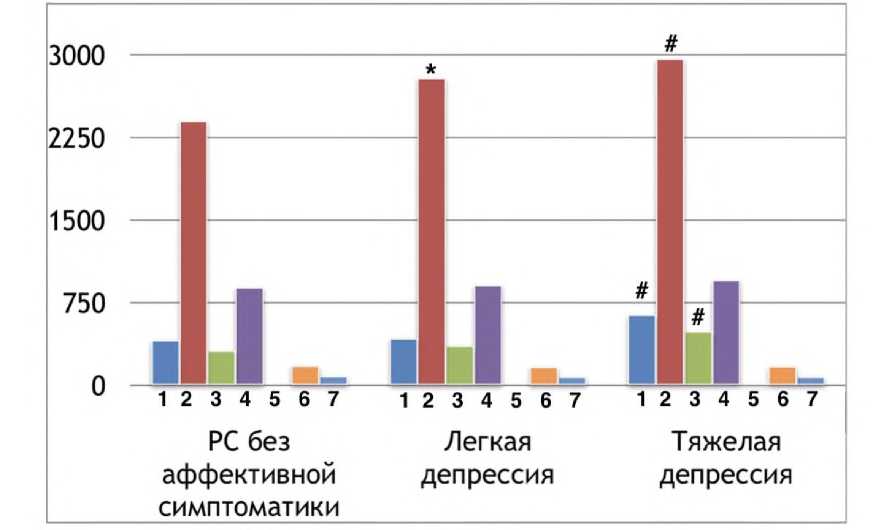
Рисунок 1. Распределение показателей цитокинового статуса больных рассеянным склерозом с коморбидным рекуррентным депрессивным расстройством, мкг/мл
Примечание. 1 - ИЛ-10; 2 - ИЛ-6; 3 - ФНО-а; 4 - y-ИФН; 5 — ИЛ-4; 6 - ИЛ-10; 7 - ИЛ-2. Достоверность различий (U-критерий Манна-Уитни): * - p<0,05 по сравнению с больными рассеянным склерозом без депрессивных симптомов; # - p<0,05 по сравнению с больными рассеянным склерозом с депрессивным расстройством легкой степени.
У больных рассеянным склерозом с депрессивным расстройством легкой степени в отличие от больных рассеянным склерозом без симптомов депрессии отмечалась более высокая продукция ИЛ-6. В то же время содержание ИЛ- 1р, ФНО-а, ИЛ-6 в культуральных супернатантах мононуклеарных клеток крови больных при тяжелой депрессии превышало соответствующие параметры пациентов с легкой депрессивной симптоматикой. Нами была выявлена прямая корреляционная связь между степенью выраженности депрессивного расстройства и спонтанной продукцией ИЛ-1р (rs=0,83; p<0,0001), ФНО-а (rs=0,89; p<0,0001), ИЛ-6 (rs=0,82; p<0,0001) мононуклеарными клетками крови больных рассеянным склерозом.
ОБСУЖДЕНИЕ
Известно, что иммунная и нейроэндокринная системы в физиологических условиях находятся в непрерывном коммуникативном взаимодействии посредством своих гуморальных и клеточных элементов. Срыв иммунного гомеостаза, т.е. нарушение иммунологической толерантности к аутоантигенам, ведет к возникновению аутоиммунных процессов, деструкции органов и тканей, опосредованных аутореактивными Т-клетками и аутоантителами [22, 23, 24].
В иммунопатогенезе рассеянного склероза ведущее значение имеют аутореактивные мие-лин-специфические CD4 + T-клетки. Активация IFN-Y-ассоциированных Th1-клеток и ИЛ-17-ассоциированных Th17-клеток ведет к хроническому воспалению в нервной ткани, инициирует нейродегенерацию и прогрессию заболевания. Цитокины, являющиеся сигнальными трансмиттерами межклеточных взаимодействий, выполняют ключевую роль в иммунопатогенезе рассеянного склероза [25, 26, 27].
Наличие сходных иммунологических механизмов патогенеза рассеянного склероза и аффективных расстройств подтверждается множеством современных исследований. Так, при депрессии выявлены аутоантитела к рецепторам нейротрансмиттеров и глютамату, а также активация микроглии и периваскулярных макрофагов в паренхиме мозга наряду с подавлением функции астроцитов, синтез макрофагами и клетками микроглии провоспалительных цитокинов и хинолиновой кислоты, которые подавляют транспортеры аминокислот и астроглиальную глутаматсинтетазу, что сопровождается воспалением и гибелью клеток олигодендроглии. Под контролем цитокинов находится и метаболизм триптофана/кинуренина [28, 29, 30].
Таким образом, цитокин-индуцированные изменения нейротрансмиссии наблюдаются при воспалении в нервной ткани и обусловливают генерацию симптоматики депрессии, что, вероятно, и является одним из механизмов формирования аффективных симптомов при рассеянном склерозе.
Выявленные в настоящем исследовании особенности цитокинового статуса у больных рассеянным склерозом с сопутствующим рекуррентным депрессивным расстройствам тяжелой степени, в частности повышение продукции основных провоспалительных цитокинов (ИЛ-1β, ФНО-α, ИЛ-6), инициирующих прогрессирующую нейродегенерацию и прогрессию заболевания при рассеянном склерозе, зависимость тяжести симптомов депрессивного расстройства от уровня продукции данных цитокинов ‒ всё это свидетельствует о том, что воспаление является общим механизмом патогенеза как рассеянного склероза, так и рекуррентного депрессивного расстройства, от степени выраженности которого зависит тяжесть депрессивной симптоматики.
ЗАКЛЮЧЕНИЕ
Непрерывно-прогредиентное течение рассеянного склероза сопровождается развитием аффективных расстройств в форме рекуррентного депрессивного расстройства, преимущественно средней и тяжелой степени тяжести, характеризующихся наличием как когнитивноаффективных, так и соматических симптомов. Степень выраженности рекуррентного депрессивного расстройства коррелирует с изменением параметров цитокинового статуса: тяжелая аффективная симптоматика характеризуется изменением функциональной активности иммунокомпетентных клеток, в частности проявляющейся повышением продукции цитокинов.
КОНФЛИКТ ИНТЕРЕСОВ
Представленные в настоящей статье материалы не содержат каких-либо потенциальных или явных конфликтов интересов авторов.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Данная работа финансировалась за счет бюджетных средств НИИФКИ и средств ООО «АБОЛмед» (Новосибирск).
СООТВЕТСТВИЕ ПРИНЦИПАМ ЭТИКИ
Исследования проводились в соответствии с этическими стандартами, разработанными на основании Хельсинской Декларации ВМА «Этические принципы проведения научных медицинских исследований с участием человека» и «Правил надлежащей клинической практики» (Приказ МЗ РФ № 200н от 01.04.2016 г.).
Исследования были одобрены локальным этическим комитетом при НИИФКИ (выписка из протокола № 121 от 4 декабря 2019 г.).
Список литературы Параметры цитокинового статуса у больных рассеянным склерозом с коморбидным депрессивным расстройством
- Trapp B.D., Nave K.A. Multiple sclerosis: an immune or neurodegenerative disorder? Annu. Rev. Neurosci. 2008; 31: 247-269. DOI: 10.1146/annurev.neuro.30.051606.094313
- Quintana F.J., Perez-Sanchez S., Farez M.F. Immunopathology of multiple sclerosis. Medicina (Buenos Aires). 2014; 74(5): 404-410.
- Mohebi F., Eskandarieh S., Mansournia M.A., Mohajer B., Sahraian M.A. Multiple Sclerosis in Tehran: Rising Prevalence alongside Stabilizing Incidence - True Increase or Enhanced Diagnosis? Arch. Iran. Med. 2019 Aug 1; 22(8): 429-434.
- Jahanbani-Ardakani H., Alsahebfosoul F., Etemadifar M., Abtahi S.H. Interleukin 18 Polymorphisms and its serum level in Patients with Multiple Sclerosis. Ann. Indian Acad. Neurol. 2019; 22(4): 474-476. DOI: 10.4103/aian.AIAN_515_18
- Гольдина И.А., Маркова Е.В. Нейроиммунные механизмы патогенеза рассеянного склероза. Красноярск: Научно-инновационный центр, 2018: 150. DOI: 10.12731/978-5-906314-89-5
- Смагин А.А., Гольдина И.А., Гайдуль К.В., Любарский М.С. Исследование пролиферативной активности мононуклеарных клеток крови больных рассеянным склерозом при воздействии пептида региона envelope эндогенного ретровируса человека HERV-E Х4-1. Медицинская иммунология. 2014;16 (3): 247-256.
- Idova G.V., Markova E.V., Gevorgyan M.M., Al'perina E.L., Zhanaeva S.Ya. Cytokine Production by Splenic Cells in C57BL/6J Mice with Depression-Like Behavior Depends on the Duration of Social Stress. Bull. Exp. Biol. Med. 2018; 164(5): 645-649. G
- DOI: 10.1007/s10517-018-4050-9
- Idova G.V., Markova E.V., Gevorgyan M.M., Al'perina E.L., Zhukova E.N. Changes in Production of Cytokines by C57Bl/6J Mouse Spleen during Aggression Provoked by Social Stress. Bulletin of Experimental Biology and Medicine. 2016; 160(5): 679-682.
- DOI: 10.1007/s10517-016-3248-y
- Ветлугина Т.П., Балашов П.П., Никифорова О.А., Одинцова И.Н., Иванова С.А., Попова Е.Н., Васильева О.А. Иммунологическая недостаточность и психическое здоровье населения нового города Сибири. Иммунология. 1996; 17 (2): 62-65.
- Иванова С.А. Психонейроиммуномодуляция в клинике и терапии невротических и аффективных расстройств: автореф. дис.. д.м.н. Томск, 2000: 43.
- Ветлугина Т.П., Иванова С.А., Корнетов Н.А., Киселев Я.Ю., Прозументов А.Л. Возможные механизмы иммунного влияния сертралина в динамике терапии депрессивных расстройств. Российский психиатрический журнал. 1999; 5: 35-39.
- Гольдин Б.Г. ФНО-а в формировании когнитивной недостаточности при аффективных расстройствах. Здоровье и образование в XXI веке. 2018; 20 (10): 14-17.
- DOI: 10.26787/nydha-2226-7425-2018-20-10-14-17
- Гольдин Б.Г., Гольдина И.А. Цитокины в этиологии и патогенезе депрессии. Здоровье и образование в XXI веке. 2017; 19 (11): 17-25.
- DOI: 10.26787/nydha-2226-7417-2017-19-11-17-25
- Гольдина И.А., Гольдин Б.Г. Экспрессия гена envelope эндогенного ретровируса человека HRV-E Х4-1 при аффективных расстройствах. Здоровье и образование в XXI веке. 2016; 18 (11): 49-54.
- Rossi S., Studer V., Motta C., Polidoro S., Perugini J., Macchiarulo G., Giovannetti A.M., Pareja-Gutierrez L., Calo A., Colonna I., Furlan R., Martino G., Centonze D. Neuroinflammation drives anxiety and depression in relapsing-remitting multiple sclerosis. Neurology. 2017; 89 (13): 1338-1347.
- DOI: 10.1212/WNL.0000000000004411
- Маркова Е.В., Княжева М.А., Рюмина Т.В., Козлов В.А. Особенности функционирования клеток иммунной системы у особей с агрессивно- и депрессивно-подобным типами поведения. В мире научных открытий. 2014; 8(56): 131148.
- DOI: 10.12731/wsd-2014-8-10
- Markova E., Knyazheva M., Savkin I., Аmstislavskaya T. Psychoneuroimmunomodulating effect of immune cells treated with psychoactive drug in depressive - like animals. European Psychiatry. 2018; 48 (1): 293.
- DOI: 10.1016/j.eurpsy.2017.12.016
- Patten S.B., Marrie R.A., Carta M.G. Depression in multiple sclerosis. Int. Rev. Psychiatry. 2017; 29 (5): 463-472.
- DOI: 10.1080/09540261.2017.1322555
- Gay M.C., Bungener C., Thomas S., Vrignaud P., Thomas P.W., Baker R., Montel S., Heinzlef O., Papeix C., Assouad R., Montreuil M. Anxiety, emotional processing and depression in people with multiple sclerosis. BMC Neurol. 2017; 17 (1): 43.
- DOI: 10.1186/s12883-017-0803-8
- Shin J.S., Kwon Y.N., Choi Y., Lee J.Y., Lee Y.I., Hwang J.H., Choi S.H., Kim S.M. Comparison of psychiatric disturbances in patients with multiple sclerosis and neuromyelitis optica. Medicine (Baltimore). 2019; 98 (38): e17184.
- DOI: 10.1097/MD.0000000000017184
- Гольдина И.А., Сафронова И.В., Павлов В.В., Гайдуль К.В. Некоторые особенности цитокинового статуса при персистирующем хламидиозе. Цитокины и воспаление. 2005; 4(2): 91.
- Ветлугина Т.П. Клиническая психонейроиммунология: итоги и перспективы. Сибирский вестник психиатрии и наркологии. 2008; 1 (84): 12-17.
- Ветлугина Т.П., Невидимова Т.И., Никитина В.Б., Лобачева О.А., Бохан Н.А., Семке В.Я. Патогенетическое обоснование технологии иммунокоррекции при психических расстройствах и болезнях зависимости. Сибирский вестник психиатрии и наркологии. 2013; 1 (76): 7-12.
- Garg N., Smith T.W. An update on immunopathogenesis, diagnosis, and treatment of multiple sclerosis. Brain Behav. 2015; 5 (9): e00362.
- DOI: 10.1002/brb3.362
- Li Y.F., Zhang S.X., Ma X.W., Xue Y.L., Gao C., Li X.Y., Xu A.D. The proportion of peripheral regulatory T cells in patients with Multiple Sclerosis: A meta-analysis. Mult. Scler. Relat. Disord. 2019; 28: 75-80.
- DOI: 10.1016/j.msard.2018.12.019
- Вострякова С.А., Алифирова В.М., Иванова С.А. Апоптоз лимфоцитов и факторы его регуляции у больных рассеянным склерозом. Бюллетень сибирской медицины. 2009; 8 (1-2): 15-18.
- Jadidi-Niaragh F., Mirshafiey A. Th17 cell, the new player of neuroinflammatory process in multiple sclerosis. Scand. J. Immunol. 2011; 74 (1): 1-13.
- DOI: 10.1111/j.1365-3083.2011.02536.x
- Hoffmann C., Zong S., Mane-Damas M., Molenaar P., Losen M., Martinez-Martinez P. Autoantibodies in Neuropsychiatric Disorders. Antibodies (Basel). 2016; 5 (2): 9.
- DOI: 10.3390/antib5020009
- Brites D., Fernandes A. Neuroinflammation and Depression: Microglia Activation, Extracellular Microvesicles and microRNA Dysregulation. Front Cell Neurosci. 2015; 9:4 76.
- DOI: 10.3389/fncel.2015.00476
- Zhao G., Liu X. Neuroimmune Advance in Depressive Disorder. Adv. Exp. Med. Biol. 2019; 1180: 85-98.
- DOI: 10.1007/978-981-32-9271-0_4


