Паспортизация новых линий и гибридов подсолнечника селекции ВНИИМК с помощью биохимических и молекулярных маркеров
Автор: Гучетль С.З., Челюстникова Т.А., Антонова Т.С.
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 3 (163), 2015 года.
Бесплатный доступ
Паспортизация новых перспективных линий и гибридов подсолнечника по изоферментным маркерам и молекулярным микросателлитным локусам ДНК является важным инструментом для защиты прав селекционеров. Целью данной работы была паспортизация 12 линий и четырех гибридов подсолнечника селекции ВНИИМК. Для характеристики селекционного материала использовали методы анализа изоферментов и полимеразной цепной реакции амплификации ДНК. С использованием пяти изоферментных и восьми SSR-локусов были составлены биохимические и молекулярно-генетические паспорта. По сравнению с группами линий ВНИИМК, изученными в предыдущие годы, уникальность набора новых линий, выявляемая методом анализа вариабельности изоферментных систем, стала меньше. Анализ биохимических характеристик 12 линий показал, что они группируются в восемь групп, отличающихся друг от друга. Гибридные комбинации обладали уникальными изоферментными спектрами. Уникальность линий и гибридов, полученная при помощи анализа изоферментных систем, составила 75 %. При анализе SSR-локусов выявлена индивидуальность аллельного состава каждой линии и гибрида, за исключением линий ВКІ-ими А и ВКІ-ими Б, которые являются стерильным и фертильным аналогами. Уникальность линий и гибридов, полученная при помощи микросател- литных локусов, составила 93 %. Установлено, что полиморфными и информативными для данной группы образцов являются четыре изоферментные системы: эстераза, малатдегидрогеназа, 6-фосфо-глюконатдегидрогеназа, глюкозофосфа- тизомераза, и пять микросателлитных локусов: ORS509, ORS 595, ORS1144, ORS1796, ORS 1036. Среднее число аллелей на локус для них составило 2.
Подсолнечник, паспортизация, ssr-маркеры, изоферментные локусы
Короткий адрес: https://sciup.org/142171302
IDR: 142171302 | УДК: 631.523:633.854.78
Текст научной статьи Паспортизация новых линий и гибридов подсолнечника селекции ВНИИМК с помощью биохимических и молекулярных маркеров
Введение. Паспортизация и идентификация линий, гибридов и сортов сельскохозяйственных культур с помощью биохимических и молекулярных маркеров широко применяется в селекционной практике. Для этих целей в качестве генетических маркеров используются и морфологические признаки. Однако количество информативных маркеров такого типа ограничено. К тому же фенотипические признаки могут иметь сложный характер наследования и часто зависят от условий внешней среды.
Биохимические и молекулярные маркеры не зависят от условий окружающей среды, являются многочисленными, в большинстве своем кодоминантно наследуются и их анализ осуществляется в лабораторных условиях в краткие сроки. С помощью биохимических и молекулярных маркеров в нашей стране и за рубежом производится генетическая паспортизация таких культур, как пшеница [1; 2], соя [3], яблоня [4], рис [5], виноград [6], подсолнечник [7; 8; 9]. Так, во Франции с использованием пяти SSR-маркеров (simple sequence repeat) паспортизировано 286 сортов картофеля с созданием базы данных, заключающей в себе аллельный состав каждого сорта [10]. Семьдесят восемь SSR-маркеров были отобраны и использованы для оценки генетической изменчивости среди набора 124 инбред-ных линий подсолнечника [11]. Согласно исследованиям Imerovski с соавторами, ДНК-локусы, ассоциированные с селекционно-ценными признаками, также являются эффективными для идентификации генотипов подсолнечника [8].
Паспортизация образцов, линий и гибридов подсолнечника селекции ВНИИМК при помощи изоферментных систем, RAPD и SSR-производных амплифициро-ванных фрагментов ДНК проводится с середины 90-х годов прошлого века [12; 13; 14; 15].
Целью данной работы была характеристика районированных и перспективных линий и гибридов подсолнечника селек- ции ВНИИМК по биохимическим – изо-ферментным маркерам и молекулярным – микросателлитным локусам ДНК.
Материалы и методы. Материалом для исследования служили 12 линий и четыре гибрида коллекции подсолнечника ВНИИМК (табл. 1, 2). Для определения однородности генотипов отбирали по 3–5 индивидуальных растений каждого образца.
Изоферменты экстрагировали гомогенизацией части семядоли сухой семянки в 20 мкл 0,1 М трис-HCl буфера с добавлением 0,1 %-ного поливинилпирролидона. Электрофорез выполняли в 12 %-ном крахмальном геле с добавлением 2 % сахарозы. Для электрофоретического разделения изоферментов использовали две буферные системы, составленные по методикам, предложенным Cardy et аl. [16]. После электрофореза гелевая пластина разрезалась тонкой нихромовой нитью на 5–6 срезов. Выявление зон энзиматической активности проводилось окрашиванием по стандартным прописям Vallejos [17]. Исследовали пять изоферментных систем, описанных ранее в работе Туркав с соавторами [15].
Для проведения ПЦР (полимеразной цепной реакции амплификации) геномную ДНК выделяли из семядольных листьев 5–7-днев-ных этиолированных проростков подсолнечника с помощью модифицированного метода Saghai-Maroof et аl. [18] с использованием СТАВ буфера. Для проведения ПЦР использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 1,5–3 мM MgCl2; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы (Сибэнзим, Москва). Для амплификации применяли термоциклер S1000тм (BioRad, США). Условия амплификации: начальная денатурация при 96 оС в течение 2 мин; затем 30 циклов при соблюдении температурно-временного режима: отжиг при 60 оС в течение 40 с, элонгация – 1 мин при 70 оС, денатурация при 94 оС – 30 с, финальная элонгация – 2 мин. Использовали восемь SSR-локусов, наследование которых было установлено исследованиями Челюстниковой [14], Гу-четль с соавторами [13] и Antonova с соавторами [19].
Электрофорез продуктов амплификации проводили в агарозном геле (2 % агароза, 1 х ТАЕ-буфер) с использованием камеры для горизонтального электрофореза (SE.2, ДНК-технология, Россия) в течение 1–1,5 часов при силе тока 58 mA и напряжении 90–100 V. Последующее окрашивание осуществляли бромистым этидием. Визуализация результатов электрофореза в ультрафиолетовом свете и их документирование обеспечивались при помощи системы цифровой документации видеоизображения BIO-PRINT (Vilber Lourmat, Франция).
Результаты и обсуждение. По результатам предыдущих работ для характеристики линий и гибридов по биохимическим маркерам были выбраны полиморфные изоферментные системы с примерно равной частотой встречаемости аллозимных вариантов [12; 15]. Это эстераза (EST), малатдегидрогеназа (МDH), 6-фосфоглюконатдегидрогеназа (6PGD), глюкозофосфатизомераза (GPI), глутаматдегидрогеназа (GDH). На рисунке 1 представлены энзиматические электрофоретические спектры некоторых изученных образцов.
А.

Б.
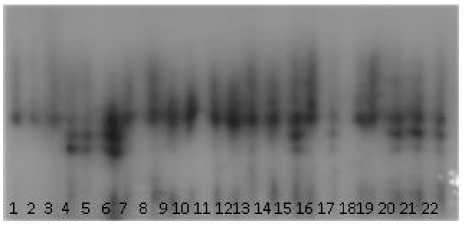
В.
■

12345678 910111213141516171819 20 2122
Рисунок 1 – Электрофоретические спектры изоферментных систем подсолнечника:
А – глюкозофосфатизомераза (GPI);
Б – малатдегидрогеназа (MDH);
В – эстераза (EST).
Расположение на дорожках: 1–3 – ВК 302,
4–6 – ВК 101, 7–9 – RG, 10–12 – Р 96, 13–14 – ВК 551(К), 15–19 – Арсенал, 20–22 – Фактор
Изоферментные спектры контролируются локусами с 2–3 аллелями, которые обозначены как: SS – контролирующий аллозим с наиболее медленной электрофоретической подвижностью, FF – алло-зим с быстрой электрофоретической подвижностью, vFvF – аллозим с наибольшей электрофоретической подвижностью. Обычно гомозиготные генотипы представлены на фореграммах одной фракцией. Исключение составляют образцы подсолнечника с генотипом Mdh – SS, представленные тремя фракциями. Гетерозиготные генотипы, в зависимости от четвертичной структуры фермента, представлены 2–5 фракциями.
Образец считали однородным, если все проанализированные семянки имели идентичный генотип. В случае если образец был неоднородным, то за типичный генотип принимали преобладающий. По всем инбредным линиям и гибридам были составлены изоферментные паспорта (табл. 1, 2).
Количество аллелей для различных локусов варьировало от 1 до 2. Среднее число аллелей на локус составило 1,6 (с учетом мономорфных локусов) и 2 (без учета мономорфных локусов). Анализ биохимических характеристик 12 линий показал, что они группируются в восемь групп, отличающихся друг от друга (табл.
Таблица 1
Изоферментные фенотипы 12 инбредных линий подсолнечника
ВНИИМК, г. Краснодар, 2015 г.
|
Линия |
Изоферментный фенотип |
||||
|
EST |
MDH |
GPI |
PGD |
GDH |
|
|
ВК 1ими А |
FF |
SS |
FF |
SS |
SS |
|
ВК 1ими Б |
FF |
SS |
FF |
SS |
SS |
|
BK 22 ими |
FF |
SS |
FF |
SS |
SS |
|
BK 301 |
FF |
SS |
FF |
FF |
SS |
|
ВК 930 |
FF |
SS |
FF |
FF |
SS |
|
ВА 760 |
vFvF |
FF |
SS |
FF |
SS |
|
P 96 |
FF |
FF |
SS |
FF |
SS |
|
ВК 302 |
FF |
FF |
FF |
FF |
SS |
|
ВК 101 |
SS |
SS |
SS |
FF |
SS |
|
RG |
SS |
FF |
FF |
FF |
SS |
|
ВК 876 |
SS |
SS |
FF |
SS |
SS |
|
ВК 195 |
SS |
SS |
FF |
SS |
SS |
Таким образом, в некоторые группы попало несколько линий, имеющих сходный генотип по составу изоферментов. Уникальность анализируемой коллекции линий составила 67 %. Столь низкий процент уникальности вызван отчасти тем, что линии ВК 1 ими А и ВК 1 ими Б являются стерильным и фертильным аналогами соответственно, и должны совпадать по всем остальным признакам.
Линии ВК 876 и ВК 195 также обладают сходным спектром изоферментов. Тем не менее, необходимо признать, что по сравнению с группами других линий ВНИИМК, изученных нами в предыдущие годы также методом анализа вариабельности изоферментных систем, процент уникальности новых линий становится меньше. Так, уникальность анализированных по изоферментным локусам 18 селекционных инбредных линий подсолнечника коллекции ВНИИМК в 1996 г. составила 78 % [15]. Уникальность 32 линий подсолнечника из той же коллекции, анализированной в 2004 г., составила 75 % [12]. Кроме того, некоторые изоферментные локусы, ранее характеризовавшиеся наличием нескольких аллелей, при изучении новых линий показывают только одно аллельное состояние. В более ранних исследованиях Туркав с соавторами [15] и Гучетль с соавторами
[12] паспортизация селекционного материала выполнялась по полиморфным системам, в состав которых входили эстераза, малатдегидрогеназа, 6-фосфоглюко-натдегидрогеназа, глюкозофосфатизомераза, глутаматдегидрогеназа. У изученно-го в 2015 г. набора линий, полиморфизм по глутаматдегидрогеназе выявлен не был. Уменьшение полиморфизма селекционного материала могло произойти либо из-за происхождения ин-бредных линий из одного или небольшого числа источников, либо из-за различной адап-тивной ценности аллельных вариантов, приводящей к преобладанию в коллекции одного из аллелей.
Четыре исследованных гибрида имели отличающиеся изоферментные спектры (табл. 2). Совокупный процент уникальности анализированных линий и гибридов составил 75.
Таблица 2
Изоферментные фенотипы четырех гибридов подсолнечника
ВНИИМК, г. Краснодар, 2015 г.
|
Гибрид |
Изоферментный фенотип |
||||
|
EST |
MDH |
GPI |
PGD |
GDH |
|
|
Имидж |
FF |
SS |
FF |
SS |
SS |
|
Арсенал |
FvF |
FS |
FS |
FF |
SS |
|
Фактор |
FS |
FS |
FS |
FF |
SS |
|
Окси |
SS |
SS |
FF |
SS |
SS |
Гибриды Фактор и Арсенал гетерозиготны по трем изоферментным локусам – Est, Mdh, Gpi . В силу того, что родительские линии гибридов Имидж (ВК 1 ими и ВК 22 ими) и Окси (ВК 876 и ВК 195) имели идентичные фенотипы, у этих гибридов нет изоферментных локусов в гетерозиготном состоянии. Следовательно, определение уровня гибридности по изо-ферментным локусам невозможно. Но возможно определение генетической чистоты гибрида, поскольку для этого используются и гомозиготные гены, т.к. при биологическом и механическом засорении гибрида может изменяться спектр любого изофермента.
Изоферментные маркеры в условиях отсутствия роботизированной техники для проведения ПЦР остаются востребованными в силу быстроты их определе- ния для паспортизации и для определения генетической чистоты коммерческих партий линий и гибридов подсолнечника. Но достичь с помощью только изофермент-ных маркеров 100 %-ной отличимости линий и гибридов не представляется возможным. Необходимо использование ПЦР-производных молекулярно-генетических маркеров и оптимизация их количества. В предыдущих работах было идентифицировано 17 инбредных линий коллекции ВНИИМК при помощи 10 SSR-локусов. Использование данных локусов позволило отличить генотипы друг от друга в 100 % случаев [19]. Использование трёх SSR и трёх SCAR-локусов для генотипирования коллекции 32 отечественных селекционных образцов подсолнечника позволило идентифицировать образцы лишь в 59 % случаев [13].
В результате анализа одиннадцати линий и четырех гибридов подсолнечника по восьми SSR-локусам были получены специфические и хорошо воспроизводимые фрагменты ДНК. Для каждого образца определены индивидуальные SSR-спектры, различающиеся числом ампликонов и их размерами на электрофореграммах (рис. 2).
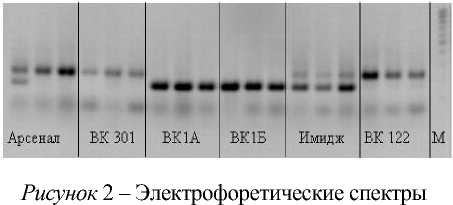
продуктов амплификации ДНК у линий и гибридов подсолнечника по локусу ORS 1796.
М – маркер молекулярного веса 100 пн
Количество аллелей для различных локусов варьировало от 1 до 2. Среднее число аллелей на локус составило 1,6 (с учетом мономорфных локусов) и 2 (без учета мономорфных локусов). Эти показатели совпадают с полученными ранее для других линий и гибридов подсолнечника [14; 19]. Три локуса не показали полиморфизма: IUB-6, ORS 553, RTS29. Остальные пять локусов показали по два аллельных состояния (табл. 3, 4).
Для обозначения аллельных вариантов использовали количество пар нуклеотидных оснований (пн) фрагмента ДНК. Гетерозиготные спектры, т.е. спектры, в которых присутствовали фракции двух разных аллелей, в таблицах обозначены двумя числами, разделенными косой чертой (/). При анализе электрофоретических спектров линий выявлена индивидуальность аллельного состава каждой из них, за исключением линий ВК 1 А ими и ВК 1 Б ими, которые, как было отмечено выше, являются стерильным и фертильным аналогами (табл. 3). Процент уникальности анализированной группы линий составил 91.
Таблица 3
Аллельные состояния микросателлитных локусов 11 линий подсолнечника
|
Генотип |
SSR-локус |
|||||||
|
ORS 509 |
ORS 595 |
IUB-6 |
ORS 1144 |
ORS 1796 |
ORS 553 |
RTS 29 |
ORS 1036 |
|
|
ВК 302 |
195* |
100 |
350 |
177 |
157 |
135 |
320 |
245 |
|
ВК 101 |
220 |
127 |
350 |
136 |
157 |
135 |
320 |
245 |
|
ВК 876 |
195 |
127 |
350 |
136 |
157 |
135 |
320 |
245 |
|
ВК 195 |
195 |
127 |
350 |
177 |
157 |
135 |
320 |
245 |
|
Р 96 |
220 |
127 |
350 |
177 |
157 |
135 |
320 |
245 |
|
ВК 930 |
220 |
127 |
350 |
177 |
232 |
135 |
320 |
255 |
|
RG 8 |
220 |
127 |
350 |
136 |
232 |
135 |
320 |
255 |
|
ВК 301 |
220 |
127 |
350 |
177 |
232 |
135 |
320 |
245 |
|
ВК 1 А ими |
220 |
127 |
350 |
136 |
157 |
135 |
320 |
245 |
|
ВК 1 Б ими |
220 |
127 |
350 |
136 |
157 |
135 |
320 |
245 |
|
ВК 22 |
195 |
127 |
350 |
177 |
232 |
135 |
330 |
255 |
|
* – количество пар нуклеотидных оснований (пн) аллеля SSR-локуса |
||||||||
Четыре исследованных гибрида имели отличающиеся по аллельному составу микросателлитных локусов генотипы (табл. 4).
Таблица 4
Аллельные состояния микросателлитных локусов четырех гибридов подсолнечника
|
Генотип |
SSR-локус |
|||||||
|
ORS 509 |
ORS 595 |
IUB-6 |
ORS 1144 |
ORS 1796 |
ORS 553 |
RTS 29 |
ORS 1036 |
|
|
Фактор |
195 ** / 220 |
100* |
350 |
136/ 177 |
157 |
135 |
320 |
245 |
|
Окси |
195 |
127 |
350 |
136/ 177 |
157 |
135 |
320 |
245 |
|
Арсенал |
220 |
127 |
350 |
136/ 177 |
232 |
135 |
320 |
245 |
|
Имидж |
195/ 220 |
127 |
350 |
136/ 177 |
157/2 32 |
135 |
320/ 330 |
245/25 5 |
|
* – количество пар нуклеотидных оснований (пн) аллеля гомозиготного SSR-локуса ** – количество пар нуклеотидных оснований (пн) аллелей SSR гетерозиготного локуса |
||||||||
Для гибрида Фактор характерно гетерозиготное состояние локусов ORS 509 и ORS 1144. Хотя родительские формы гибрида Фактор (линии ВК 101 и ВК 302) обладали отличающимися аллельными вариантами по локусу ORS 595, но в силу доминирования аллеля 100 пн у линии ВК 302 гибрид имеет по данному локусу лишь одно аллельное состояние – 100 пн. Гибриды Окси и Арсенал гетерозиготны по локусу ORS 1144. Гибрид Имидж обладал наибольшим количеством локусов в гетерозиготном состоянии: ORS 509, ORS 1144, ORS 1796, RTS 29 и ORS 1036. Для гибридов Имидж и Окси, у которых не было изоферментных локусов в гетерозиготном состоянии, выявлены SSR-локусы, по которым возможно определение уровня гибридности. Совокупный процент уникальности анализированных линий и гибридов составил 93.
Таким образом, с использованием пяти изоферментных и восьми SSR-локусов были составлены биохимические и молекулярно-генетические паспорта и установлена уникальность каждой инбредной линии (за исключением линий-аналогов) и гибридной комбинации. Процент уникальности линий, выявленный при помощи анализа изоферментных систем, составил 67, а при помощи микросател-литных локусов – 91. Совокупный процент уникальности линий и гибридов, выявленный при помощи анализа изо-ферментных систем, составил 75, при помощи микросателлитных локусов – 93. Установлено, что полиморфными и информативными для данной группы образцов являются четыре изоферментные системы: эстераза, малатдегидрогеназа, 6-фосфоглюконатдегидрогеназа, глюкозофосфатизомераза и пять микросателлит-ных локусов: ORS509, ORS 595, ORS1144, ORS1796, ORS 1036.
Список литературы Паспортизация новых линий и гибридов подсолнечника селекции ВНИИМК с помощью биохимических и молекулярных маркеров
- Вдовиченко Л.Д., Глазко В.И. Генетическая паспортизация сортов пшеницы с использованием ISSR-PCR маркеров//Сельскохозяйственная биология. -2007. -№ 3. -С. 33-37.
- Бобошина И.В., Боронникова С.В. Идентификация перспективных для Урала сортов пшеницы мягкой с использованием межмикросателлитного анализа полиморфизма ДНК//Фундаментальные исследования. -2013. -№ 6. -С. 92-97.
- Рамазанова С.А. Идентификация генотипов сои разного происхождения с использованием полиморфизма девяти микросателлитных локусов ДНК//Сб. статей 2-й междунар. конф. по сое: Современные проблемы селекции и технологии возделывания сои, Краснодар, 9-10 сентября. -2008.-С. 129-136.
- Супрун И.И., Токмаков С.В., Малюченко О.П., Ушакова Я.В., Бабаков А.В. Генотипирование сортов яблони российской селекции с использованием микросателлитных маркеров//Известия ТСХА. -2011. -Выл. 6.-С. 162-166.
- Гончарова Ю.К., Иванов А.Н., Князева КВ., Глазко В.И. Эстеразные спектры и адаптивная пластичность сортов риса//Доклады российской академии сельскохозяйственных наук. -2007. -№ 1. -С. 3-4.
- Cabezas J.A., Ibanez J„ Lijavetzky D., Velez D., Bravo G„ Rodriguez V. . A 48 SNP set for grapevine cultivar identification//Plant Biology. -2011. -№ 11.-P. 153.
- Саналатий A.B., Солоденко A.E., Сиволап Ю.М. Идентификация генотипов подсолнечника украинской селекции при помощи SSRP-анализа//Цитология и генетика. -2006. -Т. 40. -№ 4. -С. 31-37.
- Imerovski Dimitrijevic A., Miladinovic D„ Dedic D., Jocic.S'., Miklic V. Molecular profiles of sunflower lines resistant to broomrape (Orobanche cumana Wallr.)//International Symposium on Broomrape (Orobanche spp.) in Sunflower. Chisinau, Republic of Moldova. August 25-27. -2011. -P. 25.
- Усатое A.B., Маркин H.B., Горбаченко Ф.И., Федорова МА., Тихобаева В.Е., Горбаченко О.Ф., Азарин КВ. SSR-анализ геномной ДНК ЦМС-линий подсолнечника//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2011. -№ 1 (146-147). -С. 15-20.
- Moisan-Thiery М., Marhadour.S'., Kerlan М. С., Dessenne К, Perramant М., Gokelaere Т., Hingrat Y. Le. Potato cultivar identification using simple sequence repeats markers (SSR)//Potato Research. -2005. -Vol. 48. -Is 3^1. -P.191-200.
- Zhang L. S, Le Clerc V, Li S., Zhang D. Establishment of an effective set of simple sequence repeat markers for sunflower variety identification and diversity assessment//Canadian Journal of Botany. -2005. -83 (1). -P. 66-72.
- Гучетль C.3. Челюстникова T.A., Рамазанова С. А., Антонова Т.С. Молекулярногенетическая характеристика инбредных линий подсолнечника по изоферментным маркерам и ДНК профилям//Науч.-тех. бюл. ВНИИМК. -2004. -Вып. 2 (131). -С. 42-46.
- Гучетль С.З., Челюстникова Т.А., Арасла-нова Н.М., Антонова Т.С. SSR и SCAR генотипирование коллекции отечественных селекционных образцов подсолнечника, устойчивых и восприимчивых к расе Е Orobanche cumana Wallr.//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2012. -Вып. № 1 (150). -С. 20-26.
- Челюстникова ТА. Полиморфизм микро-сателлитных локусов в генотипах культурного и дикорастущего подсолнечника//Масличные культуры. Науч.-тех. бюл. ВНИИМК -2008. -Вып. 2(139). -С. 19-23.
- Туркав С.З., Лоскутов А.В., Губенко Т.П. Оценка генетической чистоты линий и гибридов подсолнечника с помощью изоферментных маркеров//Науч.-тех. бюл. ВНИИМК. -1996. -Вып. 117.-С. 33-37.
- Cardy B.S., Stuber C.W., Goodman М.М. Techniques for starch gel electrophoresis of enzymes for maize (Zea mays L.)//Institute of Statist. Mineograph. Series, 1317, North Carolina State Univers. -1981. -154 c.
- Vallejos C.E. Enzyme activity staining//Isozymes in plant genetics and breeding: Part A. -Amsterdam: Elsevier. -1983. -P. 469-516.
- Saghai-Maroof M.A., Soliman K.M., Jorgensen R.A., Allard R.W. Ribosomal DNA spacer-length polymorphisms in barley: mendelian inheritance, chromosomal location, and population dynamics//Proc. NAS USA. -1984. -Vol. 81. -P. 8014-8018.
- Antonova T.S., Guchetl S.Z., Tchelustnikova ТА., Ramazanova S.A. Development of marker system for identification and certification of sunflower lines and hybrids on the basis of SSR-analysis//Helia. -2006. -Vol. 29. -№ 45. -P. 63-72.


