Паспортизация по микросателлитным локусам генотипов подсолнечника - дифференциаторов устойчивости к заразихе
Автор: Гучетль С.З., Челюстникова Т.А., Сныга Н.А.
Статья в выпуске: 1 (146-147), 2011 года.
Бесплатный доступ
Были паспортизированы генотипы подсолнечника - дифференциаторы устойчивости к расам заразихи от Or4 до Or7. Проведена оценка их генетической выравненности с помощью микросателлитных локусов. По 9-и микросателлитным локусам методом полимеразной цепной реакции ДНК идентифицировано 6 генотипов подсолнечника - дифференциаторов. Установлена уникальность каждого из них. Выявлено, что не все линии являются гомозиготными, а гибридная комбинация 16Ах25 не является выравненной. Проведенная работа позволит осуществлять мониторинг их генетической стабильности.
Подсолнечник, дифференциаторы, заразиха, устойчивость, пцр, микросателлитные маркеры, паспортизация
Короткий адрес: https://sciup.org/142150981
IDR: 142150981 | УДК: 633.854.78:591.151:543.9
Текст научной статьи Паспортизация по микросателлитным локусам генотипов подсолнечника - дифференциаторов устойчивости к заразихе
Подсолнечник является основной масличной культурой, как в нашей стране, так и во всем мире. В последние годы в мировой прак- тике ограничивающим фактором его возделывания стал высокий уровень поражения облигатным паразитом – заразихой (Orobanche cumana Wallr.). Многообещающим способом борьбы с заразихой считается использование гербицидов. Но более надёжным методом борьбы является создание устойчивых сортов и гибридов подсолнечника [1].
Нарушения условий выращивания подсолнечника способствуют распространению физиологических рас заразихи. Начиная с 2006 г., в некоторых регионах России были отмечены районы с высоковирулентными расами заразихи [2]. Таким образом, существует необходимость контроля над новыми расами заразихи в регионах России, где занимаются возделыванием подсолнечника. Для этого необходимо использовать линии-дифференциаторы устойчивости к разным расам заразихи. Первые дифференциаторы, идентифицирующие пять вирулентных групп, названных от А до E, создали Vranceanu и др. (1980) [3]. За эти годы вирулентность популяций паразита изменилась. За рубежом выявлены источники устойчивости к заразихе разных рас, используемые в селекционных схемах скрещивания. Мы используем их как дифференциаторы, способствующие идентификации новых рас.
Молекулярно-генетические маркеры позволяют паспортизировать линии-дифференциаторы и осуществлять мониторинг их генетической стабильности. Молекулярный маркер, который сцеплен с геном устойчивости к заразихе, может быть полезным инструментом для маркер-опосредованной селекции, обеспечивая средство для быстрой идентификации желательных индивидов или линий.
Целью нашей работы была паспортизация генотипов подсолнечника – дифференциаторов устойчивости к разным расам заразихи и оценка их генетической выравненности с помощью микросателлитных локусов.
Материалы и методы. В качестве объекта исследования использовали следующие образцы: ВК639 – инбредная линия отдела селекции и семеноводства гибридного подсолнечника ВНИИМК, LC1002 – линия, устойчивая к расе D, LC 1007 и 261 – устойчивая к расе E, LC-1093 – к расе F, 16А×25 – гибридная комбинация, устойчивая к расе G (получены из Румынии от М. Pacureanu-Joita), Р96 – линия, устойчивая к расе F (получена из Испании от J. Melero-Vara).
ДНК выделяли из выращенных в темноте 57-дневных проростков подсолнечника. Выделение проводили по методу Saghai-Maroof et аl. (1984) [4] с модификациями авторов. Для проведения полимеразной цепной реакции использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 1,5-3,0 мM MgCl 2 ; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы (Москва, ГОСНИИГЕНЕТИКА). Амплификацию проводили в приборе «Терцик» (ДНК-технология, Россия). Для проведения ПЦР использовали следующий терморежим: начальная денатурация при 96 оС в течение 2 мин, затем 30 циклов при соблюдении температурно-временного режима: денатурация при 94 оС – 30 сек, отжиг при 55-60 оС в течение 40 сек, элонгация – 1 мин при 70 оС, финальная элонгация – 2 мин при 72 оС.
Электрофорез продуктов амплификации проводили в агарозном геле (1,5 и 2 % агароза, 1х ТАЕ – буфер) с использованием камеры для горизонтального электрофореза (SE.1, ДНК-технология, Россия) в течение 1-1,5 часов при силе тока 50-58 mA и напряжении 80-100 V. Окрашивание геля производили бромистым этидием. Документирование результатов электрофореза обеспечивалось при помощи гель-документирующей видеосистемы BIO-PRINT (Vilber Lourmat, Франция).
Результаты и обсуждение. По 9-и микро-сателлитным локусам, с уже известными параметрами ПЦР, разделения в электрофоретическом геле и наследованием [5; 6], нами были паспортизированы дифференциаторы устойчивости подсолнечника к заразихе, несущие разные гены устойчивости – от Or4 до Or7. Эти гены обеспечивают устойчивость подсолнечника к расам от А до G, поэтому мы ставили цель охарактеризовать их по молекулярно-генетическим маркерам. При постановке эксперимента для определения аллельного состояния микросателлитных локусов была использована линия ВК639 с уже известным аллельным состоянием микросателлитных маркеров.
Количество полученных аллелей для различных локусов варьировало от 1 до 3 (таблица), среднее число аллелей на локус составило 1,6 (с учетом мономорфных локусов) и 2,2 (без учета мономорфных локусов). Этот показатель соответствует количеству аллелей на локус, полученному Гучетль с соавторами (2007б) [7]. При изучении коллекции инбредных линий ВНИИМК было определено такое же среднее число аллелей на локус (2,2).
Три локуса из исследованных не показали полиморфизма: Наr432, ORS 6 и HNCA2. Соответственно, данные локусы в этой коллекции не различают генотипы.
Наиболее полиморфным оказался локус ORS5 (рисунок). Исследуемые образцы характеризуются по этому локусу 3-мя аллельными состояниями – a, b, c.
По два аллельных состояния показали локусы Har 514, Наr1327, Наr1442, Наr1608.
По всем 9-и SSR-локусам получены четкие, характерные для микросателлитов электрофоретические спектры, которые хорошо воспроизводились при повторных анализах. Размер фрагментов ДНК составлял от 100 до 250 п.н. При анализе электрофоретических спектров шести образцов выявлена индивидуальность аллельного состава каждого из них. Девять пар праймеров выявили полиморфизм у всех исследованных образцов. Таким образом, установлена возможность использования указанных микросателлитных локусов в качестве маркеров для идентификации дифференциаторов устойчивости к заразихе и составления их молекулярно-генетических паспортов. Кроме того, нами было выявлено, что не все образцы являются гомозиготными. Линия LC 1003 показала гетерозиготный генотип по локусу ORS5, что говорит о её недостаточной вырав-ненности. Более типичным гетерозиготное состояние, выявленное по локусам Наr514 и ORS5, является для гибридной комбинации 16А×25. Но, вместе с тем, этот гибрид не является выравненным, так как локусы Наr514 и Наr1442 показывают наличие разных типов аллелей: a и ab по локусу Наr514 и a, 0 по локусу Наr1442.
Таким образом, по 9 микросателлитным локусам нами паспортизировано 6 дифференциаторов подсолнечника, различающихся своей устойчивостью к разным расам заразихи. Установлена уникальность каждого из них.
Таблица – и дентификация дифференциаторов подсолнечника с помощью микросателлитных маркеров
|
Генотип |
Раса заразихи |
Л о к у с |
||||||||
|
Наr432 |
Наr514 |
Наr1327 |
Наr1442 |
Наr1608 |
ORS6 |
ORS5 |
IUB6 |
HNCA2 |
||
|
ВК639 |
а |
b |
а |
0 |
c |
a |
c |
a |
a |
|
|
LC1002 |
D |
b |
b |
a |
a |
c |
a |
b |
a |
a |
|
LC 1003 |
E |
b |
a |
a |
a |
c |
a |
bc |
a |
a |
|
261 |
E |
b |
b |
a |
0 |
b |
a |
c |
a |
a |
|
LC1093 |
F |
b |
a |
a |
0 |
b |
a |
c |
a |
a |
|
Р96 |
F |
b |
b |
b |
0 |
c |
a |
a |
a |
a |
|
16Ах25 |
G |
b |
a, ab |
a |
a, 0 |
c |
a |
ab |
a |
a |
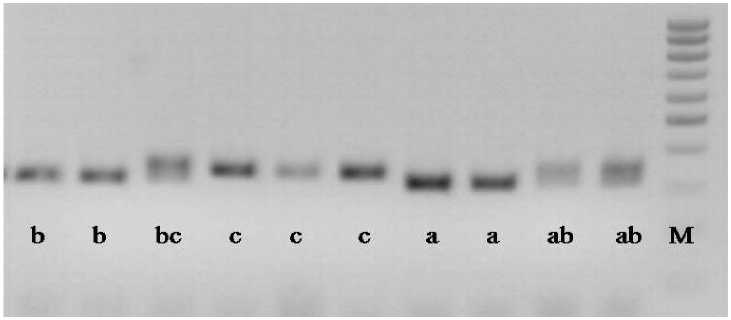
Рисунок – Электрофоретические спектры продуктов амплификации ДНК у дифференциаторов подсолнечника по локусу ORS5. A – a, b, с – аллели локуса ORS5; М – маркер молекулярного веса 100 bp


