Патогенетическая терапия доброкачественной гиперплазии предстательной железы и простатической интраэпителиальной неоплазии
Автор: Красняк Степан Сергеевич
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) - это новообразование, которое клинически проявляется прогрессирующим увеличением предстательной железы. Однако опухоль предстательной железы бывает и злокачественной, возникающаей вследствие низкодифференцированной простатической интраэпителиальной неоплазии (ПИН), являющейся доказанным предраковым состоянием. Цель. Изучить опубликованные на сентябрь и октябрь 2020 года данные по распространению, механизмам развития ДГПЖ и ПИН и методам их лечения. Материалы и методы. Были проанализированы результаты поиска по научным базам данных PubMed, MEDLINE, Embase по запросам «ДГПЖ», «ПИН», «эпидемиология ДГПЖ», «механизмы развития», «лечение ДГПЖ и ПИН». Результаты. ДГПЖ является очень распространенным заболеванием среди пожилого населения. К механизмам развития ДГПЖ относятся возраст, генетические и гормональные нарушения, «факторы роста», воспаление и факторы образа жизни. ПИН является единственным общепризнанным предшественником аденокарциномы предстательной железы. Основными методами лечения считаются ингибиторы 5α-редуктазы, ингибиторы фосфодиэстеразы-5, а также хирургические методы. Кроме того, растительные активные молекулы также широко используются в терапии при ДГПЖ и ПИН. Выводы. Поскольку лечение ингибиторами 5α-редуктазы и фосфодиэстеразы-5, а также хирургические методы имеют довольно много побочных эффектов и осложнений, был разработан уникальный растительный комплекс Гардапрост, который останавливает избыточный рост клеток при ДГПЖ. Куркумин, генистеин и эпигалокатехин-3-галлат, входящие в состав препарата, образуют безопасное средство, направленное на борьбу с ростом предстательной железы при ее гиперплазии, а также имеет значимый эффект при профилактике обострений хронического простатита и малигнизации у пациентов с ПИН.
Дгпж, пин, механизмы действия, лечение дгпж, куркумин, генистеин, эпигалокатехин-3-галлат
Короткий адрес: https://sciup.org/142225721
IDR: 142225721 | DOI: 10.29188/2222-8543-2020-13-4-66-74
Текст обзорной статьи Патогенетическая терапия доброкачественной гиперплазии предстательной железы и простатической интраэпителиальной неоплазии
Естественный рост населения Земли и увеличение продолжительности жизни ведут к росту в популяции мужчин старшей возрастной группы, что делает проблему симптомов нарушенного мочеиспускания (СНМ) социально значимой [1]. Затраты на медикаментозную терапию в долгосрочной перспективе крайне велики, а используемые в настоящее время медикаментозные препараты, а тем более хирургические опции не лишены побочных эффектов и осложнений [2]. Это является причиной продолжающихся исследований по поиску альтернативных вариантов медикаментозной терапии [2].
Цель исследования: оценить эффективность и безопасность препарата Диунорм® капсулы, в профилактике и лечении нарушенного мочеиспускания у мужчин.
МАТЕРИАЛЫ И МЕТОДЫ
Критериями исключения на момент 1 визита стали: трудовой распорядок с постоянной или периодической работой в ночное время; получаемая ранее терапия СНМ; необходимость оперативного лечения или применение любого другого вида неотложного лечения интеркуррентных заболеваний с целью предотвращения прогрессирования заболевания и нанесения вреда здоровью пациента;отсутствие ноктурии среди СНМ предъявляемых пациентом; регулярный прием лекарственных средств, приводящих к изменению параметров мочеиспускания в течение периода исследования или изменению исследуемых показателей за исключением альфа-1-адреноблокаторов (АБ); перенесенные операции на предстательной железе или мочеиспускательном канале; наличие опухоли мочевого пузыря сейчас или в анамнезе;хронический алкоголизм или наркомания; психические заболевания; острая или хроническая почечная недостаточность любой степени выраженности; гиперчувствительность к любому из компонентов исследуемого препарата; нарушение пациентом протокола исследования.Все пациенты на момент включения в исследование подписали информированное согласие.
На первичном визите и до включения в исследование, помимо сбора анамнеза и физикального осмотра больные заполняли шкалы опросники: Международная система суммарной оценки заболеваний предстательной железы (International Prostate Symptom Score, IPSS) Международный индекс эректильной функции (The international index of erectile function, IIEF-5), дневник мочеиспускания, который пациент вел в течение 3-х суток. Среди лабораторных методов использованы анализ мочи по Нечипоренко, бактериология мочи и определение уровня общего простатспецифического антигена (ПСА). Инструментальная диагностика включала выполнение урофлоуметрии и ультразвукового исследования (УЗИ) мочевого пузыря из трансабдоминального и предстательной железы из ректального доступа. При УЗИ регистрировали исходный объем (мл) и толщину передней стенки мочевого пузыря (мм), объем остаточной мочи (см3), объем предстательной железы (см3) и величину интравезикальной простатической протрузии (мм). Аналогичный лабораторноинструментальный контроль проведен на сроках 45 и 90 суток.
В настоящем исследовании изучена эффективность препарата Диунорм®, который представляет собой натуральный комплекс природного происхождения. Стандартная капсула 400 мг содержит: Каланхоэ перистого (Bryophyllum pinnatum) экстракт – 120 мг, Валерианы лекарственной экстракт (Valeriana officinalis L.) – 160 мг Солодки голой экстракт (Glycyrrhizia glabra) – 120 мг.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Трое пациентов контрольной группы на сроках 14-е, 21-е и 45-е сутки отказались от приема тамсуло-зина в связи с эякуляторными расстройствами, что составило 20% от исходно включенных в исследование. Дальнейший анализ проведен для 12 пациентов контроля, закончивших исследование. Все 42 пациента основной группы наблюдения остались комплаентны на протяжении всего периода наблюдения (р<0,01). У пациентов обеих групп наблюдения не отмечено как манифестации симптоматической инфекции мочевыводящих путей, так и бессимптомной бактериурии, что потребовало бы коррекции терапии и исключения из протокола. Также не было отмечено существенной динамики по уровню ПСА, что, видимо, исключает влияние исследуемого препарата на метаболизм тестостерона. Однако для окончательного вывода стоит увеличить сроки наблюдения в основной группе до 12 месяцев.
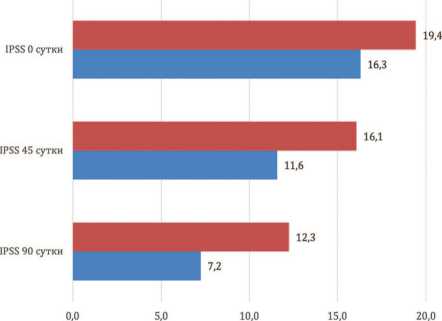
Консервативная терапия СНМ в обеих группах сопровождалась субъективным снижением симптоматики согласно суммарному баллу по шкале IPSS. Так, в основной группе наблюдения данный показатель составил 16,3±1,4, 11,6±1,5 и 7,2±0,8 балла на 0, 45 и 90 сутки исследования, соответственно. Таким образом отмечено его снижение на 28,4±11,6% и 55,2±6,2% относительно исходного значения ( р <0,0001) (рис. 1). Суммарный балл по шкале IPSS в группе контроля на аналогичных сроках наблюдения: 19,4±4,1, 16,1±3,6 и 12,3±5,6 балла. Это обеспечило следующие проценты снижения: 16,8±8,8% и 40,3±15,7% соответственно ( р <0,0001) (рис. 1). И хотя относительные скорости снижения суммарного балла по шкале IPSS в группах наблюдения достоверно не различались,абсолютный показатель по шкале IPSS к выходу из эксперимента был ниже в основной группе наблюдения,составив 7,2±0,8 балла против 12,3±5,6 балла в контроле ( р <0,05) (рис. 1). Однако полученные нами данные могут быть связаны с исходно более низким значением IPSS в основной группе наблюдения и эффектом малой вы-борки,что требует дополнительного набора пациентов и повторного анализа по анализируемому показателю.
■ контрольная группа, п=12
■ основная группа, п=42
Рис. 1. Динамика снижения суммарного балла по шкале IPSS в группах наблюдения.
Fig. 1 The dynamics of the decrease in the total score on the IPSS scale in the observation groups.
Еще одним из положительных моментов, с нашей точки зрения,является прогрессивное снижение частоты ноктурии в основной группе наблюдения на протяжении всего исследования. Средняя частота ночных мочеиспусканий при включении в исследование в этой группе составила 2,5±0,8 за ночь, через 1,5 месяца данный показатель уменьшился на 46,6±33,1% до 1,3±0,8 (р=0,0039) (рис. 2). Через 3 месяца приема Диу- норма частота ночных мочеиспусканий относительно исходных значений уменьшилась на 68,5±23,5% до 0,7±0,5 (р=0,0001) (рис. 2). Подобная динамика имела место и у пациентов, принимающих тамсулозин. Частота ночных мочеиспусканий при контрольных обследованиях на 45-е и 90-е сутки снизилась на 36,1±24,5% и 49,3±33,0%, соответственно (р<0,001) (рис. 2), хотя механизмы воздействия на ноктурию у используемых препаратов различны, что мы попытаемся обсудить ниже
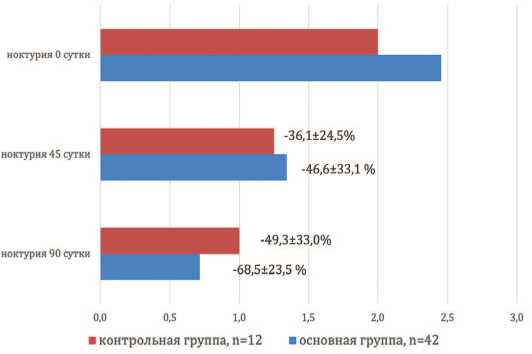
Рис. 2. Динамика ноктурии в группах наблюдения
Fig. 2. Dynamics of nocturia in observation groups
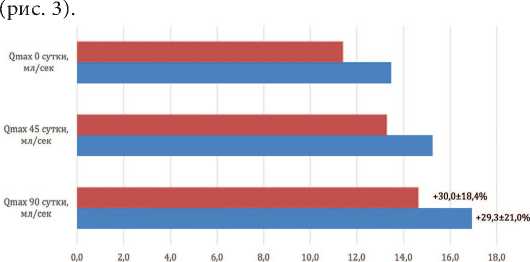
Стоит отметить, что сонографические показатели в обеих исследуемых группах не претерпели статистически достоверных колебаний за весь период наблюдения. Объем предстательной железы в основной группе на контрольных точках исследования составил 41,5±4,1 см3, 40,2±3,9 см3 и 38,7±4,2 см3 и не отличался от аналогичного показателя в контроле – 45,0±6,7 см3 41,1±4,4 см3 и 40,0±4,0 см3 (р>0,05). Однако стоит остановиться на некоторых тенденциях. Так, в основной группе отмечен статистически недостоверный рост емкости мочевого пузыря с 299,3±64,5 мл при обращении пациента за помощью до 356,7±68,1 мл через 3 месяца терапии, что в среднем составило 31,1±19,4%. При этом в основной группе наблюдения не зарегистрировано роста объема остаточной мочи и снижения уроф-лоуметрических показателей, что говорит об отсутствии влияния «Диунорма» на контрактильную функцию детрузора. Более того, применительно к объему остаточной мочи для основной группы получено недостоверное снижение показателя, который составил на 0-ые, 45-е и 90-е сутки 29,5±9,8 мл, 21,0±9,2 мл и 12,7±7,7 мл, чего не наблюдалось в контроле 46,9±12,4 мл, 37,5±16,7 мл и 29,2±17,4 мл соответственно (р<0,05). А для максимального потока зарегистрирован достоверный рост у пациентов,принимавших Диу-норм, что составило 13,4±0,7 мл/сек, 15,2±0,9 мл/сек и 16,9±0,7 мл/сек на контрольных точках. Таким образом, максимальная скорость мочеиспускания в основной группе увеличилась на 1,8 и 3,5 мл/сек через 1,5 и экспериментальная и клиническая урология № 4 2 0 2 0
3 месяца соответственно.Общий рост за весь период наблюдения в среднем составил 29,3±21,0% (р<0,001)
■ контрольная группа, п=12 ■ основная группа, п=42
Рис.3. Динамика увеличения максимальной скорости потока мочи Qmax в группах наблюдения
Fig. 3. The dynamics of the increase in the maximum flow Qmax in the observation groups
Анализ опросника IIEF-5 не выявил какой-либо динамики в группах наблюдения на протяжении 3 месяцев ( p >0,05). Однако при оценке эякуляторной функции в контрольной группе еще 4 пациента пожаловались на анэякуляцию. Таким образом, с тремя пациентами, покинувшими исследование по этим же причинам, частота расстройств эякуляции на фоне приема тамсулозина составила 46,7%, что достоверно больше чем в основной группе наблюдения ( р < 0,0001), при этом в 42,9 % из них это стало причиной отказа от приема препарата.
Рандомизация в протоколе проводилась по желанию пациента после ознакомления с возможными вариантами лечения. Обращает внимание тот факт, что несмотря на ограничительные по возрасту критерии включения, в основную группу вошла более молодая часть пациентов 51,4±7,9 лет против 58,4±3,9 лет в контроле. И хотя различия не являются статистически достоверными ( р >0,05), можно заключить, что «молодые» пациенты не спешат прибегнуть к всесторонне исследованному фармакологическому препарату взамен на средство растительного происхождения.
В нашем исследовании в основной группе наблюдения отмечена более выраженная, хотя статистически не достоверная, тенденция по купированию ноктурии по сравнению с контролем (рис. 2).
Естественно, окончательные выводы о возможных преимуществах терапии препаратом Диунорм будет возможно сделать при увеличении числа наблю-дений.Однако на этом этапе мы склонны ассоциировать положительное влияние на ноктурию не только с воздействием на гладкую мускулатуру детрузора за счет блокады М3-холинорецепторов и прямым миорелаксирующим действием, что показано в исследованиях [3-5] по экстракту Каланхоэ перистого (Bryophyllum pinna-tum). Частота ночных микций может быть снижена вследствие нормализации сна и снижении диуретического эффекта. В ряде исследований было показано что экстракт Валерианы (Valeriana officinalis L.), включающий масла изовалериановой и валериановой кислот и тритерпеновые гликозиды, способен улучшать высвобождение и нарушать обратный нейрональный захват гамма-аминомасляной кислоты (ГАМК) [6], а также выступать агонистом серотониновых и аденозиновых рецепторов в центральной нервной системе [7, 8]. Это способствует нормализации сна, снижая вероятность спонтанных пробуждений [9, 10]. Экстракт Солодки голой (Glycyrrhiza glabra) в качестве действующих веществ содержит глицирризиновую кислоту, бета-сито-стерин, ликвиритин, ликохалкон А, у которых описаны минералокортикоидные эффекты и повышение секреции Na-уретического пептида [11, 12]. Это достоверно снижает экскрецию воды и натрия из организма [13].
Вышеописанные механизмы реализуют также снижение симптоматики по шкале IPSS. Достаточно позитивным моментом можно считать увеличение максимальной скорости потока мочи на фоне увеличения емкости мочевого пузыря в основной группе наблюдения, что, как уже отмечали выше, говорит о сохранности сократительной функции детрузора.
ВЫВОДЫ
Комплекс Диунорм достоверно и сопоставимо с альфа-блокатором тамсулозином снижает выраженность СНМ и частоту ноктурии у первичных молодых пациентов, не вызывая при этом эякуляторных рас-стройств.Мы не призываем экстраполировать полученные результаты на всех мужчин с СНМ, однако, в группе «молодых» пациентов с наличием ноктурии и желанием избежать анэякуляции данный подход может быть эффективным инструментом коррекции расстройств мочеиспускания.
Список литературы Патогенетическая терапия доброкачественной гиперплазии предстательной железы и простатической интраэпителиальной неоплазии
- Аляев Ю.Г., Глыбочко П.В., Пушкарь Д.Ю. Урология Российские Клинические Рекомендации 2017. [Alyaev Yu.G., Glybochko P.V., Pushkar D.Yu. Urologiya Rossiyskie Klinicheskie Rekomendatsii = Urology Russian Clinical Guidelines 2017. (In Russian)].
- Foo KT. What is a disease? What is the disease clinical benign prostatic hyperplasia (BPH)? World J Urol 2019;37(7):1293-1296. DOI: 10.1007/s00345-019-02691-0
- Egan KB. The Epidemiology of Benign Prostatic Hyperplasia Associated with Lower Urinary Tract Symptoms: Prevalence and Incident Rates. Urol Clin North Am 2016;43(3):289-297. DOI: 10.1016/j.ucl.2016.04.001
- Bostwick DG. Prostatic intraepithelial neoplasia. Curr Urol Rep 2000;1(1):65-70 DOI: 10.1007/s11934-000-0037-x
- Geller J, Sionit L, Partido C, Li L, Tan X, Youngkin T, et al. Genistein inhibits the growth of human-patient bph and Prostate cancer in histoculture. Prostate 1998;34(2):75-79. :23.0.C0;2-I. DOI: 10.1002/(SICI)1097-0045(19980201)34
- Das K, Buchholz N. Benign prostate hyperplasia and nutrition. Clin Nutr ESPEN 2019;33:5-11.
- DOI: 10.1016/jxlnesp.2019.07.015
- De Nunzio C, Presicce F, Tubaro A. Inflammatory mediators in the development and progression of benign prostatic hyperplasia. Nat Rev Urol 2016;13(10):613-626.
- DOI: 10.1038/nrurol.2016.168
- Paolone DR. Benign prostatic hyperplasia. Clin Geriatr Med 2010;26(2):223-239.
- DOI: 10.1016/jxger.2010.02.010
- Bostwick DG, Qian J. High-grade prostatic intraepithelial neoplasia. Mod Pathol 2004;17(3):360-379. 10.1038/ modpathol.3800053.
- DOI: 10.1038/modpathol.3800053
- Sakr WA, Billis A, Ekman P, Wilt T, Bostwick DG. Epidemiology of high-grade prostatic intraepithelial neoplasia. In: Scandinavian Journal of Urology and Nephrology, Supplement; 2000;34(205):11-18.
- DOI: 10.1080/003655900750169275
- Gupta S, Prajapati A, Gupta S, Mistry B. Prostate stem cells in the development of benign prostate hyperplasia and prostate cancer: Emerging role and concepts. Biomed Res Int 2013:107954.
- DOI: 10.1155/2013/107954
- Wen S, Chang HC, Tian J, Shang Z, Niu Y, Chang C. Stromal androgen receptor roles in the development of normal prostate, benign prostate hyperplasia, and prostate cancer. Am J Pathol 2015;185(2):293-301.
- DOI: 10.1016/j.ajpath.2014.10.012
- Chughtai B, Forde JC, Thomas DM, Laor L, Hossack T, Woo HH, at al. Benign prostatic hyperplasia. Nat Rev Dis Prim 2016;2(1):1-15.
- DOI: 10.1038/nrdp.2016.31
- Carson C, Rittmaster R. The role of dihydrotestosterone in benign prostatic hyperplasia. Urology 2003;61(4):2-7. 10.1016/ S0090-4295(03)00045-1.
- DOI: 10.1016/S0090-4295(03)00045-1
- Lee C-L, Kuo H-C. Estrogen and G protein-coupled estrogen receptor agonist G-1 cause relaxation of human gallbladder. Tzu Chi Medical Journal 2017;29(2):79-83.
- DOI: 10.4103/tcmj.tcmj_20_17
- Nicholson TM, Ricke WA. Androgens and estrogens in benign prostatic hyperplasia: Past, present and future. Differentiation 2011;82(4-5):184-199.
- DOI: 10.1016/j.diff.2011.04.006
- Bostanci Y, Kazzazi A, Momtahen S, Laze J, Djavan B. Correlation between benign prostatic hyperplasia and inflammation. Curr Opin Urol 2013;23(1):5-10.
- DOI: 10.1097/M0U.0b013e32835abd4a
- Chughtai B, Lee R, Te A, Kaplan S. Inflammation and benign prostatic hyperplasia: Clinical implications. Curr Urol Rep 2011;12(4):274-277.
- DOI: 10.1007/s11934-011-0191-3
- Wang W, Bergh A, Damber JE. Chronic inflammation in benign Prostate hyperplasia is associated with focal upregulation of cyclooxygenase-2, Bcl-2, and cell proliferation in the glandular epithelium. Prostate 2004;61(1):60-72.
- DOI: 10.1002/pros.20061
- Roehrborn CG, Schwinn DA. а1-adrenergic receptors and their inhibitors in lower urinary tract symptoms and benign prostatic hyperplasia. J Urol 2004;171(3):1029-1035. 10.1097/01. ju.0000097026.43866.cc.
- DOI: 10.1097/01.ju.0000097026.43866.cc
- Andersson KE. Alpha-adrenoceptors and benign prostatic hyperplasia: basic principles for treatment with alpha-adrenoceptor antagonists. World J Urol 2002;19(6):390-396. 10.1007/ s00345-001-0237-0.
- DOI: 10.1007/s00345-001-0237-0
- Chu C, Deng J, Man Y, Qu Y. Green Tea Extracts Epigallocatechin-3-gallate for Different Treatments. Biomed Res Int 2017;2017:1-9.
- DOI: 10.1155/2017/5615647
- Bostwick DG, Cheng L. Precursors of prostate cancer. Histopathology 2012;60(1):4-27.
- DOI: 10.1111/j.1365-2559.2011.04007.x
- Nelson WG, De Marzo AM, Isaacs WB. Prostate cancer. N Engl J Med 2003;349(4):366-381.
- DOI: 10.1056/NEJMra021562
- Bostwick DG, Amin MB, Dundore P, Marsh W, Schultz DS. Architectural patterns of high-grade prostatic intraepithelial neoplasia. Hum Pathol 1993;24(3):298-310.
- DOI: 10.1016/0046-8177(93)90041-E
- Bechis SK, Otsetov AG, Ge R, Olumi AF. Personalized medicine for the management of benign prostatic hyperplasia. J Urol 2014;192(1):16-23.
- DOI: 10.1016/j.juro.2014.01.114
- Upreti R, Hughes KA, Livingstone EW, Gray CD, Minns FC, Macfar-lane DP, at al. 5а-reductase type 1 modulates insulin sensitivity in men. J Clin Endocrinol Metab 2014;99(8):13971406. 10.1210/ jc.2014-1395.
- DOI: 10.1210/jc.2014-1395
- Kaplan SA, Chung DE, Lee RK, Scofield S, Te AE. A 5-year retrospective analysis of 5а-reductase inhibitors in men with benign prostatic hyperplasia: Finasteride has comparable urinary symptom efficacy and prostate volume reduction, but less sexual side effects and breast complications than dutasteride. Int J Clin Pract 2012;66(11): 1052-1055.
- DOI: 10.1111/j.1742-1241.2012.03010.x
- Diamandis EP. Can chemoprevention reduce the risk of prostate cancer? Clin Chem 2010;56(8):1214-1215. 10.1373/ clinchem.2010.147918.
- DOI: 10.1373/clinchem.2010.147918
- Wei L, Lai ECC, Kao-Yang YH, Walker BR, MacDonald TM, Andrew R. Incidence of type 2 diabetes mellitus in men receiving steroid 5а-reduc-tase inhibitors: Population based cohort study. BMJ 2019;365:1204-1214.
- DOI: 10.1136/bmj.l1204
- Hazlehurst JM, Oprescu AI, Nikolaou N, Di Guida R, Grinbergs AE, Davies NP, at al. Dual-5а-reductase inhibition promotes hepatic lipid accumulation in man. J Clin Endocrinol Metab 2016;101(1):103-113.
- DOI: 10.1210/jc.2015-2928
- Baig MS, Kolasa-Wolosiuk A, Pilutin A, et al. Finasteride-induced inhibition of 5а-reductase type 2 could lead to kidney damage-animal, experimental study. Int J Environ Res Public Health 2019;16(10):1726.
- DOI: 10.3390/ijerph16101726
- Garcia PV, Barbieri MF, Perobelli JE, Consonni SR, Mesquita SP, Kempinas WG, at al. Morphometric-stereological and functional epididymal alterations and a decrease in fertility in rats treated with finasteride and after a 30-day post-treatment recovery period. Fertil Steril 2012;97(6):1444-1451.
- DOI: 10.1016/j.fertnstert.2012.03.025
- Rahimi-Ardabili B, Pourandarjani R, Habibollahi P, Mualeki A. Finasteride induced depression: A prospective study. BMC Clin Pharmacol 2006;6(1):1-6.
- DOI: 10.1186/1472-6904-6-7
- Fibbi B, Morelli A, Vignozzi L, et al. Characterization of phosphodiesterase Type 5 expression and functional activity in the human male lower urinary tract. J Sex Med 2010;7(1):59-69. 10.1111/ j.1743-6109.2009.01511.x.
- DOI: 10.1111/j.1743-6109.2009.01511.x
- Uckert S, Oelke M. Phosphodiesterase (PDE) inhibitors in the treatment of lower urinary tract dysfunction. Br J Clin Pharmacol 2011;72(2):197-204.
- DOI: 10.1111/j.1365-2125.2010.03828.x
- Kang KK, Kim JM, Yu JY, Ahn BO, Yoo M, Kim YC. Effects of phosphodiesterase type 5 inhibitor on the contractility of prostate tissues and urethral pressure responses in a rat model of benign prostate hyperplasia. Int J Urol 2007;14(10):946-951. 10.1111/ j.1442-2042.2007.01874.x.
- DOI: 10.1111/j.1442-2042.2007.01874.x
- Wong P, Lawrentschuk N, Bolton DM. Phosphodiesterase 5 inhibitors in the management of benign prostatic hyperplasia and erectile dysfunction: The best of both worlds. Curr Opin Urol 2009;19(1):7-12.
- DOI: 10.1097/M0U.0b013e328316c357
- Tinel H, Stelte-Ludwig B, Htitter J, Sandner P. Pre-clinical evidence for the use of phosphodiesterase-5 inhibitors for treating benign prostatic hyperplasia and lower urinary tract symptoms. BJU Int 2006;98(6):1259-1263.
- DOI: 10.1111/j.1464-410X.2006.06501.x
- Kim EH, Larson JA, Andriole GL. Management of benign prostatic hyperplasia. Annu Rev Med 2016;67(1):137-151. 10.1146/ annurev-med-063014-123902.
- DOI: 10.1146/annurev-med-063014-123902
- Wasson JH, Reda DJ, Bruskewitz RC, Elinson J, Keller AM, Henderson WG. A comparison of transurethral surgery with watchful waiting for moderate symptoms of benign prostatic hyperplasia. N Engl J Med 1995;332(2):75-79.
- DOI: 10.1056/NEJM199501123320202
- Tan AHH, Gilling PJ, Kennett KM, Frampton C, Westenberg AM, Fraundorfer MR. A randomized trial comparing holmium laser enucleation of the prostate with transurethral resection of the prostate for the treatment of bladder outlet obstruction secondary to benign prostatic hyperplasia in large glands (40 to 200 grams). J Urol 2003;170(4):1270-1274.
- DOI: 10.1097/01.ju.0000086948.55973.00
- Kotha RR, Luthria DL. Curcumin: Biological, pharmaceutical, nutraceutical, and analytical aspects. Molecules 2019;24(16):2930-2957.
- DOI: 10.3390/molecules24162930
- Kim HJ, Park JW, Cho YS, et al. Pathogenic role of HIF-1a in prostate hyperplasia in the presence of chronic inflammation. Biochim Biophys Acta - Mol Basis Dis 2013; 1832( 1): 183-194. 10.1016/ j.bbadis.2012.09.002.
- DOI: 10.1016/j.bbadis.2012.09.002
- Guo H, Xu YM, Ye ZQ, Yu JH, Hu XY. Curcumin induces cell cycle arrest and apoptosis of prostate cancer cells by regulating the expression of IKBa, c-Jun and androgen receptor. Pharmazie 2013;68(6):431-434.
- DOI: 10.1691/ph.2013.2861
- Shi Q, Shih C, Lee K. Novel Anti-Prostate Cancer Curcumin Analogues That Enhance Androgen Receptor Degradation Activity. Anticancer Agents Med Chem 2009;9(8):904-912.
- DOI: 10.2174/187152009789124655
- Kim SK, Seok H, Park HJ, et al. Inhibitory effect of curcumin on testosterone induced benign prostatic hyperplasia rat model. BMC Complement Altern Med 2015;15(1):380. 10.1186/ s12906-015-0825-y.
- DOI: 10.1186/s12906-015-0825-y
- Devassy JG, Nwachukwu ID, Jones PJH. Curcumin and cancer: Barriers to obtaining a health claim. Nutr Rev 2015;73(3):155-165.
- DOI: 10.1093/nutrit/nuu064
- Polkowski K, Mazurek AP. Biological properties of genistein. A review of in vitro and in vivo data. Acta Pol Pharm - Drug Res 2000;57(2):135-155.
- Klein CB, King AA. Genistein genotoxicity: Critical considerations of in vitro exposure dose. Toxicol Appl Pharmacol 2007;224(1):1-11. https://doi.org/10.1016Zj.taap.2007.06.022.
- Spagnuolo C, Russo GL, Orhan IE, et al. Genistein and cancer: Current status, challenges, and future directions. Adv Nutr 2015;6(4):408-419.
- DOI: 10.3945/an.114.008052
- Chacko SM, Thambi PT, Kuttan R, Nishigaki I. Beneficial effects of green tea: A literature review. Chin Med 2010;5(1):13-21.
- DOI: 10.1186/1749-8546-5-13
- Shimizu M, Sakai H, Shirakami Y, et al. Preventive effects of (-)-epigal-locatechin gallate on diethylnitrosamine- induced liver tumorigenesis in obese and diabetic C57BL/KsJ-db/db mice. Cancer Prev Res 2011;4(3):396-403.
- DOI: 10.1158/1940-6207.CAPR-10-0331
- Nagai K, Jiang MH, Hada J, et al. (-)-Epigallocatechin gallate protects against NO stress-induced neuronal damage after ischemia by acting as an anti-oxidant. Brain Res 2002;956(2):319-322. 10.1016/ S0006-8993(02)03564-3.
- DOI: 10.1016/S0006-8993(02)03564-3
- Tepedelen BE, Soya E, Korkmaz M. Epigallocatechin-3-gallate reduces the proliferation of benign prostatic hyperplasia cells via regulation of focal adhesions. Life Sci 2017;191:74-81. 10.1016/ j.lfs.2017.10.016.
- DOI: 10.1016/j.lfs.2017.10.016
- Chen J, Song H. Protective potential of epigallocatechin-3-gallate against benign prostatic hyperplasia in metabolic syndrome rats. Environ Toxicol Pharmacol 2016;45:315-320.
- DOI: 10.1016/j.etap.2016.06.015


