Патогенетически значимые изменения толстокишечной микрофлоры при псориазе
Автор: Нестеров А.С., Гумаюнова Н.Г., Потатуркина-нестерова Н.И., Пантелеев С.В., Шроль О.Ю.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 1, 2016 года.
Бесплатный доступ
Целью исследования явилось изучение состояния толстокишечной микробиоты у больных псо- риазом и ее состава в зависимости от вида и тяжести заболевания.Материалы и методы. Проводили объективное обследование пациентов. Оценка тяжести псо- риаза производилась с помощью общепринятого индекса охвата и тяжести псориаза PASI. Изу- чение микрофлоры кишечника у больных псориазом и лиц контрольной группы проводили соглас- но приказу Минздрава России. Культуры, выросшие на питательных средах, подвергали группо- вой, родовой и видовой идентификации (стафилококки, эшерихии).Результаты исследования показали, что у всех пациентов кожный процесс был распространен- ным с оценкой PASI от 38,8 до 72 баллов. Обследованные пациенты имели следующие формы псо- риаза: псориаз вульгарный (ПсВ) - 73,55 %, псориатический артрит (ПсАр) - 26,45 %. Во всех случаях псориатический артрит сопровождался наличием кожных проявлений распространенно- го псориатического процесса. При изучении изменений микрофлоры толстой кишки было отме- чено некоторое угнетение облигатных микроорганизмов, проявлявшееся в уменьшении обсеме- ненности толстого отдела кишечника. Полученные данные свидетельствуют о наличии более глубоких дисбиотических нарушений в толстом отделе кишечника у больных с тяжелой формой псориаза в сочетании с артритом, проявляющихся в угнетении нормальной микрофлоры и росте условно-патогенных и даже патогенных микроорганизмов. Наибольшие сдвиги по составу микро- флоры отмечались при стаже заболевания псориазом более 20 лет.Выводы. У 86 % обследованных пациентов с псориазом обнаружены явления дисбиоза в толстом отделе кишечника. Дисбиотические сдвиги усугублялись в зависимости от тяжести течения кожного процесса и были более выражены у больных с псориазом в сочетании с артритом.
Псориаз, толстая кишка, дисбиоз, микробиота, коморбидность
Короткий адрес: https://sciup.org/14113140
IDR: 14113140 | УДК: 616.5:616.1
Текст научной статьи Патогенетически значимые изменения толстокишечной микрофлоры при псориазе
Введение. Псориаз представляет собой генетически детерминированное аутоиммунное заболевание мультифакториального генеза с рецидивирующим течением, многообразием фенотипов, клинических разновидностей и возможным выявлением различных коморбидностей [1–3].
По данным литературы, распространенность псориаза во всем мире достигает 4–7 % [4]. По мнению K. Reich, легкие формы заболевания, которые поражают менее 3–5 % площади тела и не дают значимых изменений в иммунном статусе больного, требуют только местного лечения [3]. Псориаз среднетяжелого и тяжелого течения является системным, иммуноопосредованным воспалительным процессом, приводящим к развитию со- путствующих заболеваний или усугубляющим их [1, 5–7].
Проблема лечения псориаза не теряет своей актуальности и, несмотря на появление новых современных методов лечения, остается сложной задачей, требующей персонифицированного и, в случае выявления тяжелых коморбидностей, мультидисциплинарно-го подхода [1, 8]. Для лечения псориаза существует широкий спектр местных и системных препаратов, большинство из которых обладает иммуномодулирующим эффектом [9, 10]. При выборе индивидуальной схемы терапии учитывается распространенность и степень тяжести псориаза, стадия псориатического процесса, его клиническая форма, а также отношение к болезни самого пациента [11].
Так, при локализации высыпаний на открытых участках кожного покрова (лицо, волосистая часть головы и кисти) болезнь оказывает значительное влияние на качество жизни и вызывает тяжелые психоэмоциональные переживания. По данным G. Krueger et al., 40 % больных псориазом были разочарованы в эффективности получаемого лечения и 32 % считали лечение недостаточным [12]. В связи с этим необходимо продолжать поиск новых патогенетических подходов в терапии псориаза.
В настоящее время особенно остро ставится вопрос об участии микрофлоры кишечника в патологии человека [13–15]. Установлено, что при псориазе наиболее часто встречающимися коморбидными состояниями являются сахарный диабет, неалкогольный стеатогепатит, кардиоваскулярные расстройства [16, 17]. При этом основную роль в развитии стеатогепатита отводят качественным и количественным нарушениям состава микробиоты кишечника, которые рассматриваются в качестве индуктора ФНО-α-стимули-рованной воспалительной реакции, являющейся также одним из патогенетических звеньев в развитии псориаза [18]. Таким образом, как при псориазе, так и при ряде ко-морбидных состояний имеется взаимосвязь воспалительных реакций с изменениями микрофлоры кишечника. В частности, недавно опубликованные данные свидетельствуют о том, что изменение (модификация) состава микробиоты кишечника за счет подавления патогенной и условно-патогенной микрофлоры улучшает толерантность к пероральной нагрузке глюкозой и уменьшает стеатоз печени [19]. Кроме того, в этих же исследованиях отмечена корреляция между уменьшением количества патогенных и условнопатогенных бактерий в слепой кишке и снижением концентрации липополисахарида в плазме крови, а также уменьшением экспрессии м-РНК кишечного ФНО-α. Полученные данные указывают на то, что микробиота кишечника является фактором, объединяющим патогенез псориаза и коморбидных состояний [1]. В связи с этим изучение микробиоты толстой кишки может являться одним из звеньев диагностики такого системного процесса, как псориаз.
В настоящее время существуют различные методы оценки микрофлоры толстого отдела кишечника, однако, несмотря на некоторые недостатки, способ культурального изучения толстокишечной микробиоты не теряет своей актуальности в связи с доступностью для врача и пациента и приемлемой системой оценки результатов [13].
Цель исследования. Изучение состояния толстокишечной микробиоты у больных псориазом и ее состава в зависимости от вида и тяжести заболевания.
Материалы и методы. Согласно современным представлениям, диагностика псориаза проводится на основании данных объективного обследования с применением пробы на наличие у пациентов симптомов псориатической триады [6, 11]. Оценка тяжести псориаза производится с помощью общепринятого индекса охвата и тяжести псориаза PASI. Основываясь на значениях индекса, выделяют 3 степени тяжести псориаза (легкую, среднюю и тяжелую).
Обследовано 90 больных псориазом в возрасте от 21 до 78 лет (средний возраст – 38 лет), находившихся на лечении в стационаре Областного клинического кожновенерологического диспансера г. Ульяновска в 2013–2015 гг. Группу сравнения составили 20 практически здоровых людей.
Изучение микрофлоры кишечника у больных псориазом и лиц контрольной группы проводили согласно приказу Минздрава России от 09.06.2003 № 231 «Об утверждении отраслевого стандарта «Протокол ведения больных. Дисбактериоз кишечника» (ОСТ 91500.11.0004-2003) на базе бактериологической лаборатории.
Забор фекалий для микробиологического исследования производили в стерильные флаконы с использованием стерильных стеклянных палочек после естественной дефекации из глубины исследуемого материала.
Культуры, выросшие на питательных средах, подвергали групповой (анаэробные, неспорообразующие бактерии), родовой (лактобациллы, бифидобактерии, энтерококки) и видовой идентификации (стафилококки, эшерихии). Таксономическую принадлежность изолированных бактерий оценивали на основании изучения роста бактерий в аэробных и анаэробных условиях, отношения к окраске по Грамму, характера роста на селективных средах, биохимической и серологической идентификации [21].
Полученные результаты подвергали корреляционному анализу с помощью пакета программ Statistica 6.0.
Результаты и обсуждение. Среди обследованных больных мужчины составили 63 % (57 чел.), женщины – 37 % (33 чел.). Стаж заболевания псориазом у пациентов варьировал от 2 мес. до 43 лет (в среднем – 15 лет), псориаз у всех пациентов находился в прогрессирующей стадии. К моменту госпитализации период обострения псориаза продолжался от 2 нед. до 5 мес. (в среднем – 1 мес.).
У всех пациентов кожный процесс был распространенным, PASI составлял от 38,8 до 72,0 балла (среднее значение – 50,7 балла). Обследованные пациенты имели следующие формы псориаза: псориаз вульгарный (ПсВ) – 73,55 %, псориатический артрит (ПсАр) – 26,45 %. Во всех случаях псориатический артрит сопровождался наличием кожных проявлений распространенного псориатического процесса.
66,7 % (60 чел.) обследованных предъявляли жалобы со стороны работы желудочнокишечного тракта (боли, имеющие постпран-диальный характер, явления метеоризма, эпизоды диареи).
При изучении изменений микрофлоры толстой кишки в зависимости от формы псориаза достоверных различий в составе микроорганизмов выявлено не было (p>0,05) (табл. 1). Однако было отмечено некоторое угнетение облигатных микроорганизмов, проявлявшееся в уменьшении обсемененно-сти толстого отдела кишечника. Выявлено уменьшение представителей рода Bifidobacterium при псориазе в сочетании с артритом и при вульгарном псориазе по сравнению с контролем в 1,3 и 1,2 раза соответственно, а также уменьшение представителей рода Lactobacillus , которых при псориазе в сочетании с артритом было меньше, чем при вульгарной форме псориаза.
Общая микробная обсемененность (общее микробное число, ОМЧ) толстого отдела кишечника у больных псориазом была достоверно ниже, чем в группе сравнения. Изучение состояния толстокишечной микрофлоры показало наличие признаков дисбиоза у 86 % пациентов с псориазом: дисбиоз 1-й степени выявлен у 14 % пациентов, 2-й степени – у 59 %, 3-й степени – у 13 % больных.
При псориатическом артрите количество грибов рода Candida было увеличено в 1,15 раза, что косвенно свидетельствует о прогностически более тяжелом состоянии. Также при данной форме псориаза выявлено более выраженное снижение содержания типичных форм кишечной палочки по сравнению с вульгарной формой. При этом содержание нетипичных форм кишечной палочки, а также Clostridium и St. aureus при псориазе в сочетании с артритом превышало их содержание при вульгарной форме псориаза.
Полученные данные свидетельствуют о наличии более глубоких дисбиотических нарушений в толстом отделе кишечника у больных с тяжелой формой псориаза в сочетании с артритом, проявляющихся в угнетении нормальной микрофлоры и росте условно-патогенных и даже патогенных микроорганизмов.
Наибольшие сдвиги по составу микрофлоры отмечались при стаже заболевания псориазом более 20 лет (табл. 2).
S. aureus и Klebsiella spp. выявлены только у больных со стажем заболевания более 20 лет. При этом у данных пациентов обнаружено в 2 раза больше представителей рода Candida , чем в группе сравнения, и меньше основных представителей фекальной нормальной микробиоты в толстой кишке (бифидо- и лактобактерий, типичных кишечных палочек) (p<0,05).
Установлена прямая зависимость между продолжительностью заболевания псориазом и микробной обсемененностью толстой кишки (r=0,56) (рис. 1).
Таким образом, наиболее выраженные нарушения в составе толстокишечной микробиоты выявлены у больных, страдающих псориазом более 20 лет. Эти изменения проявлялись в снижении количества индигенной микробиоты и появлении кишечных палочек с нетипичными свойствами.
Таблица 1
Количественное содержание микробиоты в толстом отделе кишечника, lg КОЕ/мл
|
Микроорганизмы |
ПсВ |
ПсAр |
Здоровые |
|
Bifidobacterium |
7,70±1,07* |
7,18±1,18* |
9,50±0,50 |
|
Lactobacillus |
6,37±0,76* |
6,05±0,77* |
7,54±0,59 |
|
E.coli типичн. |
6,49±1,38 |
6,03±1,24 |
7,71±0,42 |
|
E. coli л/нег. |
4,06±1,20* |
4,85±1,03* |
3,25±0,50 |
|
E. coli гемол. |
3,18±1,30 |
3,53±1,35 |
- |
|
Enterococcus |
5,77±0,91 |
5,65±1,04 |
5,99±0,64 |
|
S. viridans |
5,02±1,42 |
5,25±1,53 |
- |
|
St. aureus |
3,05±0,61 |
4,06±0,71 |
- |
|
S. epidermidis |
5,03±1,05 |
4,68±0,68 |
3,04±0,11 |
|
Candida |
4,70±1,00* |
5,40±0,75* |
2,80±0,45 |
|
Acinetobacter |
6,15±1,20 |
- |
- |
|
Proteus |
3,58±0,66 |
3,43±0,51 |
3,08±0,15 |
|
Clostridium |
4,17±0,66* |
4,60±0,55* |
3,15±0,21 |
|
Bacteroides |
7,27±1,20 |
7,34±1,04 |
9,02±0,46 |
|
Klebsiella |
5,49±0,85 |
4,49±1,31 |
- |
|
ОМЧ |
8,28±0,87 |
7,92±0,84 |
9,71±0,40 |
Примечание. * – достоверность отличия показателя от показателя здоровых лиц (р<0,05).
Таблица 2
|
Микроорганизмы |
Больные псориазом |
Здоровые |
|
Bifidobacterium |
6,88±0,76* |
9,50±0,50 |
|
Lactobacillus |
5,77±0,59* |
7,54±0,59 |
|
E. coli типичные |
5,90±1,23* |
7,71±0,42 |
|
E. coli лак/нег. |
4,54±1,51 |
3,25±0,50 |
|
E. coli гемолит. |
3,68±1,17 |
- |
|
Enterococcus |
6,09±0,78* |
5,99±0,64 |
|
S. viridans |
4,98±0,80 |
- |
|
S. aureus |
3,69±0,81 |
- |
|
S. epidermidis |
5,27±0,77 |
3,04±0,11 |
|
Candida |
5,32±0,81* |
2,80±0,45 |
|
Acinetobacter |
5,30±0,00 |
- |
|
Proteus |
3,58±0,51 |
3,08±0,15 |
|
Clostridium |
4,43±0,98 |
3,15±0,21 |
|
Bacteroides |
7,00±1,26* |
9,02±0,46 |
|
Klebsiella |
4,99±1,46 |
- |
|
ОМЧ |
7,72±0,77* |
9,71±0,40 |
Примечание. * – достоверность отличия показателя от показателя здоровых лиц (р<0,05).
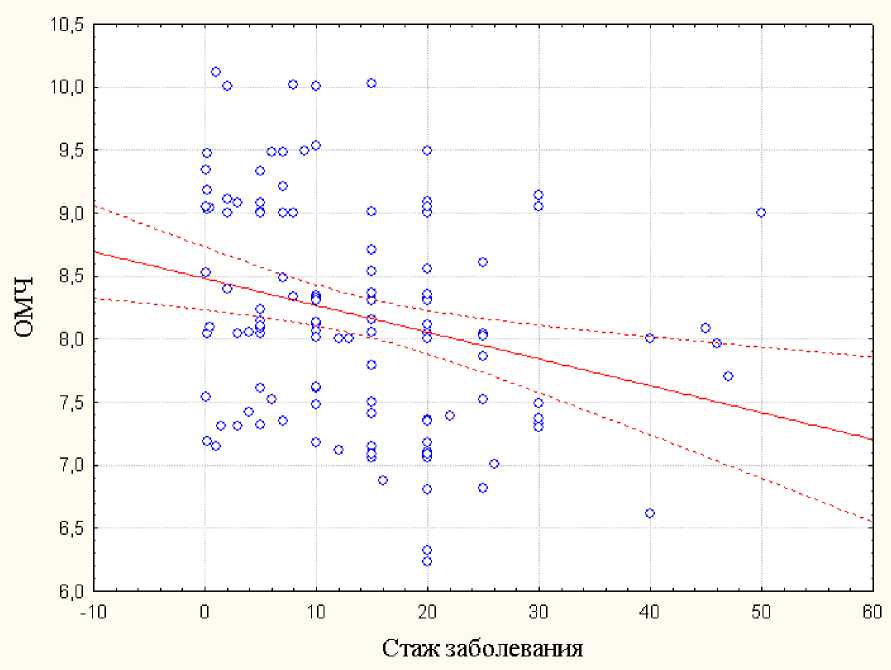
Рис. 1. Зависимость микробной контаминации толстой кишки от продолжительности течения псориаза
Выводы:
-
1. У 86 % обследованных пациентов с псориазом обнаружены явления дисбиоза в толстом отделе кишечника. Большая часть (66,7 %) обследованных больных предъявляла жалобы на боли, имеющие постпранди-альный характер, явления метеоризма, эпизоды диареи. При этом все пациенты имели прогрессирующую форму заболевания и распространенный кожный процесс.
-
2. Дисбиотические сдвиги усугублялись в зависимости от тяжести течения кожного процесса и были более выражены у больных с псориазом в сочетании с артритом.
-
3. Оценка полученных данных свидетельствует о наличии корреляции между тяжестью псориатического процесса по PASI и степенью выраженности дисбиоза в толстой кишке (r=0,56).
-
4. Наиболее выраженные нарушения в составе толстокишечной микробиоты выявлены у больных, страдающих псориазом более 20 лет. Эти изменения проявлялись в снижении количества индигенной микробиоты и появлении кишечных палочек с нетипичными свойствами.
Список литературы Патогенетически значимые изменения толстокишечной микрофлоры при псориазе
- Квереши А.А., Чой Х.К., Сетти А.Р., Курхан Г.С. Псориаз и риск развития диабета и гипертензии (Проспективное исследование медицинских сестер США). Русский медицинский журн. 2010; 12: 765-768
- Raychaudhuri S.P., Farber E.M. The prevalence of psoriasis in the world. Journal of the Europeon Academy of Dermatology and Venerology. 2001; 15: 1617
- Reich K. The concept of psoriasis as a systemic inflammation: implications for disease management. Journal of the Europeon Academy of Dermatology and Venerology. 2012; 26 (2): 3-11
- Курников Г.Ю., Клеменова И.А., Жукова Г.И., Воронова Н.Ю. Состояние микрофлоры толстой кишки у больных хроническими дерматозами. Российский журн. кожных и венерических болезней. 2002; 3: 38-39
- Кочергин Н.Г., Потекаев Н.Н., Смирнова Л.М. Наш первый опыт применения адалимумаба при псориазе. Российский журн. кожных и венерических болезней. 2012; 5: 37-41
- Молочков В.А., Бадокин В.В., Альбанова В.И., Волнухин В.А. Псориаз и псориатический артрит. М.: Т-во научных изданий КМК; 2007. 300
- Нестеров А.С. Система перекисного окисления липидов эритроцитов при хронических дерматозах. Российский журн. кожных и венерических болезней. 2007; 3: 37-39
- Boehncke W.H., Boehncke S., Tobin A.M., Kirby B. The «psoriatic march»: A concept of how severe psoriasis may drive cardiovascular comorbidity. Exp. Dermatol. 2011; 20: 303-307
- Олисова О.Ю., Теплюк Н.П., Пинегин В.Б. Современные методы лечения псориаза. Русский медицинский журн. 2015; 9: 483-486
- Пегано Дж. О.А. Лечение псориаза -естественный путь: пер. с англ. М.: КУДИЦ-ОБРАЗ; 2001. 194
- Олисова О.Ю. Псориаз: эпидемиология, патогенез, лечение. Consilium medicum. 2010; 5: 34-37
- Krueger G., Koo J., Lebwohl M., Menter A., Stern R.S., Rolstad T. The impact of psoriasis on quality of life: results of a 1998 National Psoriasis Foundation patientmembership survey. Arch Dermatol. 2001; 137 (3): 280-284
- Бондаренко В.М., Мацулевич Т.В. Дисбактериоз кишечника как клинико-лабораторный синдром: современное состояние проблемы: руководство для врачей. М.: ГЭОТАР-Медиа; 2007. 304
- Парфенов А.И. Энтерология: руководство для врачей. М.: Триада-Х; 2002. 744
- Zaidel O., Lin H.C. Uninvited Guests: The Impact of Small Intestinal Bacterial Overgrowth on Nutritional Status. J. Practical Gastroenterology. 2003; July: 27-34
- Рыбин А.В., Нестеров А.С., Потатуркина-Нестерова Н.И., Нестерова А.В. Этиологическая структура онихомикозов у больных псориазом. Успехи современного естествознания. 2011; 1: 107-108
- Ravi-Nikolić A., Radosavljević G., Jovanović I. Systemic photochemotherapy decreases the expression of IFN-γ, IL-12p40 and IL-23p19 in psoriatic plaques. Eur. J. Dermatol. 2011; 21 (1): 53-57
- Kim I.H., West C.E., Kwatra S.G., Feldman S.R., O’Neill J.L. Comparative efficacy of biologics in psoriasis: a review. Am. J. Clin. Dermatol. 2012; 13 (6): 365-374
- Гриневич В.Б., Сас Е.И., Кравчук Ю.А., Ефимов О.И., Орос А.И. Новые подходы к лечению хронического системного воспаления и синдрома инсулинорезистентности у больных неалкоголь-ной жировой болезнью печени. Русский медицинский журн. 2011; 5: 298-304
- Гумаюнова Н.Г., Нестеров А.С., Потратуркина-Нестерова Н.И., Магомедов М.А. Новые подходы к диагностике кишечного дисбиоза у пациентов с псориатической болезнью. Вестник РУДН. Сер. Медицина. 2009; 2: 93-97


