Патоморфологические исследования внутренних органов лабораторных крыс при изучении хронической токсичности кормовой добавки кобаметин
Автор: Кравченко В.М., Косых А.В., Шантыз А.Х., Еганян Е.С.
Статья в выпуске: 3 т.259, 2024 года.
Бесплатный доступ
Целью исследований стало изучение влияния кормовой добавки кобаметин при длительном применении на органы и ткани лабораторных животных. По результатам исследований можно отметить достоверную разницу в показателях массового коэффициента печени между животными контрольной и опытных групп: в 1-й группе данный показатель был выше, чем в контроле на 15,39 %, во 2-й опытной группе на 25,70 %. Также зафиксирована достоверная разница между контрольной и 2-й опытной группой по разнице массовых коэффициентов селезенки: в опытной группе данный показатель оказался ниже на 16,40 %. Патологоанатомические и гистологические исследования показали, что кормовая добавка кобаметин в дозах 153,0 мг/кг 307,0 мг/кг может вызывать нарушения гемодинамики и в различной степени выраженные дистрофические изменения во внутренних органах подопытных крыс. В контрольной группе животных патоморфологических изменений не установлено. Полученные результаты следует учитывать при составлении полной картины хронического токсического действия добавки с учетом лабораторных данных, общего анализа крови и биохимического профиля сыворотки крови в целях прогнозирования возможных побочных эффектов при выборе доз в клинических исследованиях.
Хроническая токсичность, кобаметин, кормовая добавка, лабораторные животные, внутренние органы, патоморфология, гистоструктура
Короткий адрес: https://sciup.org/142242471
IDR: 142242471 | УДК: 619:574.64:616-091 | DOI: 10.31588/2413_4201_1883_3_259_105
Текст научной статьи Патоморфологические исследования внутренних органов лабораторных крыс при изучении хронической токсичности кормовой добавки кобаметин
Как известно микроэлементы входят в состав целого ряда ферментов и гормонов поэтому играют значительную роль в питании животных и птицы [9]. По многолетним данным исследований ветеринарных специалистов и ученых одной из главных причин расстройств обмена веществ и, соответственно, здоровья продуктивных животных является хронический комплексный дефицит микроэлементов как кобальт, марганец железо, цинк, медь [1, 2, 4].
Традиционно применяемая минеральная основа компонентного состава корма в виде неорганических солей не является оптимальной для обеспечения жизнедеятельности животных, в виду возможного антагонизма между микроэлементами, их низкой биодоступности, инактивации витаминов [7, 8].
Недостаток кобальта замедляет процесс кроветворения, приводит к эндемическому заболеванию-акобальтозу, ингибированию фермента транскарбоксилазы, фермента оказывающее большое значение в реакциях окисления лейцина [3, 6].
Поэтому включение органических форм микроэлементов в комбикорм позволяет сократить ввод отдельных неорганических кормовых добавок, повысить экономическую эффективность сельскохозяйственного производства за счет улучшения продуктивности животных [8].
А. В. Сорокина с соавторами считает, что «Данные, получаемые в ходе клинико-лабораторных исследований, в частности патоморфологических, представляют особую ценность при составлении полной картины токсического действия препарата при его многократном введении, поскольку позволяют идентифицировать органы-мишени воздействия препарата, оценить степень и обратимость эффектов и, соответственно, спрогнозировать возможные нежелательные явления при клинических исследованиях» [5].
В связи с этим целью данной работы стало определение влияния кормовой добавки кобаметин на органы и ткани лабораторных животных в ходе изучения хронической токсичности.
Материал и методы исследований. Исследования на лабораторных животных проводились на базе научно-испытательного центра токсико-фармакологических исследований и разработки лекарственных средств ветеринарного применения, кормовых добавок и дезинфектантов (НИЦ Ветфармбиоцентр), являющийся структурным подразделением ФГБОУ ВО «Кубанский государственный аграрный университет имени И. Т. Трубилина». Патоморфологические исследования проводили в лаборатории патоморфологии кафедры анатомии, ветеринарного акушерства и хирургии Кубанского ГАУ.
В качестве объекта исследований использовали кормовую добавку кобаметин, которая предоставляет собой комплексное соединение кобальта с 2 амино-метил-тио-(S-оксо-S-амино) масляной кислоты.
Изучение параметров хронической токсичности кормовой добавки проводили на половозрелых крысах разного пола в течение 90 дней. Для исследования было сформировано три группы крыс в возрасте 3-3,5 месяцев, с массой тела, в среднем, 228,33 г (две опытные и одна контрольная) по десять животных в каждой, по пять самок и пять самцов.
В остром опыте величина LD50 была установлена на уровне дозы 1533,4 мг/кг, отправным моментом для выбора доз в первой опытной группе животных явилась 1/10 от LD50, установленной в остром опыте – 153 мг/кг массы тела, второй опытной группе 1/5 или 307 мг/кг массы тела. Третья группа лабораторных крыс служила биологическим контролем. Схема опыта предусматривала однократное ежедневное применение кормовой добавки внутрижелудочно через специальный зонд. Животным контрольной группы аналогичным способом задавали дистиллированную воду.
Патологоанатомические и патогистологические исследования проводили по общепринятой методике, с фиксацией материала в 10 %-ном растворе формалина. Все манипуляции с лабораторными крысами проводили с соблюдением международных рекомендаций с Европейской директивой 2010/63 согласно методике вскрытия и извлечения органов лабораторных животных (крысы).
Результат исследований. В результате анализа полученных результатов при длительном внутрижелудочном введении лабораторным животным кормовой добавки, установлено, что добавка в испытанных дозах оказывает определенное патологическое воздействие на организм лабораторных животных: в 1-й опытной группе был зафиксирован падеж 1-й головы на 14-й день эксперимента), во 2-й опытной группе зафиксирован падеж 1-й крысы на 9-й день эксперимента, в контрольной группе сохранность составила 100 %. У павших животных за 14-38 часов до гибели отмечались учащенное дыхание, снижение двигательной активности, отказ от воды и корма. У выживших животных 1-й опытной группы отмечалось лёгкое угнетение спустя 10 дней после начала хронического опыта, продолжительностью от 2-х до 4-х суток, у животных 2-й опытной группы начиная с 4-х суток эксперимента также отмечалось угнетение и снижение двигательной активности продолжительностью до 7-и суток.
Таблица 1 – Масса внутренних органов и массовые коэффициенты у крыс при изучении хронической токсичности кормовой добавки, г
|
Орган |
Группа |
||
|
контроль |
опыт 1 |
опыт 2 |
|
|
Желудок, г |
2,144±0,121 |
1,919±0,063 |
2,016±0,108 |
|
м.к., % |
0,702±0,037 |
0,640±0,019 |
0,674±0,042 |
|
Селезенка, г |
1,341±0,027 |
1,276±0,026 |
1,133±0,044 |
|
м.к., % |
0,440±0,008 |
0,426±0,009 |
0,378±0,015* |
|
Почки, г |
2,174±0,072 |
2,177±0,046 |
2,284±0,136 |
|
м.к., % |
0,712±0,008 |
0,726±0,008 |
0,760±0,041 |
|
Легкие, г |
3,350±0,214 |
3,231±0,228 |
3,196±0,222 |
|
м.к, % |
1,098±0,067 |
1,076±0,069 |
1,064±0,066 |
|
Сердце, г |
1,325±0,052 |
1,33±0,032 |
1,247±0,035 |
|
м.к., % |
0,434±0,013 |
0,444±0,009 |
0,416±0,009 |
|
Печень, г |
10,31±0,296 |
11,682±0,263 |
12,751±0,563 |
|
м.к., % |
3,378±0,017 |
3,898±0,094* |
4,246±0,133* |
Результаты достоверны по отношении к группе биологического контроля: * - P≤0,05
С целью проведения патологоанатомического исследования внутренних органов и тканей и определения массовых коэффициентов (м.к.) в конце эксперимента была проведена некропсия пяти животных из каждой экспериментальной группы. Результаты определения масс и массовых коэффициентов внутренних органов представлены в таблице 1.
Масса внутренних органов опытных крыс находились в пределах физиологических показателей для данного вида животных. Стоит отметить достоверную разницу в показателях массового коэффициента печени между животными контрольной и опытных групп: в 1-й группе данный показатель был выше, чем в контроле на 15,39 %, во 2-й опытной группе на 25,70 % (при P≤0,05). Также зафиксирована достоверная разница между контрольной и 2-й опытной группой по разнице массовых коэффициентов селезенки: в опытной группе данный показатель оказался ниже на 16,4 % (при P≤0,05).
В целях сравнительного анализа паталогических изменений в органах и тканях относительно павших животных опытных групп была выведена из эксперимента одна крыса контрольной группы на 15 день опыта путем декапитации. Существенных изменений в патологической картине при изучении состояния внутренних органов у крысы контрольной группы не зарегистрировано.
В почках отмечали хроническую венозную гиперемию, которая характеризовалась атрофией канальцев в результате активной диффузной пролиферации молодых клеток соединительной ткани. Большинство эпителиоцитов канальцев находились в состоянии зернистой дистрофии, а часть из них была подвергнута некрозу. При этом повсеместно отмечали отложения пигмента гемосидерина (Рисунок 6).
В миокарде сердца определяли хроническую венозную гиперемию, которая характеризовалась бурой индурацией с атрофией кардиомиоцитов в результате пролиферации молодых клеток соединительной ткани, образованием пигмента гемосидерина и некрозом отдельных кардиомиоцитов (Рисунок 7).
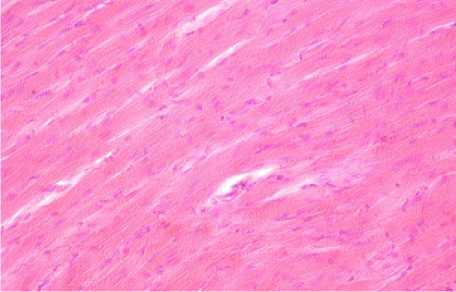
Рисунок 1 - Миокард сердца крысы контрольной группы. Окраска гематоксилином и эозином, ув. 400 (об. 40, ок. 10)
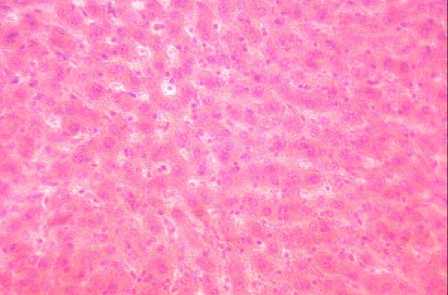
Рисунок 2 – Печень крысы контрольной группы. Окраска гематоксилином и эозином, ув. 400 (об. 40, ок. 10)
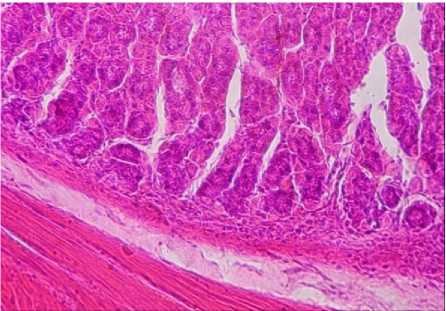
Рисунок 3 – Желудок крысы контрольной группы. Окраска гематоксилином и эозином, ув. 400 (об. 40, ок. 10)
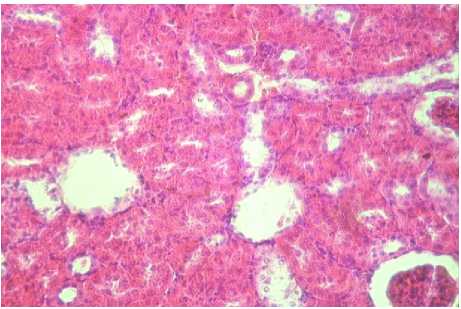
Рисунок 4 – Почка крысы контрольной группы. Окраска гематоксилином и эозином, ув. 400 (об. 40, ок. 10)
В печени отмечали хроническую венозную гиперемию. В результате чего происходила тотальная дискомплексация балок, атрофия, зернистая дистрофия и некроз гепатоцитов, образование пигмента гемосидерина, пролиферация молодых клеток соединительной ткани (Рисунок 8).
В селезенке диагностировали хроническую венозную гиперемию, которая характеризовалось пролиферацией молодых клеток соединительной ткани со стороны капсулы и трабекул, атрофией фолликулов и образование значительного количества гемосидерина в красной пульпе (Рисунок 9).
В желудочных и брыжеечных лимфоузлах отмечали процессы экссудации, которые сопровождались расширением краевых, корковых и мозговых синусов, а также пролиферацию отдельных небольших групп полибластов со стороны капсулы и трабекул.
У крысы первой опытной группы явления нарушения гемодинамики протекали хронически и характеризовались бурой индурацией с накоплением пигмента гемосидерина в легких, печени, почках и увеличением его количества в селезенке. Кроме того, в печени и почках отмечали преобладание процессов острой и хронической альтерации в виде некроза, белковой и жировой дистрофии.
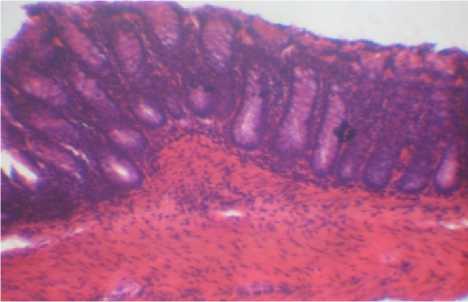
Рисунок 5 – Дуоденум крысы первой опытной группы. Хронический катаральный энтерит. Окраска гематоксилином и эозином, ув. 200 (об. 20, ок. 10)
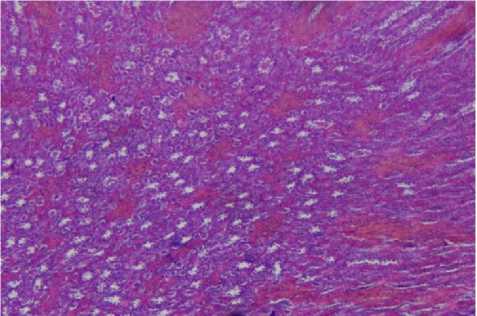
Рисунок 6 – Почка крысы первой опытной группы. Хроническая венозная гиперемия. Окраска гематоксилином и эозином, ув. 200 (об. 20, ок. 10)
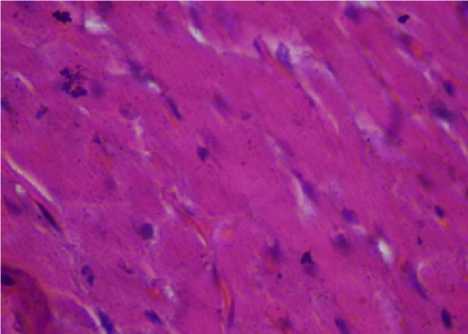
Рисунок 7 – Миокард сердца крысы первой опытной группы. Бурая индурация, кариолизис кардиомиоцитов. Окраска гематоксилином и эозином, ув. 400 (об. 40, ок. 10)
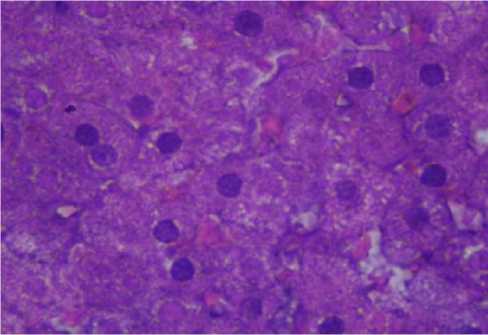
Рисунок 8 – Печень крысы первой опытной группы. Бурая индурация, зернистая дистрофия и кариолизис гепатоцитов.
Окраска гематоксилином и эозином, ув. 600
(об. 40, ок. 15)
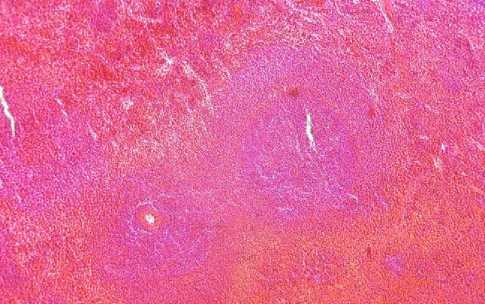
Рисунок 9 – Селезенка крысы первой опытной группы. Бурая индурация.
Окраска гематоксилином и эозином, ув. 200 (об. 20, ок. 10)
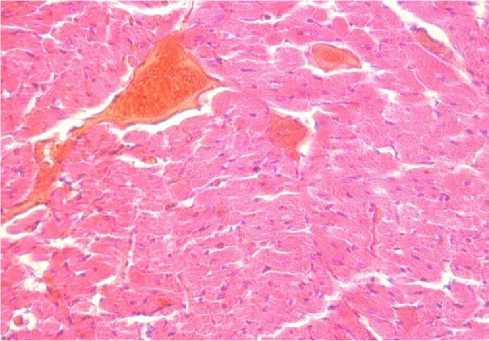
Рисунок 10 – Миокард сердца крысы второй
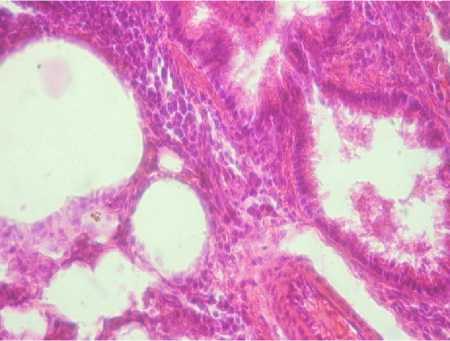
Рисунок 11 – Легкое крысы второй опытной
опытной группы. Острая венозная гиперемия.
Окраска гематоксилином и эозином, ув. 400 (об.
группы. Острая венозная гиперемия и отек.
Окраска гематоксилином и эозином, ув. 400
40, ок. 10)
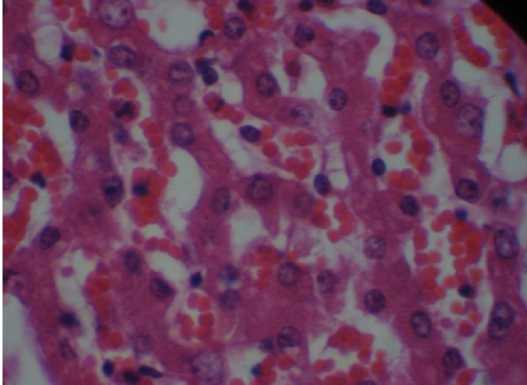
Рисунок 12 – Печень крысы второй опытной группы. Острая венозная гиперемия. Окраска гематоксилином и эозином, ув. 600 (об. 40, ок.
(об. 40, ок. 10)
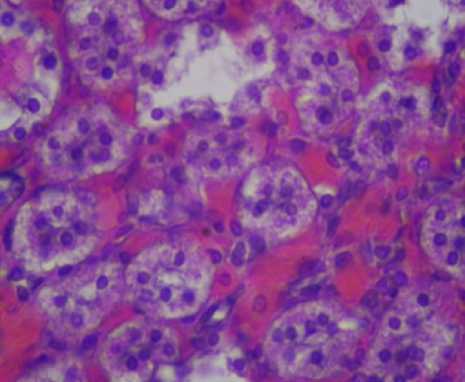
Рисунок 13 – Почка крысы второй опытной группы. Острая венозная гиперемия. Окраска гематоксилином и эозином, ув. 600 (об. 40, ок. 15)
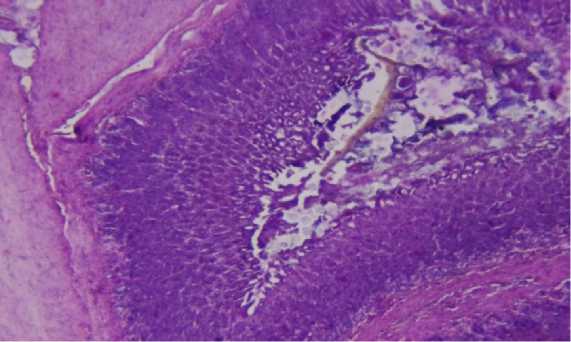
Рисунок 14 – Тонкий отдел кишечника крысы второй опытной группы. Острый катаральный энтерит. Окраска гематоксилином и эозином, ув. 200 (об. 20, ок. 10)
В миокарде сердца отмечали острое венозное полнокровие, которое характеризовалось расширением кровеносных сосудов, вследствие чего эндотелиальные клетки приобретали уплощенную и вытянутую форму (Рисунок 10).
В легких определяли острое венозное полнокровие сосудов, преимущественно капилляров, выпот отечной жидкости в бронхи, бронхиолы в альвеолы, в результате этого часть бронхов, бронхиол и альвеол была расширена, а альвеолярный эпителий десквамирован (Рисунок 11).
В печени выявляли острую венозную гиперемию междольковых капилляров, что обуславливало раздвигание и искривление печеночных балок. Некоторые балки находились в состоянии дискомплексации (Рисунок 12).
В почках выявляли острую венозную гиперемию, которая характеризовалась переполнением капилляров, расположенных между канальцами и их сдавливанием, в результате чего просветы канальцев ссужались (Рисунок 13).
В селезенке из-за острой венозной гиперемии в красной пульпе отмечается тотальное расширение синусов, в результате чего эндотелиальные клетки приобретали вытянутую форму и располагались на значительном расстоянии друг от друга.
В дуоденуме определяли острое катаральное воспаление, которое характеризовалось гиперсекрецией эпителиоцитов слизистой оболочки, в результате чего они увеличивались в размере, а затем разрывались и весь экссудат, состоящий из секрета и остатков эпителиоцитов, поступал в просвет кишечника и полностью его заполнял (Рисунок 14).
В бронхиальных и средостенных лимфоузлах отмечали острое венозное полнокровие, которое характеризовалось переполнением и расширением кровеносных сосудов, переполнением и расширением краевых, корковых и мозговых синусов, содержащих в себе элементы крови.
В желудочных и брыжеечных лимфоузлах отмечали экссудативное воспаление, которое характеризовалось переполнением и расширением краевых, корковых и мозговых синусов в результате экссудации серозного экссудата, содержащего в своем составе незначительное количество лимфатических клеток.
Заключение.
Патологоанатомические и гистологические исследования показали, что кормовая добавка кобаметин в дозах 153,0 мг/кг 307,0 мг/кг может вызывать нарушения гемодинамики и в различной степени выраженные альтеративные изменения во внутренних органах подопытных крыс. В контрольной группе животных патоморфологических изменений не установлено.
Полученные результаты следует учитывать при составлении полной картины хронического токсического действия добавки с учетом лабораторных данных общего анализа крови и биохимического профиля сыворотки крови в целях прогнозирования возможных побочных эффектов при выборе доз в клинических исследованиях.
Список литературы Патоморфологические исследования внутренних органов лабораторных крыс при изучении хронической токсичности кормовой добавки кобаметин
- Бабаев, Ш. Б. Применение меди, марганца и кобальта при лечении гипо- и гиперхромных форм анемии / Ш. Б. Бабаев [и др.] // Микроэлементы в сельском хозяйстве и медицине. – Киев, 2009. – С. 127.
- Ветеринарная токсикология / Д. Д. Хайруллин, Ф. А. Медетханов, А. П. Овсянников, Л. А. Муллакаева. – Казань: Казанская государственная академия ветеринарной медицины имени Н.Э. Баумана, 2019. – 150 с.
- Еганян, Е. С. Изучение острой и хронической токсичности кормовой добавки абиопептид-плюс на лабораторных животных / Е. С. Еганян, А. Х. Шантыз, Е. Ю. Марченко // Международный научно-исследовательский журнал. – 2020. – № 12- 2(102). – С. 91-94.
- Жолобова, И. С. Изучение острой токсичности нового хелатного соединения на основе кобальта / И. С. Жолобова, А. В. Косых // Точки научного роста: на старте десятилетия науки и технологии. Материалы ежегодной научно-практической конференции преподавателей по итогам НИР за 2022 г., Краснодар, 12 мая 2023 года. – Краснодар: Кубанский государственный аграрный университет имени И.Т. Трубилина, 2023. – С. 211–213.
- Опыт проведения клинико-лабораторных исследований в доклинической оценке безопасности лекарств (Часть 2: биохимические и патоморфологические исследования) / А. В. Сорокина, С. В. Алексеева, Н. В. Еремина, А. Д. Дурнев // Ведомости научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. – 2019. – Т. 9. – № 4. – С. 272-279.
- Иванов, И. С. Влияние микроэлементов Cu, Co, Zn и Mn в органической форме на организм животных / И.С. Иванов, В. А. Руденок, Е. И. Трошин, А. Н. Куликов // Вопросы нормативно-правового регулирования в ветеринарии. – 2016. – № 4. – С. 246-249.
- Куликов, А. Н. Влияние хелатных комплексов Cu и Zn с глицином и сульфатов данных металлов на мясную продуктивность ягнят / А. Н. Куликов, И. С. Иванов, А. В. Шишкин, Ю. Г. Крысенко // Инновационные технологии для реализации программы 20 научно-технического развития сельского хозяйства: материалы Международной научно-практической конференции. В 3 т. – Ижевск: ФГБОУ ВО Ижевская ГСХА. – 2018. – Т. 2. – С. 66-68.
- Фоминова, И. О. Профилактика смешанных заболеваний животных микроэлементами / И. О. Фоминова // Инновации в производстве, хранении и переработке сельскохозяйственной продукции: науч.- практ. конф. студентов, аспирантов и молодых ученых. – Ставрополь. – 2015. – С. 240-243.
- Шантыз, А. Х. Хроническая токсичность кормовой добавки абиотоник / А. Х. Шантыз, Е. Ю. Марченко // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. – 2020. – № 161. – С. 52-60.


