ПЦР-диагностика с флуоресцентной детекцией в режиме реального времени для быстрого обнаружения Mycoplasma hyopneumoniae в ассоциации c Streptococcus pneumoniae у свиней
Автор: Толстова Е.А., Лигидова М.М., Агольцов В.А., Черных О.Ю., Падило Л.П., Попова О.М.
Статья в выпуске: 2 т.254, 2023 года.
Бесплатный доступ
Цель исследования - применение ПЦР с флуоресцентной детекцией в режиме реального времени для обнаружения при микстинфекциях Mycoplasma hyopneumoniae и Streptococcus pneumoniae. Результаты, полученные при проведении лабораторных диагностических исследований патматериала от свиней, поступившего в Кропоткинскую краевую лабораторию за последние 3 года (с 2020 по 2022 гг.), свидетельствуют о высокой частоте обнаружения M. hyopneumoniae в ассоциации с S. pneumoniae (от 40 до 60 %). ПЦР - диагностика с флуоресцентной детекцией в режиме реального времени оптимальна для быстрого обнаружения Mycoplasma hyopneumoniae в ассоциации c Streptococcus pneumoniae у свиней.
Диагностика, пцр с флуоресцентной детекцией в режиме реального времени, свиньи
Короткий адрес: https://sciup.org/142238113
IDR: 142238113 | УДК: 619.615.33.616.24-002.636.4 | DOI: 10.31588/2413_4201_1883_2_254_264
Текст научной статьи ПЦР-диагностика с флуоресцентной детекцией в режиме реального времени для быстрого обнаружения Mycoplasma hyopneumoniae в ассоциации c Streptococcus pneumoniae у свиней
В настоящее время максимально ранняя диагностика смешанных инфекций является важнейшим принципом контроля за распространением инфекции в свиноводстве. ПЦР является единственным методом, основанном на прямой идентификации агента или его генетического материала. В основе полимеразной цепной реакции (ПЦР) лежит многократное реплицирование специфического участка нуклеотидной последовательности, катализируемое ДНК-полимеразой [2, 6, 9, 11].
Полимеразная цепная реакция – циклический процесс, принцип которого сводится к следующему: молекулу ДНК подвергают температуре 95 °C (денатурации) для расплетения двойной цепи ДНК, далее при охлаждении до 5565°C праймеры комплементарно присоединяются к специфическому фрагменту одноцепочной ДНК (отжиг праймеров), и при последующем повышении температуры до 72 °C начинается ферментативный процесс достройки (синтез) молекулы ДНК при участии фермента Taq-полимеразы. Эти операции составляют один цикл ПЦР и приводят к удвоению количества ДНК в исследуемом образце [2, 6, 13].
Микоплазмы – условно-патогенные микроорганизмы, способные проникать в ткани макроорганизма, размножаться в них, снижая его резистентность. Патогенными видами для свиней являются M. hyopneumoniae, M. hyorhinis, M. hyosynoviae, M. flocculare, M. axanthum и некоторые варианты A. laidlawii [1, 3, 16].
Микоплазмы могут распространяться аутогенно, горизонтально, и вертикально, вызывая соответственно эндогенные и экзогенные, в том числе инаппарантные инфекции [3, 4, 7].
M. hyopneumoniae – является возбудителем энзоотической пневмонии свиней ( Pneumonia enzootica) – инфекционной болезни, которая характеризуется катаральной бронхопневмонией, непостоянной лихорадкой, кашлем, задержкой роста и развития поросят и прогрессирующим их исхуданием при осложнениях бактериальными и вирусными возбудителями. Микоплазменная пневмония является длительной по течению патологией, особенно когда ассоциируется с другими инфекционными агентами [5, 9, 17].
Микоплазменные инфекции часто протекают как микстинфекции, в основном в сочетании с бактериями, такими как S. pneumoniae [5, 15, 17].
Streptococcus pneumoniae – важный зоонозный патоген, является основополагающей причиной развития у животных отита, менингита, сепсиса, бронхопневмонии. S. pneumoniae представляет собой защищённый капсулой микроб. Капсульные антигенные полисахариды формируют разнообразие серотипов возбудителя. Кроме того, даже среди штаммов одного серотипа Streptococcus pneumoniae наблюдается высокая генотипическая, фенотипическая и географическая изменчивость. Кроме того, S. pneumoniae имеет и другой комплекс факторов вирулентности, способствующий преодолению иммунной системы макроорганизма [8, 12, 14].
Цель исследования. Применение ПЦР с флуоресцентной детекцией в режиме реального времени для обнаружения при микстинфекциях Mycoplasma hyopneumoniae и Streptococcus pneumoniae.
Материал и методика исследований. Исследования проводились на базе Кропоткинской краевой ветеринарной лаборатории. Был применен ПЦР метод с флуоресцентной детекцией в режиме реального времени, с использованием ПЦР-наборов «Вет-Фактор» для выявления ДНК возбудителей микоплазмоза, рассчитанный на 110 реакций, и «АплиСенс» и для выявления ДНК стрептококкоза, рассчитанный на 55 реакций. Материалом для лабораторных исследований служили: смывы из носовых ходов и ротовой полости свиноматок и трупы поросят от одного до четырёх месяцев.
Для постановки ПЦР было задействовано следующее оборудование: Амплификаторы («Rotor-Gene 6000» Corbett Research, Австралия) и «Real-time CFX Connect» (Bio-Rad Laboratories, США) с принадлежностями, твердотельный термостат для пробирок типа «Эппендорф» на 1,5мл с диапазоном температур от 25 до 99 °C (ТТ-2-«Термит», Россия), микроцентрифуга для пробирок типа «Эппендорф» до 12 тыс. об/мин («MiniSpin», Германия), вортекс («ТЭТА-2», Россия) вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости («ОМ-1», Россия), настольный бокс с бактерицидной лампой («БАВп-«Ламинар-С» - 1,2», Россия).
Результат исследований.
Инфекции, вызванные M. Hyopneumoniae, являются причиной больших потерь для свиноводческой промышленности из-за замедленного роста и повышенного потребления корма, а также увеличивается опасность возникновения других респираторных инфекций. В таблице 1 представлены виды микоплазм изолированных от свиней.
Таблица 1 – Виды микоплазм изолированных от свиней
|
Вид микоплазм |
Заболевание, место выделения |
|
Mycoplasma hyopneumoniae |
Энзоотическая пневмония |
|
Mycoplasma hyorhinis |
Пневмония, полисерозит, полиартрит |
|
Mycoplasma arginini |
Выделена из респираторного тракта свиней |
|
Acholeplasma axanthum |
Изолирована из тканей свиней (легкие) |
|
Mycoplasma hyosynoviae |
Артрит у растущих и находящихся на откорме свиней |
|
Mycoplasma flocculare |
Выделена из дыхательных путей |
|
Mycoplasma sualvi |
Выделена из кишечника |
|
Mycoplasma hyopharyngis |
Выделена из кишечника |
|
Mycoplasma hyoartrinosa |
Выделена из суставной жидкости |
|
Mycoplasma hyogenitalium |
Выделена из матки |
|
Mycoplasma (Eperitroosum) suis |
Выделена из респираторного тракта свиней |
Результаты, полученные при проведении лабораторных диагностических исследований патматериала, поступившего в Кропоткинскую краевую лабораторию за последние 3 года (с 2020 по 2022 гг.), свидетельствуют о высокой частоте обнаружения M. hyopneumoniae в ассоциации с S. pneumoniae (Таблица 2).
Таблица 2 – Статистические данные по M. hyopneumoniae в ассоциации с S. pneumoniae в
Краснодарском крае за 2020-2022 гг.
|
Год |
Количество проб патматериала |
Проведено ПЦР исследований |
Получено положительных результатов |
% положительных результатов |
|
2020 |
15 |
15 |
6 |
40,0 |
|
2021 |
12 |
12 |
5 |
41,6 |
|
2022 |
20 |
20 |
12 |
60,0 |
Патологический материал отбирали следующим образом: мазки (со слизистой носоглотки, ротоглотки) снимали с помощью стерильного зонда, зонд помещали в пластиковую микропробирку объемом 1,5 мл с 0,5 мл стерильного физиологического раствора. Фрагменты тканей и органов - кусочки паренхиматозных органов размером 1х1х1 см (печень, легкие, селезенка), лимфатические узлы, фрагменты пораженных кожных покровов, мозг – отбирали в стерильные контейнеры.
Далее готовили исследуемые пробы для выделения ДНК. Пробы тканей и органов гомогенизировали с использованием стерильных фарфоровых ступок и пестиков, затем готовили 10% суспензию на стерильном фосфатном буфере. Суспензию переносили в пробирку объемом 1,5 мл и центрифугировали при 2 тыс. об/мин («MiniSpin», Eppendorf) в течение 5 минут. Супернатант использовали для экстракции НК.
Следующим этапом была экстракция ДНК из исследуемых образцов. Объем исследуемого материала для экстракции ДНК – 50-100 мкл для жидких проб, 20-40 мг для твердых гомогенизированных проб.
Отбирали и необходимое количество одноразовых пробирок для проб, включая пробирку для отрицательного контроля экстракции. Маркировали пробирки, пробирку для отрицательного контроля экстракции промаркировали как ВК-. Внесли в каждую пробирку по 10 мкл реагента ВКО из конкретного набора реагентов для амплификации ДНК, затем по 500 мкл лизирующего раствора. В пробирку ВК-вносили 100 мкл ОКО. В остальные пробирки с лизирующим раствором и ВКО вносили по 100 мкл проб, используя наконечники с фильтром.
Все пробы, включая пробирку ВК-, аккуратно перемешивали на вортексе и прогревали 5 минут при 60 ºС. Далее проводили центрифугирование образцов при 12000 об/мин5 («MiniSpin», «Eppendorf») в течение одной минуты. К прогретым пробам добавляли 100 мкл преципитирующего раствора, перемешивали на вортексе, после чего сбрасывали капли с крышек на микроцентрифуге. Тщательно ресуспендировали сорбент универсальный на вортексе. В каждую пробирку отдельным наконечником добавляли по 50 мкл ресуспендированного сорбента универсального. Перемешали на вортексе, оставили на столе на 5 минут. Для успешной сорбции пробирки с сорбентом периодически встряхивали на вортексе. Далее осаживали сорбент универсальный в пробирках центрифугированием при 12000 об/мин. («MiniSpin», «Eppendorf») в течение одной минуты. Удаляли супернатант с помощью вакуумного отсасывателя со сменными наконечниками. Добавляли к осадку 300 мкл раствора для отмывки №1, перемешивали на вортексе до полного ресуспендирования сорбента. Осаживали сорбент универсальный центрифугированием при 12 000 об/мин. («MiniSpin», «Eppendorf») в течение одной минуты. Удаляли супернатант с помощью вакуумного отсасывателя со сменными наконечниками. Добавляли к осадку 500 мкл раствора для отмывки №2, перемешивали на вортексе до получения однородной суспензии. Осаживали сорбент универсальный центрифугированием при 12000 об/мин («MiniSpin», «Eppendorf») в течение одной минуты. Удаляли супернатант с помощью вакуумного отсасывателя со сменными наконечниками, далее повторяли этот этап еще раз.
Затем тщательно, не захватывая сорбент, удаляли жидкость полностью.
Помещали пробирки в термостат при температуре 60 ºС на 15 минут для подсушивания. При этом крышки пробирок были открытыми.
Таблица 3 – Оценка результатов анализа ПЦР с флуоресцентной детекцией в режиме реального времени
|
Проба |
Канал детекции |
Результат |
|
|
JOE(HEX)/ Yellow |
FAM/Green |
||
|
M. hyopneumoniae S. pneumoniae |
ВКО |
||
|
ПКО К+ |
До 31 |
до 31 |
Реакции положительного и внутреннего контролей прошли успешно |
|
ДНК буфер К |
Сигнал отсутствует |
Сигнал отсутствует |
Реакция прошла успешно |
|
Любое значение |
Сигнал отсутствует |
Специфическая контаминация! Требуется повторная постановка! Рекомендуется поставить смывы |
|
|
Сигнал отсутствует |
Любое значение |
Контаминация ВКО! Требуется повторная постановка! Рекомендуется поставить смывы |
|
|
ОКО ВК |
Сигнал отсутствует |
Любое значение от 1 до 32 |
Экстракция прошла успешно |
|
Любое значение |
Сигнал отсутствует или любое значение |
Специфическая контаминация! Требуется повторная постановка! Рекомендуется поставить смывы |
|
|
Сигнал отсутствует |
Сигнал отсутствует или значение Ct >32 |
Результат недостоверный, возможно из-за ингибиторов. Требуется повторная экстракция! |
|
|
Образцы |
Любое значение от 1 до 30 |
Сигнал отсутствует или любое значение |
Результат анализа положительный. ДНК. M.hyopneumoniae. S. pneumoniae присутствует |
|
Сигнал отсутствует |
Любое значение от 1 до 32 |
Результат анализа отрицательный |
|
|
Сигнал отсутствует |
Сигнал отсутствует или значение Ct >32 |
Результат не достоверный. Требуется повторная экстракция |
|
Таблица 4 – Данные расчета ПЦР-исследования с флуоресцентной детекцией в режиме реального времени M. hyopneumoniae в ассоциации с S. pneumoniae
|
M. hyopneumoniae |
|||||||
|
Лунка |
Флуор. |
Мишень |
Содерж. |
Проба |
Cq |
Среднее Cq |
Стандарное отклонение Cq |
|
C02 |
FAM |
Неизвестно |
3 |
21,22 |
21,22 |
0,000 |
|
|
D02 |
FAM |
Неизвестно |
4 |
16,08 |
16,08 |
0,000 |
|
|
E02 |
FAM |
Неизвестно |
5 |
15,53 |
15,53 |
0,000 |
|
|
F02 |
FAM |
Неизвестно |
око |
14,41 |
14,41 |
0,000 |
|
|
G02 |
FAM |
Неизвестно |
К- |
Н/О |
0,00 |
0,000 |
|
|
H02 |
FAM |
Неизвестно |
ПК |
20,04 |
20,04 |
0,000 |
|
|
A02 |
HEX |
Неизвестно |
1 |
Н/О |
0,00 |
0,000 |
|
|
B02 |
HEX |
Неизвестно |
2 |
18,14 |
18,14 |
0,000 |
|
|
C02 |
HEX |
Неизвестно |
3 |
16,38 |
16,38 |
0,000 |
|
|
D02 |
HEX |
Неизвестно |
4 |
Н/О |
0,00 |
0,000 |
|
|
F02 |
HEX |
Неизвестно |
5 |
Н/О |
0,00 |
0,000 |
|
|
F02 |
HEX |
Неизвестно |
око |
Н/О |
0,00 |
0,000 |
|
|
G02 |
HEX |
Неизвестно |
К- |
Н/О |
0,00 |
0,000 |
|
|
H02 |
HEX |
Неизвестно |
ПК |
10,21 |
10,21 |
0,000 |
|
|
S. pneumonia |
|||||||
|
Лунка |
Флуор. |
Мишень |
Содерж. |
Проба |
Cq |
Среднее Cq |
Стандартное отклонение Cq |
|
A02 |
HEX |
Неизвестно |
1 |
23,44 |
23,44 |
0,000 |
|
|
B02 |
HEX |
Неизвестно |
2 |
18,93 |
18,93 |
0,000 |
|
|
C02 |
HEX |
Неизвестно |
око |
Н/О |
0,00 |
0,000 |
|
|
D02 |
HEX |
Неизвестно |
К- |
Н/О |
0,00 |
0,000 |
|
|
E02 |
HEX |
Неизвестно |
ПК |
16,75 |
16,75 |
0,000 |
|
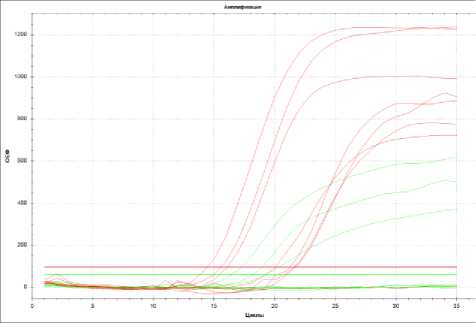
Рисунок 1 – График положительного результата анализа на M. hyopneumoniae
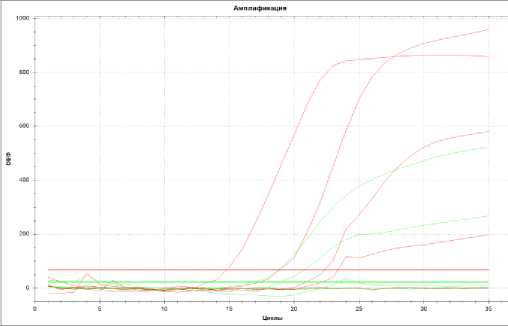
Рисунок 2 – График положительного результата анализа на S. pneumoniae
Следующим этапом было добавление в пробирки по 100 мкл буфера для элюции ДНК, ТЕбуфера. Встряхивали на вортексе до получения однородной суспензии. Прогревали пробы при температуре 60 ºС в течение 5 минут с закрытыми крышками, встряхивая каждые 2 минуты. Заключительным этапом экстракции было центрифугирование пробирок при 12000 об/мин («MiniSpin», «Eppendorf») в течение одной минуты. Надосадочная жидкость содержала очищенную НК.
Далее подготавливали образцы к проведению ПЦР. Общий объем реакционной смеси – 25 мкл, объем ДНК-пробы – 10 мкл. Успешное прохождение реакции контролируют использованием ПКО, ВКО Т2 и ДНК буфера.
Перемешали смесь на вортексе и сбросили капли кратковременным центрифугированием. Отобрали необходимое количество пробирок для амплификации ДНК исследуемых и контрольных проб. Внесли по 15 мкл приготовленной реакционной смеси. Используя наконечники с фильтром, в подготовленные пробирки внесли: в пробирку отрицательного контроля ПЦР (К-) 10 мкл ДНК буфера, в ряд пробирок для исследуемых проб - в каждую внесли по 10 мкл ДНК соответствующей пробы (включая пробу ВК-), а в пробирку с положительным контролем ПЦР (К+) – 10 мкл ПКО.
Поместили подготовленные для проведения ПЦР пробирки в ячейки амплификаторов («Rotor-Gene 6000» Corbett Research, Австралия) и «Real-time CFX Connect» (Bio-Rad Laboratories, США). Запрограммировали прибор согласно инструкциям производителя. После завершения программы амплификации отработанные пробирки утилизировали в соответствии с МУ 1.3. 2569 -09.
Таблица 5 – Параметры контроля качества M. hyopneumoniae в ассоциации с S. pneumoniae
|
M. hyopneumoniae |
||||
|
Описание |
Значение |
Исправ. |
Результаты |
Искл. из анализа |
|
Отр. контр. с Cq менее |
38 |
True |
False |
|
|
Контр. б/матр. с Cq менее |
38 |
True |
False |
|
|
Контр. б/рев. с Cq менее |
38 |
True |
False |
|
|
Пол. контр. с Cq менее |
30 |
True |
False |
|
|
Неизвестная проба без Cq |
Н/О |
True |
FAM: G2. HEX: A2, D2, E2, F2, G2. |
False |
|
Стандарт без Cq |
Н/О |
True |
False |
|
|
Эффективность более |
110,0 |
True |
||
|
Эффективность менее |
90,0 |
True |
||
|
Станд. кривая R^2 менее |
0,980 |
True |
||
|
Ст. откл. гр. репл. Cq более |
0,20 |
True |
False |
|
|
S. pneumonia |
||||
|
Описание |
Значение |
Исправ. |
Результаты |
Искл. из анализа |
|
Отр. контр. с Cq менее |
38 |
True |
FAM:C2 |
False |
|
Контр. б/матр. с Cq менее |
38 |
True |
False |
|
|
Контр. б/рев. с Cq менее |
38 |
True |
False |
|
|
Пол. контр. с Cq менее |
30 |
True |
False |
|
|
Неизвестная проба без Cq |
Н/О |
True |
False |
|
|
Стандарт без Cq |
Н/О |
True |
False |
|
|
Эффективность более |
110,0 |
True |
||
|
Эффективность менее |
90,0 |
True |
||
|
Станд. кривая R^2 менее |
0,980 |
True |
||
|
Ст. откл. гр. репл. Cq более |
0,20 |
True |
False |
|
Учет результатов ПЦР-анализа проводился по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца). Результат считался достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции ДНК в соответствии с таблицей 3.
В случае, если в ВК – значение Ct для ВКО отсутствует или превышает граничное, а в К+ значение Ct для ВКО менее граничного (и в образцах Ct для ВКО менее граничного) – результаты можно считать достоверными. Также, в случае если значение Ct для ВКО в К+ отсутствует или превышает граничное, а в ВК- и образцах менее граничного – результаты можно считать достоверными. Если для исследуемого образца по каналу JOE(HEX)/Yellow значение Сt определяется позднее 30 цикла при корректном прохождении положительных и отрицательных контролей – он считается спорным и исследуется повторно с этапа выделения НК. Если при повторной постановке наблюдается схожий результат (Ct на канале JOE (HEX)/Yellow более 30), требуется повторное взятие материала от того же животного для проведения ПЦР-исследования и (или) использование альтернативных методов диагностики.
Графики положительных результатов ПЦР-исследований с флуоресцентной детекцией в режиме реального времени M. hyopneumoniae и S. pneumoniae представлены на рисунке 1 и 2.
Данные расчета результатов ПЦР-исследований M. hyopneumoniae в ассоциации с S.pneumoniae представлены в таблице 4.
Параметры контроля качества M. hyopneumoniae в ассоциации с S. pneumoniae представлены в таблице 5 .
Заключение . Результаты, полученные при проведении лабораторных диагностических исследований патматериала от свиней, поступившего в Кропоткинскую краевую лабораторию за последние 3 года (с 2020 по 2022 гг.), свидетельствуют о высокой частоте обнаружения M. hyopneumoniae в ассоциации с S. pneumoniae (от 40 до 60 %). ПЦР–диагностика с флуоресцентной детекцией в режиме реального времени оптимальна для быстрого обнаружения Mycoplasma hyopneumoniae в ассоциации c Streptococcus pneumoniae у свиней.
Резюме
Цель исследования - применение ПЦР с флуоресцентной детекцией в режиме реального времени для обнаружения при микстинфекциях Mycoplasma hyopneumoniae и Streptococcus pneumoniae. Результаты, полученные при проведении лабораторных диагностических исследований патматериала от свиней, поступившего в Кропоткинскую краевую лабораторию за последние 3 года (с 2020 по 2022 гг.), свидетельствуют о высокой частоте обнаружения M. hyopneumoniae в ассоциации с S. pneumoniae (от 40 до 60 %). ПЦР – диагностика с флуоресцентной детекцией в режиме реального времени оптимальна для быстрого обнаружения Mycoplasma hyopneumoniae в ассоциации c Streptococcus pneumoniae у свиней.
Список литературы ПЦР-диагностика с флуоресцентной детекцией в режиме реального времени для быстрого обнаружения Mycoplasma hyopneumoniae в ассоциации c Streptococcus pneumoniae у свиней
- Агольцов, В. А. Эффективность и безопасность лекарственных препаратов при лечении экспериментальных и спонтанных микоплазменных инфекций / В. А. Агольцов, Л. П. Падило, О. П. Бирюкова, М. М. Лигидова // Ветеринария сегодня. – 2022. – № 11. – С. 169-175.
- Бирюченкова, М. В. Разработкаметодов обнаружения генома Streptococcus suis на основе полимеразной цепной реакции / М. В. Бирюченкова // Труды Федерального центра охраны здоровья животных. – Владимир. – 2017. – Том 15. – С. 70-81.
- Ефанова, Л. И. Микоплазменная инфекция у свиней / Л. И. Ефанова, А. В. Степанов, М. М. Свиридов, О. А. Манжурина // Достижения науки и техники АПК. – 2012. – № 1 – С. 35-36.
- Лигидова, М. М. Терапевтическая эффективность энтрикима при энзоотической пневмонии свиней / М. М. Лигидова, В. А. Агольцов, Л. П. Падило, А. А. Гусев // Научная жизнь. – 2020. – Выпуск 9. – С. 1260-1269.
- Лигидова, М. М. Изучение фармакокинетики действующих веществ препарата «Энтриким» при применении его животным / М. М. Лигидова, Е. А. Толстова, А. М. Семиволос, В. А. Агольцов, М. П. Мариничева // Аграрный научный журнал. – 2022. – № 8 – С. 47-49.
- Суханин, А. А. Использование ПЦР для идентификации патогенных стрептококков / А. А. Суханин // Вопросы нормативно-правового регулирования в ветеринарии. – 2010. – № 2. – С. 13-15.
- Толстова, Е.А. Особенности диагностики и терапии стрептококкоза свиней, осложненного РРСС на племенной ферме / Е. А. Толстова, В. А. Агольцов, Л. П. Падило // Научная жизнь – 2022. – Том 17. – В. 1 – С.157-166.
- Толстова, Е. А. Диагностика, терапия и специфическая профилактика стрептококкоза свиней, осложненного пастереллезом и микоплазмом / Е. А. Толстова, М. М. Лигидова, Л. П. Падило, А. М. Семиволос, В. А. Агольцов // Аграрный научный журнал. – 2022. – № 1. – С. 71-75.
- Тюлькин, С. В. Применение ДНК-диагностики для выявления рецессивных мутаций у сельскохозяйственных животных // С. В. Тюлькин, И. И. Гиниатуллин, Т. М. Ахметов, Л. А. Рахматов // В сборнике: Молекулярная диагностика. Сборник трудов. – 2014. – С. 524-525.
- Clark, L. K. Evaluation of the effectiveness of a macrolide antibiotic on reduction of respiratory pathogens in 12-day and 21-day weaned pigs / L. K. Clark, C. C. Wu, W. G. Alstine, K. E. Knox // J. Swine Health Prod. – 1998. – V. 6 (6). – P. 257-262.
- Dacak, D. Primer reporte de micoplasmosis en Procyon cancrivorus en cautiverio en Asunción / D. Dacak, J. Petters, L. Batista-Cirne, M. Lucero [et al.] // Paraguay. Rev. Inv. Vet. – Perú. – 2021. – V. 32 (1). – P. 19494. – DOI: 10.15381/RIVEP.V32I1.19494.
- De Almeida, J. F. Polimerase chain reaction (PCR) in the diagnosis of goat mycoplasmosis proceeding from cultures stored in glycerol / J. F. De Almeida, E. R. do Nascimento, V. L. de Almeida Pereira, M. L. Barreto [et al.] // Rev. Bras. Med. Vet. – 2007. – V. 29 (2). P. 54-57.
- Mc Kelvie, J. Evaluation of tulathromycin for the treatment of pneumonia following experimental infection of swine with Mycoplasma hyopneumoniae / J. McKelvie, J. H. Morgan, I. A. Nanjiani, J. Sherington, T. G. Rowan, S. J. Sunderland // Veterinary Therapeutics. – 2005. – V. 6 (2). – P. 197-202. – PMID: 16094566.
- Morrow, C. J. Antimicrobial susceptibility of pathogenic mycoplasmas in chickens in Asia / C. J. Morrow, Z. Kreizinger, R. R. Achari, K. Bekő, C. Yvon, M. Gyuranecz // Vet. Microbiol. – 2020. – P. 250:108840. – DOI: 10.1016/j.vetmic.2020.108840.
- Olson, L. B. The effect of tilmicosin in minimizing atrophic rhinitis, pneumonia, and pleuritis in swine / L. B. Olson, L. R. Bäckström // J. Swine Health Prod. – 2000. – V. 8 (6). – P. 263-268.
- Suresh, V. K. Novel Real-Time PCR Assay for Rapid Detection of Virulent Streptococcus equi Subspecies zooepidemicus - An Emerging Pathogen of Swine / V. K. Suresh [et al.] // Front Vet. – Sci.2021.DOI:10.3389/fvets.2021.604675.
- Zhang, X. H. Investigation of the efficiency and safety of tilmicosin phosphate in treating experimental mycoplasmal infections in pigs / X. H. Zhang, J. Z. Pan, N. Wu, S. Tang, X. D. Lei, Y. Y. Sun [et al.] // Turk. J. Vet. Anim. Sci. – 2018. – V. 42 (6). – P. 571-580. – DOI: 10.3906/vet-1804-76.


