Персонализированные аспекты развития идиопатического коксартроза
Автор: Мироманов Александр Михайлович, Забелло Трофим Васильевич, Доржеев Владимир Владимирович, Мироманова Наталья Анатольевна, Емельянов Артур Сергоевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2017 года.
Бесплатный доступ
Цель. Выявить персонализированные прогностические критерии развития идиопатического остеоартроза тазобедренного сустава. Материалы и методы. В исследование включено 100 неродственных пациентов с идиопатическим остеоартрозом тазобедренного сустава III-IV стадии в возрасте 61,3 ± 8,5 лет, русской национальности, проживающих на территории Забайкальского края. Контрольную группу составили 100 пациентов без патологии суставов аналогичного возраста (60 ± 8,3 года), национальности и ареала проживания. Критерии исключения - другие виды остеоартрозов (посттравматические, ревматоидные и пр.), острые и хронические воспалительные заболевания в стадии обострения, остеопороз. В работе использован клинический, лабораторный (полиморфизм генов - TLR2-753Arg > Gln, TLR6-249Ser > Pro, FCGR2A-166His > Arg, DEFB1-52G > A, DEFB1-20G > A, TGFb1-25Arg > Pro, TNFα-308G > А, IL4-589C > Т) и инструментальный (рентгенография) методы исследования. Результаты. Статистическая значимость различий между группой пациентов с идиопатическим коксартрозом и группой контроля отмечена в случаях носительства генотипа -166Arg/Arg гена FCGR2A (χ2 - 99,2, p
Идиопатический коксартроз, прогноз, гены, полиморфизм
Короткий адрес: https://sciup.org/142201022
IDR: 142201022 | УДК: 616.728.2-007.248-021.3:575.174.015.3-047.72 | DOI: 10.18019/1028-4427-2017-23-3-331-335
Текст научной статьи Персонализированные аспекты развития идиопатического коксартроза
Коксартроз является наиболее распространенным заболеванием суставов [1, 2] и в 60 % случаев приводит к снижению работоспособности, в 11,5 % – к инвалидности и почти в 80 % – к необходимости проведения первичной артропластики сустава, что свидетельствует о высокой медицинской и социальной значимости данного заболевания, которое не только значительно ухудшает качество жизни больного, но и приводит к большим социально-экономическим затратам [3, 4].
Предвидение возможного развития данного заболевания и при необходимости проведение превентивных профилактических мер является важным аспектом современной медицины [5].
К настоящему времени многими исследователями ведутся поиски маркеров развития остеоартроза [6, 7, 8, 9, 10, 11], однако, к сожалению, «идеального» диа- гностического показателя до сих пор не выявлено.
Согласно исследованиям последних лет, ведущая роль в развитии заболеваний отводится наследственным факторам. Генетически обусловленная продукция белков оказывает значимое влияние на развитие целого ряда патологических состояний, в том числе и развитие остеоартрозов [11]. Вследствие вышесказанного, выявление ассоциации той или иной патологии с определенным генотипом, в конечном итоге, позволит создать базу данных (генетический паспорт) и своевременно осуществлять необходимые профилактические мероприятия, тем самым предотвращать развитие заболеваний и/или осложнений [12].
Цель исследования – выявить персонализированные прогностические критерии развития идиопатического остеоартроза тазобедренного сустава.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось согласно этическим принципам, предъявляемым Хельсинкской Декларацией Всемирной Медицинской Ассоциации (World Medical Association Declaration of Helsinki (1964, 2011 – поправки) и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ 19.06.2003 г. № 266.
В качестве объекта исследования использованы образцы периферической крови 100 неродственных пациентов в возрасте 61,3 ± 8,5 лет с идиопатическим остеоартрозом тазобедренного сустава III–IV стадии, русской национальности, проживающих на территории Забайкальского края и получивших высокотехнологичную медицинскую помощь (тотальное эндопротезирование тазобедренного сустава) в травматологическом отделении НУЗ «Дорожная клиническая больница на ст. Чита-2». Контрольная группа была представлена 100 пациентами без патологии суставов аналогичного возраста (60 ± 8,3 года), национальности и ареала проживания. Критерии исключения – другие виды остеоартрозов (посттравматические, ревматоидные, подагрические и пр.), острые и хронические воспалительные заболевания в стадии обострения, остеопороз.
Для генетических исследований выбирали точко-вую мутацию TLR2 в позиции 753 (Arg > Gln), мутацию TLR6 в позиции 249 (Ser > Pro), мутацию FCGR2A в позиции 166 (His > Arg), мутацию DEFB1 в позиции 52 (G > A), мутацию DEFB1 в позиции 20 (G > A), мутацию TGFb1 в позиции 25 (Arg > Pro), мутацию TNFα в позиции 308 (G > А) и мутацию IL4 в позиции 589 (C > T). Амплификацию фрагмента исследуемых генов проводили в термоцикле (модель Ре «Бис» – М111 (ООО «Бис-Н», г. Новосибирск). В работе использовали стандартные наборы праймеров научно-производственной фирмы «Литех»-«SNP» (Москва). Визуализацию продуктов амплификации выполняли с помощью электрофореза в 3 % агарозном геле с добавлением бромистого этидия в проходящем ультрафиолетовом свете [12].
Исследования осуществляли при поступлении пациентов в стационар. Полученные данные обработаны с помощью пакета программ «Microsoft Office Exel 2010» и «BIOSTAT». Для описания характера распределения количественных признаков определялись средние величины (М), стандартные отклонения (SD). Для анализа групп по качественному бинарному признаку применялся критерий χ2. Для сравнения количественных показателей использовали критерий Манна-Уитни. Степень риска развития событий оценивали по величине отношения шансов (odd ratio (OR)) с расчетом для него 95 % доверительного интервала (CI). Различия считались статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ И ДИСКУССИЯ
Распределение носительства генотипов исследуемых полиморфизмов представлено в таблице.
Зафиксировано, что не все исследуемые мутантные генотипы имели статистическую значимость различий между группой пациентов с идиопатическими коксар-трозами и группой контроля: генотип -166Arg/Arg гена FCGR2A (χ2 – 99,2, p<0,0001, OR – 255,2); генотип -52А/ А гена DEFB1 (χ2 – 58,7, p < 0,0001, OR – 11,2); генотип -20А/А гена DEFB1 (χ2 – 42,2, p < 0,0001, OR – 8,3); генотип -589Т/Т гена IL4 (χ2 – 49,7, p < 0,0001, OR – 25,2) (таблица).
При детальном персонифицированном анализе состава выявленных полиморфизмов в группе с коксартро-зами отмечено, что при одновременном носительстве 3 и 4 мутантных гомозигот исследуемых полиморфизмов отмечается более раннее развитие заболевания (до 40 лет) и его быстрое прогрессирование, в то время как у лиц контрольной группы носительство 2 и более мутантных гомозигот изучаемых SNP генов не выявлено.
Обнаружено, что FCGR2A (CD32) входит в группу рецепторов для Fc – конца иммуноглобулинов класса G. Данный рецептор локализован на моноцитах, гранулоцитах, эозинофилах, макрофагах и В-лимфоцитах и способствует взаимодействию с иммуноглобулинами и, как следствие, приводит к развитию ответной реакции в виде активации макрофагов, сопровождаемой синтезом цитокинов и других биологически активных молекул. Работ по изучению влияния полиморфизма гена FCGR2A(His166Arg) на развитие остеоартрозов нами не выявлено, однако отмечено, что сочетанное носительство генотипа -166Arg/Arg гена FCGR2A с генотипом -159С/С гена СD14 у пациентов с гриппом AH1N1 приводило к молниеносному течению и летальному исходу [13].
В последнее время большое внимание уделяется изучению факторов врожденного иммунитета, в частности противомикробным пептидам, к которым относятся дефенсины. β-дефенсины обладают широким спектром противобактериальной, противовирусной и противогрибковой активности, участвуют в хемотаксисе, в индукции адаптивного иммунитета, в созревании дендритных клеток и пр. β-дефенсин 1 кодируется геном DEFB1, который локализуется на коротком плече хромосомы 8 в локусе 8p22-23 в кластере β-дефенсинов. Полиморфизм гена DEFB1 может быть ассоциирован с выраженностью продукции ß-дефенсина 1 на уровне слизистых оболочек, поэтому данным полиморфизмом можно объяснить различную восприимчивость к заболеваниям инфекционного генеза [14].
Установлено, что полиморфные маркеры DEFB1 (-20G/A, -44C/G, -52G/A) ассоциированы с широким спектром заболеваний (ВИЧ-1-инфекцией, сепсисом, инфекцией, вызванной C. albicans, P. aeruginosa и др.). Таким образом, можно сделать предположение, что полиморфные маркеры могут быть связаны со сниженными (неполноценными) реакциями врожденного иммунитета за счет дефектов в генах, что приводит к снижению экспрессии дефенсинов и, тем самым, способствует уменьшению защиты на уровне слизистых оболочек и развитию патологии [15].
Показано, что наличие гомозиготного генотипа -589Т/Т гена IL4 сопровождается сниженной продукцией цитокина IL-4, что, в свою очередь, способствует длительному сохранению повышенного содержания провоспалительных цитокинов, и соответственно, прогрессированию воспаления, что неумолимо приводит к деструктивным процессам в тканях [16].
Таблица
Значения SNP исследуемых генов в развитии идиопатического коксартроза (χ2)
|
Генотип |
Группа контроля (n = 100) |
Группа c идиопатическим коксартрозом (n = 100) |
OR [95 % CI] |
Исход |
|
SNP гена TLR2(Arg753Gln) |
||||
|
Arg/Arg |
65 (65 %) |
84 (84 %)* |
2,83 [1,44–5,55] |
Благоприятный |
|
Arg/Gln |
35 (35 %) |
16 (16 %)* |
0,35 [0,18–0,69] |
Благоприятный |
|
Gln/Gln |
– |
– |
1,0 [0,02–50,89] |
Неблагоприятный |
|
SNP гена TLR6 (Ser249Pro) |
||||
|
Ser/Ser |
4 (4 %) |
9 (9 %) |
2,37 [0,71–7,98] |
Благоприятный |
|
Ser/Pro |
54 (54 %) |
38 (38 %) |
0,52 [0,3–0,92] |
Благоприятный |
|
Pro/Pro |
42 (42 %) |
53 (53 %) |
1,56 [0,89–2,72] |
Неблагоприятный |
|
SNP гена FCGR2A(His166Arg) |
||||
|
His/His |
68 (68 %) |
10 (10 %)* |
0,05 [0,02–0,11] |
Благоприятный |
|
His/Arg |
32 (32 %) |
34 (34 %)* |
1,09 [0,61–1,97] |
Благоприятный |
|
Arg/Arg |
– |
56 (56 %)* |
255,2 [15,4–4223] |
Неблагоприятный |
|
SNP гена DEFB1(G52A) |
||||
|
G/G |
54 (54 %) |
12 (12 %)* |
0,12 [0,06–0,24] |
Благоприятный |
|
G/A |
35 (35 %) |
30 (30 %)* |
0,8 [0,44–1,44] |
Благоприятный |
|
A/A |
11 (11 %) |
58 (58 %)* |
11,2 [5,32–23,5] |
Неблагоприятный |
|
SNP гена DEFB1(G20A) |
||||
|
G/G |
52 (52 %) |
19 (19 %)* |
0,22 [0,11–0,41] |
Благоприятный |
|
G/A |
36 (36 %) |
28 (28 %)* |
0,69 [0,38–1,26] |
Благоприятный |
|
A/A |
12 (12 %) |
53 (53 %)* |
8,3 [4,0–17] |
Неблагоприятный |
|
SNP гена TGFb1(Arg25Pro) |
||||
|
Arg/Arg |
60 (60 %) |
67 (67 %) |
1,35 [0,76–2,41] |
Благоприятный |
|
Arg/Pro |
28 (28 %) |
25 (25 %) |
0,86 [0,46–1,61] |
Благоприятный |
|
Pro/Pro |
12 (12 %) |
8 (8 %) |
0,64 [0,25–1,63] |
Неблагоприятный |
|
SNP гена TNFα(G308А) |
||||
|
G/G |
73 (73 %) |
73 (73 %) |
1,0 [0,54–1,87] |
Благоприятный |
|
G/A |
27 (27 %) |
26 (26 %) |
0,95 [0,51–1,78] |
Благоприятный |
|
A/A |
– |
1 (1 %) |
3,0 [0,12–75,3] |
Неблагоприятный |
|
SNP гена IL4(C589T) |
||||
|
C/C |
73 (73 %) |
29 (29 %)* |
0,15 [0,08–0,28] |
Благоприятный |
|
C/T |
25 (25 %) |
37 (37 %)* |
1,76 [0,96–3,24] |
Благоприятный |
|
T/T |
2 (2 %) |
34 (34 %)* |
25,2 [5,86–108,7] |
Неблагоприятный |
Примечание: * – статистическая значимость различий по сравнению с группой контроля (при р < 0,05).
Прогнозирование идиопатического коксартроза иллюстрируется следующими клиническими наблюдениями.
Клиническое наблюдение № 1 . Пациент И., 58 лет, госпитализирован на плановое оперативное лечение с диагнозом: идиопатический коксартроз справа III-IV ст., слева I-II ст. НФС I-II ст. Коксалгия справа (МКБ-10 – М16.1) (рис. 1). Сопутствующая патология: атеросклероз аорты, мозговых артерий, симптоматическая гипертензия. При поступлении пациенту произведено исследование SNP гена FCGR2A(His166Arg), SNP гена DEFB1(G52A), SNP гена DEFB1(G20A) и SNP гена IL4(C589T). Установлено, что пациент является носителем генотипа -166Arg/Arg гена FCGR2A, генотипа -52G/А гена DEFB1, генотипа -20G/G гена DEFB1 и генотипа -589Т/Т гена IL4, что подтверждает наши доводы о влиянии сочетания исследуемых мутантных гомозигот на развитие коксартроза.
Клиническое наблюдение № 2. Пациент Д., 38 лет, госпитализирован на плановое оперативное лечение с диагнозом: идиопатический двусторонний коксартроз IV ст., НФС III ст. Коксалгия больше слева (МКБ-10 – М16.1) (рис. 2). В первые сутки пациенту произведено исследование SNP гена FCGR2A(His166Arg), SNP гена DEFB1(G52A), SNP гена DEFB1(G20A) и SNP гена IL4(C589T). Установлено, что пациент является носителем 4 мутантных гомозигот исследуемых генов: генотипа -166Arg/Arg гена FCGR2A, генотипа -52А/А гена DEFB1, генотипа -20А/А гена DEFB1 и генотипа -589Т/Т гена IL4, что может свидетельствовать о влиянии носительства трех и более мутантных гомозигот на более раннее и быстро прогрессирующее течение данного заболевания.
Клиническое наблюдение № 3 . Резидент из группы контроля В., 50 лет, имеющийся диагноз: ЖКБ. Хронический калькулезный холецистит, ремиссия. Атеросклероз аорты, мозговых артерий. Симптоматическая гипертензия. Каких-либо симптомов и синдромов поражения суставов не выявлено (рис. 3). При исследовании у данного человека SNP гена FCGR2A(His166Arg), SNP гена DEFB1(G52A), SNP гена DEFB1(G20A) и SNP гена IL4(C589T) зафиксировано носительство только 1 мутантной гомозиготы исследуемых генов – генотип -20А/А гена DEFB1. Данный факт свидетельствует о низкой предрасположенности к развитию коксартроза.
К линическое наблюдение № 4 . Резидент из группы контроля М., 60 лет, имеющийся диа-гноз: ИБС. Прогрессирующая стенокардия напряжения II ф. кл. Н2А. Атеросклероз аорты, мозговых артерий. Симптоматическая гипертензия. Каких-либо симптомов и синдромов поражения суставов не зарегистрировано (рис. 4). При исследовании у данного пациента SNP гена FCGR2A(His166Arg), SNP гена DEFB1(G52A), SNP гена DEFB1(G20A) и SNP гена IL4(C589T) носительства мутантных гомозигот изучаемых генов не выявлено.
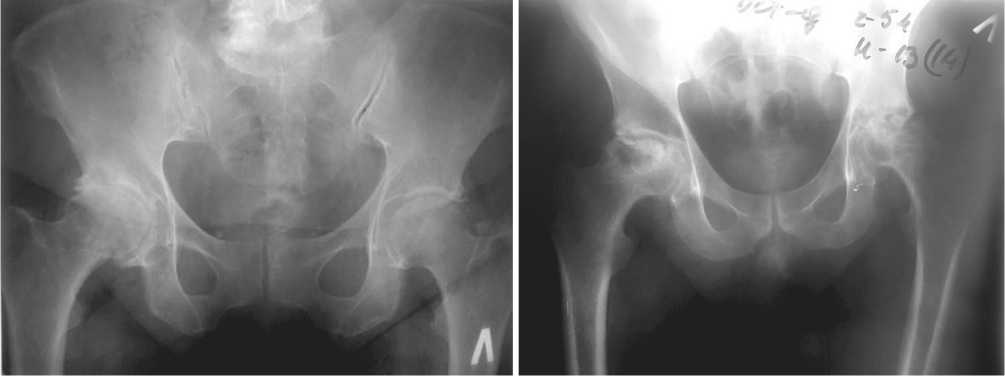
Рис. 1. Рентгенограмма таза в прямой проекции. Идиопатический коксартроз III-IV ст. справа, II ст. слева
Рис. 2. Рентгенограмма таза в прямой проекции. Идиопатический двусторонний коксартроз IV ст.
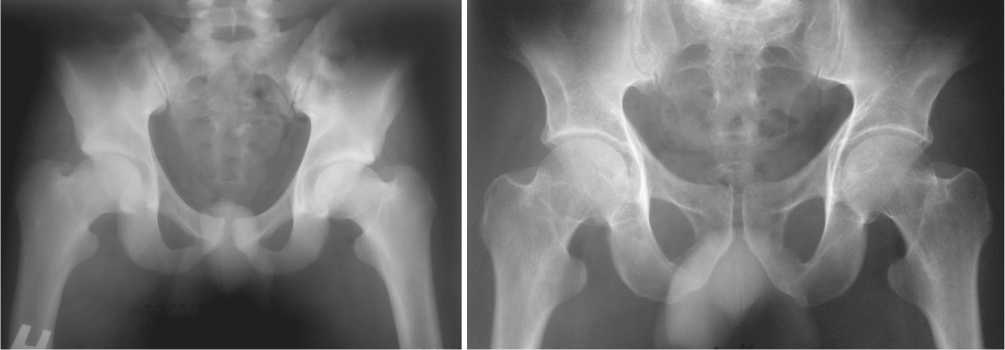
Рис. 3. Рентгенограмма таза в прямой проекции у пациента В. без патологии тазобедренных суставов
Рис. 4. Рентгенограмма таза в прямой проекции пациента М. без патологии тазобедренных суставов
Таким образом, выявление генотипа -166Arg/Arg гена FCGR2A, генотипа -52А/А гена DEFB1, генотипа -20А/А гена DEFB1 и генотипа -589Т/Т гена IL4 у резидентов позволяет прогнозировать развитие идиопатического коксартроза, что санкционирует возможность проведения превентивных профилактических мероприятий и предотвращения развития данного социально значимого заболевания.
ВЫВОДЫ
-
1. Определение SNP генов – FCGR2A (His166A), DEFB1 (G52A), DEFB1(G 20A) и IL-4 (C589 T) позволяет предвидеть развитие коксартроза при наличии сочетания носительства как минимум 2 их мутантных гомозигот.
-
2. При выявлении носительства 3 и более мутантных гомозигот SNP генов – FCGR2A (His166A), DEFB1 (G52A), DEFB1(G 20A) и IL-4 (C589 T) отмечается раннее и быстро прогрессирующее течение идиопатического коксартроза.
Список литературы Персонализированные аспекты развития идиопатического коксартроза
- Травматизм, ортопедическая заболеваемость, состояние травматолого-ортопедической помощи населению России в 2015 году: сборник/под ред. С.П. Миронова. М.: Телер, 2016. 145 с.
- Adatia A., Rainsford K.D., Kean W.F. Osteoarthritis of the knee and hip. Part I: aetiology and pathogenesis as a basis for pharmacotherapy//J. Pharm. Pharmacol. 2012. Vol. 64, N 5. P. 617-625. Doi: 10.1111/j.2042-7158.2012.01458.x.
- Buchanan W.W., Kean W.F. Osteoarthritis I: Epidemiological risk factors and historical considerations//InflammoPharmacology. 2002. Vol. 10, N 1-2. P. -21 DOI: 10.1163/156856002320751982
- Hunter D.J., McDougall J.J., Keefe F.J. The symptoms of osteoarthritis and the genesis of pain//Med. Clin. North Am. 2009. Vol. 93, N 1. P. 83-100 DOI: 10.1016/j.mcna.2008.08.008
- Об утверждении стратегии развития медицинской науки в Российской Федерации на период до 2025 года: распоряжение Правительства РФ № 2580-р от 28.12.2012//КонсультантПлюс, 2012. URL: www.consultant.ru (дата обращения: 11 апреля 2017).
- Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего артроза коленного сустава у взрослых: пат. 2249210 Рос. Федерация. № 2003104858/15; заявл. 17.02.2003; опубл. 20.08.2004, Бюл. № 9. 6 с.
- Способ ультразвуковой диагностики ранних стадий остеоартроза тазобедренного сустава: пат. 2321350 Рос. Федерация. № 2006137731/14; заявл. 25.10.2006; опубл. 10.04.2008, Бюл. № 10. 8 с.
- Способ прогнозирования риска возникновения остеоартроза у лиц с гипермобильностью суставов: пат. 2558990 Рос. Федерация. № 2014132991; заявл. 11.08.2014; опубл. 10.08.2015, Бюл. № 22. 9 с.
- Способ прогнозирования предрасположенности к развитию посттравматического остеоартроза коленного сустава: пат. 2600860 Рос. Федерация. № 2014153254/15; заявл. 25.12.2014; опубл. 27.10.2016, Бюл. № 30. 11 с.
- Chapman K., Valdes A.M. Genetic factors in OA pathogenesis//Bone. 2012. Vol. 51, N 2. P. 258-264 DOI: 10.1016/j.bone.2011.11.026
- Забелло Т.В., Мироманов А.М., Мироманова Н.А. Генетические аспекты развития остеоартроза//Фундам. исслед. 2015. № 1-9. С. 1970-1976.
- Полиморфизм гена TNF-α (G-308А) у больных с гнойно-воспалительными осложнениями при переломах длинных костей конечностей в Забайкальском крае/А.М. Мироманов, О.Б. Миронова, М.В. Трубицын, Ю.А. Витковский//Забайкал. мед. вестн. 2013. № 1. С. 41-45. URL: http://chitgma.ru/zmv2 (дата обращения: 11 апреля 2017).
- Генетический полиморфизм CD14, TNFα и FCGR2A у больных гриппом AH1N1 в Забайкальском крае/Н.Н. Страмбовская, А.В. Говорин, Ю.А. Витковский, А.А. Петров//Мед. иммунология. 2011. № 1. С. 83-86.
- The complexity of selection at the major primate beta-defensin locus/C.A Semple, A. Maxwell, P. Gautier, F.M. Kilanowski, H. Eastwood, P.E. Barran, J.R. Dorin//BMC Evol. Biol. 2005. Vol. 5. P. 32 DOI: 10.1186/1471-2148-5-32
- Ассоциация полиморфных маркеров, локализованных в 5'-нетранслируемой области гена β-дефенсина DEFB1, с гипертрофией аденоидных вегетаций/О.А. Свитич, Л.В. Ганковская, И.В. Рахманова, И.А. Зайцева, В.А. Ганковский//Вестн. РГМУ. 2012. № 3. С. 59-62.
- Миронова О.Б. Некоторые патогенетические механизмы развития хронического травматического остеомиелита при переломах длинных трубчатых костей: автореф. дис. … канд. мед. наук: 14.03.03. Чита, 2014. 22 с.


