Персонализированный подход к послеоперационной химиотерапии в комбинированном лечении немелкоклеточного рака легкого (клиническое наблюдение)
Автор: Родионов Евгений Олегович, Миллер Сергей Викторович, Цыганов Матвей Михайлович, Черемисина Ольга Владимировна, Тузиков Сергей Александрович, Литвяков Николай Васильевич, Фролова Ирина Георгиевна, Величко Светлана Андреевна, Лукьяненок Павел Иванович, Полищук Татьяна Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 (75), 2016 года.
Бесплатный доступ
Представлено клиническое наблюдение комбинированного лечения немелкоклеточного рака легкого с назначением персонализированной адъювантной химиотерапии. В качестве предиктивных маркеров используется уровень экспрессии в опухолевой ткани легкого генов монорезистентности АВСС5, RRM1, ERCC1, TOP1, TOP2a, TUBB3 и TYMS после предоперационной химиотерапии. Данный случай свидетельствует о целесообразности оценки экспрессии генов монорезистентности до и после проведения предоперационной химиотерапии и имеет важное значение с точки зрения определения индивидуальной чувствительности опухоли к отдельным химиопрепаратам, что дает возможность планировать лечение конкретного больного.
Комбинированное лечение, рак легкого, персонализированное лечение, гены монорезистентности, адъювантная химиотерапия
Короткий адрес: https://sciup.org/14056693
IDR: 14056693 | УДК: 616.24-006.6-059-089.168.1 | DOI: 10.21294/1814-4861-2016-15-3-97-101
Текст научной статьи Персонализированный подход к послеоперационной химиотерапии в комбинированном лечении немелкоклеточного рака легкого (клиническое наблюдение)
Результаты хирургического лечения немелкоклеточного рака легкого (НМРЛ) III стадии остаются неудовлетворительными, 5-летняя выживаемость составляет лишь 19–24 %, а используемая химиотерапия не дает существенного прироста выживаемости больных [1, 4]. Одной из причин недостаточной эффективности химиотерапии является отсутствие индивидуализированного выбора химиопрепаратов и тактики лечения конкретного больного, когда используются только стандартные клинические, прогностические и предсказательные критерии, не учитывающие чувствительность/резистент-ность опухоли больного к отдельным препаратам [5]. Чувствительность/резистентность опухолевых клеток к отдельным химиопрепаратам определяют гены монорезистентности. В этом плане для рака легкого описаны такие гены монорезистентности, как АВСС5, RRM1, ERCC1, TOP1, TOP2a, TUBB3 и TYMS. Экспрессию данных генов в опухолевой ткани легкого важно учитывать для персонализации лекарственной терапии НМРЛ [2, 6].
Приводим клиническое наблюдение индивидуализированного подхода к назначению адъювантной химиотерапии НМРЛ, в котором для назначения адъювантной химиотерапии в качестве предиктивных маркеров используется уровень экспрессии в опухолевой ткани легкого генов монорезистентности АВСС5, RRM1, ERCC1, TOP1, TOP2a, TUBB3 и TYMS до лечения и после предоперационной химиотерапии.
Больной С., 55 лет, обратился в Томский НИИ онкологии 13.01.14 с жалобами на одышку смешанного характера при незначительной физической нагрузке, периодические боли тупого характера в грудной клетке слева, малопродуктивный кашель с вязкой мокротой светлого цвета. Считает себя больным с ноября 2013 г., когда появилась одышка и кашель; по месту жительства выполнена флюорография лишь 25.12.13, по результатам которой заподозрен рак левого легкого.
Больному в Томском НИИ онкологии проведено комплексное обследование, включающее
общеклинические анализы, ЭКГ, ультразвуковое исследование органов брюшной полости, почек, надключичных лимфоузлов, эндосонографию органов средостения, видеогастроскопию, видеобронхоскопию, компьютерную томографию органов грудной полости. По данным компьютерной томографии (14.01.14) – объем легких слева уменьшен за счет ателектаза язычковых сегментов; структура ателектаза неравномерная с расширением просвета бронхов и, вероятно, распадом легочной ткани; опухоль расположена в развилке верхне- и нижнедолевого бронхов, опухолевая инфильтрация распространяется на нижнедолевой бронх, вероятно, на главный, обтурирует язычковые бронхи, инфильтрирует нижнюю легочную вену, вероятно, перикард, левую ветвь легочной артерии и все долевые (рис. 1). По данным видеобронхоскопии (13.01.14) – межсегментарная шпора S1-3 и нижняя стенка в/долевого бронха представлены бугристой опухолевой тканью; S3–4 визуализируется до субсегментов; S1–2 сужены до ½. Взята биопсия опухолевой ткани и фрагмент здоровой ткани бронха (с контралатеральной стороны), которые были помещены в пробирку с консервирующим раствором RNALater (Ambion, USA). Данных за отдаленное метастазирование получено не было.
На основании проведенного обследования пациенту был установлен диагноз: центральный рак верхнедолевого бронха слева с прорастанием перикарда и метастатическим поражением лимфоузлов средостения IIIА стадии Т3N2M0, гистология № 1363-70/14 + ИГХ от 20.01.14: плоскоклеточный рак низкой степени дифференцировки без ороговения.
До операции больному было проведено 2 н еоадъювантные химиотерапии по схеме винорел-бин/карбоплатин: винорелбин внутривенно в дозе
50 мг на 1-й и 8-й дни цикла в 13:00, во 2-й день, через 20 ч после введения винорелбина внутривенно капельно в 09:00 вводился карбоплатин в дозе 650 мг. Интервал между курсами химиотерапии составил 21 день.
При контрольном обследовании по данным видеобронхоскопии и спиральной компьютерной томографии – эффект неоадъювантной химиотерапии расценен как стабилизация процесса. Осложнений химиотерапии не наблюдалось. На втором этапе комбинированного лечения 1.04.14 выполнена радикальная операция в объеме пневмонэктомии слева с резекцией перикарда и медиастинальной лимфо-диссекцией. Макропрепарат – опухоль до 7 см в диаметре, инфильтрирует верхнюю легочную вену, верхняя доля в ателектазе (рис. 2).
Непосредственно после удаления препарата произведен забор материала для молекулярногенетического исследования (опухолевая ткань, неизмененная ткань легкого и бронха). Ближайший послеоперационный период протекал без особенностей, швы сняты на 12-е сут после операции. Осложнений не наблюдалось.
По результатам гистологического исследования №7316-32/14 от 08.04.14 – плоскоклеточный рак низкой степени дифференцировки без ороговения с метастатическим поражением 1 из 3 лимфоузлов средостения, II степень лекарственного патоморфоза. Таким образом, послеоперационной диагноз остался прежним.
Выделение РНК из опухолевой ткани биопсийных и операционных образцов производилось с помощью набора Plus RNeasy mini Kit (Qiagen, Germany), уровень экспрессии генов монорезистентности оценивался при помощи количественной ПЦР в режиме реального времени (qPCR) по технологии TaqMan на амплификаторе RotorGene 6000, Corbett Research Australia. Ме-
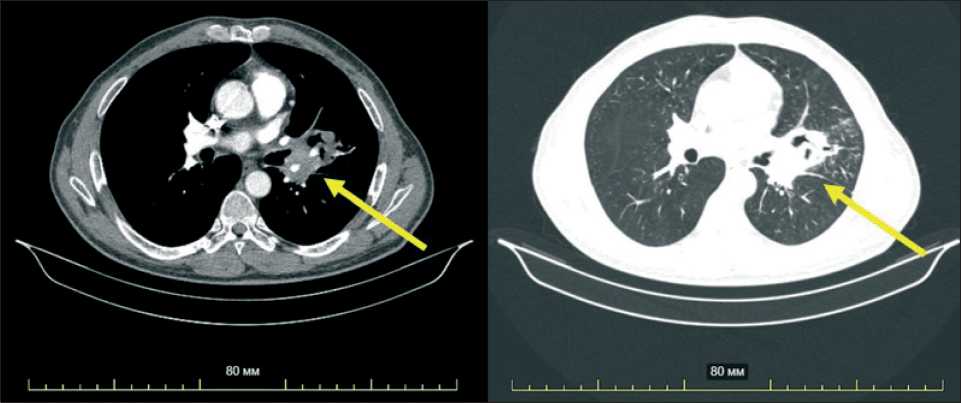
Рис. 1. СКТ. Опухоль (показана стрелкой) расположена в развилке верхне- и нижнедолевого бронхов слева, распространяется на нижнедолевой бронх, вероятно, на главный, обтурирует язычковые бронхи, инфильтрирует нижнюю легочную вену, левую ветвь легочной артерии
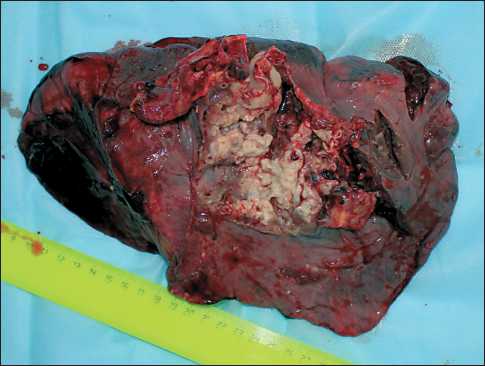
Рис. 2. Удаленное левое легкое. Опухоль в верхней доле до 7 см с распадом, инфильтрирует верхнюю легочную вену, дистальные отделы главного бронха тодика проведения ПЦР и праймеры описаны в статье Е.Ю. Юмова и др. [3]. Были определены уровни экспрессии генов монорезистентности до лечения: RRM1=1,039, TYMS=0,762, ABCC5=0,570, ERCC1=0, TOP1=0,714, TUBB3=2,012, TOP2a=0,502.
По данным молекулярно-генетического анализа операционного материала зафиксировано снижение уровня экспрессии гена TUBB3=1,875, а также низкий уровень экспрессии TOP2a (0,673), что свидетельствовало о химиорезистентности к винорелбину и доксорубицину соответственно. Резистентность к гемцитабину определяет высокий уровень экспрессии трех генов: RRM1, TYMS и ABCC5. У больного С. после неоадъювантной химиотерапии в опухоли уровень экспрессии гена RRM1 снизился и составил 0,758, уровень TYMS повысился до среднего уровня – 1,400, а экспрессия гена ABCC5 увеличилась в два раза и составила 1,065, что свидетельствует о резистентности к гемцитабину. В опухоли после НАХТ обращало на себя внимание отсутствие экспрессии гена ERCC1 (0) и экспрессия гена TOP1 (0,916) на уровне неизмененной ткани бронхов, что определяло чувствительность к препаратам платины и иринотекану соответственно.
По результатам анализа изменения уровней экспрессии генов монорезистентности пациенту
Список литературы Персонализированный подход к послеоперационной химиотерапии в комбинированном лечении немелкоклеточного рака легкого (клиническое наблюдение)
- Трахтенберг А.Х., Колбанов К.И. Рак легкого. М., 2012. 176 с
- Шатохина С.Н., Захарова Н.М., Дедова М.Г., Самбулов В.И., Шабалин В.Н. Морфологический маркер прогрессии новообразования при раке гортани//Вопросы онкологи. 2013. Т. 59, № 2. С. 66-70
- Юмов Е.Л., Цыганов М.М., Литвяков Н.В., Полищук Т.В., Миллер С.В., Родионов Е.О., Тузиков С.А. Экспрессия генов множественной лекарственной устойчивости и монорезистентности при немелкоклеточном раке легкого//Сибирский онкологический журнал. 2014. № 1. С. 16-22
- Goldstraw P., Crowley J., Chansky K., Giroux D.J., Groome P.A., Rami-Porta R., Postmus P.E., Rusch V., Sobin L. The IASLC Lung Cancer Staging Project: proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM Classification of malignant tumours//J. Thorac. Oncol. 2007. Vol. 2. P. 706-714
- Lan J., Huang H.Y., Lee S.W., Chen T.J., Tai H.C., Hsu H.P., Chang K.Y., Li C.F. TOP2A overexpression as a poor prognostic factor in patients with nasopharyngeal carcinoma//Tumor Biol. 2014. Vol. 35 (1). P. 179-187 DOI: 10.1007/s13277-013-1022-6
- Wei C.H., Gorgan T.R., Elashoff D.A., Hines O.J., Farrell J.J., Donahue T.R. A meta-analysis of gemcitabine biomarkers in patients with pancreatico-biliary cancers//Pancreas. 2013. 42 (8). P. 1303-1310 DOI: 10.1097/MPA.0b013e3182a23ae4


