Перспективы эндоскопического лечения пациентов с гетеротопией слизистой желудка в шейном отделе пищевода (обзор литературы)
Автор: Хихлова А.О., Олевская Е.Р., Долгушина А.И.
Журнал: Московский хирургический журнал @mossj
Рубрика: Обзоры
Статья в выпуске: 4 (82), 2022 года.
Бесплатный доступ
За последние годы отмечается интерес к проблеме гетеротопии слизистой желудка (СОЖ) в шейном отделе пищевода. Нерешенной проблемой является ведение пациентов с клиникой ларинго-фарингеального рефлюкса (ЛФР). Методы лечения данного состояния дискутабельны, четких алгоритмов не разработано. Большинство авторов сообщают о малой эффективности консервативной терапии. Радикальные хирургические методы носят исторический характер. Наибольшего внимания заслуживают эндоскопические методы лечения. Инвазивные эндоскопические вмешательства, такие как мукозальная резекция и диссекция в подслизистом слое, выполняют при развитии неоплазии в очагах желудочной гетеротопии в пищеводе. Применение аргоноплазменной коагуляции (АПК) и радиочастотной аблации (РЧА), направленных на эрадикацию очагов гетеротопии СОЖ в пищеводе с купированием клинической симптоматики, обеспечивает хорошие результаты. Учитывая локализацию гетеротопии и потенциальный риск развития послеоперационных стриктур пищевода, предпочтение стоит отдавать наиболее безопасной методике - РЧА. Многообразие малоинвазивных технологий при лечении симптомных пациентов с желудочной гетеротопией в пищеводе требует дальнейшего изучения для разработки стандартизованного подхода к выбору терапии.
Inlet patch, радиочастотная аблация, гетеротопия, шейный отдел пищевода
Короткий адрес: https://sciup.org/142236584
IDR: 142236584 | УДК: 616.329-089 | DOI: 10.17238/2072-3180-2022-4-114-123
Текст научной статьи Перспективы эндоскопического лечения пациентов с гетеротопией слизистой желудка в шейном отделе пищевода (обзор литературы)
Гетеротопия слизистой оболочки желудка в проксимальном отделе пищевода, обозначаемая в литературе термином «inlet patch» (англ. «пятно на входе»), представляет собой наличие участков желудочного эпителия в области верхнего пищеводного сфинктера или дистальнее устья пищевода на несколько сантиметров.
Частота выявления «inlet patch» при эндоскопическом исследовании широко варьирует от 0,1 до 14,5 % [1]. Высокие показатели эндоскопического поиска гетеротопии СОЖ обусловлены прежде всего осведомленностью специалиста и тщательным прицельным осмотром проксимального отдела пищевода (на уровне 15–20 см от резцов). По мнению ряда авторов обнаружение гетеротопии может служить критерием качественной эзофагогастродуоденоскопии (ЭГДС) [2].
При эндоскопическом осмотре участки гетеротопии СОЖ в шейном отделе пищевода визуализируются как очаги округлой или неправильной овальной формы, чаще имеют продольную направленность, иногда распространяются в поперечном направлении, достигая циркулярного расположения (рис. 1).
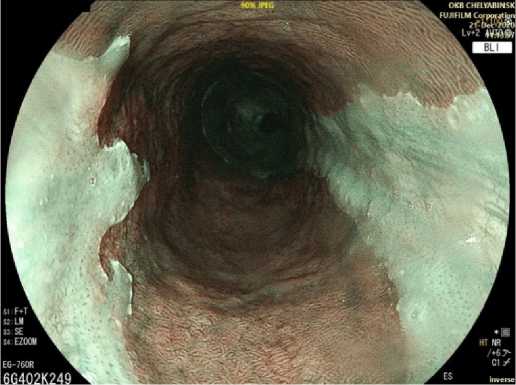
Рис. 1. Циркулярный очаг желудочной гетеротопии в шейном отделе пищевода: осмотр в режиме Blue Light Imaging (BLI) Fig. 1. Circumferential cervical gastric heterotopic mucosa: Blue Light Imaging (BLI)
Размеры очагов варьируют от нескольких миллиметров до нескольких сантиметров. Контуры, как правило, четкие, ровные, реже нерегулярные. На фоне бледно-розовой окраски слизистой пищевода, выстланной многослойным плоским эпителием, очаги желудочной гетеротопии, имеющие более яркую розовую окраску с бархатистой поверхностью, становятся хорошо отличимыми. В англоязычной литературе окраску «inlet patch» часто сравнивают с «лососевым» оттенком. Использование узкоспектральных режимов эндоскопического осмотра усиливает контраст участков желудочной гетеротопии и позволяет повысить частоту обнаружения в три раза по сравнению с осмотром в белом свете [3]. Поверхность очагов «inlet patch» может быть плоской, приподнятой или углубленной. В некоторых случаях происходит утолщение многослойного плоского эпителия по контурам углубленных гетеротопий, что ведет к формированию мембран (вебов) слизистой оболочки пищевода, определяемых в том числе при рентгенконтрастном исследовании пищевода (рис. 2).
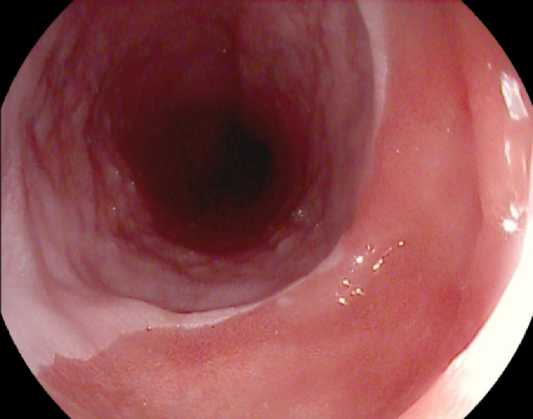
Рис. 2. Углубленный очаг гетеротопии СОЖ в пищеводе с формированием мембраны (веба): осмотр в белом свете Fig. 2. Depressed gastric heterotopic mucosa in the esophagus with membrane (web) formation: white light imaging
Обычно очаги гетеротопии СОЖ данной области располагаются на боковых стенках пищевода: единичные, множественные или парные, локализованные друг напротив друга, напоминающие «целующиеся inlet patch». Зачастую в непосредственной близо- сти от очагов гетеротопии в проксимальном отделе пищевода можно наблюдать мелкие ретенционные кисты, содержащие в своем составе желудочные железы. Иногда на поверхности ретенционых кист можно визуализируются участки желудочной гетеротопии минимальных размеров (рис. 3).
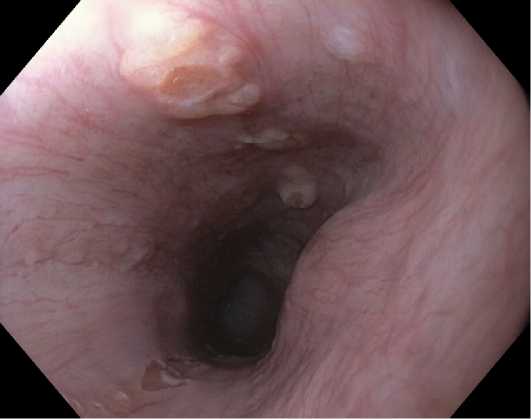
Рис. 3. Гетеротопия СОЖ из ретенционных кист шейного отдела пищевода
Fig. 3. Heterotopic gastric mucosa arising from retention cysts in cervical esophagus
Редко гетеротопия СОЖ встречается в других отделах пищевода. Также в дистальном отделе пищевода над уровнем зубчатой линии встречаются аналогичные очаги желудочного эпителия. Данные участки цилиндроклеточного эпителия не имеют отношения к метаплазии и не должны быть приняты за пищевод Баррета.
Вопрос о происхождении гетеротопии СОЖ в проксимальном отделе желудка остается дискутабельным. На сегодняшний день существуют три гипотезы появления «inlet patch» – врожденная, метапластической трансформации на фоне кислотного рефлюкса и связанная с разрывом ретенционных кист желудочных желез [4]. Однако, большинство авторов склоняется к теории о врожденном происхождении, когда на 11 неделе эмбриогенеза происходит замещение цилиндрического эпителия многослойным плоским в дистальном и проксимальном направлениях со средней части пищевода, при этом проксимальный участок пищевода остается незамещенным [5]. Эту теорию подтверждает наличие клеток, характерных для СОЖ эмбриона, выявленных при иммуногистохимическом исследовании, а также наличие гетеротопии у детей [5]. В нашей практике выявлены идентичные очаги гетеротопии СОЖ в проксимальном отделе пищевода у однояйцевых близнецов, что также может выступать в пользу эмбриогенного происхождения «inlet patch».
В локусах «inlet patch» наиболее распространенным типом желудочного эпителия являются кардиальный и фундальный, редко антральный. В исследовании U. Peitz и соавт. (2017 г.) было отмечено, что очаги небольшого размера характеризуются наличием кардиального типа эпителия, в то время как фундальный тип чаще встречается в гетеротопиях крупного размера [6]. Значимым является то, что «inlet patch» при наличии париетальных клеток, может продуцировать некоторое количество кислоты. Некоторые исследователи оценивали секреторную способность очагов гетеротопии СОЖ различными методами – рН метрия желудка и области верхнего пищеводного сфинктера после гастриновой стимуляции, хромоскопия с раствором конго красного и 24-часовая рН метрия без стимуляции кислотопродукции [4]. E. Korkut и соавт. у 13 % пациентов выявили секрецию кислоты в локусах гетеротопии при 24-часовой рН метрии [7].
Сведения о распространенности Helicobacter pylori в локусах желудочной гетеротопии варьируют, по некоторым данным достигая 82 % [4]. Вероятно, показатели инфицирования коррелируют с распространенностью инфекции Helicobacter pylori в общей популяции. По мнению ряда авторов, хеликобактерная обсемененность гетеротопии СОЖ может являться ступенью формирования каскада Корреа с появлением атрофии, метаплазии, дисплазии и карциномы (рис. 4) [8].
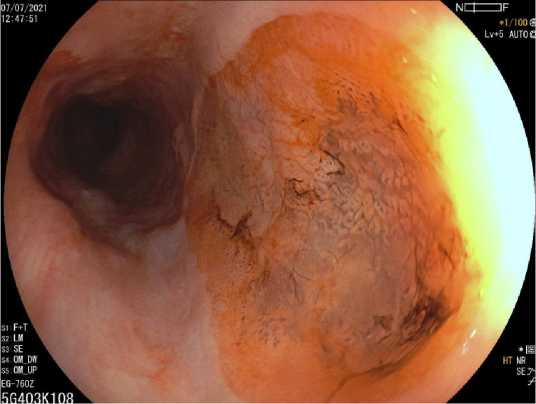
Рис. 4. Атрофические изменения в очаге кислотопродуцирующей inlet patch: хромоскопия с раствором 2 % раствора конго красного, осмотр в белом свете Fig. 4. Atrophic changes in the acid-producing inlet patch: 2 % Congo red solution chromoscopy, white light imaging
В исследованиях не получено влияния гастроэзофагеального рефлюкса на уровень обсемененности очагов гетеротопии СОЖ Helicobacter pylori [9].
Клиническое значение гетеротопии СОЖ в проксимальном отделе пищевода на протяжении многих лет является предметом обсуждений. В большинстве случаев для нее характерно бессимптомное течение. Однако, способность желудочного эпителия гетеротопии продуцировать слизь и кислоту в окружении слизистой оболочки проксимального отдела пищевода с более поверхностным распределением чувствительных нервных окончаний, а также ее анатомическая близость к слизистой оболочки гортаноглотки, чувствительной к кислотному воздействию, может индуцировать развитие клинической симптоматики [9]. Описаны случаи эрозивно-язвенных поражений в участках гетеротопии, фиброза, очагов ангиодисплазии, развития трахеопищеводных свищей, кровотечения, стриктур, дивертикулов [4]. В 2004 г. B.H. von Rahden была предложена классификация, позволившая структурировать клинические проявления гетеротопии СОЖ, учитывая морфологические изменения (табл. 1) [4].
По данным различных исследований клинические проявления могут присутствовать до 73,1 % случаев, доминирующими являются боль в горле, охриплость, изжога, ощущение «кома», дисфагия и одинофагия [4]. В литературе отмечена ассоциация гетеротопии СОЖ в верхний отдел пищевода с хроническими отитами и синуситами, бронхиальной астмой [8]. Большинство исследователей указывают на необходимость дальнейших исследований для изучения потенциальной связи клинических симптомов как с локализацией и/или размерами «inlet patch», так и с морфологическими особенностями гетеропированной слизистой оболочки [4, 8, 11].
Одним из значимых вопросов необходимости выявления и наблюдения пациентов с гетеротопией СОЖ в проксимальном отделе пищевода является ее роль в канцерогенезе. По данным систематического обзора литературы описано порядка 50 случаев аденокарциномы в проксимальном отделе пищевода, возникшей в локусе желудочной гетеротопии. Таким образом, частота выявления неоплазии в «inlet patch» низка, составляет 0–1,56 % [12]. На основании этих данных в 2017 г. Британское общество гастроэнтерологов и Ассоциация верхней гастроинтестинальной хирургии Великобритании и Ирландии выступили с позицией, что «inlet patch» не требует динамического наблюдения и рутинной биопсии. В 2019 году французский исследователь V.Jadot и соавт. сообщили 50 % случаев обнаружения морфологически верифицированных «inlet patch» среди пациентов с выявленной мутацией гена CDH1, ассоциированного с высоким риском развития наследственного рака желудка диффузного типа. В данной группе пациентов не зафиксировано ни одного случая рака пищевода на фоне «inlet patch» [13]. Вслед за этой публикацией P.Leclercq и соавт. (2020 г.) предположили, что островок цилиндроклеточного эпителия в верхней трети пищевода представляет собой потенциальную опасность в отношении развития аденокарциномы у пациентов-носителей мутации гена CDH1, в том числе подвергшихся профилактической гастрэктомии, что обусловливает необходимость прицельного эндоскопического осмотра с забором гистологического материала гетеротопированной СОЖ в проксимальном отделе пищевода [11].
Таблица 1
Клинико-патологическая классификация гетеротопии слизистой желудка в пищевод (B.H. von Rahden, 2004 г.)
Table 1
Clinicopathologic classification of esophageal heterotopic gastric mucosa (B.H. von Rahden, 2004 г.)
|
Категория Category |
Описание Description |
Симптомы / Находки Symptoms / Findings |
|
I |
Бессимптомная Asymptomatic |
Отсутствуют None |
|
II |
Симптомная без морфологических изменений Symptomatic without morphologic changes |
Симптомы ларинго-фарингеального рефлюкса: кашель, «ком» в горле, осиплость, дискомфорт в горле Symptoms of laryngo-pharyngeal reflux: cough, globus sensation, hoarseness, sore throat |
|
III |
Симптомная с осложне ниями Symptomatic with complications |
Стриктуры, мембраны, свищи, кровотечение, изъязвление Strictures, webs, fistula, bleeding, ulcers |
|
IV |
Интраэпителиальная дисплазия (низкая и высокая) Intraepithelial dysplasia (low grade / high grade) |
Неспецифичны Non-specific |
|
V |
Инвазивная аденокарцинома: а) макроскопически визуализируемый очаг гетеротопии б) микроскопический локус гетеротопии Invasive adenocarcinoma: a) macroscopically visible patch of HGM b) microscopic foci of HGM |
От отсутствия симптомов до дисфагии From no symptoms to dysphagia |
Консервативные методы лечения
На сегодняшний день в отсутствии методических рекомендаций по ведению пациентов с гетеротопией СОЖ в проксимальном отделе пищевода не существует стандартизованного подхода к лечению. Практически всеми авторами признано, что бессимптомная желудочная гетеротопия пищевода не нуждается в лечении [14]. В случае появления симптомов ЛФР оправданным является назначение ингибиторов протонной помпы, антагонистов Н2-рецепторов, антацидов. Большин- ство авторов отметили, что эффект при приеме ингибиторов протонной помпы нестойкий [4].
Хирургические методы лечения
Сообщения о хирургических методах лечения желудочной гетеротопии в шейном отделе пищевода связаны с обнаружением инвазивной аденокарциномы на ее фоне [15]. Всеми авторами отмечено, что в отсутствии стандарта по лечению аденокарциномы, развившейся из гетеротопии слизистой оболочки желудка в пищеводе, в большинстве случаев руководствовались стандартами по лечению плоскоклеточной карциномы пищевода. Пациенты подвергались фаринго-ларингоэзофагэктомии с тонкокишечной и желудочной пластикой, с шейной лимфодиссекцией и адью-вантной химиотерапией в зависимости от стадии заболевания. Akanuma и соавт. проанализировали 43 случая аденокарциномы на фоне желудочной гетеротопии в шейном отделе пищевода, подвергшейся хирургической операции [15]. Средний возраст пациентов составил 60,4 года с преобладанием женского пола (88,4 %), дисфагия (74,4 %) у которых явилась основным клиническим симптомом. Размеры новообразования варьировали от 12 до 70 мм (в среднем 36,4 мм), половина из которых имели экзофитный характер роста. Благоприятные результаты лечения в течении периода наблюдения от 5 до 60 месяцев были достигнуты только у 42 % пациентов.
Эндоскопические методы лечения
С развитием эндоскопических технологий, при осложненных вариантах гетеротопии слизистой желудка в шейном отделе пищевода предпринимались различные методики.
Эндоскопическая мукозальная резекция
Aaron B. Domm и соавт. продемонстрировали положительные результаты после эндоскопической мукозальной резекции у 7 пациентов с «inlet patch» без очагов дисплазии и неоплазии (средний возраст 40 лет) с различной клинической симптоматикой ларингофарингеального рефлюкса, не отвечающих на терапию ингибиторами протонной помпы [16]. 4 пациента отметили полное купирование предшествующих симптомов.
Basseri и соавт. описали случай эндоскопической мукозальной резекции желудочной гетеротопии в шейном отделе пищевода, ассоциированной с ларингеальной плоскоклеточной карциномой у пациентки 33 лет с жалобами на изжогу, дисфагию и кашель в течение длительного времени [17]. Сочетание химиолучевой терапии было основным этапом лечения злокачественного образования гортани. В последующем с целью эрадикации источника ларингоэзофагеального рефлюкса выполнили резекцию гетеротопии, осложнившуюся стриктурой верхней трети пищевода и потребовавшей проведения эндоскопического бужирования.
По литературным данным преимущественно после 2010 года возрастает диагностика ранних форм аденокарциномы в очагах желудочной гетеротопии в шейном отделе пищевода. Эндоскопическая резекция слизистой оболочки была выполнена у пяти пациентов с ранней формой аденокарциномы пищевода [18]. У трех из этих пациентов не было никаких признаков рецидива в течение 12 и 31 месяцев наблюдения.
При выполнении эндоскопической мукозальной резекции очагов гетеротопии авторы рекомендуют проводить эндоскопическое наблюдение каждые три месяца в течение года, затем один раз ежегодно [18].
Также имеются единичные случаи выполнения резекции при слабой дисплазии в очаге «inlet patch» [17]. А Richard H. Cartabuke и соавт. сообщили об успешном выполнении эндоскопической мукозальной резекции участка тяжелой дисплазии [19].
Эндоскопическая диссекция в подслизистом слое
О выполнении эндоскопической диссекции в подслизистом слое (ESD) по поводу ранней формы аденокарциномы, развившейся из «inlet patch», имеются единичные сообщения, несмотря на преимущества метода [20–22]. Возможно, это обусловлено ограниченным опытом многих клиник по выполнению ESD, высоким риском образования стриктур при данной локализации. В половине продемонстрированных случаев не представлены отдаленные результаты лечения, в других наблюдалась неполноценная диссекция, потребовавшая повторных вмешательств. Kitasaki с соавт. (2022) описали случай высокодифференцированной аденокарциномы в желудочной гетеротопии проксимального отдела пищевода без признаков инвазии и метастатического поражения по результатам компьютерной томографии и эндосонографии у мужчины 52 лет, курильщика, которому выполнено трижды ESD по поводу рецидива неоплазии через 21 и 19 месяцев [23]. При последней ESD по данным гистологического исследования резекция оказалась неполноценной, также выявлена лимфатическая инвазия. Пациент перенес эзофагэктомию с благоприятной 5-летней выживаемостью.
Эндоскопическое бужирование
Известно, что «inlet patch» может осложняться формированием мембран, стриктур верхней трети пищевода, сопровождаясь клиникой прогрессирующей дисфагии, изжоги, ощущения «кома» в горле. Как правило, описанные случаи данного осложнения представлены протяженными, чаще 2 – 3 см и более, очагами гетеротопии, занимающими более 75 % окружности просвета пищевода [24, 25]. Эндоскопическое бужирование во всех случаях было эффективным. Некоторые авторы полагают, что последующие аблационные методики могут улучшить результаты лечения [26].
Аргоноплазменная коагуляция
В зарубежных публикациях имеются данные об использовании аргоноплазменной коагуляции при гетеротопии слизистой желудка в шейном отделе пищевода, преимущественно в группе пациентов с ощущением «кома» в горле.
В 1997 году Sauve и соавт. сообщили об успешной эради-кации гетеротопии СОЖ в шейном отделе пищевода с очагом тяжелой дисплазии после 6 курсов АПК у пациента, перенесшего комбинированное лечение по поводу злокачественного новообразования гортаноглотки [26]. Авторы предположили, что дисплазия могла быть индуцирована лучевой терапией шейной области 2 года назад.
A.Meining и соавт. (2006 г.) изучили влияние АПК (мощность коагуляции составила 60 Вт и потока аргона – 2 л/мин) на купирование симптомов у 10 пациентов с наличием «inlet patch» и жалобами на чувство «кома» в горле и/или болью в горле. Авторы отметили существенное улучшение самочувствия больных, практически полное исчезновение указанных симптомов через 8 недель после проведённой терапии [27]. Однако, потенциальный риск возникновения стриктур после АПК существует [28]. В проспективном рандомизированном исследовании с двойным слепым контролем у пациентов с аналогичными жалобами M. Bajbouj и соавт. (2009 г.) продемонстрировали, что у 82 % пациентов, которым выполнили АПК значительно уменьшился дискомфорт в горле по сравнению с отсутствием таковых у пациентов группы контроля, а у 90 % эндоскопически зафиксировано полное исчезновение участков гетеротопии [29]. Долгосрочная эффективность АПК с использованием визуальной аналоговой шкалы симптомов по истечении в среднем 27 месяцев наблюдения была зафиксирована у 74 % пациентов [30]. Однако, авторы отметили, что из 45 % пациентов с эндоскопическим контролем у половины обнаружена резидуальная гетеротопия [30]. В метаанализе, включавшем шесть исследований по применению АПК у сим-птомных пациентов с гетеротопией СОЖ в верхнюю треть пищевода, ответ на терапию был зафиксирован более чем у 80 % пациентов. Медиана времени наблюдения в этих исследованиях составляла от 1 до 36 месяцев [29].
В нескольких исследованиях о применении АПК при симптоматической гетеротопии в устье пищевода у детей также были продемонстрированы благоприятные результаты лечения у 70 % пациентов в течение 3-летнего периода наблюдения с полной эндоскопической эрадикацией [31].
Радиочастотная аблация
Радиочастотная аблация в настоящее время является широко используемым методом эндоскопической эрадикационной терапии дисплазии слизистой оболочки, возникающей на фоне пищевода Баррета. Она используется при лечении диспластиче-ских изменений пищевода, эктазии сосудов антрального отдела желудка (GAVE), лучевой проктопатии, холангиокарциномы и неоплазии поджелудочной железы [32].
Основное преимущество ее использования по сравнению с другими аблационными методиками обусловлено стандартной глубиной деструкции ткани до уровня мышечной пластинки слизистой оболочки пищевода, что приводит к более низкой частоте побочных эффектов в виде рубцовых стриктур и перфораций [10]. Возможность выбора катетера доставки энергии к очагу необходимого размера существенно повышает эффективность и сокращает время процедуры (рис. 5). Ввиду этого показания для применения РЧА при заболеваниях желудочно-кишечного тракта продолжают расширяться.
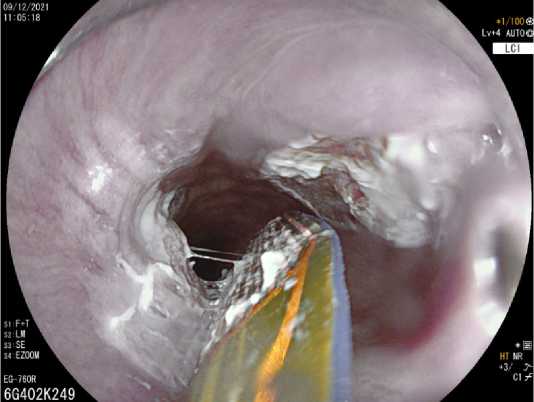
Рис. 5. Радиочастотная аблация гетеротопии СОЖ в пищеводе с помощью внутриканального катетера гибкого катетера Barrx™ Channel RFA Endoscopic Catheter
Fig. 5. Radiofrequency ablation of heterotopic gastric mucosa in the esophagus with flexible catheter Barrx™ Channel RFA Endoscopic Catheter
Эрадикация очагов гетеротопии при помощи аблационных методов, с учетом их локализации в области устья пищевода, должна сопровождаться выбором наиболее безопасного и эффективного.
В последние годы появилось несколько публикаций об использовании радиочастотной абляции (РЧА) для лечения гетеротопии СОЖ в проксимальном отделе пищевода [33]. В 2015 году Richard H. Cartabuke дополнил EMR участка тяжелой дисплазии в «inlet patch» сеансом РЧА всей области гетеротопии, локализованной на расстоянии от 19 до 22 см от резцов и охватывающий 75 % окружности пищевода. Последующее исследование через 6 месяцев показало полную эрадикацию участка гетеротопии [19].
В 2016 году J.M. Dunn и соавт. впервые в пилотном исследовании 10 пациентов (средний возраст 56 лет, 60 % мужчин) с ощущением «кома» в горле сообщили о применении радиочастотной аблации (РЧА) при желудочной гетеротопии в шей- ном отделе пищевода со средним размером 2 см2 [33]. Для РЧА использовали внутриканальные устройства с мощностью 12 Дж/см2. Полной эндоскопической и гистологической эрадика-ции у 80 % пациентов удалось достичь в среднем за 2 сеанса. Соответственно, купировались симптомы ощущения «кома» в горле, першения, кашля (р<0,05). Авторы подтверждают безопасность метода, так, в среднем при 179 сеансов аблации не было получено ни одной стриктуры в течении 14 месяцев.
Аналогичные результаты получили I. Kristo и соавт., сфокусировавшись на лечении методом РЧА исключительно больших симптомных «inlet patch» (≥20 мм в диаметре) у 10 пациентов, для которых терапия ИПП в течение 3 месяцев оказалась неэффективной [10]. Предварительно с помощью манометрии высокого разрешения у пациентов исключили функциональные расстройства пищевода, рН-импедансометрия указала на отсутствие гастроэзофагеальной рефлюксной болезни. Для аблации больших гетеротопий использовали как внутриканальные гибкие катетеры, так и фокальные катетеры, фиксируемые к дистальному концу аппарата. Помимо полной макроскопической эрадикации у 80 % пациентов после 2 сеансов и разрешения симптоматики, авторы продемонстрировали улучшение качества жизни пациентов, в частности психической компоненты здоровья (р=0,007). В данном исследовании также авторы не зафиксировали ни одной стриктуры в течение 1,9 (±0,5) года.
Выводы
Визуализация гетеротопии СОЖ в шейном отделе пищевода улучшается при тщательной эндоскопической диагностике, в том числе с применением уточняющих методик. Тактика ведения пациента должна определяться на основании клинико-морфологических изменений. Накопленный опыт меняет концепцию лечения от консервативной терапии в сторону использования малоинвазивных интервенционных методик. РЧА на сегодняшний день демонстрирует наибольшую безопасность и эффективность.
Expert Rev Gastroenterol Hepatol ., 2016, № 10(3), pp. 405–414. https://doi . org/ 10.1586/17474124.2016.1125780
Список литературы Перспективы эндоскопического лечения пациентов с гетеротопией слизистой желудка в шейном отделе пищевода (обзор литературы)
- López-Colombo A., Jiménez-Toxqui M., Gogeascoechea-Guillén P.D., Meléndez-Mena D., Morales-Hernández E.R., Montiel-Jarquín Á.J., Amaro-Balderasa E. Prevalence of esophageal inlet patch and clinical characteristics of the patients. Rev Gastroenterol Mex., 2019, № 84(4), pp. 442-448. https://doi.org/10.1016/j.rgmx.2018.07.003
- Blanco C., Teusabá E., Russi K. A Case Report of Circumferential Presentation with Stricture of Heterotopic Gastric Mucosa in the Cervical Esophagus. Revista Colombiana De Gastroenterología, 2015, № 30(2), pp. 225-231. https://doi.org/10.22516/25007440.45
- Al-Mammari S., Selvarajah U., East J.E., Bailey A.A., Braden B. Narrow band imaging facilitates detection of inlet patches in the cervical oesophagus. Dig Liver Dis., 2014, № 46(8), pp. A237. https://doi.org/10.1016/j.dld.2014.05.001
- Ciocalteu A., Popa P., Ionescu M., Gheonea D.I. Issues and controversies in esophageal inlet patch. World J Gastroenterol., 2019, № 25(30), pp. 4061-4073. https://doi.org/10.3748/wjg.v25.i30.4061
- Chong V.H. Clinical significance of heterotopic gastric mucosal patch of the proximal esophagus. World J Gastroenterol., 2013, №19(3), pp. 331-338. https://doi.org/10.3748/wjg.v19.i3.331
- Peitz U., Vieth M., Evert M., Arand J., Roessner A., Malfertheiner P. The prevalence of gastric heterotopia of the proximal esophagus is underestimated, but preneoplasia is rare - correlation with Barrett’s esophagus. BMC Gastroenterol., 2017, № 17(1). https://doi.org/10.1186/s12876-017-0644-3
- Korkut E., Bektaş M., Alkan M., Ustün Y., Meco C., Ozden A., Soykan I. Esophageal motility and 24-h pH profiles of patients with heterotopic gastric mucosa in the cervical esophagus. Eur J Intern Med., 2010, № 21(1), pp. 21-24. https://doi.org/10.1016/j.ejim.2009.10.009
- Chong V.H., Jalihal A. Heterotopic gastric mucosal patch of the esophagus is associated with higher prevalence of laryngopharyngeal reflux symptoms. Eur Arch Otorhinolaryngol., 2010, № 267(11), pp. 1793-1799. https://doi.org/10.1007/s00405-010-1259-2
- Gutierrez O., Akamatsu T., Cardona H., Graham D.Y., El-Zimaity H.M. Helicobacter pylori and hetertopic gastric mucosa in the upper esophagus (the inlet patch). Am J Gastroenterol., 2003, № 98(6), pp. 1266-1270. https://doi.org/10.1111/j.1572-0241.2003.07488.x
- Kristo I., Rieder E., Paireder M., Schwameis K., Jomrich G., Dolak W., Parzefall T., Riegler M., Asari R., Schoppmann S.F. Radiofrequency ablation in patients with large cervical heterotopic gastric mucosa and globus sensation: Closing the treatment gap. Dig Endosc., 2018, № 30(2), pp. 212-218. https://doi.org/10.1111/den.12959
- Leclercq P., Jadot V., Bours V., Kohnen L., Honoré P., Martin M., De Flines J., Mutijima E., Leclercq P. Inherited CDH1 pathogenic variant: is there a place for surveillance of esophageal gastric inlet patch? Therap Adv Gastroenterol., 2020, № 13, pp. 1-2. https://doi.org/10.1177/1756284820916399
- Sahin G., Adas G., Koc B. et al. Is cervical inlet patch important clinical problem? Int J Biomed Sci., 2014, № 10(2), pp. 129-135.
- Jadot V., Segers K., Bours V., Kohnen L., Honoré P., Martin M., De Flines J., Mutijima E., Leclercq P. Cancer gastrique diffus héréditaire. Série de 8 patients appartenant à une même famille et revue de la littérature [Hereditary diffuse gastric cancer: case serie of 8 patients from a single family and literature review]. Rev Med Liege., 2019, № 74(3), pp. 134-138.
- Rusu R., Ishaq S., Wong T., Dunn J.M. Cervical inlet patch: new insights into diagnosis and endoscopic therapy. Frontline Gastroenterol., 2018, № 9(3), pp. 214-220. https://doi.org/10.1136/flgastro-2017-100855
- Akanuma N., Hoshino I., Akutsu Y., Shuto K., Shiratori T., Kono T., Uesato M., Sato A., Isozaki Y., Maruyama T., Takeshita N., Matsubara H. Primary esophageal adenocarcinoma arising from heterotopic gastric mucosa: report of a case. Surg Today., 2013, № 43(4), pp. 446-451. https://doi.org/10.1007/s00595-012-0206-9
- Domm A.B., Sarskan S., Cheng D., Conklin J.L., Lo S.K. Esophageal Inlet Patch Removal Using Endoscopic Mucosal Resection. Gastrointestinal Endoscopy, 2007, № 65(5), pp. AB148. https://doi.org/10.1016/j.gie.2007.03.20210.1016/j.gie.2007.03.202
- Basseri B., Conklin J.L., Mertens R.B., Lo S.K., Bellack G.S., Shaye O.A. Heterotopic gastric mucosa (inlet patch) in a patient with laryngopharyngeal reflux (LPR) and laryngeal carcinoma: a case report and review of literature. Dis Esophagus., 2009, № 22(4), pp. E1-E5. https://doi.org/10.1111/j.1442-2050.2008.00915.x
- Cock C., Hamarneh Z. Gastric inlet patches: symptomatic or silent? Curr Opin Otolaryngol Head Neck Surg., 2019, № 27(6), pp. 453-462. https://doi.org/10.1097/MOO.0000000000000581
- Cartabuke R.H., Thota P.N. High-grade dysplasia in thoracic inlet patch treated by focal endoscopic mucosal resection and radiofrequency ablation. Gastrointest Endosc., 2015, № 81(5), pp. 1297-1298. https://doi.org/10.1016/j.gie.2014.12.004
- Kadota T., Fujii S., Oono Y., Imajoh M., Yano T., Kaneko K. Adenocarcinoma arising from heterotopic gastric mucosa in the cervical esophagus and upper thoracic esophagus: two case reports and literature review. Expert Rev Gastroenterol Hepatol., 2016, № 10(3), pp. 405-414. https://doi.org/10.1586/17474124.2016.1125780
- Probst A., Schaller T., Messmann H. Adenocarcinoma arising from ectopic gastric mucosa in an esophageal inlet patch: treatment by endoscopic submucosal dissection. Endoscopy, 2015, № 47, pp. E337-E338. https://doi.org/10.1055/s-0034-1392423
- Oono Y., Kensuke S., Yoda Y., Hori K., Ikematsu H., Yano T. Cervical esophageal adenocarcinoma arising from heterotopic gastric mucosa, treated with endoscopic submucosal dissection. Endoscopy, 2019, № 51(2), pp. E28-E29. https://doi.org/10.1055/a-0767-6253
- Kitasaki N., Hamai Y., Yoshikawa T., Emi M., Kurokawa T., Hirohata R., Ohsawa M., Okada M. Recurrent esophageal adenocarcinoma derived from ectopic gastric mucosa: A case report. Thorac Cancer., 2022, № 13(6), pp. 876-879. https://doi.org/10.1111/1759-7714.14339
- Shimamura Y., Winer S., Marcon N. A Giant Circumferential Inlet Patch With Acid Secretion Causing Stricture. Clin Gastroenterol Hepatol., 2017, № 15(4), pp. A22-A23. https://doi.org/10.1016/j.cgh.2016.10.004
- Годжелло Э. А., Булганина Н. А., Хрусталева М. В. Гетеротопия слизистой желудка и длинный сегмент пищевода Барретта, осложненные рубцовой стриктурой верхней трети пищевода. Экспериментальная и клиническая гастроэнтерология, 2021. № 189(5). С. 92-96. https://doi.org/10.31146/1682-8658-ecg-189-5-92-96
- Sauvé G., Croué A., Denez B., Boyer J. High-grade dysplasia in heterotopic gastric mucosa in the upper esophagus after radiotherapy: successful eradication 2 years after endoscopic treatment by argon plasma coagulation. Endoscopy, 2001, № 33(8), pp. 732. https://doi.org/10.1055/s-2001-16221
- Meining A., Bajbouj M., Preeg M., Reichenberger J., Kassem A.M., Huber W., Brockmeyer S.J., Hannig C., Höfler H., Prinz C., Schmid R.M. Argon plasma ablation of gastric inlet patches in the cervical esophagus may alleviate globus sensation: a pilot trial. Endoscopy, 2006, № 38(6), pp. 566-570. https://doi.org/10.1055/s-2006-925362
- Meining A., Bajbouj M. Gastric inlet patches in the cervical esophagus: what they are, what they cause, and how they can be treated. Gastrointest Endosc., 2016, № 84(6), pp. 1027-1029. https://doi.org/10.1016/j.gie.2016.08.012
- Bajbouj M., Becker V., Eckel F., Miehlke S., Pech O., Prinz C., Schmid R.M., Meining A. Argon plasma coagulation of cervical heterotopic gastric mucosa as an alternative treatment for globus sensations. Gastroenterology, 2009, № 137(2), pp. 440-444. https://doi.org/10.1053/j.gastro.2009.04.053
- Klare P., Meining A., von Delius S. Wolf P., Konukiewitz B., Schmid R.M., Bajbouj M. Argon plasma coagulation of gastric inlet patches for the treatment of globus sensation: it is an effective therapy in the long term. Digestion, 2013, № 88(3), pp. 165-171. https://doi.org/10.1159/000355274
- Di Nardo G., Cremon C., Bertelli L., Oliva S., De Giorgio R., Pagano N. Esophageal Inlet Patch: An Under-Recognized Cause of Symptoms in Children. J Pediatr., 2016, pp. 99-104. https://doi.org/10.1016/j.jpeds.2016.05.059
- ASGE Technology Committee, Navaneethan U., Thosani N., Goodman A., Manfredi M., Pannala R., Parsi M.A., Smith Z.L., Sullivan S.A., Banerjee S., Maple J.T. Radiofrequency ablation devices. VideoGIE, 2017, № 2(10), pp. 252-259. https://doi.org/10.1016/j.vgie.2017.06.002
- Dunn J.M., Sui G., Anggiansah A., Wong T. Radiofrequency ablation of symptomatic cervical inlet patch using a through-the-scope device: a pilot study. Gastrointest Endosc., 2016, № 84(6), pp. 1022-1026. https://doi.org/10.1016/j.gie.2016.06.037


