Первичные и метастатические муцинозные опухоли яичников. Трудности в диагностике и новые тенденции в лечении
Автор: Кедрова Анна Генриховна, Шабловский Олег Радомирович, Забозлаев Федор Георгиевич, Нечаева Ольга Евгеньевна, Красильников Сергей Эдуардович, Максименко Татьяна Анатольевна, Герасимов Алексей Владимирович
Журнал: Клиническая практика @clinpractice
Рубрика: Передовая статья
Статья в выпуске: 2 (22), 2015 года.
Бесплатный доступ
С целью улучшения результатов лечения больных злокачественными опухолями яичников произведен анализ клинико-морфологических и генетических особенностей муцинозных опухолей яичников (МОЯ) с оценкой факторов, влияющих на подбор индивидуального лечения. На примере 4-х клинических случаев представлены особенености диагностики первичного муцинозного рака яичников, метастатического рака яичников при колоректальным раке, метастатического муцинозного рака яичников при мезотелиоме брюшины, прогрессирование муцинозной карциномы аппендикса с метастазированием в яичник.
Муцинозный рак яичников, псевдомиксома брюшины, метастазы колорек- тального рака в яичник, муцинозная карцинома аппендикса, злокачественная мезотелиома брю- шины
Короткий адрес: https://sciup.org/14338528
IDR: 14338528
Текст научной статьи Первичные и метастатические муцинозные опухоли яичников. Трудности в диагностике и новые тенденции в лечении
Муцинозный тип новообразований яичников составляет около 15% от всех первичных опухолей придатков матки, а метастазы других муцинозных опухолей наблюдаются в яичниках в 8% наблюдений [1]. Злокачественные муцинозные опухоли обычно состоят из клеток желудочно-кишечного типа, содержащих цитоплазматический муцин и первично располагаются в желудочно-кишечном тракте [2]. Дифференциальная диагностика первичного и метастатического поражения яичников, даже при применении гистоиммунохимических методов, представляет значительные трудности, так как имеется ряд общих признаков, а первичный очаг не всегда удается выявить одномоментно с метастазами. Чаще муцинозные метастатические опухоли яичников могут быть ассоциированы с раком кишечника, поджелудочной железы, миксомой брюшины, могут быть связаны с наследственным синдромом, в частности с синдромом Линча 2. Наличие «гигантских» яичников иногда имеет внешнюю картину первичного рака, а гистопатологически соответствует метастазам, источник которых может проявиться спустя 4-6 мес. [3]. Метастатические опухоли из желудочно-кишечного тракта часто имитируют рак яичников у женщин в пре- и постменопаузе и имеют худший прогноз в сравнении с немуцинозной аденокарциномой кичечника [4]. Еще одной проблемой муцинозного рака, выявляемого из разных первичных очагов, является его низкая чувствительность к стандартным схемам химиотерапии, что, несмотря на медленный рост таких опухолей, приводит к низкой выживаемости [4]. В этой связи многие клиницисты лечат таких пациентов в контексте плохого прогноза, особеннно при перитонеальном распространении [5]. Таким образом, несмотря на хорошо известную проблему сочетания муцинозного поражения яичников с колоректальной карциномой, вопросы диагностики и тактики лечения остаются до конца не определенными.
Материалы и методы: Мы представляем анализ 4-х случаев больных: с колоректальным раком и метастатическим поражением яичников, с первичным муцинозным раком яичников, мезотелиомой брюшины с поражением яичников и первино-множественного поражения толстой кишки и яичников. Все па- циентки были пременопаузального возраста, имели сходные предоперационные данные диагностики и визуальные операционные находки, однако в дальнейшем их гистопатологические диагнозы и течение болезни значительно различались. Всем пациенткам проводилось гистоиммунохимическое исследование и тестирование экспрессии генов опухолей (ПЦР в режиме реального времени), используя фиксированные формалином парафиновые образцы. Предварительно проводился экспертный морфологический анализ образцов опухолей, окрашенных гематоксилином-эозином. Иммуногистохимическое окрашивание опухоли было выполнено на парафиновых блоках, с использованием авидин-биотин-иммунопе-роксидазного метода, с 3-амино-9-этил карбазолом в качестве хромогена и гематоксилином в виде контраста. Срезы окрашивали моноклональными антителами к CK7, CK20, РЭА, ER/ PR, WT, Dpc4, PAX8.
Клинические данные по больным представлены в таблице 1.
Клинический случай 1. Пациентка В., 48 лет, в анамнезе 2 родов, 2 аборта, 8 лет назад выполнялась лапароскопическая резекция правого яичника по поводу дермоидной кисты (стеклопрепаратов не представлено). В октябре 2012 г. обратилась в ФНКЦ ФМБА России с жалобами на увеличение живота в объеме и периодические схваткообразные боли в брюшной полости. Больная также отмечала частые запоры, которыми страдала последние 3 мес. При осмотре: состояние пациентки удовлетворительное, ECOG 0-1, живот увеличен в размерах за счет опухоли и раздутых петель кишечника (задержка стула 3 дня), кожные покровы нормальной окраски, признаков отеков и обезвоживания нет. После предварительной подготовки выполнено УЗИ органов брюшной полости, которое определило, что яичники представлены двусторонними гигантскими опухолями: справа 126 х 156 х 189 мм и слева 233 х 179 х 145 мм. По данным гастро- и колоноскопии патологии не выявлено. По данным маммографии состояние молочных желез соответствует возрастной норме. Результаты опухолево-ассоциированных маркеров крови: СА-125-275 МЕ/мл; СА 19-9 - 368 МЕ/мл; РЭА -12,3 нг/мл; НЕ4-24 пмоль/л. 22 октября 2012 года выполнена операция: экстирпация матки с придатками,
Клиническая характеристика больных
Таблица 1
|
Гистологический тип опухоли и возраст больной |
Стадия, первичная опухоль |
Остат. опухоль |
Исходные маркеры |
Исход, от 24 мес. до 36 мес. |
|
Клиническое наблюдение 1. Пациентка В. 48 лет, Муцинозная цистаденокарцинома яичников Т2бN0M0, G2, R0 |
Яичники:126 x 156 x 189 мм и 233 x 179 x 145 мм IIb, яичники, Аппендикс – интактный, сальник – опухоли нет |
ЭМП. Удаление большого сальника. Аппендэктомия. Ревизия забрюшинных лимфатических узлов. |
СА 125-275МЕ/мл; СА 19-9-368 МЕ/мл; РЭА – 12,3нг/мл; НЕ4 – 24 пмоль/л |
6 курсов паклитаксел 175 мг/м2 и карбоплатин AUC 5 и 4 курса XELOX + бевацизумаб. Ремиссия. |
|
Клиническое наблюдение 2. Пациентка К. 52 года, рак ободочной кишки с метастазами в яичники |
Опухоль кишки – 4,6 см; Яичники: 168 x 279 x 273 мм и 123 x 114 x 182 мм |
Гемиколэктомия с ЭМП, без остаточной опухоли |
СА 125 - 485 МЕ/мл; СА 19-9 - 567 МЕ/мл; РЭА 63,5нг/мл; НЕ4 43 пмоль/л |
XELOX 6 курсов, ПР без прогрессирования 26 мес. |
|
Клиническое наблюдение 3 Пациентка M. 46 лет. Мезотелиома брюшины с поражением яичников, большого сальника |
Яичник правый: 7 x 9 x 12 см + опухоль в брыжейке кишки до 4-5 см, утолщение брюшины с множеством мелких кист в забрюшинном пространстве размерами 6,5 x 9,0 x 3,5 см |
Инфильтрация оставшейся части воронко-тазовых и круглых связок матки, участки утолщенной брюшины в латеральных каналах брюшной полости |
СА 125-42МЕ/мл; СА 19-9 - 75 МЕ/мл; РЭА 6,3нг/мл; НЕ4 8 пмоль/л |
цисплатин 75 мг/м2 внутрибрюшинно каждые 21 день и гемцитабин 800 мг/м2 1 и 8 дни. |
|
Клиническое наблюдение 4 Пациентка H. 38 лет. Прогрессирование муцинозного рака слепой кишки Т2N0M0, метастазы в яичник, миксома брюшины. |
Удалена опухоль аппендикса, через 8 мес. Прогрессирование – многокамерная опухоль левого яичника, размерами до 6,7 x 5,6 x 11,4 см (правый удален ранее) и миксома брюшины. |
Правосторонняя гемиколэктомия, экстирпация матки с придатками. Удаление большого сальника |
СА 125-34 МЕ/мл; СА 19-9 – 61,2 МЕ/ мл; РЭА – 15,1нг/мл; НЕ4 – 47,5 пмоль/л |
Химиотерапия 6 курсов: оксалиплатин в сочетании с 24-часовыми еженедельными инфузиями 5-фторурацила и использованием лейковорина |
удаление большого сальника. Аппендэктомия. Ревизия забрюшинных лимфатических узлов. Операция: опухоли яичников и матка удалены поэтапно, без вскрытия капсул, асцитическая жидкость до 3 литров была полностью эвакуирована. Визуальных данных за остаточную опухоль нет. Макропрепарат яичников представлен кистозно-солидными образованиями с интактной поверхностью и с множеством внутренних перегородок.
Первоначальное плановое гистологическое исследование предположило метастатический рак яичников (рис.1 и рис.2), вероятного происхождения из желудочно-кишечного тракта. Однако интактная ткань аппендикса, связь муцинозной опухоли с ранее удаленной дермоидной кистой и отсутствие находок при неоднократном исследовании желудочнокишечного тракта в течение года исключает вторичный характер поражения яичников [7]. Препараты пересмотрены и выполнено ги- стоиммунохимическое исследование: СК 7+; CDX2+; PAX8+, ER + (локально)/PR-, СК 20-, РЭА -, WT1 - . Заключение: иммуноморфотип опухоли соответствует первичной муцинозной цистаденокарциноме яичников. Стадия Т2бN0M0, G2, R0. В послеоперационном периоде маркеры нормализовались, всего проведено 6 курсов химиотерапии паклитаксел 175мг/м2 и карбоплатин AUC 5 х21 день. Через 7 месяцев, после окончалия химиотерапии, пациентка обратилась с жалобами на боли в животе и прибавку в весе 10 кг. При проведенном обследовании выявлено: повышение маркеров (СА-125-87МЕ/мл; СА 19-9 - 48МЕ/мл) и 2 кистозных образования до 4 см в области малого таза. Диагноз: Рецидив муцинозного рака яичников. Проведено обследование ЖКТ и выполнена повторная циторедуктивная операция. Дополнительно – генетическое исле-дование первичной опухоли. Выявлена KRAS -мутация. Учитывая тип опухоли и небольшой
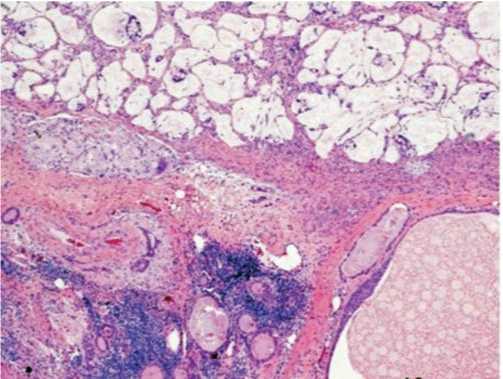
Рис. 1. ICD-0 код 8480/3. Первичный муцинозный рак яичника кишечного типа, клетки с эозинофильной цитоплазмой, нарушенная стратификация клеток с атипией ядер и редкими фигурами митоза. Наблюдаются скопления атипичных желез, в виде гнезд, располагающихся глубоко в строме.
Иммуногистохимический профиль первичной муцинозной цистаденокар-циномы яичников: СК 7+; CDX2+; PAX8+, ER + (локально)/PR-, СК 20 -, РЭА -, WT1 -, РЭА-; CA-125 +/-, бета-катенин отрицательный.
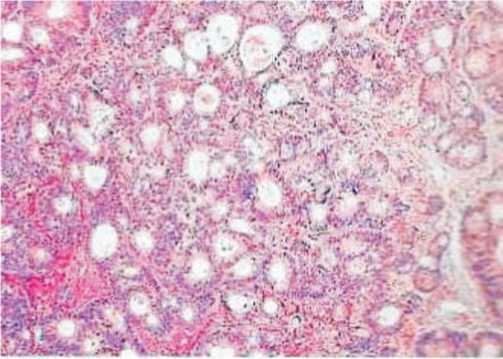
Рис. 2. Метастаз в яичник муцинозной аденокарциномы ободочной кишки. Метастазы муцинозных опухолей могут имитировать гистопатологические особенности первичных опухолей яичников в 5-10 % случаев. Обычно они хорошо дифференцированы, железы проникают в строму снаружи с наличием инфильтративных очагов на поверхности.
Иммуногистохимический профиль метастазов аденорарциномы муцинозного типа из толстой кишки: CK7-, CK20 +, РЭА +, CA + 125--, MUC2 +, CDX2 + и бета-катенина + (ядерное окрашивание)
промежуток времени без химиотерапии, принято решение изменить схему лечения: пациентке предложена терапия XELOX (оксалиплатин и капецитабин) и бевацизумаб, всего проведено 4 курса лечения, признаков рецидива нет. По данным маркеров и УЗИ – без признаков прогрессирования.
Клинический случай 2. Пациентка К., 52 лет, в июле 2013 г, обратилась в клинику с признаками частичной кишечной непроходимо- сти, которая формировалась около 2 месяцев: периодические боли, вздутие живота, нерегулярный стул. При ультразвуковом исследовании брюшной полости выявлены крупные многокамерные опухоли яичников, с перегородками различной толщины и эхогенными включениями, размеры образований: 168 х 279 х 273 мм и 123 х 114 х 182 мм. В области ободочной кишки найдено образование до 5 см, изменений печени, почек, селезенки, забрюшинных лимфатических узлов, асцитической жидкости не зафиксировано. При колоноскопии в средней трети ободочной кишки экзо-фитно кольцеобразное образование, сужающее просвет кишки до 0,7 см. Гистологическая верификация – умереннодифференцированная аденокарцинома кишечного типа. Маркеры: Са-19,9 – 567 МЕ/мл, Са-125 -485 МЕ/мл, РЭА – 63,5 МЕ/мл, НЕ4-43 пмоль/л. Пациентке выполнена гемиколэктомия, экстирпация матки с придатками, удаление большого сальника. Визуальных признаков остаточной опухоли нет. Гистологическое заключение: метастазы в яичники высокодифференцированной аденокарциномы, муцинозного типа, вероятнее всего из ЖКТ (рис. 2) В послеоперационном периоде проведено 6 курсов химиотерапии режима XELOX (оксалиплатин и капицетабин). За 24 месяца наблюдений признаков прогрессирования болезни нет.
Клинический случай 3. Пациентка М. 46 лет, в анамнезе наружный эндометриоз, 1 роды в 22 года, затем вторичное бесплодие, по поводу которого 7 и 3 года назад перенесла две лапароскопические операции по удалению эндометриоидных кист яичников с резекцией эндометриоидных очагов по брюшине. В мае 2012 года больная поступила в гинекологическое отделение Новосибирского областного онкодиспансера из-за диффузных болей в животе, сопровождающихся тошнотой и рвотой. Также пациентка отмечала, что за 3мес. резко увеличился живот, до размеров 30-32 недельной беременности. При осмотре: живот болезненный в верхних отделах, напряжен, есть признаки начального обезвоживания, при сохранении всех функциональных проб, EGOC 0-1. Аскультативно в легких дыхание проводится во все отделы, отмечено высокое стояние диафрагмы, в животе выслушиваются звуки перестальтики. По картине обзорного снимка брюшной полости наблюдаются признаки формирующейся многоуровневой кишечной непроходимости. Больная взята на операцию по «срочным показаниям». При выполнени-ми срединной лапаротомии имелись трудности при вхождении в брюшную полость из-за подпаянных петель кишечника к утолщенной брюшине. После разделения спаяк и удаления нескольких кистозных масс, ограниченных тонкими пленочными перегородками, удалось осмотреть малый таз. В малом тазу обнаружен увеличенный правый яичник, размерами 7x9 x12 см (рис. 3), матка и левый яичник не изменены.
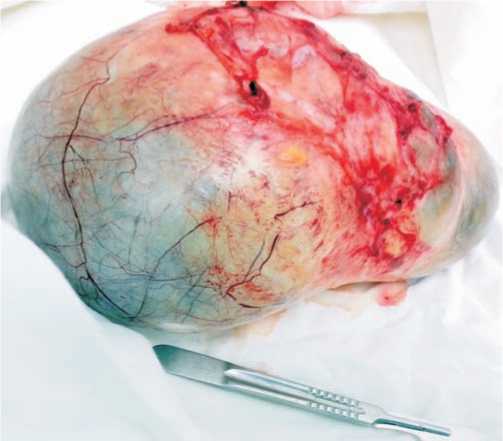
Дополнительно имелись кистозные образования в области брыжейки тонкой кишки (4 см в диаметре), в забрюшинном пространстве, размерами 6,5 x 9,0 x 3,5 см. С учетом выполнения операции по «срочным показаниям» и отсутствием хорошей плановой подготовки больной, была произведена максимально возможная циторедукция опухолевых новообразований, петли кишечника максимально освобождены от опухолевых спаек с ограниченным муцинозным содержимым. Дополнительно произведена резекция уплотненных участков брюшины. В брюшную полость установлен контрольный дренаж и порт для проведения внутрибрюшинной химиотерапии. Остаточная опухоль оставалась в виде утолщенного инфильтрата брюшины в малом тазу, в области культи воронко-тазовых и круглых связок матки. В послеоперационном периоде обследован ЖКТ, патологии не выявлено, результаты опухолево-ассоциированных маркеров крови на 9 сутки после операции: СА-125-42МЕ/мл; СА 19-9 - 75 МЕ/мл; РЭА - 6,3нг/ мл; НЕ4 - 8 пмоль/л. Первичное гистологическое заключение: атипическая муцинозная пролиферирующая цистаденома яичников (муцинозная пограничная опухоль яичников с имплантационными метастазами по брюшине). При пересмотре препаратов и выполнении гистоиммунохимического исследования диагноз изменился: мезотелиома брюшины с метастазами в яичник. Макроскопические данные показали перитонеальную опухоль с поверхностным поражением яичников, сальника, кишечника. При микроскопии: есть очаги муцинозной папиллярной опухоли на мезотелиальной поверхности, умеренная или начальная ядерная атипия с множественными мембранными нарушениями по типу анизону-
Рис. 3 А. Увеличенный правый яичник, размерами 7 Х 9 Х 2 см. мезотелиома брюшины с метастазами в яичник.
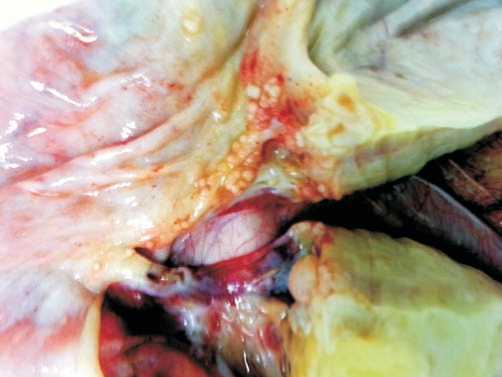
Рис. 3 Б. Видны очаги солидно-папиллярных сосочков на поверхности, утолщенные участки капсулы.
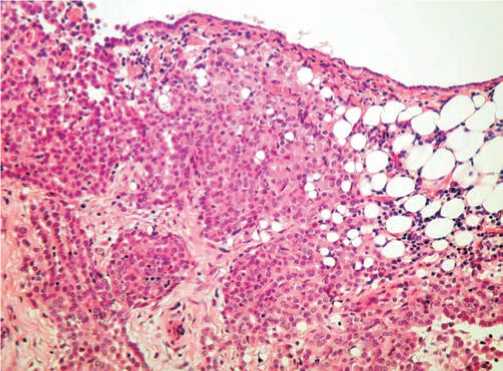
Рис. 3В. Уплотненные участки брюшины. Микроскопия.
клеоза и редкими фигурами митозов, <1/10 в поле зрения. Также просматривается очаговая стромальная инвазия больших групп клеток без десмопластического ответа и некрозов. Во всех срезах – атипичная мезотелиальная пролиферация с единичными псаммомными телами на фоне хронической воспалительной реакции стромы. Иммуногистохимическое исследование: СК 20+, EMA+, HBME-1+, CAM5.2+, ER+, PR+, Vimentine +, РЭА -, WT1 -, СК 7- и PAX8-. При кариотипировании у больной выявлена потеря 14 хромосомы. В дальнейшем проведено 6 курсов химиотерапии: цисплатин 75 мг/м2 внутрибрюшинно каждые 21 день и гемцитабин 800 мг/м2 1, 8, 15 дни. В настоящий момент признаков прогрессирования болезни нет.
Клинический случай 4. Больная Н., 38 лет, поступила в областную больницу г. Барнаула в мае 2013 года с симптомами «острого живота», ей был выставлен диагноз острый аппендицит, и выполнена лапароскопическая апендектомия. Ранее больная отмечала менее интенсивные боли в животе, в основном связывая их с началом менструального цикла. Из анамнеза: роды в 20 лет, в последующем – вторичное бесплодие, ассоциированное с наруж-ним эндометриозом, в 26 лет удален правый яичник (гистологически – эндометриоидная киста 6х8 см). Генетическая семейная история наследственного рака не имеет. При гистологическом исследовании удаленного материала выставлен диагноз: муцинозная цистаденома апендикса. Через 5 недель после операции выполнена колоноскопия, во время которой выявлены и удалены 3 полипа толстой кишки без признаков малигнизации. Через 8 месяцев больная обратилась к гинекологу с жалобами на увеличение живота в объеме, боли в брюшной полости и нарушения мочеиспускания. При ультразвуковом исследовании обнаружен выраженный асцит и подвижная многокамерная опухоль левого яичника, размерами до 6,7х5,6х11,4 см, имеющая умеренный кровоток по перегородкам. Предварительный дооперационный диагноз: цистаденома левого яиника. Результаты опухолево-ассоциированных маркеров: СА-125- 34МЕ/мл; СА 19-9 – 61,2 МЕ/мл; РЭА -15,1нг/мл; НЕ4- 47,5 пмоль/л. В феврале 2014 года выполнена срединная лапаротомия, после эвакуации 8 литров асцитической жидкости с муциносодер- жащими компонентами, произведена ревизия органов брюшной полости и забрюшинного пространства. В рану выведен левый яичник, представленый опухолью до 12 см, произведена аднексэктомия. Капсула новообразования не повреждена. Правый яичник ранее удален, матка без внешних изменений. При срочном гистологическом исследовании: в удаленном левом яичнике – атипическая пролиферирующая муцинозная цистаденома. Далее выполнена экстирпация большого сальника и матки, взята множественная биопсия брюшины в местах ее уплотнений и утолщения. При дальнейшей ревизии забрюшинного пространства и всех отделов толстой кишки, печени и поджелудочной железы признаков опухоли не выявлено. Плановое гистологическое заключение с пересмотром стеклопрепаратов после апендектомии: В препаратах ранее удаленного апендикса хорошо прослеживаются неравномерные включения муцина, проникающие в стенку кишки на фоне атипичного железистого эпителия, расположенного в виде полосок и неправильных фигур, что может соответствовать муцинозной аденокарциноме низкого потенциала злокачественности (LaMn). Иммуногистохимическое исследование: CK7-, ER-, локально-положительны: CK20+; дифузно-положительны: РЭА +, β-катенин, CDX-2+). В удаленном левом яичнике – кистозная опухоль, имеет 6 камер, с муцинозным содержимым, перегородки плотные, с грубыми папиллярными разрастаниями внутри.
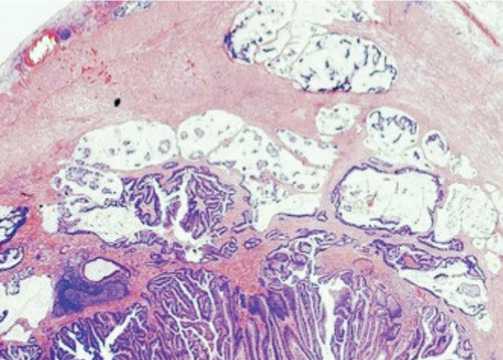
Рис. 4. Микроописание: эпителий расположен в виде папиллярных структур, напоминает эпителий цервикального канала шейки матки с атипичными клетками, содержащими муцин, четко прослеживается инвазия в строму >5мм, инфильтрированную нейтрофилами.
Иммуногистохимическое исследование: CK7+ (диффузно положительное окрашивание), нет окрашивания: РЭА-, β-катенин-, CDX-2-, CK20-, CDX-2-. Определен дикий тип KRAS-мутации в опухоли яичника и аппендиксе. Таким образом, у пациентки имеется прогрессирование рака слепой кишки с метастазом в яичник и развитием злокачественной миксомы брюшины. После получения гистологического заключения пациентке предложена правосторонняя гемиколэктомия, которая выполнена спустя 2 месяца после операции экстирпации матки с придатками. Элементов опухолевого роста не обнаружено. Проведена химиотерапия – 6 курсов: оксалиплатин в сочетании с 24-часовыми еженедельными инфузиями 5-фторурацила и использованием лейковорина. Пациентка находится под динамическим контролем.
Обсуждение
Современный алгоритм дифференциальной диагностики муцинозных поражений яичников классифицирует все двусторонние изменения, как метастатические, а при одностороннем поражении к метастатическим чаще относятся образования до 12 см [6]. С помощью такого простого правила можно определить до 84% метастатических опухолей и 100% первичных. Однако трудности первичной диагностики существуют и связаны не только с внешними сходствами муцинозных опухолей, а часто с неправильно собранным анамнезом. В целом, метастазы муцинозных опухолей в яичник могут имитировать первичные новообразования, что несет 25% клинических, и 15% морфологических ошибок [7].
Мы представили четыре случая муцинозного повреждения яичников. В первом наблюдении – у больной первичный муцинозный рак яичников. Диагноз установлен несмотря на двусторонее поражение придатков, т.к. прослеживается гистогенез опухоли, ассоциированный с дермоидной кистой, удаленной ранее, при гистологическом исследовании отсутствуют изменения в аппендиксе, и при 4-кратном контроле в течение года признаков других опухолей ЖКТ нет. Второе наблюдение примечательно тем, что метастатические опухоли имели гиганские размеры, подразумевая проведение более тщательной дифференциальной диагностики. Третий случай связан с развитием злокачественной миксомы брюшины с метастатическим поражением только одного яичника и множественными кистами по брюшине. Четвертая больная имела первичную ошибку в диагнозе, муцинозная опухоль аппендикса была расценена как доброкачественная, что привело к быстрому ее прогрессированию (метастаз в яичник и миксома брюшины) и отсроченной радикальной операции.
Все опухоли имели разный патогенез, но проявляли некоторые морфологические сходства, что требовало экспертного мнения онкоморфолога с выполнением гистоимму-нохимического исследования. С учетом установленных разных диагнозов, проводили специфическое лечение, которое во всех случаях оказалось эффективным.
Анализ гистогенеза первичных и метастатических муцинозных опухолей показал, что многие авторы связывают их развитие с наружным эндометриозом. Такое мнение основано на фактах, что определенный тип эндометриоидной ткани может пройти через муцинозную метаплазию, которая последовательно разовьется в кистозную опухоль [8]. Ассоциация муцинозной цистаденомы и ци-стаденокарциномы с дермоидными кистами может указывать на их зародышевое происхождение, а обнаружение мутаций гена KRAS в кодонах 12 и 13 – свидетельствовать об общих путях канцерогенеза с серозной цистаде-номой [9]. При этом муцинозные опухоли экспрессируют гены MUC2, MUC3 и MUC17, что нетипично для серозного, эндометриоидного и светлоклеточного рака [10].
Метастатические очаги, как правило, двухсторонние, хорошо дифференцированы, производят муцин, имеют кровоизлияния и некрозы. При их длительном развитии может происходить лютеинизация стромы яичника и внешняя мускулинизация женщины [11].
В разбираемых нами случаях cложности морфологической диагностики связывались со схожими внешними картинами муцинозных неоплазий, состоящих из множественных кист и желез, выстланных муцинозным эпителием. Основное отличие определялось отношением атипической ткани к поверхности яичника, т.к. при первичном развитии опухоли в яичнике процесс начинается изнутри, а при метастазах – с поверхности, с очагами инфильтративного роста в строму. Этот критерий мало поможет при неудачной вырезке препарата или при тотальном поражении стромы. Многие морфологи, описывая первичные муцинозные опухоли, выделяют секретирующий эпителий кишечного (однослойный – призматический или бокаловидный, содержит слизь) или эндоцервикального (высокий, цилиндрический со светлой цитоплазмой, образует крипты) типов. Однако, выраженная гетерогенность таких новообразований часто не позволяет выделить преимущественный тип эпителиоцитов, поэтому в новой классификации опухолей яичников [12] такое разделение не проводится, указывается лишь, что все муцинозные опухоли яичников с высокой пролиферацией и атипической картиной чаще напоминают эпителиальные опухоли желудочно-кишечного тракта. Определение степени дифференцировки злокачественных муцинозных опухолей опирается на два показателя: строение и степень ядерной атипии, как укрупнение ядер, агрегация и конденсация хроматина, появление эозинофильных ядрышек. Такие критерии часто субъективны, а необходимый учет митозов бывает крайне затруднительным, из-за вариабельности митотической активности в выбранных участках опухоли. В этой связи становится понятным, почему изучение генетического профиля муцинозных опухолей является необходимым. При этом нужно учитывать, что многие муцинопродуцирующие неоплазии имеют KRAS мутацию, например, присутствующую в опухолях кишки у 75% больных, или в муцинозной циста-денокарциноме яичника – в 85% [13]. Также крайне полезны иммуногистохимические маркеры: CK7, CK20, Dpc4, CDX2 (таблица 2) и опухолево-ассоциированные маркеры крови: CA19.9, СА-125 и РЭА, повышающийся при опухолях яичников и ЖКТ.
Комментируя третий и четвертый случаи с развитием «псевдемиксомы брюшины» необходимо уточнить, что термин «псевдомиксомы» используется лишь в клиническом аспекте, и не применятся в качестве патологического диагноза [14]. Наиболее вероятной причиной атипической гиперплазии мезотелия является муцинозная опухоль аппендикса или поджелудочной железы, а изменения в яичнике будут носить вторичный или третичный характер в результате включения или имплантации слизи и эпителия на его поверхности [15, 16]. Интересно, что в этих случаях также характерны идентичные KRAS мутации в аппендикулярной опухоли и синхронных яичниках [17].
С учетом анализа патогенеза муцинозных опухолей и клинического опыта, указывающего на слабую чувствительность этих новообразований к стандартной химиотерапии [18], многие авторы предлагают включать в схемы таргет-ные препараты или оксалиплатин, иринотекан, пеметриксед [19]. Результаты клинических исследований по применению оксалиплатина, капецитабина, бевацизумаба, иринотекана, пе-метрикседа при муцинозных опухолях яичников пока неизвестны, однако предварительные данные индивидуального лечения показывают лучшие результаты перед стандартом. В наших наблюдениях также индивидуальный подход
Таблица 2
Дифференциальный диагноз муцинозных опухолей
|
Маркеры опухоли |
Муцинозный РЯ |
Серозный РЯ |
толстая кишка |
апендикс |
желудок |
поджелудочная железа |
|
CK7 |
+ |
+ |
- |
- |
+ |
+ |
|
CK20 |
+/- |
- |
+ |
+ |
+ |
+ |
|
CА-125 |
- |
+ |
- |
- |
- |
- |
|
РЭА |
+ |
- |
+ |
+ |
+ |
+- |
|
ER/PR |
- |
+ |
- |
- |
- |
- |
|
WT |
- |
+ |
- |
- |
- |
- |
|
Dpc4 |
+ |
- |
+ |
+ |
- |
-/+ |
|
PAX8 |
+/- |
+ |
-/+ |
-/ + |
- |
- |
|
+ диффузно присутствует; -/+ локально может присутствовать в менее 50% наблюдений, - отсутствует. |
||||||
показал хорошие результаты лечения, что может применяться в будущем.
Таким образом, муцинозные опухоли, с одной стороны – крайне разнообразны, с другой – имеют отличительные свойства группы: минимальный полиморфизм, низкую митотическую активность (индекс пролиферации не превышает 10%), агрессивное течение связывают с интестинальным типом и дикой мутацией гена KRAS (СК20). В яичниках развиваются из инклюзионных кист при дикой мутации гена KRAS; проходят стадии развития через опухоль пограничного типа с исходом в карциному различной степени дифференцировки. Это должно учитываться при дифференциаль- ной диагностике и выборе тактики лечения.
Подход к хирургическому лечению муцинозных опухолей яичников должен быть радикальным, включая аппендэктомию, и малотравматичным, выполняться из срединного разреза, для снижения риска вскрытия капсулы образования, и соответствовать всем правилам онкологических операций.
Положительная роль адъювантной химиотерапии препаратами платины была доказана в исследованиях ICON 1, EORTCI-ACTION – 2002, для групп больных с высоким риском развития рецидива, а опыт новых схем, в зависимости от генетического профиля опухоли, продолжает накапливаться [20].
Список литературы Первичные и метастатические муцинозные опухоли яичников. Трудности в диагностике и новые тенденции в лечении
- Горелова И.А. Муцинозные опухоли яичников различного потенциала злокачественности. Автореф. дис.. канд.мед.наук. М., 2008.
- Yamao K, Yanagisawa A, Takahashi K et al. Clinicopathological features and prognosis of mucinous cystic neoplasm with ovarian-type stroma: A Multi-Institutional Study of the Japan Pancreas Society. Pancreas. 2011 Jan;40(1):67-71. doi: 10.1097/MPA.0b013e3181f749d3.
- Ongom P.A., Odida M., Lukande R., et.al. Metastatic colorectal carcinoma mimicking primary ovarian carcinoma presenting as ‘Giant’ ovarian tumors in an individual with probable Lynch syndrome. J Med Case Rep. 2013; 7 (158).
- Benedix F, Kube R, Meyer F, et al. Colon/Rectum Carcinomas (Primary Tumor) Study Group. Comparison of 17,641 patients with right-and left-sided colon cancer: differences in epidemiology, perioperative course, histology, and survival. Dis Colon Rectum. 2010;53(1):57-64.
- Fujiwara A, Noura S, Ohue M, Shingai T, et.al. Significance of the resection of ovarian metastasis from colorectal cancers. J Surg Oncol 2010, 102(6):582-87.
- Kanemitsu Y, Kato T, Hirai T et al. Survival after curative resection for mucinous adenocarcinoma of the colorectum. Dis Colon Rectum 2003;46:160-67.
- NCCN Guidelines Mucinous tumors of ovaries. Version 3.2014 www.nccn.org/patients
- Rouzbahman M., Runjan Chetty R. Mucinous tumours of appendix and ovary: an overview and evaluation of current practice. J Clin Pathol 2014;67:193-97.
- Tang L, Yang J, Ng SK, Rodriguez N. Autoantibody profiling to identify biomarkers of key pathogenic pathways in mucinous ovarian cancer. Eur J Cancer. 2010 Jan; 46(1): 170-9.
- Morice P., et al. Borderline ovarian tumors: pathological diagnostic dilemma and risk factors for invasive or lethal recurrence The lancet Oncol. 2012; 13; p e103-e115.
- Bosman FT, Carneiro F, Hruban RH, (Eds.) WHO Classification of Tumours of the Digestive System. 4th Edition, International Agency for Research on Cancer, Lyon 2010.
- Longacre T.A., Prat J., Bell D.A., et.al. Mucinous tumours. WHO Classification of Tumours of Female Reproductive Organs. 4th Edition, Edited by Robert J. Kurman. Lyon 2014, pp. 25-29.
- Verhulst J, Ferdinande L, Demetter P, et. al. Mucinous subtype as prognostic factor in colorectal cancer: a systematic review and meta-analysis. J Clin Pathol. 2012; 65(5): 381-88.
- Bridda A, Padoan I, Mencarelli R, et.al.//Peritoneal mesothelioma: a review. Med Gen Med 2007, 9:32.
- Feldman AL, Libutti SK, PingPank JF, et.al. Analysis of factors associated with outcome in patients with malignant peritoneal mesothelioma undergoing surgical debulking and intraperitoneal chemotherapy. J Clin Oncol 2003, 21:4560-66.
- Enomoto T, Weghorst CM, Inoue M, (1991). K-ras activation occurs frequently in mucinous adenocarcinomas and rarely in other common epithelial tumors of the human ovary. Am J Pathol 139: 777-85.
- Garrett AP, Lee KR, Colitti CR, Muto MG, Berkowitz RS, Mok SC. K-ras mutation may be an early event in mucinous ovarian tumorigenesis. Int J Gynecol Pathol 2001; 20: 244-51.
- Kondi-Pafiti A, Kairi-Vasilatou E, lavazzo C, et.al. Metastatic neoplasms of the ovaries: a clinico-pathological study of 97 cases. Arch Gynecol Obstet 2011, 284:1283-88.
- Trial GOG 241. GCIG Intergroup multicentre trial of open label carboplatin and paclitaxel +/-bevacizumab compared with oxaliplatin and capecitabine +/-bevacizumab as first line chemotherapy in patients with mucinous Epithelial Ovarian Cancer (mEOC); Japanese Gynecologic Oncology Group 3017. Carboplatin/paclitaxel versus carboplatin/irinotecan.
- Randomized clinical trials of intraperitoneal chemotherapy for advanced stage epithelial ovarian cancer GOG 104/Alberts, 1996 GOG 114/Markman, 2001 GOG 172/Armstrong, 2006 GOG 252.


