Первичный скрининг грибных штаммов антагонистов из коллекции лаборатории биометода ВНИИМК к возбудителю фомоза подсолнечника (часть 1)
Автор: Маслиенко Л.В., Воронкова А.Х., Даценко Л.А., Ефимцева Е.А., Пуногина Д.А., Гайдукова С.А., Казакова В.В., Ковалева С.Р.
Рубрика: Защита растений и иммунология
Статья в выпуске: 2 (182), 2020 года.
Бесплатный доступ
Приводятся данные по первичному скринингу грибных штаммов антагонистов из коллекции лаборатории биометода ВНИИМК к агрессивному изоляту возбудителя фомоза подсолнечника Phoma macdonaldii Boerema методом двойных или встречных культур. В результате оценки 29 коллекционных грибных штаммов на трех питательных средах (картофельно-сахарозной (КСА), Рудакова и овсяной (ОА) установлено, что 23 из них обладали антагонистической активностью с одним или несколькими типами механизма действия против возбудителя фомоза подсолнечника. Двойным механизмом действия (конкуренцией за площадь питания и гиперпаразитизмом) обладал 21 штамм. Из них пять штаммов (SM-1 Sordaria sp., T-1, T-2, T-3 Trichoderma sp. и Pbc-1 Penicilliumbrevi-compactum ) проявили активность на трех средах. Площадь зарастания среды у этих штаммов антагонистов составила 80,0-100 %, при размерах гиперпаразитической зоны 1,0-5,0 см2. Максимальная гиперпаразитическая зона отмечена у штаммов: A-1 Basidiomycetes (43,4 см2) на КСА; Pk-1 P. vermiculatum (15,0 см2) на среде Рудакова; Tr-1 Trichothecium roseum (14,2 см2) на КСА; Pbc-1 P. brevi-compactum (12,0 см2) на ОА. Максимальная стерильная зона к возбудителю фомоза отмечена у штаммов: Xk-3 Chaetomium sp. (12,5 мм) на КСА и An-1 Aspergillus niger (10,0 мм) на ОА.
Подсолнечник, фомоз, штаммы антагонисты, скрининг, антагонистическая активность, конкуренция, гиперпаразитизм, антибиоз
Короткий адрес: https://sciup.org/142223415
IDR: 142223415 | УДК: 633.854.78:632.937 | DOI: 10.25230/2412-608X-2020-2-182
Текст научной статьи Первичный скрининг грибных штаммов антагонистов из коллекции лаборатории биометода ВНИИМК к возбудителю фомоза подсолнечника (часть 1)
Введение. Одной из серьёзных причин, препятствующих получению стабильно высоких урожаев подсолнечника – основной масличной культуры в Российской Федерации, является ущерб, наносимый болезнями. Все большую вредоносность на подсолнечнике показывает фомоз или черная пятнистость ( Phoma macdonaldii Boerema) [1; 2]. До середины прошлого столетия фомоз не наносил существенного вреда подсолнечнику в России. Так, в условиях Краснодарского края, несмотря на высокое распространение, фомоз не оказывал существенного влияния на урожай и посевные качества семян подсолнечника. Погодные условия в крае способствовали позднему заражению растений болезнью, обычно в фазе цветения, созревания, что связано со значительной гибелью заразного начала при отрицательных температурах в зимний период [3]. В Белгородской области к концу вегетации подсолнечника распространение болезни составляло 100 %, а развитие – до 10 % [4]. Однако в последние 10–15 лет фомоз перешел в разряд экономически значимых болезней культуры, а по распространенности занимает лидирующее положение среди других болезней [5].
Решение проблемы защиты подсолнечника от болезней, в том числе и от фомоза, связано с разработкой комплекса эффективных мероприятий, включающих создание устойчивых сортов и гибридов, разработку элементов технологии возделывания культуры, приемов и методов биологической и химической защиты, снижающих вредоносность болезней.
Основным способом борьбы с болезнями на подсолнечнике является селекционный. Во ВНИИМК исследования по созданию устойчивых сортов и гибридов подсолнечника к возбудителю фомоза уже проводятся. Изучаются биологические особенности возбудителя болезни, разрабатываются методы определения агрессивности изолятов и вредоносности патогена [6; 7].
В лаборатории биометода ФГБНУ ФНЦ ВНИИМК многие годы ведутся исследования по разработке микробиологических средств защиты масличных культур от болезней. В основе разработанной нами концепции целенаправленного создания микробиопрепаратов для защиты подсолнечника и других сельскохозяйственных культур от болезней, лежит поиск штаммов антагонистов, безопасных для человека, нефитотоксич-ных, проявляющих высокую активность в широко варьируемых условиях против комплекса патогенов, обладающих поли-функциональным типом действия. В результате многолетних исследований создана коллекция перспективных штаммов грибов и бактерий антагонистов широкого круга патогенов, поражающих масличные и другие сельскохозяйственные культуры. Нами установлено, что наиболее приемлемым путём решения проблемы защиты подсолнечника, рапса, сои от возбудителей болезней, инфекционное начало которых сохраняется в почве, является целенаправленное обогащение почвы и растительных остатков пораженных растений антагонистами, обладающими кроме фунгицидных свойств еще и целлюлозоразрушающей активно- стью. Не менее эффективным способом снижения вредоносности болезней является предпосевная обработка семян по-лифункциональными микробиопрепаратами на основе перспективных штаммов-продуцентов с широким спектром действия против комплекса патогенов [8; 9; 10; 11].
В России зарегистрированных микробиопрепаратов против фомоза на подсолнечнике нет. Против фомоза на корнеплодах зарегистрированы два бактериальных биопрепарата: на сахарной свекле БФТИМ КС-2, Ж на основе бактерии Bacillus amyloliquefaciens и на моркови - Фитоспорин-М, Ж, штамм-продуцент Bacillus subtilis [12]. Мы не обнаружили в литературе сведений о разработке биологических мер борьбы с возбудителем фомоза на подсолнечнике. Поэтому целью наших исследований было проведение ступенчатого скрининга штаммов-антагонистов из коллекции лаборатории биометода ВНИИМК к возбудителю фомоза на подсолнечнике.
На первом этапе скрининга тестировали грибные штаммы, представленные родами Trichoderma, Penicillium, Chaeto-mium, Trichothecium, Sordaria, Talaromy-ces, Aspergillus, Metarhizium и классом Basidiomycetes, а также бактерии из родов Bacillus и Pseudomonas.
Материалы и методы. Агрессивный изолят возбудителя фомоза Phoma macdonaldii выделен нами из стеблей пораженного подсолнечника на посевах ВНИИМК. Агрессивность изолятов возбудителя фомоза определяли методом «агаровых блоков» разработанным В.Ф. Зайчук (1983 г.) [13]. Для этого семена подсолнечника раскладывали в растильни по 25 штук на увлажненную фильтровальную бумагу с прослойкой ваты, сверху прикладывали агаровый блок с мицелием патогена, размером 3,0 х 4,0 мм и создавали влажную камеру. Повторность опыта 3-кратная. Учет проводили через семь суток после заражения.
Первичный скрининг штаммов-антагонистов из коллекции лаборатории биометода к возбудителю фомоза на подсолнечнике проводили к наиболее агрессивному изоляту методом двойных или встречных культур in vitro [14]. Культуры антагонистов и возбудителя болезни выращивали отдельно в течение пяти дней на агаризированной питательной среде. Стерильным сверлом вырезали блоки с мицелием антагониста и патогена и помещали в одну чашку Петри на расстоянии 6 см. Контролем служили культуры антагонистов и патогена, посеянные порознь. Контроль роста культур производили ежедневно, учеты - на 20-е сутки культивирования. Отмечали рост патогена и антагониста в процентах от площади чашки Петри (конкуренцию за площадь питания). Для этого измеряли площадь зарастания поверхности питательной среды в см2, а затем проводили перерасчет на процент по пропорции, имея ввиду площадь чашки Петри 81,0 см2. Кроме того, отмечали наличие или отсутствие зон задержки роста патогена в результате синтеза гидролитических ферментов или веществ антибиотической природы (диаметр стерильной зоны, мм), а также нарастания антагониста на колонию патогена (площадь гиперпаразитической зоны, см2). Повторность опыта 3-кратная. Антагонистов и патоген выращивали на агаризированных средах: картофельно-сахарозной (КСА) [16], овсяной (ОА) [17], а также на специализированной среде для грибов - Рудакова [18].
Результаты и обсуждение. Результаты оценки антагонистической активности коллекционных грибных штаммов к возбудителю фомоза подсолнечника на трех питательных средах (КСА, Рудакова и ОА) показали, что механизм действия грибов представлен тремя типами:
-
- антагонист занимает значительную поверхность питательной среды - более 50,0 % (конкуренция за площадь питания);
-
- антагонист образует зону нарастания на колонию патогена (гиперпаразитизм);
-
- антагонист образует стерильную зону задержки роста мицелия патогена (антибиоз).
На картофельно-сахарозном агаре изо-лят возбудителя фомоза подсолнечника
Phoma macdonaldii за 20 суток культивирования занял 100 % поверхности питательной среды.
Из 29 испытанных коллекционных грибных штаммов антагонистическую активность к возбудителю фомоза через 20 суток совместного культивирования на КСА проявили 22 штамма. Из них 15 штаммов обладали двойным механизмом действия – конкуренцией за площадь питания и гиперпаразитизмом (табл. 1).
Таблица 1
Антагонистическая активность грибных штаммов к возбудителю фомоза подсолнечника Phoma macdonaldii при температуре 25 °С на 20-е сутки совместного культивирования на картофельно-саха-розном агаре г. Краснодар, ВНИИМК, 2019 г.
|
Штамм-антагонист |
Площадь зарастания поверхности питательной среды, % |
Размер гипер-парази тичес-кой зоны, см2 |
Размер сте-риль-ной зоны, мм |
|
|
анта-гони-стом |
патогеном |
|||
|
Phoma macdonaldii (контроль) |
- |
100 |
- |
- |
|
Конкуренция за площадь питания + гиперпаразитизм |
||||
|
SM-1 Sordaria sp . |
96,2 |
3,9 |
2,5 |
0 |
|
T-1 Trichoderma sp. |
100 |
1,7 |
1,3 |
0 |
|
T-2 Trichoderma sp. |
100 |
2,1 |
1,7 |
0 |
|
T-3 Trichoderma sp. |
100 |
0,9 |
1,0 |
0 |
|
T-4 Trichoderma sp. |
100 |
1,2 |
1,0 |
0 |
|
An-1 Aspergillus niger |
98,9 |
2,0 |
1,4 |
0 |
|
Pbc-1 P. brevi-compactum |
90,0 |
7,7 |
1,4 |
0 |
|
Xk-1 Chaetomium olivaceum |
73,3 |
26,2 |
1,7 |
0 |
|
Tr-1 Trichothecium roseum |
82,1 |
17,9 |
14,2 |
0 |
|
Xk-2 Chaetomium olivaceum |
69,4 |
30,1 |
9,8 |
0 |
|
Pf-1 Penicillium funiculosum |
65,0 |
35,0 |
8,8 |
0 |
|
Pr-1 Penicillium rugulosum |
89,7 |
10,1 |
8,7 |
0 |
|
Pk-1 Penicillium vermiculatum |
65,8 |
34,1 |
8,0 |
0 |
|
И-3 Basidiomycetes |
73,1 |
30,8 |
3,1 |
0 |
|
Af-1 Aspergillus flavus |
65,0 |
37,2 |
3,3 |
0 |
|
Конкуренция за площадь питания |
||||
|
Pv-3 Penicillium verrucosum |
85,0 |
4,7 1 |
0 1 |
0 |
|
Гиперпаразитизм |
||||
|
A-1 Basidiomycetes |
46,5 |
53,6 |
43,4 |
0 |
|
Tt-1 Talaromyces trachispermus |
48,5 |
51,7 |
4,5 |
0 |
|
Антибиоз |
||||
|
Xk-3 Chaetomium sp. |
53,5 |
26,4 |
0 |
12,5 |
|
Ma-1 Metarhizium sp. |
47,8 |
41,0 |
0 |
8,0 |
|
M-24 Penicillium sp. |
52,3 |
44,4 |
0 |
3,0 |
|
Pp-1 Penicillium pupurescens |
50,0 |
50,0 |
0 |
2,0 |
Следует подчеркнуть, что среди этих антагонистов установлено подразделение на две группы штаммов.
У группы из семи штаммов, относящихся к родам Trichoderma (T-1, T-2, T-3, T-4 Trichoderma sp.), а также Aspergillus (An-1 Aspergillus niger ), Sordaria (SM-1 Sordaria sp.) и Penicillium (Pbc-1 Penicillium brevicompactum ), установлена наибольшая конкурентная способность за площадь питания по отношению к возбудителю фо-моза с небольшой зоной нарастания антагониста на колонию патогена (рис. 1.1).
Во второй группе из восьми штаммов антагонистов, относящихся к родам Trichothecium, Chaetomium, Penicillium, Aspergillus и классу Basidiomycetes , площадь зарастания питательной среды была значительно меньше, при этом патоген успевал занять 10,0–37,2 %, поэтому зона нарастания антагониста на патоген была выше. Максимальная зона нарастания антагониста на колонию патогена отмечена у штамма Tr-1 Trichothecium roseum – 14,2 см2 .
У одного штамма антагониста Pv-3 Penicillium verrucosum по отношению к возбудителю фомоза подсолнечника установлена только конкуренция за площадь питания. В двойной культуре этот штамм занял 85,0 % площади питательной среды, не образуя зоны задержки роста патогена.
Гиперпаразитизм установлен у двух грибных штаммов антагонистов, при этом максимальная зона зарастания колонии патогена отмечена у штамма A-1 Basidiomycetes (43,4 см2) (рис. 1.2).
У трех грибных штаммов к возбудителю фомоза определен антибиоз. В двойных культурах с патогеном они образовали стерильную зону задержки роста. Максимальную антибиотическую активность к возбудителю фомоза проявил штамм Xk-3 Chaetomium sp. (рис. 1.3).
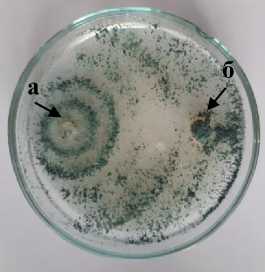
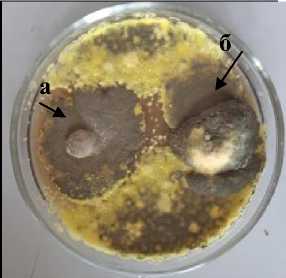
Т-1 Trichoderma sp.
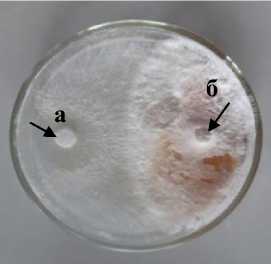
A-1 Basidiomycetes
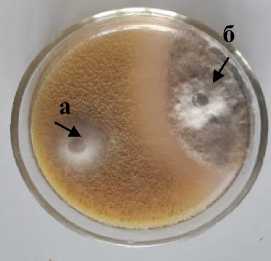
Xk-3 Chaetomium sp.
3 а – антагонист; б – патоген
Рисунок 1 – Антагонистическая активность грибных штаммов к возбудителю фомоза подсолнечника Phoma macdonaldii , через 20 суток культивирования на среде КСА, 2020 г. (ориг.): 1 – конкуренция за площадь питания; 2 – гиперпаразитизм; 3 – антибиотическая активность
Агаризированная среда Рудакова более благоприятна для выращивания штаммов антагонистов, а патоген за 20 суток занял только 42,8 % площади питательной среды. Так же, как и на среде КСА антагони- стическую активность к возбудителю фо-моза проявили 22 коллекционных штамма грибов, из них 16 штаммов обладали двойным механизмом действия (табл. 2).
Таблица 2
Антагонистическая активность грибных штаммов к возбудителю фомоза подсолнечника Phoma macdonaldii при температуре 25 0С на 20-е сутки совместного культивирования на среде Рудакова г. Краснодар, ВНИИМК, 2019 г.
|
Штамм-антагонист |
Площадь зарастания поверхности питательной среды, % |
Размер гипер-парази-тичес-кой зоны, см2 |
Размер сте-риль-ной зоны, мм |
|
|
анта-гони-стом |
патогеном |
|||
|
Phoma macdonaldii |
- |
42,8 |
- |
- |
|
Конкуренция за площадь питания + гиперпаразитизм |
||||
|
Pk-1 Penicillium vermiculatum |
100 |
29,9 |
15,0 |
0 |
|
Pr-1 Penicillium rugulosum |
100 |
14,4 |
14,4 |
0 |
|
Тк-1 Trichoderma koningii |
100 |
14,7 |
11,9 |
0 |
|
Pf-1 Penicillium funiculosum |
80,6 |
27,3 |
10,7 |
0 |
|
Tr-1 Trichothecium roseum |
91,9 |
8,2 |
8,2 |
0 |
|
Xk-1 Chaetomium olivaceum |
83,3 |
16,7 |
5,0 |
0 |
|
T-4 Trichoderma sp. |
100 |
5,1 |
4,1 |
0 |
|
An-1 Aspergillus niger |
95,9 |
5,1 |
4,4 |
0 |
|
Xk-2 Chaetomium olivaceum |
84,2 |
15,8 |
3,3 |
0 |
|
Ma - 1 Metarhizium sp. |
100 |
3,0 |
3,0 |
0 |
|
T-2 Trichoderma sp. |
100 |
3,6 |
2,9 |
0 |
|
SM-1 Sordaria sp. |
90,4 |
9,6 |
2,7 |
|
|
Xk-3 Chaetomium sp. |
85,2 |
14,9 |
2,3 |
0 |
|
T-1 Trichoderma sp. |
100 |
2,3 |
1,9 |
0 |
|
T-3 Trichoderma sp. |
100 |
1,2 |
1,0 |
0 |
|
Конкуренция за площадь питания |
||||
|
Pp-1 Penicillium purpurescens |
100 |
1,6 |
0 |
0 |
|
Pbc-1 P. brevi-compactum |
100 |
1,6 |
0 |
0 |
|
И-3 Basidiomycetes |
89,5 |
10,0 |
0 |
0 |
|
Tt-1 Talaromyces trachispermus |
79,3 |
20,8 |
0 |
0 |
|
Гиперпаразитизм |
||||
|
Af-1 Aspergillus flavus |
48,4 |
36,5 |
4,8 |
0 |
|
Антибиоз |
||||
|
M-24 Penicillium sp. |
61,1 |
27,2 |
0 |
5,0 |
|
Pv-3 Penicillium verrucosum |
80,0 |
18,6 |
0 |
6,0 |
Все штаммы из этой группы показали высокую конкурентную способность за площадь питания по отношению к патогенному изоляту Phoma macdonaldii . Площадь зарастания среды у этих штаммов антагонистов составила 80,0–100 % (рис. 2.1). Но, в отличие от среды КСА, зона нарастания антагониста на колонию патогена значительно варьировала. Максимальная гиперпаразитическая зона (8,2–15,0 см2) отмечена у пяти штаммов, 107
относящихся к родам Penicillium (Pk-1 P. vermiculatum, Pr-1 P. rugulosum, Pf-1 P. funiculosum ) , а также Trichoderma (Тк-1 Trichoderma koningii ) и Trichothecium (Tr-1 Trichothecium roseum ) (рис. 2.2).
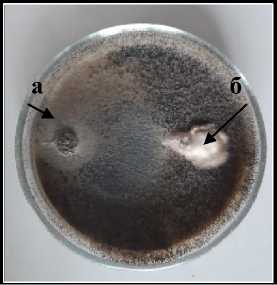
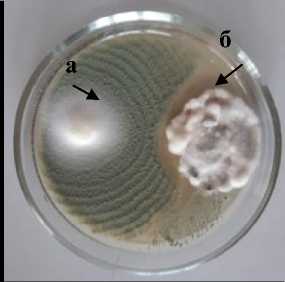
Sm-1 Sordaria sp.
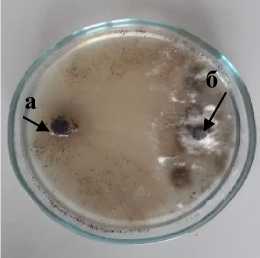
Pr-1 Penicillium rugulosum
M-24 Penicillium sp. 3
а – антагонист; б – патоген
Рисунок 2 – Антагонистическая активность грибных штаммов к возбудителю фомоза подсолнечника
Phoma macdonaldii , через 20 суток культивирования на среде Рудакова, 2020 г. (ориг.): 1 – конкуренция за площадь питания; 2 – гиперпаразитизм; 3 – антибиоз
У четырех штаммов антагонистов (Pp-1 P. purpurescens, Pbc-1 P. brevi-compactum, И-3 Basidiomycetes и Tt-1 Talaromyces trachispermus ) на среде Рудакова установлена только конкуренция за площадь питания. В двойных культурах эти штаммы заняли 79,3–100 % площади питания, не образуя зон задержек роста патогена.
Штамм Af-1 Aspergillus flavus проявил по отношению к патогену только гиперпаразитизм, с зоной нарастания 4,8 см2.
Антибиоз установлен у двух штаммов грибов антагонистов M-24 Penicillium sp. и Pv-3 P. verrucosum. Стерильная зона у этих штаммов составила 5,0–6,0 мм (рис. 2, 3).
На овсяном агаре в контроле возбудитель фомоза подсолнечника за 20 суток культивирования занял 79,0 % поверхности питательной среды (табл. 3).
Таблица 3
Антагонистическая активность грибных штаммов к возбудителю фомоза подсолнечника Phoma macdonaldii при температуре 25 0С на 20-е сутки совместного культивирования на овсяном агаре г. Краснодар, ВНИИМК, 2019 г.
|
Штамм-антагонист |
Площадь зарастания поверхности питательной среды, % |
Размер гиперпара-зитиче ской зоны, см2 |
Размер сте-риль-ной зоны, мм |
|
|
анта-гони-стом |
пато-геном |
|||
|
Phoma macdonaldii |
- |
79,0 |
- |
- |
|
Конкуренция за площадь питания + гиперпаразитизм |
||||
|
Pbc-1 P. brevi-compactum |
100 |
29,0 |
12,0 |
0 |
|
SM-1 Sordaria sp. |
71,9 |
28,1 |
7,2 |
0 |
|
T-2 Trichoderma sp. |
100 |
6,2 |
5,0 |
0 |
|
Xk-3 Chaetomium sp. |
66,7 |
19,8 |
5,0 |
0 |
|
Pv-3 Penicillium verrucosum |
60,0 |
50,0 |
4,0 |
0 |
|
Ma-1 Metarhizium sp. |
59,3 |
60,4 |
3,1 |
0 |
|
T-1 Trichoderma sp. |
100 |
3,0 |
2,4 |
0 |
|
Pp-1 Penicillium purpurescens |
79,0 |
31,0 |
2,3 |
0 |
|
T-3 Trichoderma sp. |
100 |
1,2 |
2,3 |
0 |
|
Конкуренция за площадь питания + гиперпаразитизм + антибиоз |
||||
|
An-1 Aspergillus niger |
81,7 |
18,3 |
3,0 |
10,0 |
|
Tt-1 Talaromyces trachispermus |
1,2 |
50,0 |
3,2 |
16,0 |
|
Конкуренция за площадь питания |
||||
|
Av-1 Aspergillus versicolor |
70,0 |
20,1 |
0 |
0 |
|
Антибиоз |
||||
|
Xk-2 Chaetomium olivaceum |
24,3 |
17,9 |
0 |
25,0 |
|
Af-1 Aspergillus flavus |
27,1 |
22,5 |
0 |
15,0 |
|
И-3 Basidiomycetes |
27,2 |
28,1 |
0 |
12,0 |
|
М-24 Penicillium sp. |
24,7 |
34,6 |
0 |
5,0 |
|
Xk-1 Chaetomium olivaceum |
66,7 |
22,9 |
0 |
5,0 |
|
Tr-1 Trichothecium roseum |
58,9 |
27,7 |
0 |
2,0 |
Антагонистическую активность к возбудителю фомоза на ОА проявили 18 коллекционных штаммов грибов. Из них девять штаммов, относящихся к родам Penicillium, Sordaria, Trichoderma, Chaetomium и Metarhizium , обладали двойным механизмом действия: конкуренцией за площадь питания и гиперпаразитизмом. Как и на среде Рудакова, большинство штаммов антагонистов обладали высокой конкурентной способностью, площадь зарастания среды составила 59,3–100 % (рис. 3.1). Размер гиперпаразитической зоны во всех вариантах был невысоким (2,3–7,2 см2) (рис. 3.2), за исключением варианта со штаммом Pbc-1 P. brevi-compactum , у которого зона нарастания на патоген составила 12,0 см2 .
Sm-1 Sordaria sp.
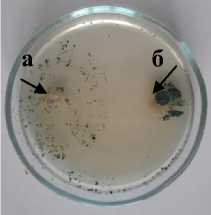
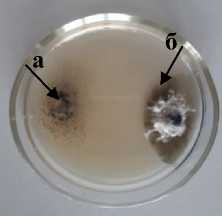
Т-2 Trichoderma sp. Xk-2 Chaetomium
2 olivaceum а – антагонист; б – патоген
Рисунок 3 – Антагонистическая активность грибных штаммов к возбудителю фомоза подсолнечника Phoma macdonaldii , через 20 суток культивирования на ОА, 2020 г. (ориг.): 1 – конкуренция за площадь питания;
2 – гиперпаразитизм; 3 – антибиоз
У штаммов An-1 Aspergillus niger и Tt-1 Talaromyces trachispermus установлен тройной механизм действия к возбудителю фомоза: конкуренция за площадь питания, гиперпаразитизм и антибиоз.
Только конкуренция за площадь питания к патогену установлена у штамма Av-1 Aspergillus versicolor.
У шести антагонистов из родов Chaetomium, Aspergillus, Penicillium и Trichothecium и класса Basidiomycetes на среде ОА установлен антибиоз, размер стерильной зоны составил 2,0–25,0 мм. Максимальная стерильная зона (25,0 мм) отмечена у штамма Xk-2 Chaetomium olivaceum (рис. 3.3).
Выводы . В результате оценки 29 коллекционных грибных штаммов на трех питательных средах КСА, Рудакова и ОА установлено, что 23 штамма обладали антагонистической активностью с одним или несколькими типами механизма действия против возбудителя фомоза подсолнечника.
Двойным механизмом действия (конкуренцией за площадь питания и гиперпаразитизмом) обладал 21 штамм грибов антагонистов. Из них пять штаммов (SM-1 Sordaria sp., T-1, T-2, T-3 Trichoderma sp. и Pbc-1 P. brevi-compactum ) проявили активность на трех питательных средах. Площадь зарастания среды у этих штаммов антагонистов составила 80,0–100 %, при размерах гиперпаразитической зоны 1,0–5,0 см2. Максимальная гиперпаразитическая зона отмечена у штаммов: A-1 Basidiomycetes (43,4 см2) на КСА; Pk-1 P. vermiculatum (15,0 см2) на среде Рудакова; Tr-1 Trichothecium roseum (14, 2 см2) на КСА и Pbc-1 P. brevi-compactum (12,0 см2) на ОА.
Только конкуренцией за площадь питания на трех средах обладали восемь грибов антагонистов. При этом только штамм Av-1 Aspergillus versicolor обладал одним механизмом действия (конкуренцией за площадь питания) на двух питательных средах КСА и ОА.
Антибиотическая активность установлена у восьми грибных антагонистов. При этом только штамм M-24 Penicillium sp.
обладал одним механизмом действия (антибиозом) на двух питательных средах КСА и Рудакова. Максимальная стерильная зона к возбудителю фомоза отмечена у штаммов: Xk-3 Chaetomium sp. (12,5 мм) на КСА, An-1 Aspergillus niger (10,0 мм) на ОА, Pv-3 Penicillium verrucosum (6,0 мм) на среде Рудакова.
Таким образом, в результате первичного скрининга 29 коллекционных грибных антагонистов против возбудителя фомоза подсолнечника антагонистическая активность установлена у 23 штаммов.
Штаммы грибов антагонистов, выделенные на первом этапе, будут оценены во вторичном скрининге, на фоне искусственного заражения возбудителем фомо-за в лабораторных условиях во влажной камере и в грунте.
Работа выполнена при финансовой поддержке гранта РФФИ и администрации Краснодарского края р_ Наставник № 19-416-235003 .
Список литературы Первичный скрининг грибных штаммов антагонистов из коллекции лаборатории биометода ВНИИМК к возбудителю фомоза подсолнечника (часть 1)
- Саукова С.Л., Ивебор М.В., Антонова Т.С., Арасланова Н.М. Возбудитель фомоза на вегетирующих растениях подсолнечника в Краснодарском крае // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2014. - Вып. 2 (159-160). - С. 167-172.
- Арасланова Н.М., Саукова С.Л., Ивебор М.В., Антонова Т.С. Идентификация видовой принадлежности возбудителя фомоза подсолнечника в Краснодарском крае // Современная микология в России: материалы Международного микологического форума. Москва, 14-15 апреля 2015 г. - М.: Нац. акад. микол., 2015. - Т. 5 - С. 61-62.
- Бородин С.Г., Котлярова И.А. Грибные болезни подсолнечника в Краснодарском крае // Болезни и вредители масличных культур (сборник научных работ). - 2006. - С. 3-10.
- Якуткин В.И. Прогноз болезней подсолнечника в России в 2005 г. и борьба с ними // Защита и карантин растений. - 2005. - № 5. - С. 41.
- Арасланова Н.М., Саукова С.Л., Антонова Т.С. К вопросу о вредоносности Phoma macdonaldii Boerema на подсолнечнике // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2018. - Вып. 3 (175). - С. 117-123.
- Арасланова Н.М., Саукова С.Л., Антонова Т.С. Реакция различающихся по агрессивности географических изолятов Phoma macdonaldii Boerema на изменение температуры и освещенности в контролируемых условиях среды // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2018. - Вып. 4 (176). - С. 162-168.
- Арасланова Н.М., Антонова Т.С., Саукова С.Л. Сравнение двух методов отбора агрессивных для подсолнечника изолятов Phoma macdonaldii Boerema // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2019. - Вып. 3 (179). - С. 85-91.
- Маслиенко Л.В. Вермикулен - перспективный микробиопрепарат полифункционального типа действия для защиты подсолнечника и других сельскохозяйственных культур от болезней // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2009. - Вып. 2. - С. 40-50.
- Маслиенко Л.В., Курилова Д.А. Разработка микробиологического метода снижения вредоносности фузариоза на сое // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2012. - Вып. 2 (151-152). - С. 167-175.
- Маслиенко Л.В., Шипиевская Е.Ю. Элементы технологии применения разных препаративных форм микробиопрепаратов на основе перспективных штаммов антагонистов Xk-1-4 Chaetomium olivaceum и Б-12 Bacillus licheniformis против белой гнили озимого рапса // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2015.- Вып. 4 (164). - С. 66-73.
- Маслиенко Л.В., Воронкова А.Х., Даценко Л.А., Ефимцева Е. А. Биологическая эффективность лабораторных образцов микробиопрепаратов на основе перспективных штаммов антагонистов против возбудителя фузариоза льна масличного на фоне искусственного заражения in vitro // Масличные культуры: Науч.-тех. бюл. ВНИИМК. - 2019. - Вып. 4 (180). - С. 128-132.
- Справочник пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации: [Электронный ресурс]. - ООО "Издательство Листерра", 2019. Режим доступа: https://www.agroxxi.ru.
- Зайчук В.Ф. Об устойчивости подсолнечника к гнилям // Масличные культуры. - 1983. - № 1. - С. 16-17.
- Егоров Н.С. Выделение микробов-антагонистов и биологические методы учета их антибиотической активности. - М.: Изд-во Моск. ун-та, 1957. - 78 с.
- Билай В.И. Фузарии. - Киев: Изд-во "Наукова думка", 1977. - 440 с.
- Пименова М.Н., Гречушкина Н.Н., Азова Л.Г., Нетрусов А.И. [и др.]. Руководство к практическим занятиям по микробиологии / Под ред. Н.С. Егорова; 2-е изд. - М.: Изд-во МГУ, 1983. - 221 с.
- Рудаков О.Л. Микофильные грибы, их биология и практическое значение. - М.: Наука, 1981. - 160 с.


