Питательные и защитные факторы среды для культивирования микробного консорциума
Автор: Бояринева И.В., Хамагаева И.С.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (94), 2022 года.
Бесплатный доступ
В настоящее время актуальным и перспективным в молочной отрасли является использование высокоактивных пробиотических штаммов для получения консорциумов с высоким биохимическим и технологическим потенциалом. К таким пробиотическим микроорганизмам относятся пропионовокислые бактерии и ацидофильная палочка. Создание консорциума на основе Propionibacterium freudenreichii Sh85 и L. acidophilus позволяет разработать специализированные пищевые продукты и биологически активные добавки с высокими пробиотическими свойствами. Получен инокулят на основе чистых культур Propionibacterium freudenreichii Sh85 и L. acidophilus в соотношении 2:1, который обладает высокой биохимической активностью и может обеспечить высокий уровень протекания ферментативных процессов при совместном культивировании на молочной среде. В статье представлены данные по оптимизации питательной среды на основе молочной сыворотки для получения биомассы консорциума пропионовокислых бактерий и ацидофильной палочки. Оптимальный температурный диапазон для наращивания биомассы на основе пробиотических культур (30±2)°С. В статье показаны результаты по подбору оптимального количества ионов кобальта в питательной среде. Для обеспечения нормального роста биомассы, высокой урожайности жизнеспособных клеток культур Propionibacterium freudenreichii Sh85 и L. acidophilus и биосинтеза витамина В12 выбрана доза внесения в питательную среду хлористого кобальта 0,0025 г./л. Полученная биомасса характеризуется высоким титром жизнеспособных клеток пропионовокислых бактерий и ацидофильной палочки 1012 к.о.е./см3. В биомассе активно протекает накопление витамина В12. Клеточная биомасса применима в качестве биологически активной добавки для непосредственного употребления и в молочной промышленности в качестве бактериального концентрата.
Биомасса, консорциум, питательная среда, пропионовокислые бактерии, ацидофильная палочка
Короткий адрес: https://sciup.org/140301794
IDR: 140301794 | УДК: 637.1 | DOI: 10.20914/2310-1202-2022-4-96-102
Текст научной статьи Питательные и защитные факторы среды для культивирования микробного консорциума
В настоящее время пробиотики на основе живых микроорганизмов (в монокультуре или в комбинации) являются наиболее разработанными и широко используемыми специфиче- скими средствами коррекции микробной экологии человека. Следует подчеркнуть, что, подавляя патогенную микробиоту, пробиотики в противоположность антибиотикам не нарушают функционирование симбиотической микробиоты желудочно-кишечного тракта [1].
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
По мнению специалистов, наиболее перспективными являются пробиотики на основе живых микроорганизмов с установленными специфическими физиолого-биохимическими эффектами, а также генно-инженерных штаммов с заданными медико-биологическими и технологическими характеристиками.
Доказано, что антагонистические свойства пробиотических микроорганизмов, присутствующих в свежеприготовленной жидкой форме более выражены, чем у тех же штаммов, находящихся в лиофилизированном состоянии; это может быть связано с присутствием в жидких формах пробиотиков более высоких концентраций уксусной, молочной кислот, перекиси водорода, а возможно и других антагонистических и иных регулярных субстанций-метаболитов.
Но, к сожалению, микробная экология каждого человека представляет собой чрезвычайно сложную по составу экосистему, на формирование которой потребовались многие миллионы лет эволюции. Поэтому, чрезвычайно трудно разработать адекватные пробиотики для каждого индивидуума для поддержания нормальной микрофлоры на оптимальном уровне путем механического объединения отдельных чистых культур микроорганизмов. Кроме того, пробиотические микроорганизмы даже человеческого происхождения иммунологически несовместимы с реципиентом, которому они предназначены и вскоре после прекращения их назначения быстро элиминируются из организма. Все это послужило основанием разработки концепции создания пробиотиков и продуктов функционального питания на основе аутоштаммов и аутоассоциаций симбиотических микроорганизмов.
Исходя из этого, создание пробиотиков и продуктов функционального питания на основе пробиотических штаммов микроорганизмов, обладающих специфическим позитивным действием на организм человека, рассматривают как стратегическое направление, направленное на поддержание и восстановление здоровья человека.
В этом отношении заслуживают внимание штаммы L. acidophilus – классические пробиотики, микроорганизмы кишечного происхождения, регулярный прием которых в «терапевтических» дозах оказывает достоверное благотворное действие на жизнедеятельность отдельных тканей, органов и общее здоровье организма потребителя. Это свойство обусловливает широкое применение L. acidophilus в пищевой отрасли и медицине [2].
Промышленное производство ацидофильных молочных продуктов, ориентированное на диетическое и лечебно-профилактическое питание населения, началось с 30-х годов прошлого века, пик их популярности пришелся на 70-80-е годы [3]. Известно более двух десятков наименований продуктов этой группы, значительная часть их, судя по видовому составу микрофлоры, являются аналогами. Напитки содержат L. acidophilus в виде монокультуры или, чаще всего, в смеси с другими заквасочными микроорганизмами обычного или пробиотического назначения (лактококки, термофильный стрептококк, бифидобактерии, пропионовокислые бактерии, дрожжи, микрофлора кефирной закваски) [4].
Пропионовокислые бактерии, обладающие высоким потенциалом, интересны для использования в биотехнологии. Биологической особенностью классических пропионовокислых бактерий (по сравнению, например, с молочнокислыми бактериями) является способность продуцировать ряд метаболитов-нутрицевтиков, включая витамины группы В, в том числе фолиевую кислоту, витамин В 12 , и бифидогенные факторы, выделение пропионовой кислоты (пропионатов) и полипептидов, обладающих антимикробными и антимутаген-ными свойствами, наличие в клетках ферментов-антиоксидантов [5–9].
Благодаря способности к продуцированию данных биологически активных веществ бактерии рода Propionibacterium актуально использовать как в качестве самостоятельных пробиотиков, так и в составе поликомпонент-ных добавок [10]. При создании многокомпонентных пробиотиков штаммы микроорганизмов должны быть совместимы по биологическим свойствам, то есть не должны подавлять друг друга как при совместном культивировании, так и в готовом продукте и усиливать синтез продуктов их метаболизма.
Несмотря на то, что существует значительное количество прописей питательных сред, до сегодняшнего дня ведутся многочисленные исследовательские работы по увеличению выхода целевых продуктов микробиологических стадий производств биопрепаратов на основе подбора составов питательных сред [11].
Цель работы – оптимизировать состав питательной среды и подобрать условия культивирования консорциума на основе пропионовокислых бактерий и ацидофильной палочки.
Материалы и методы
Экспериментальные исследования проводились на кафедре «Технология молочных продуктов. Товароведение и экспертиза товаров», в проблемной научно-исследовательской лаборатории ВСГУТУ. Объектами исследований служили L. acidophilus штамм вязкой расы ВНИМИ и пропионовокислые бактерии Propi-onibacterium freudenreichii Sh-85 .
Количественный учёт пропионовокислых бактерий в биомассе определяли методом предельных разведений на среде ГМС или ГМК-1 по ТУ 10-02-02-789-192-95 «Гидро-лизатно-молочная среда для количественного учета бифидобактерий и пропионовокислых бактерий». Идентификацию культур при совместном культивировании методом угнетения пропионовокислых бактерий антибиотиком (тетрациклином).
Определение количества клеток ацидофильной палочки осуществляли методом предельных разведений по ТУ 9229-083-0041978597 «Гидролизованное молоко с агаром».
Витамин В 12 в биомассе исследовали методом спектрофотометрии. Настоящий метод определения кобаламинов заключается в отделении и промыве клеток пропионовокислых бактерий, переводе кобаламинов в водный раствор путем гидролиза, в воздействии светом на полученный гидролизат для перевода кобаламинов в оксикобаламин и определении оптической плотности при длине волны 530 нм. Оптическая плотность раствора пропорциональна содержанию кобаламина.
Результаты и обсуждение
В ходе проведенных исследовательских работ оптимизирована питательная среда для получения биомассы консорциума пропионовокислых бактерий и ацидофильной палочки.
Для наращивания биомассы пропионовокислых бактерий и ацидофильной палочки была использована среда на основе молочной сыворотки с использованием ростовых факторов. Применение сыворотки для культивирования микроорганизмов обусловлено содержащимися в ней углеводами (моно-, олиго-и аминосахарами), липидами, минеральными солями, витаминами, органическими кислотами, ферментами и микроэлементами. Лактоза сыворотки является энергетическим субстратом для развития микроорганизмов, входящих в состав инокулята. Среда считается оптимальной, если она имеет определенные показатели рН, окислительно-восстановительного потенциала, осмотического давления и т. д.
Для поддержания буферной емкости в среду вносили натрий лимоннокислый трехзамещенный и калий фосфорнокислый однозамещенный. Поскольку пропионовокислые бактерии являются факультативными анаэробами, для загущения среды применяли агар-агар.
Известно, что микроорганизмы проявляют требовательность к наличию в питательной среде витаминов. Ацидофильная палочка испытывает потребность в рибофлавине, фолиевой кислоте и цианкобаламине. Однако, все эти витамины ацидофильная палочка может получить при совместном культивировании с пропионовокислыми бактериями, т. к. последние их синтезируют. Известно, что присутствие в среде солей кобальта увеличивает витамин-синтезирующую способность пропионовокислых бактерий [11]. Учитывая особенности синтеза витамина В 12 пропионовокислыми бактериями, в состав среды включили хлористый кобальт [12].
Магний принадлежит к числу весьма физиологически активных металлов. Ведущая роль Mg2+ связана с гликолитическим циклом, где важное значение отводится переносу фосфатов. Довольно часто Mg2+ выступает как связующее звено в ферментативных реакциях. Он принимает участие в стабилизации двойной спирали ДНК. Ионы магния играют важную роль в процессе фосфорилирования.
В качестве инокулята использовали бактериальную концентрированную закваску на основе чистых культур Propionibacterium freudenreichii Sh-85 и L. acidophilus . Согласно технологической схеме приготовления инокулята, первоначально проводили активизацию чистых культур. Далее составляли соотношение Propionibacterium freudenreichii Sh-85 и L. acidophilus 2:1. При подготовке молока для культивирования проводили стерилизацию при температуре 121 ℃ в течение 15 мин., охлаждали до температуры сквашивания (30±2)℃. В подготовленное молоко вносили 3% комбинированной бактериальной закваски для приготовления лабораторной (инокулята).
Инокулят имеет хорошие органолептические свойства, обладает умеренной кислотностью, высоким титром жизнеспособных клеток пропионовокислых бактерий и ацидофильной палочки.
Результаты по подбору компонентов состава питательной среды представлены в табл. 1.
В результате проведенных экспериментальных исследований установлен компонентный состав питательной среды для культивирования Propionibacterium freudenreichii Sh-85 и L. acidophilus , который содержит все необходимые источники питания и обладает оптимальными физико-химическими показателями.
Известно, что пропионовокислые бакте- продуценты консервирующих компонентов рии вида Propionibacterium freudenreichii прак- и биологически активных веществ и прежде тически значимы как пробиотики, как всего витамина В12.
Таблица 1.
Компонентный состав питательной среды
Table 1.
Component composition of the nutrient medium
|
Компонент | Component |
Содержание, г/л | Content, g/l |
|
Творожная сыворотка | Curd whey |
996,80 |
|
Магний хлористый | Magnesium chloride |
0,30 |
|
Натрий лимоннокислый трехзамещенный | Sodium citric acid trisubstituted |
1,00 |
|
Калий фосфорнокислый однозамещенный | Potassium phosphate monosubstituted |
0,5 |
|
Аскорбиновая кислота | Ascorbic acid |
0,10 |
|
Агар микробиологический | Microbiological agar |
1,30 |
Следует отметить, что синтез витамина В 12 зависит от условий культивирования. Известно, что корриноиды включают в группу тетрапиррольных соединений, несущих жизненно важные функции. Ионы металлов в этих соединениях находятся в комплексе с органическими лигандами, а в коферментах витамина В 12 атом кобальта связан с углеродом. Ко-В 12 – единственное металлоорганическое соединение, обнаруженное в живых организмах. Это уникальный биокатализатор. Энзиматический гемолиз Со-С связи приводит к образованию реактивных веществ. Эти вещества провоцируют протекание реакций, которые в иных случаях должны быть подавлены [13].
К настоящему времени открыто и изучено более тридцати биохимических реакций, катализируемых корриноидсодержащими ферментами. Открытие новых функций корринои-дов продолжается. Имеются сведения, что содержание корриноидов в клетках Pr. freudenreichii напрямую зависит от концентрации ионов кобальта в среде [14–20].
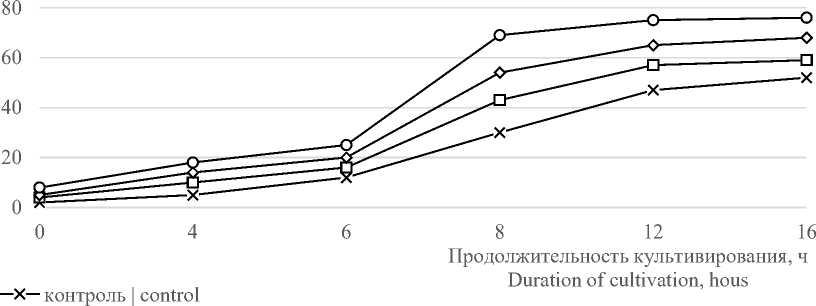
Содержание кобальта минимально в естественных питательных средах. В связи с этим, дальнейшие исследования были направлены на изучение влияния ионов кобальта на выход биомассы, синтез витамина В12 и рост клеток пробиотических культур. Хлористый кобальт вносили в количестве 0,0025 г./л, 0,0035 г./л, 0,0045 г./л. В качестве контроля использовали среду, не содержащую кобальт. Результаты исследований представлены на рисунках 1–4.
Данные, представленные на рисунке 1, показывают, что увеличение количества ионов кобальта в среде стимулирует накопление витамина В 12 . Максимальное количество витамина В 12 обнаружено в образце, содержащем 0,0045 г./л ионов кобальта, и имеет значение 76,0 мкг/л.
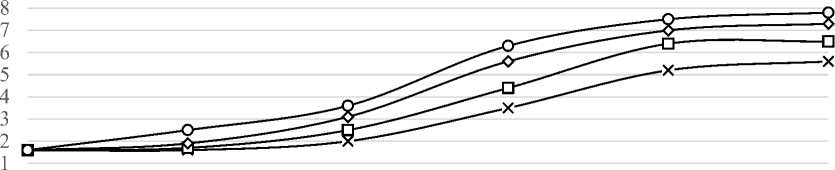
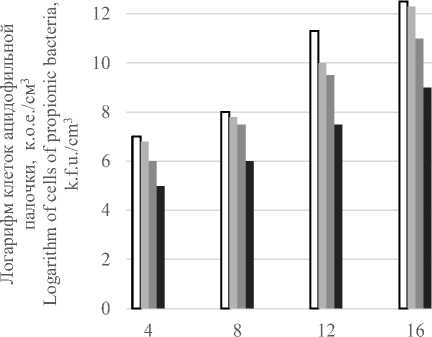
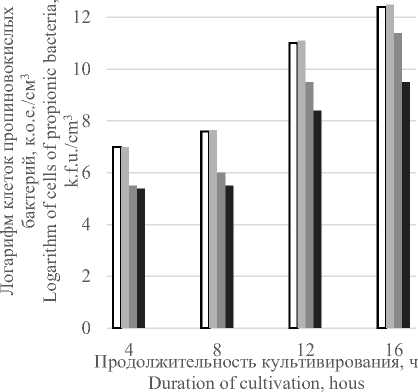
Необходимо отметить, что высокая концентрация ионов кобальта 0,0045 г./л замедляет темп наращивания биомассы (рисунок 2) и рост пробиотических культур в консорциуме. Вероятно, избыточный синтез витамина В 12 нарушает энергетические и конструктивные процессы в клетках и приводит к задержке роста микроорганизмов (рисунки 3, 4).
доза хлористого кобальта 0,0025 г/л | the dose of cobalt chloride is 0.0025 g/l доза хлористого кобальта 0,0035 г/л | the dose of cobalt chloride is 0.0035 g/l
Рисунок 1. Влияние дозы хлористого кобальта на биосинтез витамина В 12
Figure 1. Effect of cobalt chloride dose on vitamin B 12 biosynthesis
Продолжительность культивирования, ч
-X— доза хлористого кобальта 0,0045 г/л | the dose of co
baDlturcahtlioornidoef icsu0lt.i0v0a4ti5ong,/lhous
доза хлористого кобальта 0,0035 г/л | the dose of cobalt chloride is 0.0035 g/l доза хлористого кобальта 0,0025 г/л | the dose of cobalt chloride is 0.0025 g/l
Рисунок 2. Влияние дозы хлористого кобальта на накопление биомассы культур Propionibacterium freudenreichii Sh-85 и L. acidophilus
Figure 2. Effect of cobalt chloride dose on biomass accumulation of Propionibacterium freudenreichii Sh-85 and L. acidophilus cultures
Продолжительность культивирования, ч Duration of cultivaton, hous
□ контроль | control
■ доза хлористого кобальта 0,0025 г/л
■ доза хлористого кобальта 0,0035 г/л
■ доза хлористого кобальта 0,0045 г/л
| the dose of cobalt chloride is 0.0025 g/l | the dose of cobalt chloride is 0.0035 g/l
| the dose of cobalt chloride is 0.0045 g/l
Рисунок 3. Влияние дозы хлористого кобальта на рост клеток Propionibacterium freudenreichii Sh-85
-
Figure 3. Effect of Cobalt Chloride dose on
Propionibacterium freudenreichii Sh-85 cell growth
Рисунок 4. Влияние дозы хлористого кобальта на рост клеток L. acidophilus
-
Figure 4. Effect of Cobalt Chloride dose on L. acidophilus cell growth
Пропионовокислая бактерия представляет собой пример прокариота, у которого кобальт не только стимулирует образование кор-риноидов, но в определённых условиях служит фактором роста. При снижении количества ионов кобальта до 0,0025 г./л в питательной среде темп наращивания биомассы приближается к контрольному образцу и количество клеток пропионовокислых бактерий составляет в консорциуме 1012 к.о.е./см3.
При этом наблюдается высокий уровень образования витамина В 12 в биомассе. Следует отметить, что минимальная доза внесения ионов кобальта не замедляет рост ацидофильной палочки в консорциуме микроорганизмов, количество жизнеспособных клеток составляет 1012 к.о.е./см3.
Таким образом, подобрано оптимальное количество ионов кобальта 0,0025 г./л в питательной среде, обеспечивающее нормальный рост биомассы и стимулирующее накопление витамина В 12 .
Заключение
С учетом биотехнологического потенциала и сбалансированного роста микроорганизмов оптимизирована питательная среда для получения биомассы консорциума Propionibacterium freudenreichii Sh-85 и L. acidophilus . Подобрано оптимальное количество ионов кобальта в питательной среде, которое обеспечивает нормальный рост биомассы и стимулирует биосинтез витамина В 12 .
Поскольку для получения максимального выхода биомассы и синтеза метабиотиков важным критерием является создание благоприятных условий культивирования штаммов пробиотических культур в консорциуме микроорганизмов, разработанная питательная среда может быть рекомендована для приготовления бактериального концентрата прямого внесения на основе штаммов Propionibacterium freuden-reichii Sh-85 и L. acidophilus .
Список литературы Питательные и защитные факторы среды для культивирования микробного консорциума
- Mishra M., Vishwakarma K., Singh J. et al. Exploring the multifaceted role of microbes in pharmacology // Microbial Biotechnology: Volume 2. Application in Food and Pharmacology. 2018. P. 319-329. https://doi.org/10.1007/978-981-10-7140-9_7.
- Иркитова А.Н. Практическое значение и желчеустойчивость коллекционных штаммов Lactobacillus acidophilus // Известия АлтГУ. 2014. № 3 (83). С. 29-33 URL: https://cyberleninka.ru/article/n/prakticheskoe-znachenie-i-zhelcheustoychivost-kollektsionnyh-shtammov-lactobacillus-acidophilus
- Скрябина М.П., Тарабукина Н.П., Неустроев М.П., Парникова С.И. и др. Антагонистическая активность кисломолочных продуктов, обогащенных пробиотическими штаммами // Российский журнал Проблемы ветеринарной санитарии, гигиены и экологии. 2016. №. 3 (19). С. 57.
- Иркитова А.Н., Мацюра А.В. Эколого-биологическая характеристика Lactobacillus acidophilus // Ukrainian Journal of Ecology. 2017. Т. 7. № 4. С. 214-230. https://doi.org/10.15421/2017_109
- Hugenholtz J., Hunik H., Santos E., Smid J. Nutraceutical production by propionibacteria // Lait. 2002. V. 82. № 1. P. 103-112.
- Isawa K., Hojo K. Isolation and identification of a new bifidogenic growth stimulator produced by Propionibacterium Jreudenreichii ET3 // Biosci. Biotechnol. Biochem. 2002. V. 66. №. 3. P. 679-681.
- Warminska-Radiko I., Laniewska-Moroz L., Babuchowski A. Possibilities for stimulation of Bifidobacterium growth by propionibacteria // Lait.173. 2002. V. 82. № I. P. 113-121.
- Holo H., Faye T., Brede D.A., Nilsen T. et al. Bacteriocins of propionic acid bacteria // Lait. 2002. V. 82. P. 59-68.
- Vorobjeva L. Physiological peculiarities of propionibacteria present facts and prospective applications // Science Progress. 2000. V. 83. № 3. P. 277-301.
- Милентьева И.С., Козлова О.В., Еремеева Н.И. Исследование пробиотических свойств бактерий рода Propionibacterium // Вестник ЮУрГУ. Серия «Пищевые и биотехнологии». 2021. Т. 9. № 2. С. 83-92.
- Федорова О.В., Понкратова С.А., Валеева Р.Т., Исламгулов И.Р. Питательные среды в производствах медицинских и ветеринарных препаратов // Вестник технологического университета. 2017. Т. 20. №4. С. 130-133.
- Jeter R., Escalante-Semerena J.C. et al. Synthesis and use of vitamin B12 // Escherichia coli and Salmonella tephimurium. 1987. V. 1. P. 551-556.
- Boiarineva I.V., Khamagaeva I.S., Muruyev I.E. Optimization of nutrient medium composition to increase biomass of propionic acid bacteria and acidophilic bacteria // IOP Conference Series: Earth and Environmental Science. IOP Publishing, 2021. V. 640. №. 3. P. 032059. https://doi.org/10.1088/1755-1315/640/3/032059
- Хамагаева И.С., Качанина Л.М., Тумурова С.М. Биотехнология заквасок пропионовокислых бактерий // Монография. Улан-Удэ: Издательство ВСГТУ, 2006. 172 с.
- Каменская Юлия Валерьевна Влияние солей кобальта на биосинтез витамина В12 пропионовокислыми бактериями // Наука, техника и образование. 2019. № 6 (59). С. 13-15. URL: https://cyberleninka.ru/article/n/vliyanie-soley-kobalta-na-biosintez-vitamina-v12propionovokislymi-bakteriyami
- Denkova R., Denkova Z., Yanakieva V., Blazheva D. Antimicrobial activity of probiotic lactobacilli, bifidobacteria and propionic acid bacteria, isolated from different sources // Microbial pathogens and strategies for combating them: science, technology and education. 2013. V. 2. P. 857-864.
- Salehi M., Bagheri D., Sotoudeh E., Ghasemi A. et al. The combined effects of propionic acid and a mixture of Bacillus spp. probiotic in a plant protein-rich diet on growth, digestive enzyme activities, antioxidant capacity, and immune-related genes mRNA Transcript abundance in Lates calcarifer Fry // Probiotics and Antimicrobial Proteins. 2022. P. 1-13. https://doi.org/10.1007/s12602-021-09902-4
- Xie Z., Li M., Qian M., Yang Z. et al. Co-Cultures of Lactobacillus acidophilus and Bacillus subtilis Enhance Mucosal Barrier by Modulating Gut Microbiota-Derived Short-Chain Fatty Acids // Nutrients. 2022. V. 14. №. 21. P. 4475. https://doi.org/10.3390/nu14214475
- Yoon J.H., Kim J.Y., Yoo J.H., Lee S.Y. et al. Development of a selective medium for the enumeration of lactic acid bacteria and bifidobacteria in food products // Food Science and Biotechnology. 2022. P. 1-9. https://doi.org/10.1007/s10068-022-01202-z
- Miguel M., Mamuad L., Ramos S., Ku M.J. et al. Effects of using different roughages in the total mixed ration inoculated with or without coculture of Lactobacillus acidophilus and Bacillus subtilis on in vitro rumen fermentation and microbial population // Animal Bioscience. 2021. V. 34. №. 4. P. 642. https://doi.org/10.5713/ajas.20.0386


