Подбор затравочных молекул при создании ПЦР-тест-системы для идентификации растительного сырья в продуктах питания
Автор: Голубцова Ю.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технология переработки
Статья в выпуске: 10, 2014 года.
Бесплатный доступ
Подбор затравочных молекул (праймеров) - ключевое звено ПЦР (полимеразной цепной реакции), поскольку именно ими определяется возможность амплификации и выявления нужной последовательности, а также чрезвычайная гибкость метода. В связи с этим произведен выбор нуклеотидных последовательностей, которые будут многократно воспроизводиться в процессе ПЦР. Осуществлен поиск гомологичных последовательностей и их анализ. Подобраны универсальные праймеры для тест-системы.
Праймеры, тест-система, полимеразная цепная реакция, идентификация, пищевые продукты
Короткий адрес: https://sciup.org/14083365
IDR: 14083365 | УДК: 579.67:[641:613.26]
Текст научной статьи Подбор затравочных молекул при создании ПЦР-тест-системы для идентификации растительного сырья в продуктах питания
В эпоху научно-технического прогресса, в связи с изменившимися условиями труда и быта, возникла проблема роста числа заболеваний у людей, обусловленных нехваткой биологически активных нутриентов в рационе питания [1].
Одним из наиболее эффективных путей ликвидации дефицита эссенциальных нутриентов в питании человека является обогащение продуктов питания массового потребления биологически активными компонентами природного происхождения. Вследствие чего сегодня все большее внимание уделяется применению растительного сырья (плодов и ягод) в производстве продуктов питания, о чем свидетельствует рост объемов российского рынка продуктов с использованием данного вида сырья.
Интерес к съедобным растениям оправдан. Пищевые растения представляют большую ценность, прежде всего благодаря специфичным сочетаниям биологически и фармакологически активных компонентов. Такие вещества трудно создать искусственно, они хорошо усваиваются человеческим организмом, обладают лечебным и/или профилактическим действием. Благодаря природной гармонии и многообразию входящих в их состав макро- и микронутриентов (углеводы, витамины, минеральные вещества и др.), использование данного вида сырья позволит повысить пищевую и биологическую ценность пищевых продуктов [7].
При производстве пищевой продукции, обогащенной растительным сырьем, необходимо осуществлять жесткий контроль качества и достоверности видовой принадлежности вводимых природных компонентов вследствие распространяющейся фальсификации продуктов питания. По экономическим соображениям наиболее распространенный метод фальсификации – использование более дешевых заменителей ингреди- ентов, входящих в рецептуру продукта питания, имеющих, как правило, пониженную пищевую ценность. Так, например, вместо земляники садовой предлагают клубнику, а вместо персиков – абрикосы.
Решение проблемы обнаружения фальсификаций растительного сырья в продуктах требует соответствующих методов идентификации и имеет первоочередное значение в списке мероприятий, направленных на достижение безопасности и качества реализуемой пищевой продукции. В целях установления фальсификации пищевой продукции идентификация осуществляется путем совокупной оценки физико-химических, органолептических и других показателей [8]. Для этого на практике наиболее широко применяются следующие методы исследования.
Спектральные методы исследования – совокупность методов качественного и количественного определения состава объекта, основанная на изучении спектров взаимодействия материи с излучением. Спектральный анализ используется для определения пектиновых веществ, фенольных соединений, макро- и микроэлементов, содержания тяжелых металлов, степени окисления жиров и др.
Хроматографические методы исследования незаменимы при оценке качества и безопасности пищевых продуктов, имеющих очень сложный химический состав. Например, газожидкостная хроматография (ГЖХ) является наиболее важным методом для изучения состава жирных кислот природных масел и жиров, а также липидов, выделенных из различных продуктов питания. Кроме того, ГЖХ используется при определении содержания жирорастворимых витаминов, синтетических красителей, консервантов, аминокислот, углеводов, ароматических веществ пищевых продуктов, пестицидов и др. [4, 5].
Методы капиллярного электрофореза анализа сложных смесей основаны на использовании элек-трокинетических явлений (электромиграции ионов и других заряженных частиц и электроосмосе) для разделения и определения компонентов. Данный метод позволяет определять аминокислотный состав белков пищевых продуктов, состав органических кислот, содержание фруктозы, глюкозы, сахарозы.
Разработаны и внедрены ферментативные методы анализа . Их применяют при определении лимонной и яблочной кислот для соков; состава моно- и дисахаридов в молочных продуктах питания и плодово-ягодных полуфабрикатах.
Однако используемые в настоящее время методы анализа далеко не всегда позволяют исследовать пищевые продукты достаточно глубоко. Необходимость создания и постоянного усовершенствования специфичных и чувствительных методов, не требующих большого количества материала для анализа и пригодных для рутинной диагностики, неоспорима [5].
Освоение в последние годы методов ДНК-диагностики послужило стимулом для разработки и внедрения в практику высокочувствительных методик оценки качества и экспертизы продуктов питания, основанных на методе полимеразной цепной реакции (ПЦР) [3]. Полимеразная цепная реакция – это метод амплификации (многократное воспроизведение) in vitro, с помощью которого в течение нескольких часов можно выделить и размножить определенную последовательность ДНК в количестве, превышающем исходное в 10 раз. В основе метода лежит многократное копирование с помощью фермента ДНК-полимеразы определенного фрагмента ДНК по принципу комплементарности [6].
ПЦР-анализ состоит из трех основных процедур: подготовка пробы исследуемого материала, которая в большинстве случаев сводится к изоляции ДНК и ее очистке; амплификация (собственно ПЦР) и детекция продуктов амплификации. Ключевым этапом ПЦР является амплификация – направленная репликация фрагмента ДНК. Каждый цикл амплификации состоит из трех этапов: денатурация ДНК; отжиг праймеров (их присоединение к м-ДНК); элонгация праймеров (синтез). Многократное (циклическое) повторение этих трех стадий приводит к обогащению реакционной смеси молекулами ДНК-мишени, поскольку в каждом новом цикле в качестве матрицы выступает не только исходная, но и вновь синтезированная ДНК.
При создании ПЦР-тест-системы одной из основных задач является правильный подбор затравочных молекул или праймеров. Праймеры – искусственно синтезированные олигонуклеотиды, имеющие, как правило, размер от 15 до 30 п.н., идентичные соответствующим участкам ДНК-мишени. Они играют ключевую роль в образовании продуктов реакции амплификации. Правильно подобранные праймеры обеспечивают специфичность и чувствительность тест-системы [2].
Цель исследования . Подбор затравочных молекул для ПЦР-тест-системы, позволяющей идентифицировать растительное сырье в продуктах питания.
Объекты и методы исследования. В качестве объектов исследования были выбраны клубника и вишня. Для поиска последовательностей генов, к которым необходимо подобрать праймеры, удобно исполь- зовать биоинформационную базу данных NCBI. NCBI (National Centerfor Biotechnological Information, USA) – национальный центр биотехнологической информации, в числе прочего предоставляет сведения о структуре генома живых организмов – о нуклеотидных и аминокислотных последовательностях. Результаты анализа представлены в таблице 1.
Таблица 1
Анализ нуклеотидных последовательностей генома клубники и вишни
|
Наименование сырья |
Количество выбранных нуклеотидных последовательностей, присутствующих во всех геномах |
Степень сродства по скору, % |
|
Клубника (Fragaria ) |
69 |
95 |
|
Вишня (Prunussubg. Cerasus) |
25 |
95 |
Для исследования были использованы следующие сорта клубники: Fragariamoschata; Fragariaorientalis; Fragariavesca; Fragariaxananassa; Fragariavirginianasubsp. Glauca; Fragarianubicola, Fragari-adaltoniana; Fragaria sp.; Fragariachiloensis; Fragarianipponica; Fragariapentaphylla; Fragariamoupinensis; Fragar-ianilgerrensis; Fragariaiinumae; Fragariatibetica; Fragariacorymbosa. При анализе геномов Fragaria выбраны небольшие последовательности, присутствующие во всех геномах. В ходе анализа было выявлено, что общее количество нуклеотидных последовательностей в системе, представленных в Gene Bank, для клубники составило 69, наибольшее сродство по скору – 95 %.
Также проведен анализ геномов Prunussubg. Cerasus, в ходе которого выбраны небольшие последовательности, присутствующие во всех геномах. Анализируя данные, выявили 25 последовательностей для вишни, которые имеют наибольшее сродство по скору (95%).
На следующем этапе исследований в программе Bio Edit было проведено выравнивание и сравнение гомологии нуклеотидных последовательностей клубники и вишни. Результаты представлены на рисунках 1–2.

Рис. 1. Равнение и гомология нуклеотидных последовательностей клубники в программе Bio Edit

Рис. 2. Равнение и гомология нуклеотидных последовательностей вишни в программе Bio Edit
Как показал анализ, все нуклеотидные последовательности клубники и вишни обладают высоким сродством и степенью гомологии 98 %. Выбрали участки последовательностей, идентичные друг к другу, для подбора универсальных праймеров (рис. 3–4).
CGGCTCCTCGCCCCCTCCTCCCGGGAGGCGGACGTCTCGCGCGTCGCGCTCCGGCGCTTCCGCCTGGCCGA CCCTTCCGGGCGTACCGAACACCGGCGTGAATTGCGCCAAGGAACTTGAATGAAAGAGCGTTCCCCCGCCGT CCCGGAGACGGAGACCGCGCGGGTGGTTCGTCGTCTTCAGTATGTCTAAACGACTCTCGGCAACGGATATCTC GGCTCTCGCATCGATGAAGAACGTAGCGAAATGCGATACTTGGTGTGAATTGCAGAATCCCGTGAACCATCGA GTCTTTGAACGCAAGTTGCGCCCGAAGCCGTTAGGCCGAGGGCACGTCTGCCTGGGCGTCACACGTCGTTGC CCCCCCGACCCCTTCGGGAGCCGGACGGGACGGATGATGGCCTTCCCGTGTGCCCCGTCACGCGGTTGGCA TAAATACCGAGTCCTYGGCGACCGGCGTCGCGGCAATCGGTGGTTGTCAAACCTCGGTGCCTTGTCGCGTGC GTGAGTCGATCGCGGGAC
Рис. 3. Последовательности клубники
AACCTGCCTAGCAGAACGACCCGAGAACTAGTTTCAAAGCGGGGGATGAGGGGTCTTGCGGCTCCTTGTCCCT TTATCTCGGGGGGGTTGCATTGCGTTCGCGCAACCGACCCTTCCTGCGTACAAACGAACACCGGCGCGAATTG CGCCAAGGAACCTGAATGAGAGAGCGCGTCCCCGTTGCACCGGAAACGGTGCGCGCGGGCGGCGTCGTCAT CTTCAAATATGTCAAAACGACTCTCGGCAACGGATATCTCGGCTCTCGCATCGATGAAGAACGTAGCGAAATGC GATACTTGGTGTGAATTGCAGAATCCCGTGAACCATCGAGTCTTTGAACGCAAGTTGCGCCCGAAGCCATTAGG CCGAGGGCACGCCTGCCTGGGCGTCACACGTCGTTGCACCCCCACTACTCCCTCGGGATTGCGGGGTGCGGA TGATGGCCTCCCGTACGCTCCGTCGCGCGGTTGGCATAAATACCAAGTCCTCGGCGACGCACGCCACGACAAT CGGTGGTTGCGAAACCTCGGTTGCCCGTCGTGTGCGGTCGTCGCGCATCGGGGGCTCGAAAAAATGCTTGGC TCCGGCTTGGC
Рис. 4. Последовательности вишни
Разработка праймеров является самым ответственным звеном в ПЦР. Требуется подобрать такой фрагмент молекулы ДНК, который бы отличался генетической консервативностью и присутствовал бы только в исследуемом гене. При этом длина такого фрагмента должна составлять 15–30 нуклеотидов.
К выбранным участкам нуклеотидных последовательностей индивидуально подобрали праймеры, которые исключали бы перекрест при идентификации гена. Первыми выбрали праймеры с параметрами ПЦР для клубники, которые представлены на рисунке 5. Далее выбрали праймеры для идентификации вишни (рис. 6).
А
Нуклеотидный код (IUPAC)
5'-

-3'
Перевёрнутая комплементарная цепь (5' —► 3'): GTC CGC СТС CCG GGA GGA G
5' модификация (если есть)
3' модификация (если есть)
Выберите тип олигонуклеотида | оцДНК [Я
50 нМ Праймер
50 мМ Соли (Na+)
Величина поглощения при 260 нм: 1|
ОП расчитывается только для одноцепочечной ДНК или РНК
| ПОСЧИТАТЬ! | | Поменять цепи | | BLAST2 | | mfold |
Физические константы
Расчёт температуры плавления (Ты)
Длина: | 19|
Молекулярный вес: | 5790.8j (?)
Содержание GC: | 79| %
1 мл раствора с ОП равной | 1| при 260 нм
является | ~ содержит | олигонуклеотида.
5.329, микромолярным (?) и
30.9| микрограмм(а)
Простой метод (?)
С корректировкой по концентрации солей (?)
| 59| °C
По алгоритму ближайших соседей (?)
Нуклеотидный код (IUPAC)
5'-

-3'
Перевёрнутая комплементарная цепь (5* —► 3'): GCC TTG TCG CGT GCG TGA
5' модификация (если есть)
3' модификация (если есть)
Выберите тип олигонуклеотида | оцДНК |^1
50 нМ
50 мМ
Праймер
Соли(Na+)
Величина поглощения при 260 нм: |1
ОП расчитывается только для одноцепочечной ДНК или РНК
| ПОСЧИТАТЬ! I I Поменять цепи | | BLAST2 | | mfold |
Физические константы
Расчёт температуры плавления (Тм)
Молекулярный вес: |
Содержание GC: |
1 мл раствора с ОП равной [
5478.6 С?)
при 260 нм
| 55| °C
Простой метод (?)
является [ содержит | олигонуклеотида.
5.1 б| микромолярным (?) и
28.з| микрограмм(а)
I 61| °C
С корректировкой по концентрации солей (?)
| 58| °C
По алгоритму ближайших соседей (?)
Б
Рис. 5. Универсальные праймеры для идентификации клубники: А – левый праймер; Б – правый праймер
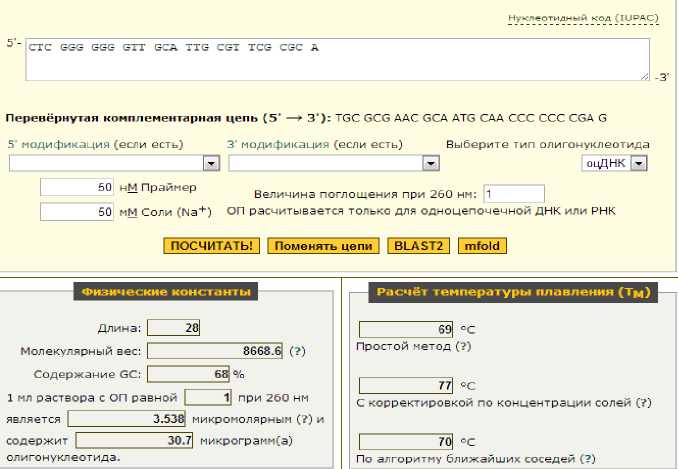
А
5'-

-3'
Перевёрнутая комплементарная цепь (5‘ —• 3'): TGC CCG TCG TGT GCG GTC GTC GCG СА
5' модификация (если есть)
3‘ модификация (если есть)
Выберите тип олигонуклеотида о^ НК U
50 нМ Праймер _ _,_ .
Величина поглощения при 260 нм: 1
50 мМ Соли (Na+) ОП расчитывается только для одноцепочечной ДНК или РНК
| ПОСЧИТАТЬ! | | Поменять цепи | | BIAST2 | | mfold |
Физические константы
Расчёт температуры плавления ( 1м)
Длина:[
Молекулярный вес: [
Содержание GC: Г
1 мл раствора является | содержит |
ОП равной Г
7976.2| (?) 73|о/о
Т| при 260 нм
I —69| °C
Простой метод (?)
олигонуклеотида.
3.5Э5| микромолярным (?) и
28.7| микрограмм(а)
I Ё| °C
С корректировкой по концентрации солей (?)
| —Й] "С
По алгоритму ближайших соседей (?)
Б
Рис. 6. Универсальные праймеры для идентификации вишни: А – левый праймер; Б – правый праймер
Выбранные универсальные непересекающиеся праймеры для определения методом ПЦР растительного сырья (клубники, вишни) представлены в таблице 2.
Универсальные праймеры для тест-системы ПЦР
Таблица 2
|
Наименование сырья |
Длина, п.н. |
Праймеры |
|
Клубника |
19 |
CTCCTCCCGGGAGGCGGAC |
|
18 |
TCACGCACGCGACAAGGC |
|
|
Вишня |
28 |
CTCGGGGGGGTTGCATTGCGTTCGCGCA |
|
26 |
TGCGCGACGACCGCACACGACGGGCA |
Таким образом, проанализированы нуклеотидные последовательности генов растительного сырья (клубники, вишни). С помощью компьютерного моделирования и анализа выбраны универсальные праймеры для идентификации методом ПЦР клубники и вишни.


