Поиск подхода к количественному определению спор микроорганизмов в пищевых системах
Автор: Посокина Н.Е., Захарова А.И., Курбанова М.Н.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Пищевые технологии
Статья в выпуске: 6, 2023 года.
Бесплатный доступ
Цель исследований - поиск подхода к контролю количественного прорастания спор микроорганизмов в пищевых системах. Задачи: определить наличие ионов кальция в суспензии проросших спор; установить зависимость концентрации ионов кальция от количества проросших спор. В качестве объекта исследования использовали штамм Bacillus subtilis ATCC 6633. Определение биологической концентрации Bacillus subtilis в споровой суспензии выполняли методом посева последовательных десятикратных разведений суспензии Bacillus subtilis в стерильной дистиллированной воде с последующим высевом суспензии и ее последовательных разведений в чашки Петри с плотной питательной средой. Прогрев суспензии проводили при температуре 95±1 °С в течение 20 минут. После прогрева определяли титр суспензии и концентрацию Ca2+. Определение концентрации Ca2+ проводили методом капиллярного электрофореза по методике М 04-52-2008 на приборе «Капель-105М» (Люмэкс, Россия). Полученная зависимость концентрации Са2+ от титра микроорганизмов позволяет определять количество проросших спор даже при минимальном их содержании, что дает возможность проводить количественное определение проросших спор в пищевых системах аналитическим методом. Такой подход к контролю количественного прорастания спор показал свою применимость для данного вида исследования, поскольку используемый в исследовании метод капиллярного электрофореза позволяет определять массовую концентрацию катионов кальция от 1,0 до 500 мг/дм3.
Споры микроорганизмов, отложенное прорастание, безопасность пищевой продукции, ионы кальция, капиллярный электрофорез
Короткий адрес: https://sciup.org/140301463
IDR: 140301463 | УДК: 579.246 | DOI: 10.36718/1819-4036-2023-6-179-185
Текст научной статьи Поиск подхода к количественному определению спор микроорганизмов в пищевых системах
Введение. С точки зрения безопасности пищевой продукции одной из самых сложных проблем при обработке пищевых продуктов физическими методами является борьба с микроорганизмами, в том числе спорами [1]. Споры, благодаря защитным механизмам, способны выдерживать радикальные изменения условий внешней среды [2–5]. Обеспечение стерилизующего эффекта часто осуществляется за счет увеличения режимов обработки, однако при этом, помимо инактивации микроорганизмов, происходит деградация необходимых для организма человека питательных веществ [6, 7]. Направление по оптимизации режимов стерилизации, обеспечивающих сохранность и безопасность готовой продукции, также актуально в связи с тем, что полное ингибирование споровой формы микроорганизмов не всегда достижимо [8, 9]. Это связано с таким явлением, как отложенное прорастание спор, или лаг-период.
Бактериальная спора является уникальной биологической системой, обладающей устойчивостью к неблагоприятным условиям, и является объектом, позволяющим изучить механизмы ее образования и прорастания [10–12]. В качестве распространенной модели используют раз- личные штаммы Bacillus subtilis, признанные в качестве объекта изучения генетической и биохимической регуляции структуры клетки.
У большинства видов спорообразование вызывается неблагоприятными для роста условиями, например истощением питательных веществ. Как внутренние, так и внешние рецепторы могут сигнализировать вегетативной клетке о прекращении роста и формировании менее метаболически требовательного и более устойчивого состояния, которое способствует ее выживанию в условиях дефицита питательных веществ [13].
Достаточность или недостаточность обработки пищевых систем физическими методами оценивают в том числе и по наличию либо отсутствию спор микроорганизмов. Споры достаточно термоустойчивы благодаря внешней оболочке и кортексу. Попадая в благоприятные условия, покоящаяся спора начинает прорастание, теряя свою термоустойчивость [14].
На рисунке 1 представлено схематичное строение споры. Ядро споры содержит комплекс дипиколиновой кислоты и хелата кальция, содержание которых колеблется от 5 до 15 % от общей сухой массы спор [15].
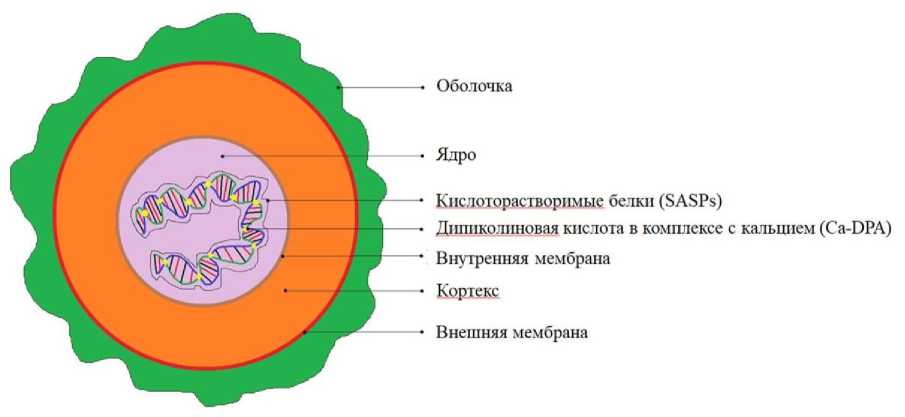
Оболочка
- Ядро
Кислоторастворшмые белки (SASPs)
Диппколиновая кислота в комплексе с кальцием (Ca-DPA)
Внутренняя мембрана
Кортекс
Внешняя мембрана
Рис. 1. Строение споры (адаптировано из [15])
При попадании в благоприятную среду активируется прорастание спор, которое условно делится на несколько этапов: активация спор (может происходить при нагревании); инициация прорастания; собственно прорастание спор (выделение дипиколиновой кислоты, ионов кальция и разрушение пептидогликана кортекса) [16].
Несмотря на то что уже многое известно о прорастании спор, остается неясным, что происходит в течение весьма изменчивого и часто длительного периода задержки между воздействием на споры питательных веществ и моментом их прорастания, в так называемый лаг-период. Например, продолжительность лаг-периода прорастания спор C. perfringens в питательных средах определяется многими факторами и уменьшается за счет термической активации и повышенного количества рецепторов прорастания. Однако, что именно происходит во время лаг-периода, кроме медленного высвобождения комплекса дипиколиновой кислоты с ионами кальция в некоторых случаях, неясно [17].
Цель исследования – поиск подхода к контролю количественного прорастания спор.
Задачи: определить наличие ионов кальция в суспензии проросших спор; установить зависимость концентрации ионов кальция от количества проросших спор.
Объекты и методы. В качестве объекта исследования использовали штамм Bacilus subtilis ATCC 6633, полученный в ФБУН ГНЦ ПМБ «ГКПМ-Оболенск». Культуру активировали посредством трех-, четырехкратного пересева че- рез каждые 24 ч в жидкую питательную среду МПБ (мясо-пептонный бульон). После этого культуру высевали на плотную агаровую среду МПА (мясо-пептонный агар) и термостатировали при температуре 37 ± 1 °С. После термостатирования в течение 3–7 дней (при относительной влажности воздуха не менее 60 %) культуру выдерживали при комнатной температуре до 14 суток в зависимости от скорости спорообразования и устойчивости спор к прорастанию. Интенсивность спорообразования бактериальной культуры контролировали под микроскопом с применением фазового контраста. Споры, выращенные на твердой среде, смывали с поверхности среды раствором фосфатного буфера из расчета 10–15 см3 раствора на 75 см2 поверхности при помощи стерильного шпателя из проволоки и сливали в пробирки. Образовавшиеся споры отделяли от питательной среды центрифугированием при 2500–3000 об/мин (модель центрифуги MPW-223e) в течение 30 мин. Осадок промывали стерильной дистиллированной водой или раствором фосфатного буфера, после чего вновь центрифугировали. Промывание с последующим центрифугированием повторяли несколько раз. Отмытые от культуральной среды споры суспензировали в растворе фосфатного буфера с рН 6,98.
Определение биологической концентрации Bacilus subtilis в споровой суспензии выполняли методом посева последовательных десятикратных разведений суспензии Bacilus subtilis в стерильной дистиллированной воде с последую- щим высевом суспензии и ее последовательных разведений в чашки Петри с плотной питательной средой МПА.
Проводили опыт с прогреванием и количественным определением Ca2+ .
-
1. Определяли титр суспензии перед прогревом (методом разведений и посевов в МПА).
-
2. Проводили прогрев суспензии при температуре 95 ± 1 °С в течение 20 мин в высокотемпературном циркуляционном термостате WiseCircu WCH12. Прогрев осуществлялся в пробирке с постановкой контроля с термометром для фиксации достижения заданной температуры.
-
3. Определяли титр суспензии и концентрации Ca2+ после прогрева.
Определение концентрации Ca2+ проводили методом капиллярного электрофореза по методике М 04-52-2008 на приборе «Капель-105М» (Люмэкс, Россия). Диапазон измеряемых значений массовой концентрации катионов кальция от 1,0 до 500 мг/дм3.
Эксперименты проводили в трехкратной повторности с отсеиванием статистически недос-
Вестник КрасГАУ. 2023. № 6 товерных данных. Математическую обработку проводили с использованием специализированного программного обеспечения TableCurve 2D v.5.01 (SYSTAT Software Inc.).
Результаты и их обсуждение. С целью изучения влияния обработки физическими методами на прорастание спор было выдвинуто предположение, что количественную оценку проросших спор возможно провести по количеству Са2+ , выделившегося из спор при прорастании, так как микробиологические методы определения количества спор занимают много времени, при этом остается риск вторичного роста вегетативных клеток, возникла необходимость поиска решения данной проблемы. Поскольку ядро спор содержит комплекс дипиколиновой кислоты и хелата кальция, было выдвинуто предположение о корреляции концентрации ионов кальция и титра микроорганизмов. С целью построения калибровочной кривой и нахождения функциональной зависимости концентрации Са2+ от количества проросших спор был проведен ряд экспериментов. Данные исследований представлены в таблице.
Количество выделенного кальция и титр микроорганизмов при прорастании спор
|
Номер эксперимента |
Концентрация микроорганизмов, КОЕ/г |
Кальций, мг/л |
|
1 |
6,5·108 |
11,36 |
|
6,5·107 |
4,358 |
|
|
6,5·106 |
3,384 |
|
|
2 |
9,1·108 |
21,86 |
|
9,1·107 |
9,987 |
|
|
9,1·106 |
5,827 |
|
|
3 |
3,0·108 |
22,67 |
|
3,0·107 |
8,107 |
|
|
3,0·106 |
5,156 |
|
|
4 |
2,5·108 |
16,95 |
|
2,5·107 |
6,214 |
|
|
2,5·106 |
4,021 |
При концентрации спор микроорганизмов в количестве (2,5–9,1) · 106 КОЕ/г количество выделенного кальция составляет от 3,384 до 5,827 мг/л.
При концентрации спор микроорганизмов в количестве (2,5–9,1) · 107 КОЕ/г количество выделенного кальция составляет от 4,358 до 9,987 мг/л.
При концентрации спор микроорганизмов в количестве (2,5–9,1) · 108 КОЕ/г количество выделенного кальция составляет от 11,36 до 22,67 мг/л.
На основании полученных данных была найдена зависимость концентрации выделившегося Са2+ от концентрации микроорганизмов (рис. 2).
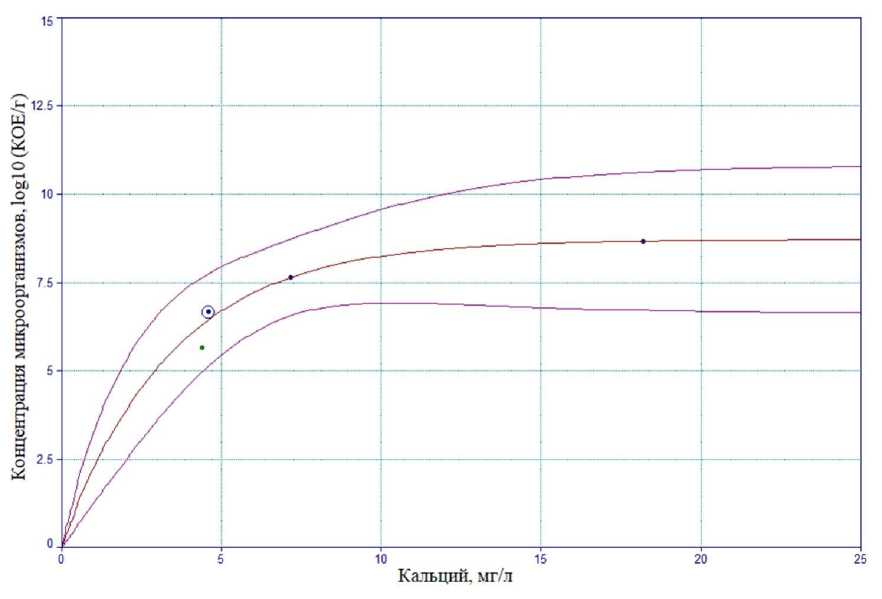
Рис. 2. Калибровочная кривая зависимости концентрации Са2+ от концентрации микроорганизмов
Данная зависимость описывается функцией
Lg N = a(1 – exp(–bm)), где N – концентрация микроорганизмов, КОЕ/г; m – количество кальция, мг/л; a – константа; b – коэффициент.
Заключение . На основании проведенного исследования можно сделать вывод, что при прорастании спор выделяется значимое количество ионов кальция, которое коррелирует с титром проросших спор микроорганизмов. На основании полученных данных была найдена зависимость концентрации выделившегося кальция от концентрации микроорганизмов, что дает возможность проводить количественное определение проросших спор в пищевых системах аналитическим методом. Такой подход к контролю количественного прорастания спор показал свою применимость для данного вида исследований, поскольку используемый в исследовании метод капиллярного электрофореза позволяет определять массовую концентрацию катионов кальция от 1,0 до 500 мг/дм3.
Список литературы Поиск подхода к количественному определению спор микроорганизмов в пищевых системах
- Посокина Н.Е., Захарова А.И. Термические способы обработки растительного сырья для увеличения его хранимоспособности // Вестник КрасГАУ. 2022. № 11. С. 192–201. DOI: 10.36718/1819-4036-2022-11-192-201.
- Role of novel polysaccharide layers in assembly of the exosporium, the outermost protein layer of the Bacillus anthracis spore / D. Lehmann [et al.] // Molecular Microbiology. 2022. № 118(3). С. 258–277. DOI: 10.1111/mmi.14966.
- Tan I.S., Ramamurthi K.S. Spore formation in Bacillus subtilis // Environmental Microbiology Report. 2014. № 6 (3). С. 212–225. DOI: 10.1111/1758-2229.12130.
- Stewart G.C. The exosporium layer of bacterial spores: a connection to the environment and the infected host // Microbiology and Molecular Biology Reviews. 2015. № 79 (4). P. 437–457. DOI: 10.1128/MMBR.00050-15.
- Coordinated Assembly of the Bacillus anthracis Coat and Exosporium during Bacterial Spore Outer Layer Formation / T.J. Boone [et al.] // mBio. 2018. № 9(6). P. e01166–18. DOI:10.1128/mBio.01166-18.
- Modelling the effect of sub(lethal) heat treatment of Bacillus subtilis spores on germination rate and outgrowth to exponentially growing vegetative cells / J.P.P.M. Smelt [et al.] // International Journal of Food Microbiology. 2008. № 128 (1). С. 34–40. DOI: 10.1016/j.ijfoodmicro.2008.08.023.
- Посокина Н.Е., Захарова А.И. Современные нетермические способы обработки растительного сырья, применяемые для увеличения его хранимоспособности // Пищевые системы. 2023. № 1 (6). С. 4–10. DOI: 10.21323/2618-9771-2023-6-1-4-10.
- Schubert W.W., Beaudet R.A. Determination of lethality rate constants and D-values for heat-resistant Bacillus spores ATCC 29669 exposed to dry heat from 125 °C to 200 °C // Astrobiology. 2011. № 11(3). P. 213–223. DOI: 10.1089/ast.2010.0502.
- Rodrigo D., Tejedor W., Martínez A. Heat Treatment: Effect on Microbiological Changes and Shelf Life // Encyclopedia of Food and Health. 2016. P. 311–315. DOI: 10.1016/B978-0-12-384947-2.00372-X.
- Dipicolinic acid as a novel spore-inspired excipient for antibody formulation / I.L. Batalha [et al.] // International Journal of Pharmaceutics. 2017. № 526 (1–2). P. 332–338. DOI: 10.1016/j.ijpharm.2017.05.012.
- Targeting the Impossible: A Review of New Strategies against Endospores / A. Romero- Rodríguez [et al.] // Antibiotics. 2023. № 12 (2). P. 248. DOI: 10.3390/antibiotics12020248.
- A monostyryl boradiazaindacene (BODIPY)- based lanthanidefree colorimetric and fluorogenic probe for sequential sensing of copper (II) ions and dipicolinic acid as a biomarker of bacterial endospores / Y. Cetinkaya [et al.] // Journal of Hazardous Materials. 2019. № 377. P. 299–304. DOI: 10.1016/j.jhazmat.2019.05.108.
- Mechanisms and Applications of Bacterial Sporulation and Germination in the Intestine / N. Koopman [et al.] // International Journal of Molecular Sciences. 2022. № 23(6). P. 3405. DOI: 10.3390/ijms23063405.
- Setlow P. Germination of Spores of Bacillus Species: What We Know and Do Not Know // Journal of Bacteriology. 2014. № 196(7). P. 1297–1305. DOI: 10.1128/JB.01455-13.
- Rekadwad B. N., Gonzalez J. M., Khobragade C.N. One Plate-double Nutrient Endospore Activation Method // Bio-101. 2020. P. e3474. DOI: 10.21769/BioProtoc.3474.
- Bacterial Spores: Mechanisms of Stability and Targets for Modern Biotechnologies / B.G. Andryukov [et al.] // Biomedical Journal of Scientific & Technical Research. 2019. № 20 (5). С. 15329–15344. DOI: 10.26717/BJSTR.2019.20.003500.
- Kinetics of Germination of Individual Spores of Geobacillus stearothermophilus as Measured by Raman Spectroscopy and Differential Interference Contrast Microscopy / T. Zhou [et al.] // PLoS ONE. 2013. № 8 (9). P. e74987. DOI: 10.1371/journal.pone.0074987.


