Полиморфизм микросателлитных локусов в генотипах культурного и дикорастущего подсолнечника
Автор: Челюстникова Т.А.
Статья в выпуске: 2 (139), 2008 года.
Бесплатный доступ
Представлены результаты исследования полиморфизма 19 SSR-локусов у 17 инбредных линий культурного подсолнечника и 10 его дикорастущих видов. В результате проведенных исследований выявлена уникальность аллельного состава для каждого генотипа. Большее аллельное разнообразие SSR-локусов обнаружено для набора дикорастущих видов подсолнечника. Два микросателлитных локуса характеризуются как видоспецифичные для Helianthus annuus L.
Короткий адрес: https://sciup.org/142150841
IDR: 142150841 | УДК: 633.864.78:591.151:543.9
Текст краткого сообщения Полиморфизм микросателлитных локусов в генотипах культурного и дикорастущего подсолнечника
Подсолнечник – важнейшая масличная культура в России. Селекция сортов и гибридов ведется на увеличение урожая и повышение пищевых качеств семян. Эти показатели часто связаны не только с биологическим потенциалом генотипа, но и с адаптивностью сортов и гибридов к различным условиям выращивания. Для улучшения характеристик, связанных с устойчивостью к неблагоприятным биотическим и абиотическим факторам, в селекционный процесс необходимо вовлекать дикорастущие виды подсолнечника. Они являются источниками устойчивости к патогенам и неблагоприятным условиям среды. Кроме того, дикорастущие виды – это ценные источники цитоплазматической мужской стерильности и генов-восстановителей фертильности, имеют оригинальный жирно-кислотный состав масла [1, 2].
Важным звеном в работе селекционера является возможность идентификации исходного рабочего материала и конечного продукта селекционной работы, представленного сортом или гибридом. Наряду с традиционной идентификацией по морфологическим признакам, широкое использование получили методы идентификации подсолнечника по составу запасного белка – гелиантинина и по спектру белков-изоферментов [3, 4]. В настоящее время для маркирования генома подсолнечника все чаще применяются маркеры, непосредственно связанные с полиморфизмом нуклеотидных последовательностей ДНК.
Для оценки генетических различий и анализа родственных взаимоотношений эффективны мик-росателлитные маркеры. Микросателлитные локусы могут представлять множественные аллели и характеризоваться сравнительно высокой гетерогенностью. Они весьма перспективны для анализа полиморфизма геномной ДНК [5]. Возможность идентификации сортов подсолнечника с помощью микросателлитов впервые показал Брюнель [6].
Ранее нами проведена работа по подбору RAPD-и SSR-локусов пригодных для молекулярногенетической характеристики отечественных генотипов подсолнечника. Исследован уровень поли- морфизма и тип наследования 10 микросателлит-ных локусов. Показана возможность использования 7 локусов, наследуемых по кодоминантному типу, для идентификации и сертификации линий и гибридов подсолнечника отечественной селекции [7, 8].
Целью данной работы являлось исследование полиморфизма 19 микросателлитных локусов у некоторых дикорастущих видов и инбредных линий культурного подсолнечника.
Материалы и методы. В качестве объекта исследований были использованы 17 инбредных линий ВК 639, ВК 464, ВК 541, ВК 571, ВК 175, ВК 678, ВК 276, ВК 580, ВК 653 ВК 910, ВК 937, ВК 680, ВК 789, ВК 551, ВК 585, ВА 93, ВК 876 и 10 дикорастущих видов подсолнечника: Н. trachelifo-lius Miller, H. strumosus L ., H. ciliares DC., H. mollis Lam., H. californicus DC., H. nuttallii T.G., H. gigan-teus L., H. longifolicus Push ., H. hirsutus Raf., H. max-imillianii Schr.
ДНК инбредных линий выделяли из выращенных в темноте 5-дневных проростков подсолнечника. Выделение проводили по модифицированному методу Saghai-Maroof [9]. Для этого 0,2 г ткани проростка растирали с 0,9 мл СТАВ буфера, выдерживали в течение часа при температуре 6 оС. Затем добавляли ½ объема смеси хлороформа и изоамилового спирта (24:1) и тщательно перемешивали. Центрифугировали. Субнатант, перенеся в чистые пробирки, вновь смешивали с равным объемом хлороформ-изоамиловой смеси. Осаждение ДНК из субнатанта проводили охлажденным до -20 оС изопропанолом. Подсушенную ДНК растворяли в 100200 мкл воды в течение 12-15 ч. ДНК дикорастущих видов подсолнечника выделяли из верхушечных листьев молодых побегов вегетирующих растений. В тканях вегетирующих растений подсолнечника высокое содержание растительных пигментов и фенольных соединений, которые затрудняют очистку нуклеиновых кислот. Для получения качественных препаратов применяли модифицированный метод выделения ДНК с использованием активированного угля [10].
Концентрацию ДНК в полученных препаратах определяли по интенсивности свечения пробы объемом 10 мкл в ультрафиолетовых лучах в 1 %-ом агарозном геле с содержанием бромистого этидия.
Для проведения полимеразной цепной реакции использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 1,5-3 мM MgCl 2 ; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеотидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы (Москва, ГОСНИИГЕНЕТИКА). Амплификацию проводили в приборе «Терцик» (ДНК-технология, Россия). Термальный режим реакций подбирали для каждой пары праймеров с учетом их нуклеотидного состава. Для большинства проведенных реакций оптимальным оказался терморежим с начальной денатурацией при 96 оС в течение 2 мин., затем 30 циклов при соблюдении температурно-временного режима: отжиг при 55-60 оС в течение 40 сек., элонгация – 1 мин. при 70 оС, денатурация при 94 оС – 30 сек., финальная элонгация – 2 мин.
Электрофорез продуктов амплификации проводили в агарозном геле (2% агароза, 1х ТАЕ-буфер) с использованием камеры для горизонтального электрофореза (SE.1, ДНК-технология, Россия) в течение 1-1,5 ч при силе тока 58 mA и напряжении 90100 V. Документирование результатов электрофореза обеспечивалось при помощи трансиллюминатора и видеосистемы (ДНК-технология, Россия) с программным обеспечением Gel Imager-2.
Для группировки генотипов и определения генетического расстояния между образцами использован Ward метод кластерного анализа пакета программного обеспечения «Statistica 6.0»
Результаты и обсуждение. Для сравнительного анализа аллельного состава микросателлитных локусов инбредных линий культурного и дикорастущих видов подсолнечника были выбраны 19 микро-сателлитных локусов, известных из литературных источников [11, 12]. В таблице представлена их характеристика.
В результате амплификации 19 микросателлит-ных локусов у 28 генотипов подсолнечника было выявлено 64 аллеля. При этом 18 инбредных линий селекции ВНИИМК имели 48 аллелей, а 10 дикорастущих видов – 56.
В наборе линейных генотипов количество аллелей на локус варьировало от 1 до 4, а у дикорастущих видов оно менялось в пределах от 1 до 5 (см. таблицу).
Среднее количество аллелей на исследованный локус для линий культурного подсолнечника составило 2,5, тогда как этот показатель для дикорастущих видов несколько выше – 3,3.
Десять локусов из 19 анализированных проявили себя более полиморфными в геномах дикорастущих видов. Аллельный состав локусов ORS 509 и ORS 559 у инбредных линий был более разнообразным по сравнению с анализированными дикорасту- щими образцами.
Локус IUB-3 для всего изученного набора генотипов оказался мономорфным. При амплификации ДНК по данному локусу получена всего одна фракция длиной около 200 пар нуклеотидов, как для генотипов культурного подсолнечника, так и для дикорастущих его видов.
У дикорастущих видов по локусам HNCA-2 и ORS 1209 вообще не было выявлено аллелей. Возможно, что эти два локуса являются видоспецифичными для Helianthus annuus L., т. к. известно, что повторяющиеся единицы микросателлитной ДНК различны по своей специфичности. Некоторые повторы встречаются в большом количестве во всех видах определенного рода, в то время как другие могут присутствовать в одном или нескольких видах. Известно, что обнаружены существенные отличия между дикими видами и культурными видами высших растений в степени амплификации повторов [13].
На основе данных распределения аллелей по 19 микросателлитным локусам при помощи кластерного анализа построены три дендрограммы. Первая отражает степень дистанцирования между 17 ин-бредными линиями культурного подсолнечника (рис. 1). Вторая – общая дендрограмма, построенная по результатам анализа генотипов культурного и дикорастущего подсолнечника (рис. 2). Третья отражает степень дистанцирования между 10 видами дикорастущего подсолнечника (рис. 3).
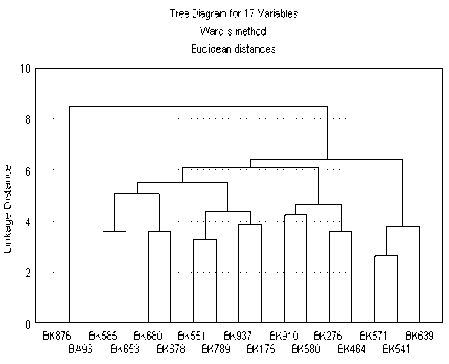
Рисунок 1 – Дендрограмма групповых дистанций между линиями подсолнечника, построенная на основе аллельного разнообразия 19 микросателлитных локусов
Для линий культурного подсолнечника минимальная генетическая дистанция 2,4 между линиями ВК 571 и ВК 541. Максимальное значение генетической дистанции – 8,5 – характеризует степень дистанцирования линий ВК 876 и ВА 93 от объединенного кластера, включающего остальные генотипы. В целом, дендрограмма иллюстрирует уникальность аллельного состава 15 генотипов по использованному набору микросателлитных локусов.
Анализ общей дендрограммы (рис. 2) показал, что линии культурного подсолнечника и дикорастущие виды образовали два различающихся кластера, значительно дистанцированных друг от друга (генетическая дистанция 10,9).
представлены двумя группами с уровнем дистанцирования 5,8. Дендрограмма иллюстрирует уникальный аллельный состав для 10 генотипов по использованному набору микросателлитных локусов.
Таким образом, проведенные исследования показали индивидуальность аллельного состава 19 микросателлитных локусов у изученных генотипов
Таблица – Характеристика микросателлитных локусов у дикорастущих видов и инбредных линий культурного подсолнечника
|
Локус |
Повтор |
Последовательность фланкирующих праймеров 5’-3’ |
Число аллелей у |
|
|
линий |
дикорастущих видов |
|||
|
Har 432 |
GT |
CTT TAT CCC CCA CCC CCT CC GGG TTT AGT GGC CAG TAG TTG TC |
3 |
4 |
|
Har 514 |
GA |
GGT CAA CGG ATT TAG AGT C GTA TTG ATT CCA ACA TCC AG |
2 |
3 |
|
Har 1327 |
ATT |
CCG TTA GGT AGT TTA CTT GCG AC GGT GGG GGG AAT ATT CTG AGG TG |
2 |
3 |
|
Har1442 |
ATT |
GCT TAT GTG CTT ACG TGT TCC TG CTA AAC AGT TCG GCG AGT GTA GG |
4 |
4 |
|
Har 1608 |
ATT |
GAT CTT AGG TCC GCC AC GAT GGC ATT TGG CTA GAC |
3 |
5 |
|
ORS-6 |
AGG |
GTG GAG AGA GGT GTA GAG AGC CAC CCC TCA CCC TGA CAC |
2 |
4 |
|
ORS-5 |
AAC |
ATC TGG AGC AGC AAA TTC AG CTG CTG CCC ACC ATA CTG |
3 |
2 |
|
IUB-6 |
GT |
TCG GTA TCG TTT GCT AAT GG GGT AAC TCT AAA GCT CTG TC |
2 |
3 |
|
HNCA-2 |
GT |
TGA GAC AAG CAT AAG CAC TAG ACA AGA CAA GGG ACT |
2 |
- |
|
IUB-3 |
TTTTTTTG |
GCA TTA GGT AGA TAG CCC CAG GTG GTA CCC TCA CTA GTC CTC T |
1 |
1 |
|
ORS 509 |
(AT) (GT) |
CAA CGA AAA GAC AGA ATC GAA A CCG GGA ATT TTA CAA GGT GA |
4 |
2 |
|
ORS 553 |
AG |
CAA GGA CGC ATA GTG AGG GTA AGG TCG TTT CAG GTG AGA GC |
2 |
3 |
|
ORS 559 |
AG |
TGA TGG TAA TGC ATC GGG TA CAC ACC ATC CTT GTA AAA TCA |
4 |
3 |
|
ORS 815 |
CTT |
GGA AAG CAG CAA TGG TTC ATA A CAC CAA GTG CAA ACC CTA GAA A |
2 |
3 |
|
ORS 1144 |
(CT) (CA) |
TTA ATG TTG TTG CAG CCG TCT C GCC CGT AAG GTG ATC TGT TAG TAG T |
3 |
3 |
|
ORS 533 |
CT |
TGG TGG AGG TCA CTA TTG GA AGG AAA GAA GGA AGC CGA GA |
2 |
4 |
|
ORS 1209 |
ATT |
CTA TGG GCC TCA CAA ACA CTT G GAT GTG AAA CAG CTC CAT ACT C |
2 |
- |
|
ORS 1796 |
ATT |
CGA AGG AAG GAA CCT GCC TC CCA TAG GCG TTT ACT TCT CGA G |
2 |
5 |
|
ORS 1287 |
CT |
GAT ATG AGC CCA TCA CTC ATC GAA GAT ATG TCA GGT CAC ACC C |
3 |
4 |
Дикорастущий вид H. ciliares DC по аллельному составу изученных локусов оказался приближен к культурной инбредной линии ВК 653 и расположен в кластере, объединяющем генотипы линий культурного подсолнечника. Дендрограмма иллюстрирует уникальность аллельного состава использованных в работе генотипов по 19 локусам.
В третьем дендрите (рис. 3) исследованные генотипы дикорастущих видов подсолнечника культурного подсолнечника и его дикорастущих сородичей. Выявлен более высокий полиморфизм микросателлитных локусов у дикорастущих видов подсолнечника. Обнаружена возможная видоспе-цифичность локусов HNCA-2 и ORS 1209 для генотипов подсолнечника Helianthus annuus L.
Исследования выполнены при частичной финансовой поддержке РФФИ и администрации Краснодарского края, грант № 06-04-96757.
Tree Diagramfor 27 Variables
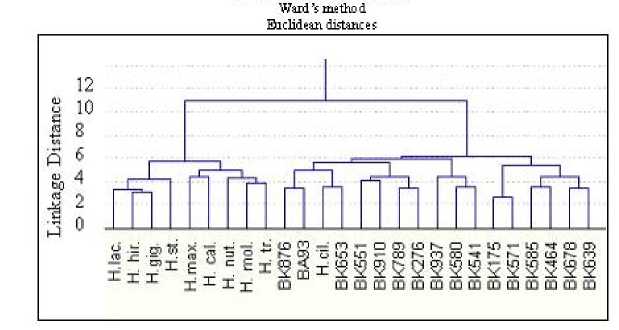
Рисунок 2 – Дендрограмма групповых дистанций между линиями
подсолнечника, построенная на основе аллельного разнообразия 19 микросателлитных локусов
(H. hir. – H. hirsutus Raf, H. gig – H. giganteus L., H. st – H. strumosus L., H. max – H. maximillianii Schr, H. cal – H. californicus DC., H. nut – H. nuttallii T.G, H. mol – H. mollis Lam, H. tr – Н. trachelifolius Miller, H. cal – H. californicus DC, H. lac – H. longifolicus Push).
Tree Diagram for 10 Variables Ward's method Euclidean distances
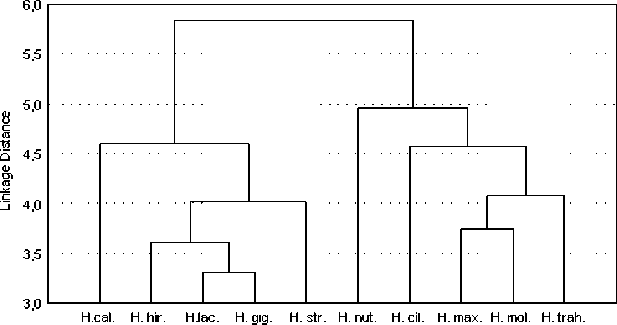
Рисунок 3 – Дендрограмма групповых дистанций между дикорастущими видами подсолнечника, построенная на основе аллельного разнообразия 19 микросателлитных локусов. (Сокращения латинских наименований те же, что и на рис. 2).
– 2000. – 34. – № 2. – С. 84-90.
-
4. Анисимова И. Н. Гетерогенность и полиморфизм 11-S-глобулина семян подсолнечника / И. Н. Анисимова, И. П. Гаврилюк // Генетика. – 1989. – Т. 25. – № 7. – С. 1248-1254.
-
5. Goodfellow P. N. Viewpoint: microsatellites and the genetic maps / P. N. Goodfellow // Current Biology. – 1993. – V. 3. – P. 149-151.
-
6. Brunel D. A microsatellite marker of Helianthus annuus L. / D. Brunel // Plant Mol. Biol. – V. 24. – P. 397-400.
-
7. Челюстникова Т. А. SSR-анализ молекулярно-генетического полиморфизма линий и гибридов подсолнечника / Т. А. Челюстникова, С. З. Гучетль, С. А. Рамазанова, Т. С. Антонова // Вестник Российской академии сельскохозяйственных наук. – 2006. – № 1. – С. 46-48.
-
8. Гучетль С. З. Паспортизация инбредных линий подсолнечника Helianthus annuus L методами RAPD и SSR-ПЦР / С. З. Гучетль, Т. А. Челюстни-кова, Т. С. Антонова, С. А. Рамазанова // Наука Кубани. – 2008. – № 2. – С. 49-54
-
9. Saghai-Maroof M. A. Ribosomal DNA spacer-length po-limorphisms in barley : Mende-lian inheritance, chromosomal locationand populationdynamics / Saghai-Maroof M. A., Soliman K. M., Jorgensen R. A. et al. // PNAS USA. – 1984. – 81. – P. 8014-8018.
-
10. Vroh I. Improver RAPD amplification of recalcitrent plant DNA by the use of activated charcoal during DNA extraction / I. Vroh, Harvengt et al. // Plant


