Полиморфные варианты генов ферментов системы детоксикации ксенобиотиков CYP2Е1, GSTM1, GSTT1, EPHX1 как биомаркеры чувствительности к экспозиции побочными продуктами водоподготовки (на примере хлороформа)
Автор: Дроздова Елена Валентиновна, Колеснева Екатерина Владмировна, Сяхович Виталий Эдуардович, Долгина Наталья Алексеевна
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 1 (41), 2023 года.
Бесплатный доступ
Установлено, что накопление хлороформа в организме и повышение его равновесных концентраций в крови экспонированного населения ассоциировано с наличием в генотипе полиморфизмов генов ферментов, участвующих в метаболизме побочных продуктов дезинфекции воды (A415G гена EPHX1, C1091T гена CYP2E1, нулевых мутаций генов глутатионтрансферазы GSTT1 и GSTM1) (р
Гены cyp2е1, gstm1, gstt1, ephx1, продукты дезинфекции воды, питьевая вода, полиморфизм генов, биомониторинг, оценка риска здоровью, биомаркеры чувствительности
Короткий адрес: https://sciup.org/142237421
IDR: 142237421 | УДК: 614.777-047.36 | DOI: 10.21668/health.risk/2023.1.15
Текст научной статьи Полиморфные варианты генов ферментов системы детоксикации ксенобиотиков CYP2Е1, GSTM1, GSTT1, EPHX1 как биомаркеры чувствительности к экспозиции побочными продуктами водоподготовки (на примере хлороформа)
в относительно низких и следовых концентрациях, их одновременное воздействие определяет риски здоровью населения при водопользовании, особенно при длительном поступлении [1–11]. Использование воды, содержащей смесь тригалометанов, повышает риски развития нарушений течения беременности у женщин (задержка внутриутробного развития плода, снижение массы тела новорожденных, преждевременные роды, врожденные дефекты развития плода) [1, 6]. По степени доказанности канцерогенного действия на человека хлороформ, бромоформ и ди-хлорбромметан Международным агентством по изучению рака (МАИР) отнесены к группе 2B (возможный канцероген для человека) на основании доказательств в экспериментах на животных [1, 2, 7–9]. Эпидемиологические исследования показали связь между воздействием тригалометанов и раком мочевого пузыря, раком прямой кишки [1, 10, 11]. Учитывая новые данные об опасности тригаломета-нов, на международном уровне наметилась тенденция к ужесточению нормативов для содержания данной группы ППД в питьевой воде. Однако пересмотр национальных нормативов требует формирования надежной доказательной базы с учетом условий водопользования в республике и особенностей чувствительности популяции к экзогенным загрязнителям, что может быть достигнуто за счет применения ряда методических подходов [12].
Из-за сложного химического состава смесей ППД и множественных путей поступления оценка фактического воздействия тригалометанов на организм человека является очень сложной задачей. Повышение точности и объективности количественной оценки рисков здоровью населения идет в том числе по пути применения данных о внутренней экспозиции – содержании загрязнителей (их метаболитов) во внутренних средах организма вещества [13–16]. Доказано, что уровни содержания хлороформа в крови могут расцениваться как биомаркеры экспозиции тригалометанами с водой. Концентрация хлороформа в крови повышается сразу после сеанса душа / ванной, мытья посуды вручную, употребления приготовленных на водопроводной воде горячих напитков (наибольшие уровни отмечаются после душа / ванной) и быстро снижается [17–20]. Однако и через 8 ч в крови можно обнаружить незначительные количества хлороформа. Постепенное его высвобождение из депо в жировой ткани при интенсивном воздействии (частый прием душа или ванной и т.д.) приводит к формированию «установившихся» концентраций хлороформа в крови (steady-state level ). Исследование образца крови без привязки к факту водопользования позволяет установить эти концентрации и более точно оценить внутреннюю экспозицию для последующей оценки рисков здоровью [21].
В то же время, помимо интенсивности воздействия и массы тела, на уровни содержания тригало-метанов в крови человека влияет комплекс факто- ров, важнейшим из которых является активность системы детоксикации ксенобиотиков. Межиндивидуальные различия в способности к биотрансформации ксенобиотиков (их метаболитов) могут быть обусловлены полиморфизмом генов, кодирующих как сами ферменты, так и рецепторы и / или факторы транскрипции, регулирующие их экспрессию. Кроме того, полиморфизмы в нескольких областях генов могут привести к изменению сродства к лиганду, активности трансактивации или уровня экспрессии рецептора, что впоследствии влияет на экспрессию генов-мишеней [22–24]. Как следствие, замедление выведения токсичных веществ и / или увеличение образования токсичных метаболитов, их накопление в организме повышают вероятность реализации негативных биологических эффектов и, соответственно, развития экологически детерминированных хронических неинфекционных заболеваний. Таким образом, наличие в генотипе полиморфизмов генов системы детоксикации ксенобиотиков может быть основой различий в индивидуальной восприимчивости к воздействию химических факторов окружающей среды, а аномальные аллели генов (полиморфизмы) ферментов, принимающих участие в метаболизме ксенобиотиков, являясь предикторами риска развития указанных выше заболеваний, могут использоваться как маркеры чувствительности организма к воздействию токсикантов [24–27].
Цитохром Р450 2E1 (CYP2E1) – основной фермент, катализирующий процесс детоксикации тригалометанов в организме людей и крыс. Относительная значимость второстепенных путей метаболизма продуктов деструкции – фосгена – зависит от наличия глутатиона, других тиолов и других нуклеофильных соединений (гистидин и цистеин). Восстановленный глутатион способен элиминировать практически все метаболиты хлороформа, образующиеся при не слишком высоких концентрациях хлороформа. Баланс между окислительным и восстановительным путями детоксикации тригалометанов (и хлороформа в частности) зависит от вещества, ткани, дозы и выраженности окислительного стресса. Для гена CYP2E1 наиболее часто рассматриваются тесно сцепленные полиморфизмы по рестрикционным эндонуклеазам PstI/RsaI, при которых мутантный аллель способствует повышенной транскрипционной и ферментативной активности. Частота встречаемости этого аллеля отличается в разных популяциях: у азиатов 6 % жителей являются носителями гомозиготного аллеля, 35 % – гетерозиготны, тогда как среди европейцев гетерозиготами является менее 6 % индивидуумов.
Полиморфизм локализованного в хромосоме 1 гена GSTM1 (глутатион-S-трансфераза класса µ) обусловлен наличием двух аллелей: функционально активного GSTM(+) и неактивного «нулевого» GSTM(-), имеющего обширную делецию, из-за чего синтез белкового продукта не происходит вообще.
Локализованный на хромосоме 22 ген GSTT1 (глу-татион-S-трансфераза (GST) тета-1) также представлен двумя аллелями: функционально активным GSTT1(+) и неактивным «нулевым» GSTТ1(-), соответствующим частичной или полной делеции, приводящей к снижению активности белка или к его отсутствию. Зарубежными учеными L.C. Backer et al. (2008) было установлено, что участники исследования с GSTT1(-) имели более высокий уровень хлороформа в крови после душа, чем GSTT1(+)-участники [20]. Исследование Kenneth P. Cantor et al. (2010) подтвердило гипотезу о связи рака мочевого пузыря у человека с генетическим полиморфизмом GSTM1, GSTZ1 [28]. В ряде статей приводятся доказательства задержки роста плода при наличии у матерей генетических полиморфизмов генов: CYP2E1, MTHFR [29], CYP2E1 и GSTZ1 [30], CYP2E1 [31]. В кросс-секционном исследовании P. Yang et al. (2016) показана связь между качеством спермы у мужского населения одной из территорий в условиях экспозиции ТГМ с водой и наличием полиморфизмов генов CYP2E1 и GSTZ1 и GSTT1 [32]. Распространенность нулевых генотипов GSTM1(-) и GSTT1(-) среди лиц европеоидной расы – 40–50 и 10–20 % соответственно [33].
Для гена микросомальной эпоксидгидролазы, являющейся важным компонентом процессов метаболизма чужеродных соединений (EPHX1), известны два функционально значимых полиморфизма, приводящие к изменению свойств фермента: в 3-м экзоне (Т337С – замена тирозина на гистидин в 113-м положении (Tyr113His)) и в 4-м экзоне (A415G – замена гистидина на аргинин в 139-м положении (His139Arg)). Полиморфизм Т337С отвечает за снижение активности фермента на 50 % («медленный» аллель), а полиморфизм A415G – за повышение активности примерно на 25 % («быстрый» аллель). Ускоренное превращение производных эпоксидов в высокоактивные метаболиты приводит к повреждению ДНК, что способствует увеличению количества хромосомных аберраций и является одной из причин развития ряда патологий.
В Республике Беларусь исследования уровней ТГМ в крови населения на территориях с водоснабжением из поверхностных источников, а также влияния генетической вариабельности популяции на их формирование до настоящего времени не проводились. Рабочая гипотеза нашего исследования состояла в том, что наличие в генотипе полиморфизмов генов системы детоксикации ксенобиотиков, принимающих участие в метаболизме хлороформа, может иметь следствием формирование потенциально более высоких уровней его содержания в биологических средах экспонированного населения при длительном воздействии, что обусловливает в конечном счете более высокую вероятность реализации рисков, ассоциированных с неблагоприятным воздействием побочных продуктов дезинфекции на организм.
Цель исследования – изучить влияние полиморфизма генов ферментов CYP2E1, GSTM1, GSTT1, EPHX1 на метаболизм побочных продуктов дезинфекции и обосновать биомаркеры индивидуальной чувствительности экспонированного населения к воздействию тригалометанов (на примере хлороформа).
Материалы и методы. В рамках работы были сформированы две группы добровольцев из числа населения г. Минска: группа наблюдения – экспонированное население, проживающее в Московском и Фрунзенском районах, снабжаемых водой из поверхностного источника, прошедшей дезинфекцию хлорированием (150 человек); контрольная группа (группа сравнения) – неэкспонированное население, проживающее в Первомайском районе, снабжаемом водой из подземных источников без применения хлорирования (47 человек). Группы были сопоставимы по возрасту (18–40 лет) и полу.
Содержание хлороформа в водопроводной воде на территории наблюдения в период, предшествующий исследованию, и во время исследования было в пределах нормативных требований – от 0,49 до 0,52 ПДК (ПДК ≤ 0,2 мг/дм3). На территории сравнения хлороформ в воде разводящей сети в пределах чувствительности метода не определялся (< 0,0125 мг/дм3). Определение хлороформа в воде проводили методом газовой хроматографии ( LOD для хлороформа 0,0125 мг/дм3).
Проведен забор периферической крови у добровольцев на базе поликлинических медицинских учреждений г. Минска в весенний период в утренние часы. Все стадии исследования соответствовали этическим нормам, у всех участников исследования было получено информированное согласие на участие в исследованиях, а также проведено анкетирование по индивидуальному водопользованию.
В качестве биомаркеров экспозиции во всех образцах крови определяли концентрации хлороформа. Исследование проводилось на базе учреждения здравоохранения «Национальная антидопинговая лаборатория» методом газовой хроматографии-масс-спектрометрии низкого разрешения, разработанным в рамках настоящего задания (СОП LM 174-2020 «Метод определения тригалометанов (хлороформа) в биологических средах»), на газовом хроматографе AGILENT 7890 с масс-спектрометрическим детектором типа «тройной квадруполь» AGILENT 7000 (Thermo Fisher Scientific, США) [34].
Также генотипы всех добровольцев были исследованы на наличие полиморфизмов A415G гена EPHX1, C1091T гена CYP2E1 и нулевых мутаций генов глутатион S-трансферазы класса µ и θ (GSTT1(-) и GSTM1(-)). Выбор генов-кандидатов для исследования основывался на особенностях метаболизма тригалометанов (хлороформа) в организме. Генотипирование проводилось на базе Республиканского унитарного предприятия «Научно-практический центр гигиены». ДНК выделяли из образцов крови с помощью коммерческого набора для выделения ДНК «Нуклеосорб», комплектация «В» производства ОДО «Праймтех» (Беларусь) согласно протоколу фирмы-изготовителя. Для установления генотипов по целевым локусам применяли метод полимеразной цепной реакции (ПЦР) в реальном времени с использованием прибора «С1000» (BioRad, США). Полученные результаты в последующем анализировались с применением соответствующего программного обеспечения. Информация о характеристиках полиморфизмов, локализации анализируемых генов и используемых ферментах рестрикции приведена в табл. 1.
Статистический анализ. Различия в распределении частот генотипов и аллелей среди лиц из группы наблюдения и лиц в группе сравнения анализировались с помощью критерия χ2. Характер распределения наблюдаемых частот генотипов и аллелей генов в популяции оценивали на соответствие уравнению Харди – Вайнберга. Качественные показатели представлены в виде абсолютного значения и доли. При описании количественных признаков (содержание хлороформа в крови) использовались общепринятые показатели: max – максимальные значения, min – минимальные значения; Ме – медиана, значения верхнего и нижнего квартилей (интерквартильный размах) – [Р25; Р75], 10, 90-го и 95-го процентилей (Р10, Р90, Р95), доверительный интервал – 95 % ДИ. При анализе количественных данных использовались методы статистической обработки с учетом вида распределения данных: при сравнении несвязанных выборок по изучаемому признаку применялся t -тест для независимых выборок, U- критерий Манна - Уитни. При сравнении показателя в нескольких независимых группах применяли непараметрический критерий Краскела – Уоллиса ( Н ). Для каждого полиморфизма и их комбинаций были рассчитаны отношения шансов (ШО, RO) с учетом 95%-ного доверительного интервала выявления в крови более высоких (≥ Р75) концентраций хлороформа у лиц с определенными полиморфизмами в сравнении с лицами без полиморфизмов.
В исследовании значение р < 0,05 считали статистически значимым. Анализ данных проводился с использованием стандартного пакета прикладных статистических программ Statistica 12.0 и Microsoft Office Excel.
Распределение генотипов и аллелей полиморфизмов исследованных генов среди добровольцев в двух группах представлено в табл. 2, оно соответствовало равновесию Харди – Вайнберга.
Полученные результаты изучения распределения полиморфных вариантов генов биотрансформации ксенобиотиков в группах наблюдения и сравнения в целом согласуются с литературными данными о распределении полиморфных вариантов генов системы метаболизма ксенобиотиков в европейской популяции. При изучении распределения частоты генотипов полиморфного локуса C1091T гена CYP2E1 гетерозиготные генотипы СТ были выявлены у 10 % лиц из группы наблюдения и у 4,3 % лиц из группы сравнения, остальные генотипы индивидуумов по данному локусу соответствовали гомозиготному генотипу дикого типа СС. Распределение нулевых генотипов GSTM(-) и GSTT1(-) составило соответственно 36,7 и 23,3 % в группе наблюдения и 36,2 и 17,0 % в группе сравнения. Анализ распределения полиморфизма 4-го экзона А415G гена EPHX1 показал, что частота встречаемости полиморфного аллеля G в опытной группе составляет 15,7 %, мутантных гомозигот GG – 9,3 %, гетерозиготного генотипа AG – 12,7 %, в то время как в контрольной группе – 8,7; 4,2 и 12,8 % соответственно.
58,7 % лиц из группы наблюдения и 51,1 % из группы сравнения имели мутантный гомо- и гетерозиготный генотипы хотя бы по одному из четырех генов: GSTM1, GSTT1, EPHX1, CYP2E1. В группе сравнения полиморфизм одного из четырех генов отмечен в 32,9 % случаев, полиморфизмы двух генов – в 18,7 %, трех генов – в 7,3 %. Встречаемость одновременно полиморфизмов нескольких генов в группах наблюдения и сравнения составила соответственно для GSTM1+EPHX1 – 6,7 и 8,5 %, GSTM1+GSTT1 – 5,3 и 4,3 %, GSTT1+EPHX1 – 2,7 и 0,0 %, для GSTT1+CYP2E1 – 2,0 и 2,1 %, EPHX1+CYP2E2 – 2,7 и 2,1 %, GSTM1+GSTT1+EPHX1 – 2,7 и 2,1 %, GSTM1+GSTT1+CYP2E1 – 2,0 и 2,1 %, GSTT1+ EPHX1+CYP2E1 – 2,7 и 0,0 %.
Таблица 1
Последовательности праймеров и ферменты рестрикции, используемые при ПЦР-анализе полиморфизма целевых генов-кандидатов
|
Ген, локализация |
Полиморфизм |
Последовательность праймеров, (5’ › 3’) |
Длина продукта, пн |
Фермент рестрикции |
Аллель, пн |
|
CYP2Е1 10q24.3 |
5`-регуляторная область С1091T |
F CCAGTCGAGTCTACATTGTCA R TTCATTCTGTCTTCTAACTGG |
411 |
RsaI |
C (412) T (351, 61) |
|
GSTM1 1q13.3 |
Делеция |
F GAACTCCCTGAAAAGCTAAAGC R GTTGGGCTCAAATATACGGTGG |
219 |
- |
норма (219) делеция (0) |
|
GSTT1 22q11.2 |
Делеция |
F TCACCGGATCATGGCCAGCA R TTCCTTACTGGTCCTCACATCTC |
459 |
- |
норма (459) делеция (0) |
|
EPHX1 1g42.1 |
4-й экзон А415G (His139Arg) |
F ACATCCACTTCATCCACGT R ATGCCTCTGAGAAGCCAT |
210 |
RsaI |
A (210) G (163, 47) |
Таблица 2
Распределение аллелей и генотипов полиморфизмов A415G гена EPHX1 (His139Arg), C1091T гена CYP2E1, GSTT1(-) и GSTM1(-) в группах наблюдения и сравнения
|
Генотипы/ аллели* |
Частота генотипов, % |
Значение р (для различных групп) |
|
|
Группа наблюдения (опытная) |
Группа сравнения (контроль) |
||
|
C1091T CYP2E1 |
|||
|
CC |
90,0 |
95,7 |
0,225 |
|
CT |
10,0 |
4,3 |
|
|
ТТ |
0,0 |
0,0 |
|
|
C |
95,0 |
97,9 |
0,393 |
|
T |
5,0 |
2,1 |
|
|
GSTT1 |
|||
|
n |
76,7 |
83,0 |
0,361 |
|
del |
23,3 |
17,0 |
|
|
GSTM1 |
|||
|
n |
63,3 |
63,8 |
0,951 |
|
del |
36,7 |
36,2 |
|
|
A415G EPHX1 |
|||
|
AA |
78,0 |
83,0 |
0,461 |
|
GA |
12,7 |
12,8 |
0,986 |
|
GG |
9,3 |
4,2 |
0,263 |
|
A |
84,3 |
91,3 |
0,228 |
|
G |
15,7 |
8,7 |
|
П р и м е ч а н и е : * AA, СС – гомозиготный генотип дикого типа; AG, CT – гетерозиготный генотип; GG, ТТ – гомозиготный мутантный генотип; A, С – аллель дикого типа; G, Т – мутантный аллель; n – дикий тип гена; del – гомозиготная делеция.
Статистически значимые различия встречаемости относительных частот мутантного гомозиготного, гетерозиготного и нормального гомозиготного генотипа по изученным генам в группах наблюдения и контроле отсутствовали по всем парам сравнения ( р > 0,05), что свидетельствует о сопоставимости сформированных выборок по группам.
Результаты и их обсуждение. В 100 % проб крови обеих групп был выявлен хлороформ: в группе наблюдения – в концентрациях от 0,03 до 0,54 нг/мл, Р95 – 0,27 нг/мл, в контрольной группе – от 0,004 до 0,37 нг/мл, Р95 – 0,13 нг/мл. Различия содержания в крови хлороформа у экспонируемого и неэкспонируемого населения (через воду) статистически значимы ( U = 2336, р < 0,01) [34]. Выявленные концентрации хлороформа в крови не превышали (за исключением одного образца) реперные концентрации (0,0004 мг/л), предложенные российскими учеными по повышению содержания в крови аспартатаминотрансферазы [16].
На следующем этапе оценивали наличие ассоциаций между наличием полиморфизмов соответствующих генов, кодирующих ферменты системы детоксикации ксенобиотиков, и уровнями хлороформа в крови населения. Далее в статье описаны выявленные ассоциации и закономерности только по группе наблюдения, поскольку статистически значимые различия между распределением аллелей в группах наблюдения и сравнения отсутствовали, а установленные статистически значимые отличия по основным ассоциациям полиморфизмов изучаемых генов с концентрациями хлороформа в крови лиц контрольной группы соответствовали тенденциям в группе наблюдения.
Для анализа ассоциаций результаты определения концентраций хлороформа в крови добровольцев группы наблюдения были обобщены по 42 условным подгруппам (вариантам) в зависимости от наличия / отсутствия полиморфизмов изучаемых генов: отсутствие в генотипе изучаемых полиморфизмов генов (подгруппа № 2), наличие в генотипе изучаемых полиморфизмов (№ 3), наличие в генотипе одного из изучаемых полиморфизмов генов (моно) (№ 4–7), наличие в генотипе полиморфизма гена в сочетании с полиморфизмами других генов (№ 8–11), наличие в генотипе полиморфизмов двух или трех генов в различных сочетаниях (№ 12–22), отсутствие в генотипе полиморфизмов конкретных генов (№ 23–26) или их определенных сочетаний (№ 27–42). Учитывая, что лишь в части подгрупп распределение концентраций соответствовало нормальному, в дальнейшем для анализа данных применялись непараметрические методы. По каждой подгруппе были рассчитаны число проб и их доля от общего числа проб в группе наблюдения, концентрации – max, min, Ме , Р25, Р75, Р10, Р90, а также число проб в подгруппе (абсолютные значения и доля в % от проб в подгруппе) с содержанием хлороформа ≥ значений Р75 и Р90, ≤ значений Р10, Р25, Р75 и Р90 для группы наблюдения в целом.
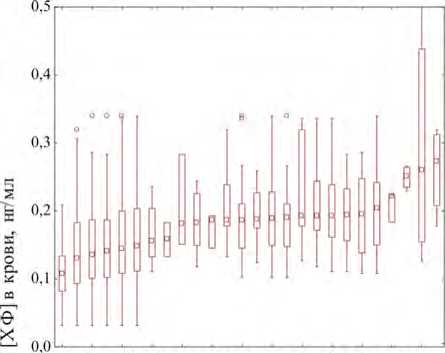
Обобщенные данные по подгруппам по содержанию хлороформа в крови добровольцев группы наблюдения в зависимости от наличия (отсутствия) полиморфизмов представлены в табл. 3 (26 подгрупп, представляющих наибольший исследовательский интерес), а визуализация результатов в виде диаграммы размаха по основным 19 подгруппам – на рис. 1.
Таблица 3
Уровни хлороформа в крови волонтеров в группе наблюдения, нг/мл
|
№ п/п |
Подгруппа по наличию/отсутствию полиморфизмов (пояснение) |
N набл. |
% от всех проб |
Me [Р25 - Р75] |
Р10 |
Р90 |
Число проб (%) с концентрацией хлороформа более (менее) соответствующего процентиля по группе наблюдения в целом |
|||
|
≥ Р75 |
≥ Р90 |
< Р10 |
< Р25 |
|||||||
|
1 |
В целом группа наблюдения |
150 |
100,0 |
0,1488 [0,1118 ÷ 0,2035] |
0,0819 |
0,2392 |
25,3 |
10,0 |
10,0 |
25,3 |
|
2 |
Нет полиморфизмов |
62 |
41,3 |
0,1082 [0,0822 ÷ 0,1341] |
0,0628 |
0,1568 |
4,8 |
0,0 |
24,2 |
56,5 |
|
3 |
Есть полиморфизмы |
88 |
58,7 |
0,1892 [0,1495 ÷ 0,2281] |
0,1310 |
0,2660 |
60,2 |
17,0 |
0,0 |
23,9 |
|
4 |
Полиморфизм GSTM1 (моно) |
30 |
20,0 |
0,1903 [0,1480 ÷ 0,2105] |
0,1279 |
0,2351 |
30,0 |
6,7 |
0,0 |
26,7 |
|
5 |
Полиморфизм GSTT1 (моно) |
9 |
6,0 |
0,1826 [0,1497 ÷ 0,2257] |
0,1178 |
0,2440 |
44,4 |
11,1 |
0,0 |
22,2 |
|
6 |
Полиморфизм EPHX1 (моно) |
8 |
5,3 |
0,1951 [0,1387 ÷ 0,2478] |
0,1081 |
0,2862 |
50,0 |
37,5 |
0,0 |
37,5 |
|
7 |
Полиморфизм CYP2E1 (моно) |
2 |
1,3 |
0,1581 [0,1333 ÷ 0,1829] |
0,1333 |
0,1829 |
0,0 |
0,0 |
0,0 |
50,0 |
|
8 |
Полиморфизм GSTM1 (не только моно) |
55 |
36,7 |
0,1869 [0,1455 ÷ 0,2105] |
0,1272 |
0,2387 |
30,9 |
9,1 |
0,0 |
27,3 |
|
9 |
Полиморфизм GSTT1 (не только моно) |
35 |
23,3 |
0,1930 [0,1711 ÷ 0,2440] |
0,1451 |
0,3061 |
48,6 |
28,6 |
0,0 |
14,3 |
|
10 |
Полиморфизм EPHX1 (не только моно) |
33 |
22,0 |
0,2040 [0,1494 ÷ 0,2422] |
0,1310 |
0,3061 |
54,5 |
30,3 |
0,0 |
24,2 |
|
11 |
Полиморфизм CYP2E1 (не только моно) |
15 |
10,0 |
0,1869 [0,1778 ÷ 0,2385] |
0,1455 |
0,3061 |
40,0 |
20,0 |
0,0 |
13,3 |
|
12 |
Полиморфизмы GSTM1+GSTT1 |
8 |
5,3 |
0,1873 [0,1745 ÷ 0,2268] |
0,1243 |
0,2586 |
37,5 |
12,5 |
0,0 |
12,5 |
|
13 |
Полиморфизмы GSTM1+EPHX1 |
10 |
6,7 |
0,1556 [0,1326 ÷ 0,2039] |
0,1219 |
0,2230 |
30,0 |
0,0 |
0,0 |
40,0 |
|
14 |
Полиморфизмы GSTT1+EPHX1 |
4 |
2,7 |
0,2512 [0,2346 ÷ 0,2643] |
0,2294 |
0,2660 |
100,0 |
75,0 |
0,0 |
0,0 |
|
15 |
Полиморфизмы GSTT1+CYP2E1 |
3 |
2,0 |
0,1819 [0,1514 ÷ 0,2832] |
0,1514 |
0,2832 |
33,3 |
33,3 |
0,0 |
0,0 |
|
16 |
Полиморфизмы EPHX1+CYP2E1 |
3 |
2,0 |
0,2222 [0,1839 ÷ 0,2237] |
0,1839 |
0,2237 |
66,7 |
0,0 |
0,0 |
0,0 |
|
17 |
Полиморфизмы GSTM1+GSTT1+EPHX1 |
4 |
2,7 |
0,2597 [0,1550 ÷ 0,4383] |
0,1272 |
0,5401 |
50,0 |
50,0 |
0,0 |
25,0 |
|
18 |
Полиморфизмы GSTM1+GSTT1+CYP2E1 |
3 |
2,0 |
0,1869 [0,1455 ÷ 0,1930] |
0,1455 |
0,1930 |
0,0 |
0,0 |
0,0 |
33,3 |
|
19 |
Полиморфизмы GSTT1+EPHX1+CYP2E1 |
4 |
2,7 |
0,2723 [0,2082 ÷ 0,3128] |
0,1778 |
0,3195 |
75,0 |
75,0 |
0,0 |
0,0 |
|
20 |
Полиморфизмы более 1 гена |
39 |
26,0 |
0,1930 [0,1617 ÷ 0,2385] |
0,1325 |
0,3061 |
46,2 |
23,1 |
0,0 |
17,9 |
|
21 |
Полиморфизмы 2 генов |
28 |
18,7 |
0,1944 [0,1565 ÷ 0,2325] |
0,1325 |
0,2626 |
46,4 |
17,9 |
0,0 |
17,9 |
|
22 |
Полиморфизм 3 генов |
11 |
7,3 |
0,1930 [0,1778 ÷ 0,3195] |
0,1455 |
0,3366 |
45,5 |
36,4 |
0,0 |
18,2 |
|
23 |
Нет полиморфизмов GSTM1 |
95 |
63,3 |
0,1310 [0,0935 ÷ 0,1829] |
0,0718 |
0,2398 |
22,1 |
10,5 |
15,8 |
63,2 |
|
24 |
Нет полиморфизма GSTT1 |
115 |
76,7 |
0,1363 [0,1013 ÷ 0,1872] |
0,0773 |
0,2222 |
18,3 |
4,3 |
13,0 |
57,4 |
|
25 |
Нет полиморфизма EPHX1 |
117 |
78,0 |
0,1414 [0,1025 ÷ 0,1869] |
0,0773 |
0,2225 |
17,1 |
4,3 |
12,8 |
57,3 |
|
26 |
Нет полиморфизма CYP2E1 |
135 |
90,0 |
0,1446 [0,1084 ÷ 0,2000] |
0,0812 |
0,2378 |
23,7 |
8,9 |
11,1 |
50,4 |
У экспонированных лиц из группы наблюдения, в генотипе которых присутствовал полиморфизм хотя бы одного изучаемого гена, хлороформ определялся в концентрациях от 0,1025 до 0,5401 нг/мл, Ме = 0,1892 нг/мл [0,1495; 0,2281], Р90 – 0,2660 нг/мл. У экспонированных лиц без изучаемых полиморфизмов генов в генотипе концентрации хлороформа находились в диапазоне от 0,0321 до 0,2087 нг/мл, Ме = 0,1082 нг/мл [0,0822; 0,1341], Р90 – 0,1568 нг/мл. Оценка достоверности установленных различий в содержании хлороформа в крови между подгруппами с наличием полиморфизмов генов и их комбинаций (№ 3–22) и подгруппой с отсутствием полиморфизмов (подгруппа № 2) по U-критерию Манна - Уитни показала, что различия статистически значимы (р < 0,01) для всех групп, за исключением подгруппы № 7 «полиморфизм CYP2E1 (моно)» (двустороннее р > 0,05), что может быть обусловлено малочисленностью данной группы. Дополнительно проведена оценка значимости различий между подгруппами с наличием полиморфизмов (№ 3–22) и подгруппами с отсутствием соответствующих полиморфизмов или их комбинаций (подгруппы № 23–26 и еще 16 подгрупп с отсутствием комбинаций полиморфизмов), различия статистически значимы для подгрупп № 3–6, 8–11, 14, 19–22 (р < 0,05) и статистически не значимы для подгрупп № 7, 12–13, 15–18 (р > 0,05).
Сравнение различий между 12 основными подгруппами (№ 2, 4–7, 12–19) методом Краскела – Уоллиса и медианным тестом показало их статистическую значимость: Н (12, N+150) = 80,5, р < 0,01, χ2 = 63,5, сс = 12, р < 0,01 (с поправкой Бонферрони). Попарные сравнения 16 основных подгрупп (№ 4–19) с использованием теста Манна – Уитни (всего 99 пар сравнения) позволили установить статистически
2 23 24 25 26 I 13 7 15 5 18 II 8 12 3 4 22 9 20 21 6 1016 1417 19
Подгруппа
° Медиана Q 25%-75% I Размах без выбр, о Выбросы • Крайние точки
Рис. 1. Диаграмма размаха для содержания хлороформа в крови волонтеров группы наблюдения в зависимости от наличия изучаемых полиморфизмов генов ферментов системы детоксикации ксенобиотиков CYP2E1, GSTM1, GSTT1, EPHX1 (подгруппы приведены в последовательности, отражающей возрастание значений медиан концентраций)
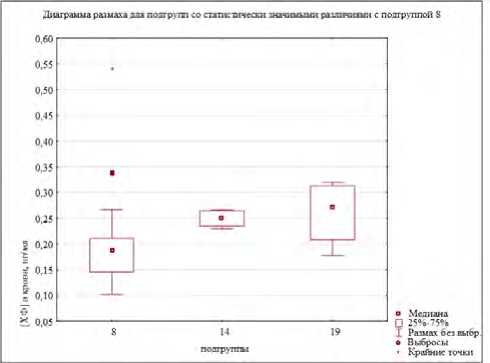
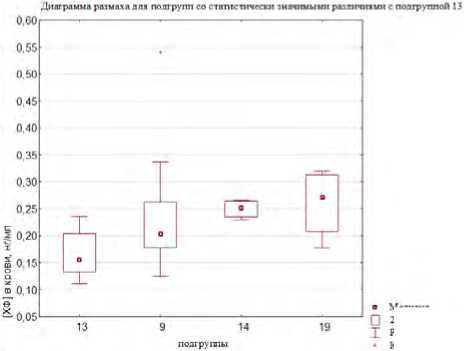
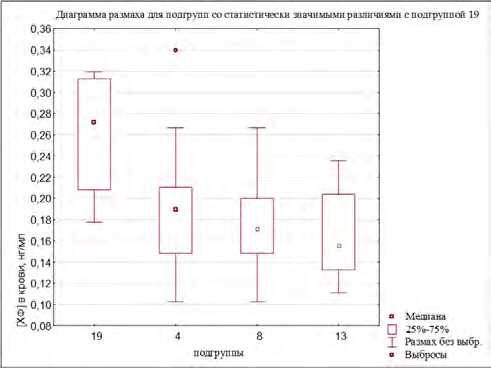
значимые различия между уровнями содержания хлороформа в крови волонтеров в следующих подгруппах: № 4 и 14 ( U = 10; Z = – 2,66; p < 0,01), № 4 и 19 ( U = 22; Z = – 2,00; p < 0,05), № 5 и 14 ( U = 3; Z = – 2,24; p < 0,05), № 12 и 14 ( U = 3; Z = – 2,12; p < 0,05), № 13 и 14 ( U = 1; Z = – 2,62; p < 0,01), № 13 и № 19 ( U = 4; Z = – 2,19; p < 0,05), № 13 и 9 ( U = 100; Z = – 2,03; p < 0,05), № 8 и 14 ( U = 22; Z = – 2,64; p < 0,01), № 8 и 19 ( U = 44; Z = – 1,97; p < 0,05). При этом уровни содержания хлороформа в крови (по медиане) были ниже в подгруппе № 4 (полиморфизм GSTM1 (моно)) на 32 и 43,1 % в сравнении с подгруппами № 14 (полиморфизмы GSTT1+EPHX1) и № 19 (полиморфизмы GSTT1+ EPHX1+CYP2E1) соответственно, ниже в группе – № 13 (полиморфизмы GSTM1+EPHX1) – на 24,1; 61,5 и 75,0 %, чем в подгруппах № 9 (полиморфизм GSTT1 (не только моно)), № 14 (полиморфизмы GSTT1+EPHX1) и № 19 (полиморфизмы GSTT1+ EPHX1+CYP2E1) соответственно, а также в подгруппе № 8 (полиморфизм GSTM1 (не только моно)) – на 34,4 и 45,7 %, чем в подгруппах № 14 и 19. Концентрации хлороформа в крови экспонированных лиц выше в подгруппе № 14 в сравнении с подгруппами № 4, 5, 12, 13 и 8 от 23,2 до 38,1 %, а также в подгруппе № 19 в сравнении с подгруппами № 4, 8 13 – на 30,2–42,9 % (рис. 2).
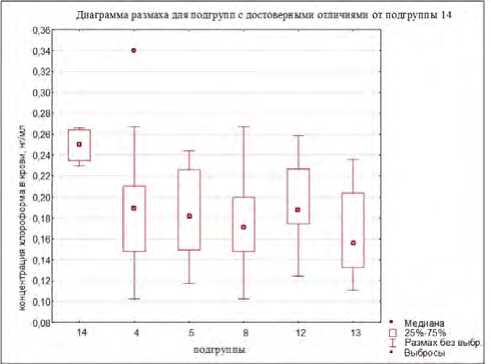
Проведен анализ различий между уровнями содержания хлороформа в крови в зависимости от наличия / отсутствия полиморфизма конкретного гена (результаты представлены на рис. 3). Наличие полиморфизмов генов GSTT1 и EPHX1, а также их одновременное присутствие отражаются на уровнях концентраций в сторону их увеличения (подгруппы № 10, 14, 17, 19).
Выполнен сравнительный анализ распределения проб с различными уровнями содержания хлороформа в крови (< P10, < P25, ≥ P75, ≥ P90 группы наблюдения) в подгруппах. Показано, что к подгруппе № 2 «нет полиморфизмов» относились все пробы с содержанием хлороформа в крови < Р10 (0,0819 нг/мл) (24,2 % проб в подгруппе) и 92,1 % проб с содержанием хлороформа < P25 (0,1118 нг/мл) (56,5 % по подгруппе). В то время как в подгруппе № 3 «есть полиморфизмы» доля проб с содержанием хлороформа < P25 составила в 2 раза меньше – 23,9 %.
В группе наблюдения из проб крови с содержанием хлороформа ≥ верхнего квартиля (Р75) (0,2035 нг/мл) 44,7 % приходилось на лиц с полиморфизмами генов GSTT1 или GSTM1, 47,4 % – с полиморфизмами EPHX1, 15,8 % – CYP2E1, и только в 7,9 % изучаемые полиморфизмы отсутствовали. Наибольший удельный вес проб с содержанием хлороформа ≥ Р75 отмечался в подгруппах № 5 «полиморфизм GSTT1 (моно)» (44,4 %), № 9 «полиморфизм GSTT1 (не только моно)» – 48,6 %, № 6 «полиморфизм EPHX1 (моно))» и № 17 «полиморфизмы GSTM1+GSTT1+EPHX1» – 50 %, № 10 «полиморфизм EPHX1 (не только моно)» – 54,5 %, № 3 «есть полиморфизмы» – 60,2 %, № 16 «полиморфизмы EPHX1+CYP2E1» – 66,7 %, № 19 «GSTT1+EPHX1+ CYP2E1» – 75 %, № 14 «полиморфизмы GSTT1+ EPHX1» – 100 %. При этом во всех подгруппах с долей проб ≥ Р75 50 % и более в генотипах присутствовали полиморфизмы гена EPHX1.
Все пробы с содержанием хлороформа в крови ≥ Р90 (0,2392 нг/мл) соответствовали лицам с наличием в генотипе полиморфизмов, из них 66,7 % имели полиморфизмы генов GSTM1 или EPHX1, 33,3 % – полиморфизмы GSTT1, 20,0 % – CYP2E1 (соответственно 75 % проб подгрупп № 13 «GSTT1+EPHX1» и № 19 «GSTT1+EPHX1+CYP2E1», 50 % проб подгруппы № 17 «GSTM1+GSTT1+EPHX1», 37,5 % проб подгруппы № 6 «полиморфизм EPHX1 (моно)»).
Расчет отношений шансов ( OR ) для наблюдаемой популяции показал (табл. 4), что для экспонированных лиц с наличием в генотипе исследуемых полиморфизмов генов (их комбинаций) относительные шансы ( OR ) содержания в крови хлороформа в концентрации ≥ Р75 значительно выше, чем у лиц без полиморфизмов ( OR = 29,8; 95 % ДИ: 8,7–102,5). В зависимости от наличия конкретных полиморфизмов отношение шансов варьируется от 8,4 раза (подгруппа № 4 «полиморфизм GSTM1 (моно)») до 59 раз (подгруппа № 19 «GSTT1+EPHX1+CYP2E1») в сравнении с отсутствием в генотипе изучаемых полиморфизмов. Исключение – подгруппы № 7 «полиморфизм CYP2E1 (моно)» и № 18 «полиморфизмы GSTM1+GSTT1+CYP2E1» (концентрация хлороформа < Р75). Наблюдаемые зависимости статистически значимы ( р < 0,05) за исключением

а
Медиана 2SH-7SH Размах Cxi выЬр Kpaiecne точки
б
г
д
Рис. 2. Уровни хлороформа в крови добровольцев группы наблюдения: диаграммы размаха для подгрупп со статистически значимыми различиями: а – с подгруппой № 4; б – с подгруппой № 8; в – с подгруппой № 13;
г – с подгруппой № 14; д – с подгруппой № 19
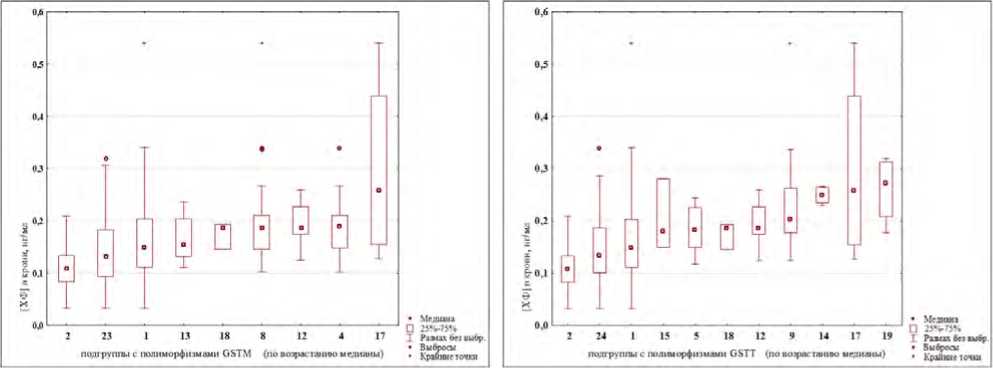
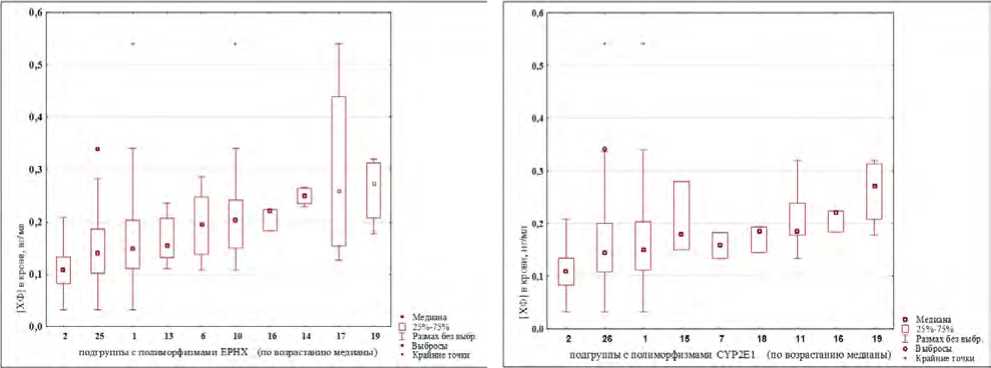
Рис. 3. Уровни хлороформа в крови добровольцев группы наблюдения: диаграммы размаха для подгрупп с наличием / отсутствием полиморфизмов генов CYP2E1, GSTM1, GSTT1, EPHX1 (последовательности подгрупп представлены соответственно возрастанию значений медиан концентраций)
подгруппы № 15. При этом наиболее высокая вероятность того, что в крови экспонированного лица хлороформ содержится в относительно более высокой концентрации (≥ Р75), отмечается при наличии в генотипе полиморфизма гена EPHX1, особенно в сочетании с полиморфизмом гена GSTТ1 (различия по всем комбинациям статистически значимы, р < 0,05) (табл. 4).
Выводы. В группе наблюдения частота генотипов полиморфного локуса C1091T гена CYP2E1 составила 10 %, встречаемости нулевых генотипов GSTM1 и GSTT1 – 36,7 и 23,3 % соответственно, полиморфизма 4-го экзона А415G гена EPHX1 – 15,7 % (мутантных гомозигот GG – 9,3 %, гетерозиготного генотипа AG – 12,7 %).
Наличие в генотипе изученных полиморфизмов (A415G гена EPHX1, C1091T гена CYP2E1, нулевые мутации генов глутатионтрансферазы GSTT1 и GSTM1) ассоциировано с замедлением выведения и биотрансформации хлороформа, его накоплением в организме и повышением равновесных концентраций хлороформа в крови населения, подвергавшегося длительному воздействию побочных продуктов дезин- фекции с водой. При содержании хлороформа в воде в пределах ПДК (0,2 мг/дм3) концентрации хлороформа в крови экспонированного населения составили: Ме = 0,1892 нг/мл [0,1495; 0,2281] у лиц с наличием полиморфизма / полиморфизмов и Ме = 0,1082 нг/мл [0,0822; 0,1341] в группе с нормальными генотипами анализируемых генов (U = 492; Z = 8,53; р < 0,0000001). При этом концентрации хлороформа в крови (по медиане) были выше на 80,4 % и более при наличии в генотипе полиморфизма А415G гена EPHX1, на 68,2 % и более – нулевого аллеля гена GSTT1, на 43,8 % и более – нулевого аллеля гена GSTM1 (различия статистически значимы при р < 0,01).
Для экспонированных лиц с наличием в генотипе исследуемых полиморфизмов генов (их комбинаций) относительные шансы (OR) содержания в крови хлороформа в концентрации ≥ Р75 значительно выше, чем у лиц без полиморфизмов (в 29,8 раза). Присутствие полиморфизма гена EPHX1 существенно увеличивает вероятность содержания хлороформа в крови в более высокой концентрации (≥ Р75, ≥ Р90), особенно в сочетании с полиморфизмом гена GSTТ1.
Таблица 4
Отношения шансов ( OR ) для полиморфных генов и их комбинаций для концентраций > Р75 содержания хлороформа в крови
|
Подгруппа по наличию / отсутствию мутантных аллелей (полиморфизмов) (пояснение) |
OR (95 % ДИ) (для проб с концентрациями хлороформа в крови ≥ Р75 с полиморфизмами к таковым и без полиморфизмов) |
Отношение рисков ( RR ) |
|
3. Есть полиморфизмы |
29,8 (8,7–102,5) |
12,4 |
|
4. Полиморфизм GSTM1 (моно) |
8,4 (21–34,1) |
6,2 |
|
5. Полиморфизм GSTT1 (моно) |
15,7 (2,7–90,8) |
9,2 |
|
6. Полиморфизм EPHX1 (моно) |
19,7 (3,2–119,9) |
10,3 |
|
7. Полиморфизм CYP2E1 (моно) |
0* |
0,0 |
|
8. Полиморфизм GSTM1 (не только моно) |
8,8 (2,4–32,1) |
6,4 |
|
9. Полиморфизм GSTT1 (не только моно) |
18,6 (4,9–70,7) |
10,0 |
|
10. Полиморфизм EPHX1 (не только моно) |
23,6 (6,1–90,8) |
11,3 |
|
11. Полиморфизм CYP2E1 (не только моно) |
13,1 (2,8–62,0) |
8,3 |
|
12. Полиморфизмы GSTM1+GSTT1 |
11,8 (1,9–74,5) |
7,8 |
|
13. Полиморфизмы GSTM1+EPHX1 |
8,4 (1,4–50,1) |
6,2 |
|
14. Полиморфизмы GSTT1+EPHX1 |
–** |
20,7 |
|
15. Полиморфизмы GSTT1+CYP2E1 |
9,8 (0,7–141,4)*** |
6,9 |
|
16. Полиморфизмы EPHX1+CYP2E1 |
39,3 (2,7–565,8) |
13,8 |
|
17. Полиморфизмы GSTM1+GSTT1+EPHX1 |
19,7 (2,0–191,8) |
10,3 |
|
18. Полиморфизмы GSTM1+GSTT1+CYP2E1 |
0* |
0,0 |
|
19. Полиморфизмы GSTT1+EPHX1+CYP2E1 |
59,0 (4,6–750,5) |
15,5 |
|
20. Полиморфизмы более 1 гена |
16,9 (4,5–63,1) |
9,5 |
|
21. Полиморфизмы двух генов |
51,1 (10,8–241,5) |
14,9 |
|
22. Полиморфизмы трех генов |
24,6 (4,3–141,9) |
11,5 |
П р и м е ч а н и е : * – в подгруппе с наличием данных полиморфизмов все пробы крови содержали хлороформ ниже Р75, ** – ОШ невозможно рассчитать, поскольку в подгруппе с наличием полиморфизмов все пробы содержат хлороформ > Р75, *** - установленные различия недостоверны, p > 0,05.
Установленные особенности позволяют рассматривать гетеро- и гомозиготные полиморфные генотипы AG/GG по гену EPHX1, CT/ТТ по гену CYP2E1, а также наличие нулевого аллеля в генах GSTT1 и GSTM1 в качестве факторов генетической предрасположенности к накоплению хлороформа в организме, что способствует повышению вероятности реализации рисков здоровью, ассоциированных с хроническим воздействием данного побочного продукта дезинфекции. Учитывая вышеизложенное, указанные полиморфизмы могут выступать в качестве биомаркеров индивидуальной чувствительности при оценке подверженности населения воздействию хлороформа, поступающего в организм с водой централизованных систем хозяйственнопитьевого водоснабжения, и применяться для совершенствования мер профилактики.
В качестве наиболее информативных биомаркеров чувствительности при оценке рисков, ассоциированных с воздействием хлороформа на уровнях, не
превышающих ПДК в воде, предлагается использовать полиморфизм A415G гена EPHX1 и делецию гена глутатионтрансферазы GSTT1, а также их комбинации, в том числе с делецией гена GSTM1 и / или полиморфизмом C1091T гена CYP2E1.
Перспективным направлением дальнейших исследований представляется изучение ассоциаций между воздействием тригалометанов и бременем патогенетически обусловленных заболеваний с учетом генетической восприимчивости популяции.
Финансирование. Работа выполнялась в рамках задания 01.01. «Разработать метод гигиенической оценки летучих химических веществ в питьевой воде» подпрограммы «Безопасность среды обитания человека» ГНТП «Научно-техническое обеспечение качества и доступности медицинских услуг», 2021–2025 годы (рег. № НИОКР 20190177).
Список литературы Полиморфные варианты генов ферментов системы детоксикации ксенобиотиков CYP2Е1, GSTM1, GSTT1, EPHX1 как биомаркеры чувствительности к экспозиции побочными продуктами водоподготовки (на примере хлороформа)
- Guidelines for Drinking-water Quality, 4th ed. with adds. - Geneva: World Health Organization, 2017. - 564 р.
- Sharma V.K., Zboril R., McDonald T.J. Formation and toxicity of brominated disinfection byproducts during chlorination and chloramination of water: a review // J. Environ. Sci. Health B. - 2014. - Vol. 49, № 3. - P. 212-228. DOI: 10.1080/03601234.2014.858576
- Егорова Н.А., Букшук А.А., Красовский Г.Н. Гигиеническая оценка продуктов хлорирования питьевой воды с учетом множественности путей поступления в организм // Гигиена и санитария. - 2013. - Т. 92, № 2. - С. 18-24.
- EPA/600/R-06/087. Exposures and internal doses of trihalomethanes in humans: multi-route contributions from drinking water [Электронный ресурс]. - URL: http://nepis.epa.gov/Adobe/PDFApdf (дата обращения: 15.01.2018).
- Kujlu R., Mahdavianpour M., Ghanbari F. Multi-route human health risk assessment from trihalomethanes in drinking and non-drinking water in Abadan, Iran // Environmental Science and Pollution Research. - 2020. - Vol. 27. - P. 42621-42630.
- Health impacts of long-term exposure to disinfection by-products in drinking water in Europe: HIWATE / M.J. Nieu-wenhuijsen, R. Smith, S. Golfinopoulos, N. Best, J. Bennett, G. Aggazzotti, E. Righi, G. Fantuzzi [et al.] // J. Water Health. -2009. - Vol. 7, № 2. - P. 185-207. DOI: 10.2166/wh.2009.073
- Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection byproducts in drinking water: a review and roadmap for research / S.D. Richardson, M.J. Plewa, E.D. Wagner, R. Schoeny, D.M. Demarini // Mutat. Res. -2007. - Vol. 636, № 1-3. - P. 178-242. DOI: 10.1016/j.mrrev.2007.09.001
- К вопросу об образовании побочных продуктов дезинфекции питьевой воды (регламентируемых и эмерджентных), их генотоксических и канцерогенных свойствах: обзор проблемы и направления дальнейших исследований / Е.В. Дроздова, В.В. Бурая, В.В. Гирина, Т.З. Суровец, А.В. Фираго // Здоровье и окружающая среда. - 2016. - № 26. - С. 12-16.
- Tellez Tovar S.S., Rodriguez Susa M. Cancer risk assessment from exposure to trihalomethanes in showers by inhalation // Environ. Res. - 2021. - Vol. 196. - P. 110401. DOI: 10.1016/j.envres.2020.110401
- Trihalomethanes in Drinking Water and Bladder Cancer Burden in the European Union / I. Evlampidou, L. FontRibera, D. Rojas-Rueda, E. Gracia-Lavedan, N. Costet, N. Pearce, P. Vineis, J.J.K. Jaakkola [et al.] // Environ. Health Perspect. -2020. - Vol. 128, № 1. - P. 17001. DOI: 10.1289/EHP4495
- Colorectal cancer and long-term exposure to trihalomethanes in drinking water: a multicenter case-control study in Spain and Italy / C.M. Villanueva, E. Gracia-Lavedan, C. Bosetti, E. Righi [et al.] // Environ. Health Perspect. - 2017. -Vol. 125, № 1. - Р. 56-65. DOI: 10.1289/EHP155
- Экспериментальные модели хронической патологии животных для оценки рисков здоровью чувствительных групп населения / Е.В. Дроздова, С.И. Сычик, В.А. Грынчак, С.Н. Рябцева // Анализ риска здоровью. - 2022. -№ 2. - С. 185-195. DOI: 10.21668/health.risk/2022.2.17
- Household exposures to drinking water disinfection by-products: whole blood trihalomethane levels / L.C. Backer, D.L. Ashley, M.A. Bonin, F.L. Cardinali, S.M. Kieszak, J.V. Wooten // J. Expo. Anal. Environ. Epidemiol. - 2000. - Vol. 10, № 4. - P. 321-326. DOI: 10.1038/sj.jea.7500098
- Опыт установления и доказывания вреда здоровью населения вследствие потребления питьевой воды, содержащей продукты гиперхлорирования / Н.В. Зайцева, И.В. Май, С.В. Клейн, Э.В. Седусова // Здоровье населения и среда обитания - ЗНиСО. - 2015. - Т. 273, № 12. - С. 16-18.
- Биохимические маркерные показатели негативных эффектов у детей при воздействии хлорорганических соединений с питьевой водой / М.А. Землянова, О.В. Пустовалова, Д.Л. Мазунина, А.С. Сбоев // Гигиена и санитария. -2016. - Т. 95, № 1. - С. 97-101. DOI: 10.18821/0016-9900-2016-95-1-97-101
- Четверкина К.В. К установлению реперного уровня содержания хлороформа в крови детского населения // Анализ риска здоровью. - 2018. - № 3. - С. 85-93. DOI: 10.21668/health.risk/2018.3.09
- Human exposure assessment for DBPs: factors influencing blood trihalomethane levels / B.C. Blount, L.L. Aylward, J. Lakind, L.S. Backer, S.M. Hays // Encyclopedia ofEnvironmental Health. - 2011. - Vol. 3. - P. 100-107. DOI: 10.1016/B978-0-444-52272-6.00103-3
- Changes in blood trihalomethane concentrations resulting from differences in water quality and water use activities / D.L. Ashley, B.C. Blount, P.C. Singer, E. Depaz, C. Wilkes, S. Gordon, C. Lyu, J. Masters // Arch. Environ. Occup. Health. -2005. - Vol. 60, № 1. - Р. 7-15. DOI: 10.3200/AEOH.60.1.7-15
- Influence of tap water quality and household water use activities on indoor air and internal dose levels of triha-lomethanes / J.R. Nuckols, D.L. Ashley, C. Lyu, S.M. Gordon, A.F. Hinckley, P. Singer // Environ. Health Perspect. - 2005. -Vol. 113, № 7. - Р. 863-870. DOI: 10.1289/ehp.7141
- Exogenous and Endogenous Determinants of Blood Trihalomethane Levels after Showering / L.C. Backer, Q. Lan, B.C. Blount, J.R. Nuckols [et al.] // Environ. Health Perpect. - 2008. - Vol. 116, № 1. - Р. 57-63. DOI: 10.1289/ehp.10049
- Predictors of blood trihalomethane concentrations in NHANES 1999-2006 / А.М. Riederer, R. Dhingra, B.C. Blount, K. Steenland // Environ. Health Perspect. - 2014. - Vol. 122, № 7. - P. 695-702. DOI: 10.1289/ehp.1306499
- Xenobiotic sensor- and metabolism-related gene variants in environmental sensitivity-related illnesses: a survey on the Italian population / D. Caccamo, E. Cesareo, S. Mariani, D. Raskovic [et al.] // Oxid. Med. Cell. Longev. - 2013. -Vol. 2013. - P. 831969. DOI: 10.1155/2013/831969
- FOXE1 polymorphisms and chronic exposure to nitrates in drinking water cause metabolic dysfunction, thyroid abnormalities, and genotoxic damage in women / D.D. Gandarilla-Esparza, E.Y. Calleros-Rincón, H.M. Macias, M.F. González-Delgado [et al.] // Genet. Mol. Biol. - 2021. - Vol. 44, № 3. - P. e20210020. DOI: 10.1590/1678-4685-GMB-2021-0020
- Markers of genetic susceptibility in human environmental hygiene and toxicology: the role of selected CYP, NAT and GST genes / R. Thier, T. Brüning, P.H. Roos, H.-P. Rihs [et al.] // Int. J. Hyg. Environ. Health. - 2003. - Vol. 206, № 3. -Р. 149-171. DOI: 10.1078/1438-4639-00209
- Autrup H. Genetic polymorphysms in human xenobiotica metabolizing enzymes as suscectibility factors in toxic response // Mutat. Res. - 2000. - Vol. 464, № 1. - P. 65-76. DOI: 10.1016/s1383-5718(99)00167-9
- DNA methylation levels and long-term trihalomethane exposure in drinking water: an epigenome-wide association study / L.A. Salas, M. Bustamante, J.R. Gonzalez, E. Gracia-Lavedan [et al.] // Epigenetics. - 2015. - Vol. 10, № 7. - P. 650-661. DOI: 10.1080/15592294.2015.1057672
- Drinking Water Disinfection By-products, Genetic Polymorphisms, and Birth Outcomes in a European Mother-Child Cohort Study / M. Kogevinas, M. Bustamante, E. Gracia-Lavedán, F. Ballester [et al.] // Epidemiology. - 2016. - Vol. 27, № 6. - P. 903-911. DOI: 10.1097/EDE.0000000000000544
- Polymorphisms in GSTT1, GSTZ1, and CYP2E1, Disinfection By-products, and Risk of Bladder Cancer in Spain / K.P. Cantor, C.M. Villanueva, D.T. Silverman, J.D. Figueroa [et al.] // Environ. Health Perspect. - 2010. - Vol. 118, № 11. -P. 1545-1550. DOI: 10.1289/ehp.1002206
- Infante-Rivard C. Drinking water contaminants, gene polymorphisms, and fetal growth // Environ. Health Perspect. -2004. - Vol. 112, № 11. - P. 1213-1216. DOI: 10.1289/ehp.7003
- Effect modification of CYP2E1 and GSTZ1 genetic polymorphisms on associations between prenatal disinfection by-products exposure and birth outcomes / B. Zhou, P. Yang, Y.-J. Gong, Q. Zeng, W.-Q. Lu, X.-P. Miao // Environ. Pollut. -2018. - Vol. 243, Pt B. - P. 1126-1133. DOI: 10.1016/j.envpol.2018.09.083
- Prenatal exposure to drinking-water chlorination by-products, cytochrome P450 gene polymorphisms and small-for-gestational-age neonates / S.G. Bonou, P. Levallois, Y. Giguere, M. Rodriguez, A. Bureau // Reprod. Toxicol. - 2017. -Vol. 73. - P. 75-86. DOI: 10.1016/j.reprotox.2017.07.019
- Interactions between CYP2E1, GSTZ1 and GSTT1 polymorphisms and exposure to drinking water trihalomethanes and their association with semen quality / P. Yang, Q. Zeng, W.-C. Cao, Y.-X. Wang [et al.] // Environ. Res. - 2016. -Vol. 147. - P. 445-452. DOI: 10.1016/j.envres.2016.03.009
- Metabolic gene polymorphism frequencies in control populations / S. Garte, L. Gaspari, A.K. Alexandrie, C. Am-brosone [et al.] // Cancer Epidemiol. Biomarkers Prev. - 2001. - Vol. 10, № 12. - Р. 1239-1248.
- Содержание хлороформа в крови населения как биомаркер экспозиции побочными продуктами дезинфекции питьевой воды / Е.В. Дроздова, С.И. Сычик, В.Э. Сяхович, Е.Н. Походня [и др.] // Медицинский журнал. - 2023. -Т. 83, № 1. - С. 23-32. DOI: 10.51922/1818-426X.2023.1.23


