Получение и перспективы применения генетически модифицированных плюрипотентных стволовых клеток
Автор: Казаченко Константин Юрьевич
Журнал: Клиническая практика @clinpractice
Рубрика: Обзоры
Статья в выпуске: 2 (14), 2013 года.
Бесплатный доступ
В данном обзоре рассмотрены способы генетического моделирования плюрипотентных стволовых клеток, проблемы экспериментальных исследований данного направления и перспективы практического применения.
Стволовые клетки, плюрипотентность, дифференцировка
Короткий адрес: https://sciup.org/14338457
IDR: 14338457
Текст обзорной статьи Получение и перспективы применения генетически модифицированных плюрипотентных стволовых клеток
Стволовыми называют недифференцированные клетки, способные к воспроизводству себе подобных и дифференцировке в специализированные (дифференцированные) клетки тканей и органов. Существует классификация стволовых клеток (СК), основанная на их способности к дифференцировке. Различают тотипотентные, плюрипотентные, мультипотент-ные и унипотентные СК.
Тотипотентные СК способны давать начало всем линиям клеток эмбриона и экстраэмбрио-нальных тканей. У млекопитающих такими клетками являются только зигота и бластомеры на стадии от 2 до 8 клеток.
Плюрипотентные СК способны дифференцироваться в любые типы клеток эмбриона (но не экстраэмбриональных тканей). У млекопитающих к плюрипотентным относятся эмбриональные СК (клетки эмбриобласта, т.е., внутренней клеточной массы бластоциста), клетки эмбриональных карцином, а также примордиальные (первичные половые) клетки.
Мультипотентные СК характеризуются способностью давать множество различных типов дифференцированных клеток определённых типов ткани (как правило, в пределах одного зародышевого листка). У млекопитающих к таким клеткам относятся, например, стволовые клетки красного костного мозга (СККМ), из которых образуются все зрелые клетки крови. Мультипотентными являются также мезенхимальные (стромальные) стволовые клетки, способные дифференцироваться в остеобласты, хондроциты и адипоциты.
Унипотентные СК способны дифференцироваться в специализированные клетки только одной линии. У млекопитающих к унипотентным клеткам относятся, например, базальные кератиноциты (предшественники керати-ноцитов наружных слоёв эпидермиса), миоса-теллоциты (предшественники мышечных волокон). Унипотентные СК расположены во многих нишах организма для обеспечения механизма поддержания ткани, её роста и регенерации [1-3].
Линии СК выявлены также у ряда представителей беспозвоночных животных, а именно – у групп беспозвоночных с чередованием полового и бесполого размножения. Примерами таких клеток являются тотипотентные археоциты губок, интерстициальные клетки кишечнополостных (в частности, интерстициальные клетки пресноводных полипов рода Hydra), тотипотентные необласты турбеллярий (наиболее известны необласты планарий) и стволовые клетки колониальных асцидий [4-8].
Первыми плюрипотентными клеточными линиями стали линии эмбриональной карциномы (ЭК), полученные из недифференцированных опухолей мыши и человека. Клетки ЭК являются производными тератокарциномы, представляющей собой разновидность опухоли зародышевых клеток. Тератокарцинома является высокозлокачественной опухолью, состоящей из соматических и экстраэмбриональ-ных тканей, а также некоторого количества клеток ЭК [9]. Показано, что у мышей трансплантации одной клетки ЭК достаточно для генерации опухоли [10]. Эти клетки обладают способностью непрерывно размножаться в культуре, а также дифференцироваться в ткани всех трех зародышевых листков, иными словами, обладают плюрипотентным характером. При этом дифференцированные производные клеток ЭК не являются злокачественными [9]. К сожалению, клетки эмбриональной карциномы человека всегда являются анеуплоидными [11]. Ввиду этого они не пригодны для клинического применения, хотя и представляют собой очень полезную модельную систему при лабораторных исследованиях.
Эмбриональные стволовые клетки
Впервые эмбриональные стволовые клетки (ЭСК) были выделены в 1981 г. из эмбриона мыши на стадии бластоциста. Бластоцист представляет собой эмбрион на преимпланта-ционной стадии, сферу, состоящую из внешнего слоя (так называемого трофобласта или тро-фоэктодермы) и эмбриобласта или внутренней клеточной массы (ВКМ). Трофобласт участвует в имплантации эмбриона, а также в формировании эктодермальной части плаценты. Эмбриобласт, из которого и были получены ЭСК, впоследствии даёт начало всем типам тканей взрослого организма. Несмотря на то, что in vivo (т.е., в развивающемся эмбрионе) ЭСК являются короткоживущими, в культуре их можно поддерживать достаточно долго в присутствии фактора LIF (leukemia inhibitory factor) или на так называемом фидере – слое эмбриональных фибробластов мыши [12]. Плюрипотентность ЭСК мыши была показана различными способами. Одним из наиболее важных тестов на плюрипотентность является способ- ность клеток к образованию химерных животных. Так, при введении в бластоцель (полость бластоциста) мыши, ЭСК способны участвовать в формировании всех тканей развивающегося эмбриона. В результате образуется химера – животное, состоящее из клеточных клонов двух разных типов – исходных (родительских) клеток и ЭСК. Так, если ЭСК, полученные от гомозиготной чёрной мыши, вводятся в бластоцист белой мыши, гомозиготной по линии albino, потомство будет иметь пятнистую окраску. Если ЭСК вводятся в бластоцисту тет-раплоидного эмбриона, можно получить животных, полностью состоящих из производных ЭСК [13].
Другим важным тестом на плюрипотентность является способность клеток к образованию тератом при эктопическом введении в организм подопытного животного. Тератома представляет собой опухоль, состоящую из тканей нескольких типов, производных одного, двух или трех зародышевых листков, причём присутствие этих тканей не свойственно тем анатомическим областям организма, в которых формируется опухоль. Тератома содержит многие дифференцированные клетки (клетки костной и хрящевой тканей, эпителия кожи, т.д.) и недифференцированные стволовые клетки, продолжающие делиться и создавать дифференцированные ткани [14].
Открытие ЭСК оказало большое влияние на многие области биологических исследований за последние тридцать лет. Например, поскольку ЭСК в культуре имитируют развитие эмбриона на ранних стадиях [15], с их помощью можно исследовать этапы развития млекопитающих in vitro , не прибегая к сбору периимплантационных эмбрионов. ЭСК позволили также расширить возможности генетического моделирования. Так, если обработать клетки химическим мутагеном, отобрать клоны ЭСК, несущих мутацию в нужном гене, а затем использовать их для создания химерных животных, можно получить модель того или иного генетического заболевания. Таким способом на мышах была получена модель болезни Леш-Найхена, возникающей в результате инактивирующей мутации гена HPRT [16].
Генетическое моделирование с использованием ЭСК стало более совершенным и эффективным с появлением методики доставки экзогенной ДНК в клеточное ядро. Используемая для этой цели ДНК представляет собой плаз- миду – внехромосомную кольцевую молекулу ДНК, содержащую необходимый ген под контролем промотора, позволяющего осуществлять эффективную экспрессию гена в клетках млекопитающих. Проникновение ДНК в клетки (трансфекция) чаще всего осуществляется с помощью электропорации – электрических импульсов определённой силы и частоты, создающих в мембране клетки временные поры, через которые молекулы чужеродной ДНК способны проникнуть в клеточную цитоплазму, а затем и в ядро. При трансфекции большая часть проникших в ядра плазмид сохраняются там в течение 2-3 дней, после чего постепенно теряются в результате последовательных клеточных делений. Лишь незначительная часть рекомбинантных молекул сохраняется в клеточном ядре за счёт стабильной интеграции в геном клетки-хозяина. В абсолютном большинстве линий клеток млекопитающих интеграция плазмиды в геном происходит в случайные сайты хромосомной ДНК, иными словами, путём негомологичной рекомбинации. ЭСК мыши представляют собой исключение, поскольку интеграция плазмиды в их геном может происходить путём гомологичной рекомбинации, т.е., в заранее известные сайты генома. Благодаря этому обстоятельству стала возможной адресная доставка (направленный таргетинг) трансгена в ЭСК.
Используемые для трансфекции плазмиды всегда содержат так называемый селективный маркер, чаще всего представляющий собой ген устойчивости к антибиотику. Обычно в качестве селективного маркера используется ген neo (неомицинфосфотрансферазы), обусловливающий устойчивость клеток к неомицину. Таким образом, клоны, содержащие стабильно интегрированную экзогенную ДНК, можно легко идентифицировать при выращивании на среде, содержащей неомицин. Благодаря этой технологии были расширены возможности трансгеноза [17 - 20].
Технически модельные эксперименты по трансгенозу с применением ЭСК осуществляются следующим образом: внутреннюю клеточную массу из преимплантационного бластоциста помещают на монослой клеток, представляющих собой матрикс для прикрепления, а также поставляющих необходимые ростовые факторы. Эти клетки носят название фидерных (питающих). В качестве фидерных клеток обычно используются эмбриональные фибро- бласты мыши. Для ингибирования дифференцировки клеток и поддержания их плюрипотентных свойств в ростовую среду добавляют также фактор LIF. В результате нескольких последовательных пассажей получают колонии плюрипотентных клеток, с помощью которых можно создавать химерных животных. Затем в ЭСК вводится плазмидная ДНК, содержащая определённый ген, после чего на среде с антибиотиком производится селекция клеток со стабильно интегрированным трансгеном. Отобранные in vitro клетки вводят в бластоцист ложнобеременной мыши и затем позволяют ей родить потомство. Таким образом, вместо отбора трансгенных животных производится селекция стволовых клеток, что позволяет предельно упростить процедуру трансгеноза.
Перенос ядер соматических клеток
Впервые успешная попытка перепрограммирования соматических клеток была осуществлена Гардоном и сотрудниками в серии экспериментов конца 50-х – начала 60-х годов ХХ века [21, 22]. В качестве модельного организма была использована африканская шпорцевая лягушка Xenopus laevis . Ядро яйцеклетки Xenopus разрушалось с помощью облучения ультрафиолетом, а затем в лишённую генетического материала яйцеклетку вводилось ядро дифференцированной соматической клетки лягушки того же вида. В качестве донорных использовались как клетки эмбриона на стадии бластулы, так и эпителиальные клетки кишечника головастика. В результате удалось получить клонированных (т.е., генетически идентичных) животных, многие из которых обладали нормальными размерами, морфологией и репродуктивным потенциалом. При использовании донорных клеток эмбриона на ранней стадии развития нормальные животные были получены в 76% случаев, при использовании же донорных клеток головастика нормальные животные были получены лишь в 37% случаев [22]. Впоследстивии эта технология, получившая название переноса ядер соматических клеток ("somatic cell nuclear transfer", SCNT) (рис. 1), была успешно использована на млекопитающих, что привело к клонированию животных различных видов, включая знаменитую овечку Долли [23-26]. При клонировании млекопитающих использовались как клетки эмбриона на различных стадиях развития, так и соматические клетки взрослого организма. Отличительная особенность
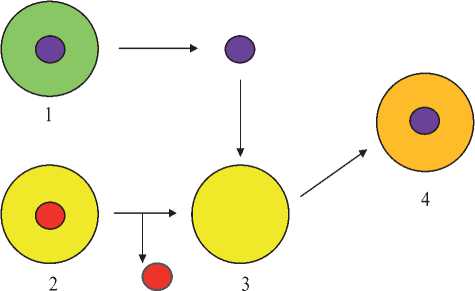
Рис. 1.
Схема получения плюрипотентных стволовых клеток с помощью метода SCNT.
1. Соматическая клетка.
2. Яйцеклетка.
3. Яйцеклетка, лишённая ядра.
4. Плюрипотентная стволовая клетка.
технологии клонирования млекопитающих состоит в том, что донорные клетки предварительно вводятся в состояние покоя (фазы Go), что достигается снижением концентрации сыворотки в ростовой среде с 10% до 0,5%. Предполагается, что стимуляция клетки к выходу из фазы роста способствует изменению структуры хроматина, что облегчает перепрограммирование [23, 27].
SCNT технология может быть использована для получения плюрипотентных стволовых клеток в медицинских целях. Полученные этим способом стволовые клетки являются изогенными для донора. Таким образом, будучи дифференцированными in vitro и затем трансплантированными донору, они не подвергнутся иммунному отторжению. Эта концепция получила название «терапевтического клонирования» и была успешно использована в экспериментах на мышах [24]. С помощью данного метода были также получены плюрипотентные стволовые клетки человека [28], однако, производство человеческих клеток с помощью SCNT сталкивается как с этическими проблемами, так и с техническими сложностями [29-32].
Индуцированные плюрипотентные стволовые клетки
Несмотря на определённые успехи в де-дифференцировке специализированных соматических клеток, факторы, индуцирующие перепрограммирование, стали исследоваться сравнительно недавно. Кроме того, во всех вышеприведённых методиках необходимо использова- ние эмбрионального материала, что ставит определённые этические барьеры на пути к использованию данных методов в медицине. В 2006 году группой Яманаки было показано, что индукцию формирования плюрипотентных стволовых клеток можно вызвать путём трансформации фибробластов мыши генами четырёх факторов – Oct3/4 (Oct4), Sox2, Klf4 и c-Myc (рис. 2). Полученные в результате клетки по свойствам (морфологии, профилю экспрессии генов, дифференцировочному потенциалу) были подобны эмбриональным стволовым клеткам и получили название индуцированных плюрипотентных стволовых клеток (iPSC – "induced pluripotent stem cells"). Плюрипотентность iPSC была подтверждена с помощью тестов на формирование тератом и создание химерных животных [33]. В 2012 году Синья Яманака за своё открытие получил Нобелевскую премию по медицине (совместно с дожившим до этого события Джоном Гардоном).
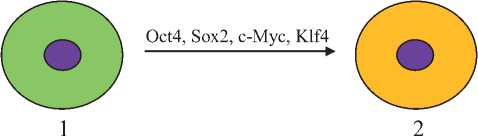
Рис. 2.
Схема получения индуцированных плюрипотентных стволовых клеток (iPSC).
1. Соматическая клетка.
2. Индуцированная плюрипотентная стволовая клетка.
Oct4, называемый также Oct3 (октамер-свя-зывающий транскрипционный фактор 4), представляет собой транскрипционный фактор, регулирующий экспрессию генов путём связывания с октамером (областью, состоящей из 8 нуклеотидов) ATGCAAAT в их промотор-но-энхансерной области. Еще до открытия Яманаки Oct4 был известен как важный фактор плюрипотентности клеток грызунов и приматов [34, 35]. У мышей экспрессия этого белка связана с плюрипотентными клетками развивающегося эмбриона. Экспрессия Oct4 инициируется на стадии 4-8 клеточного эмбриона и детектируется вплоть до стадии морулы [36]. На стадии бластоциста экспрессия Oct4 остается высокой в клетках ВКМ, но при этом почти отсутствует в трофоэктодерме. Наличие экспрессии Oct4 подтверждено для всех типов плюрипотентных клеток мыши – эмбриональ- ных стволовых клеток, клеток эмбриональной карциномы и примордиальных клеток [37, 38]. Кроме того, утрата плюрипотентности при спонтанной или индуцированной дифференцировке всегда коррелирует с падением экспрессии Oct4 [35]. Важнейшая роль Oct4 в установлении и поддержании плюрипотентности была подтверждена с помощью направленного разрушения (нокаута) гена этого фактора. Было показано, что эмбрионы мыши, дефектные по гену Oct4, не способны формировать ВКМ (т.е., эмбриональные стволовые клетки) [39]. Эмбрионы, гомозиготные по де-леции гена Oct4, развивались в бластоцистоподобные структуры, состоявшие исключительно из клеток трофоэктодермы. Таким образом, Oct4 является одним из главных факторов, определяющих формирование, самообновление и поддержание плюрипотентных клеток.
Функции белка Sox2 (SRY box 2 - бокс 2 области Y-хромосомы, определяющей пол) интенсивно исследуются, начиная с середины девяностых годов прошлого века. У млекопитающих гены семейства Sox принимают важнейшее участие на всех стадиях эмбрионального развития. Показано, что инактивация гена Sox2 на периимплантационной стадии развития приводит к гибели эмбриона. Подавление же экспрессии этого гена в культуре ЭС клеток приводит к дифференцировке последних в клетки трофоэктодермы, как и в случае с геном Oct4 [40]. Обнаружено, что Sox2 и Oct4 совместно регулируют работу нескольких сотен генов, большинство из которых экспрессируется в ЭС клетках. При этом Sox2 и Oct4 связываются с соседними, прилегающими друг к другу участками ДНК. Помимо этого, Sox2 и Oct4 являются корепрессорами для целого ряда генов, экспрессия которых подавляется в ЭС клетках [41].
Продукт протоонкогена c-myc представляет собой фактор транскрипции, способный как активировать, так и репрессировать транскрипцию генов. Уровень мРНК c-myc возрастает при стимуляции покоящихся клеток факторами роста [42]. Существует определённая зависимость между уровнем экспрессии c-myc и клеточной пролиферацией – клетки с высоким уровнем экспрессии c-myc обладают более высокой скоростью деления и укороченной фазой клеточного цикла Go. Помимо этого, увеличение экспрессии c-myc ингибирует дифференцировку многих типов клеток – эритроци- тов, лимфоцитов, нейрональных и жировых клеток, ингибирование же c-myc индуцирует дифференцировку [43]. Гиперэкспрессия гена c-myc способна вызывать злокачественную трансформацию клеток in vivo. Так, активация c-myc происходит при лимфоме Беркитта. При этом обнаруживаются хромосомные транслокации, в результате которых ген c-myc попадает в локус тяжёлых (транслокация t (8, 14)) или лёгких (транслокации t (2, 8) и t (8, 22)) цепей иммуноглобулинов, что способствует его активации [44].
Klf4 (Krueppel-подобный фактор 4) является непосредственным ингибитором белка p53. P53 же, как было показано, является одним из индукторов дифференцировки эмбриональных стволовых клеток. Таким образом, Klf4 способен индуцировать формирование плюрипотентных стволовых клеток путём подавления активности p53. С другой стороны, Klf4 активирует белок p21, что вызывает подавление пролиферации клеток. Эта антипролифератив-ная функция Klf4 может ингибироваться белком c-Myc, который подавляет экспрессию белка p21. Таким образом, для индукции плюрипотентных стволовых клеток необходимо определённое соотношение между экспрессией белков Klf4 и c-Myc [45, 46].
В первом, каноническом эксперименте, гены указанных четырёх факторов вводились в клетку на ретровирусном (лентивирусном) векторе. С одной стороны, интеграция ретровируса в геном обеспечивала стабильную экспрессию факторов индукции, и, соответственно, сравнительно высокую эффективность метода. С другой стороны, при интеграции ретровирусного вектора в геном возникает опасность инсерцион-ного мутангенеза. Более того, было показано, что ассоциированные с вирусом гены либо не всегда полностью инактивируются, либо способны возобновлять свою активность при длительном культивировании клеток или дифференцировке [47].
Анализ транскрипционного профиля выявил наличие иммунного ответа против вирусов, используемых для репрограммирования. Вследствие этого увеличивается содержание реактивных форм кислорода, активируется белок p53, индуцируется апоптоз. Все эти факторы не только уменьшают эффективность перепрограммирования [48], но и делают ретровирусный перенос факторов неприемлемым для медицинских целей. Иными словами, ис- пользование ретровирусных векторов при пе-репрограмировании возможно исключительно для модельных экспериментов.
С целью создания системы, более адекватной задачам регенеративной медицины, для доставки генов Oct4, Sox2, Klf4 и c-Myc группой Яманаки были сконструированы аденовирусные векторы. Аденовирусы не интегрируются в геном клетки-хозяина, вследствие чего отсутствует опасность инсерционного мутагенеза. Для перепрограммирования были использованы эмбриональные гепатоциты мыши. При трансдукции клеток четырьмя различными аденовирусными векторами iPSC получить не удалось, видимо, из-за недостаточной внутриклеточной концентрации всех четырёх факторов [49].
В 2008 году другой группой исследователей была предпринята попытка получения iPSC на основе гепатоцитов взрослой мыши. В серии проведённых ими экспериментов эффективность репрограммирования составила от 0,0001% до 0,001% [50]. Для сравнения можно сказать, что при ретровирусном переносе эффективность индукции составляет от 0,01% до 0,1%. Предполагается, что крайне низкая эффективность индукции iPSC при использовании аденовирусной системы связана с недостаточно длительной экспрессией факторов перепрограммирования. Это предположение подтверждается данными количественной ПЦР, свидетельствующими о резком падении экспрессии аденовирусных генов в делящихся клетках [50]. Таким образом, использование аденовирусных векторов, не интегрирующихся в геном, также не решает проблему пригодных для клинических целей iPSC, поскольку аденовирусная система обладает крайне низкой эффективностью.
Существуют также попытки создания невирусных систем экспрессии факторов перепрограммирования. Так, в 2008 году была создана конструкция с использованием пептида 2А вируса ящура, позволяющая осуществлять экспрессию полицистронных мРНК в ЭС клетках. Были сконструированы две плазмиды, на одной из которых располагались гены Oct4, Klf4 и Sox2, а на другой – ген c-myc. Клетки были успешно трансфецированы полученными конструкциями, причём анализ как с помощью ПЦР, так и с помощью Саузерн-блота подтвердил отсутствие интеграции плазмиды в геном клетки-хозяина. К сожалению, эффективность индукции iPSC также оказалась очень низкой – от 0,0001% до 0,003% [49].
Предполагается, что низкая эффективность индукции плюрипотентности при использовании описанных факторов перепрограммирования вызвана следующими причинами. Во-первых, необходимый для генерации плюрипотентных клеток уровень экспрессии всех четырёх факторов находится в очень узком диапазоне, поэтому лишь небольшая часть клеток, экспрессирующая все четыре фактора на необходимом уровне, способна приобрести свойство плюрипотентности. Так, изменение концентрации фактора Oct4 всего лишь на 50% вместо поддержания плюрипотентного состояния ЭСК индуцирует их дифференцировку [38]. Несмотря на то, что в полученных клонах iPSC РНК Oct4, Sox2, Klf4 и c-Myc гипер-экспрессирована, концентрация этих белков находится на уровне, сравнимом с таковым эмбриональных стволовых клеток. Это позволяет предположить, что iPSC обладают механизмом, осуществляющим регуляцию экспрессии всех четырёх факторов на посттрансляционном уровне.
Предполагается, что для индукции плюрипотентности нужна высокая концентрация факторов, на самообновление же полученных клеток высокая концентрация факторов оказывает ингибирующее действие. Таким образом, лишь очень небольшая часть трансдуциро-ванных клеток удовлетворяет этим свойствам. Во-вторых, возможно, что для более эффективной индукции требуется экспрессия дополнительных факторов [33].
Эффективность индукции iPSC при эпигенетическом программировании может быть увеличена при использовании некоторых низкомолекулярных химических веществ. Для этой цели обычно применяются ингибиторы метилтрансферазы ДНК и ингибиторы деацетилазы гистонов.
У млекопитающих метилирование ДНК представляет собой эпигенетическую модификацию, осуществляющую функциональное подавление (сайленсинг) части генетического материала [51]. Метилирование помогает контролировать транскрипцию генов в клетке. Например, метилирование промоторной части гена почти всегда приводит к подавлению его экспрессии. Показано также, что метилирование ДНК затрудняет перепрограммирование клеток [52]. Использование деметилирующих агентов способствует активации транскрипции генов, участвующих в индукции iPSC, и облегчает перепрограммирование клеток. В качестве ингибитора метилирования обычно используется 5'-азацитидин.
Ацетилирование гистонов – важнейшая модификация, влияющая на степень компактиза-ции хроматина. Известно, что компактизован-ный хроматин (гетерохроматин) функционально неактивен. Предполагается, что ацетилирование остатков лизина в гистонах способствует ослаблению связывания последних с ДНК, что приводит к уменьшению компакти-зации хроматина и, следовательно, облегчению транскрипции генов. Считается, что ацетилирование гистонов является одной из главных причин активации транскрипции генов в клетке. Более того, гистоны целенаправленно ацетилируются на тех промоторах, которые необходимо активировать [53]. Ингибиторы деацетилаз вызывают гиперацетилирование гистонов, что приводит к изменению укладки хроматина и активации соответствующих генов. Ингибиторы деацетилаз гистонов существенно увеличивают эффективность перепрограммирования. Наиболее часто используемыми ингибиторами деацетилаз гистонов являются субе-роиланилид гидроксамовой кислоты (SAHA), трихостатин A и вальпроевая кислота (VPA). Вальпроевая кислота является наиболее активным веществом, увеличивающим эффективность перепрограммирования более чем в 100 раз [54]. Возможно, исключительная эффективность вальпроевой кислоты связана также с наличием других активностей, помимо деацетилирующей. Более того, показано, что в присутствии вальпроевой кислоты возможна эффективная индукция плюрипотентных стволовых клеток при использовании трёх и даже двух факторов перепрограммирования.
При использовании трёх факторов (Oct4, Sox2 и Klf4), введённых в клетку на ретровирусном векторе, эффективность индукции составила ~1 %, а при использовании двух факторов (Oct4 и Sox2) – около 0,005% [55].
Перспективы использования индуцированных плюрипотентных стволовых клеток
Моделирование заболеваний in vitro
Технология iPSC предлагает возможность исследования in vitro молекулярных механизмов различных заболеваний. Для этого необхо- димы: привлечение большого числа пациентов, получение от них клеточного материала, создание линий iPSC и последующая дифференцировка iPSC в клетки, соответствующие тем заболеваниям, которым были подвержены пациенты. Подобная масштабная процедура могла бы обеспечить адекватную лабораторную модель для исследования заболевания, а также осуществления скрининга химических соединений – потенциальных лекарственных препаратов. Для некоторых заболеваний, в частности, спинальной мышечной атрофии и синдрома Ретта не только созданы соответствующие линии клеток путём направленной дифференцировки пациент-специфических iPSC, но и показана возможность терапии заболевания.
Спинальная мышечная атрофия (СМА) – наследственное заболевание, характеризующееся селективным поражением альфа-мотонейронов. СМА является достаточно распроста-нённым аутосомно-рецессивным заболеванием (частота встречаемости – 1:10000 новорожденных). Причиной заболевания являются мутации гена SMN1, приводящие к нарушению синтеза белка SMN. IPSC были созданы путём трансформации фибробластов пациента факторами Oct4, Sox2, Nanog и Lin28. После обработки культуры iPSC ретиноевой кислотой, а также специфическими нейротрофными факторами GDNF и BDNF была получена культура мотонейронов. Было показано, что обработка полученных мотонейронов вальпроевой кислотой и тобрамицином увеличивает внутриклеточное содержание белка SMN [56]. Однако, необходимы дополнительные исследования, направленные на выяснение функциональности полученных мотонейронов и, соответственно, возможности применения полученных данных in vivo .
Синдром Ретта – прогрессивное неврологическое заболевание, вызываемое мутациями гена MeCP2, расположенного в X-хромосоме. Частота встречаемости данного заболевания составляет 1:10000 - 1:15000 новорожденных. Заболевание поражает почти исключительно девочек, поскольку наличие в их генотипе двух X-хромосом обеспечивает им гетерозиготность по данной мутации и, соответственно, выживаемость в процессе внутриутробного развития. IPSC были получены из фибробластов пациенток с синдромом Ретта путём трансформации клеток факторами Oct4, Sox2, Klf-4 и c-Myc. После формирования эмбриоидных тел и их обработки нейротрофными факторами была получена культура нейрональных клеток. Было показано, что обработка полученных нейронов гентамицином увеличивала внутриклеточную концентрацию белка MeCP2, что, в свою очередь, способствовало восстановлению глу-таматэргических синапсов [57].
Фармакологические исследования
Основные средства фармацевтических компаний тратятся на исследования метаболических свойств лекарственных препаратов на этапах доклинических и клинических испытаний. Непредсказуемые воздействия на метаболизм человеческого организма являются одной из главных причин отказа от потенциальных фармацевтических препаратов. При этом одними из главных мишеней токсического поражения являются клетки печени и сердца. Предсказать гепатотоксические и кардиотоксические свойства новых лекарственных препаратов очень сложно, во многих случаях токсический эффект обнаруживается лишь на поздних стадиях клинических испытаний ввиду отсутствия адекватных моделей для исследования in vitro .
Так, в настоящее время не существует ни одной клеточной линии, на которой можно было бы адекватно исследовать метаболизм клеток печени, поскольку все доступные модели представляют собой либо клетки опухолевых линий, либо первичные гепатоциты, полученные с помощью биопсии. При этом обе категории клеток обладают существенными метаболическими ограничениями. Например, показано, что, как в первичных гепатоцитах в культуре, так и в клетках различных линий гепатомы наблюдается падение экспрессии генов цитохромов P450 – важнейших ферментов, отвечающих за метаболизм экзогенных соединений [58]. Применение технологии iPSC могло бы упростить процедуру скрининга лекарственных средств. В настоящее время разработаны способы дифференцировки iPSC в гепатоциты [59] и кардиомиоциты [60]. Тем не менее, для получения чистых линий клеток, полностью соответствующих зрелому фенотипу, требуется дополнительная оптимизация протокола.
Терапевтический потенциал iPSC
Создание пациент-специфических плюрипотентных стволовых клеток является одной из главных задач регенеративной медицины, поскольку iPSC представляют собой потенци- альный ресурс для создания неограниченного количества пациент-специфических клеток для трансплантации. Теоретически использование технологии iPSC могло бы заменить трансплантацию органов. Известно, что для больных с необратимым, прогрессирующим поражением печени трансплантация является единственным радикальным методом лечения [61]. Однако нехватка донорских органов и иммунологическая несовместимость затрудняют повсеместное использование трансплантации печени. Использование культуры аутологичных первичных гепатоцитов также не решает данную проблему, поскольку эти клетки обладают ограниченным пролиферативным потенциалом и пониженной выживаемостью.
Одной из альтернатив могло бы стать применение стволовых клеток гепатоцитов (так называемых «овальных клеток печени»), однако, количество этих клеток в ткани печени очень ограничено, что затрудняет как их выделение, так и масштабное применение [62, 63]. Следовательно, необходимо развивать дополнительные подходы к решению этой проблемы. Таким подходом может явиться создание неограниченного количества пациент-специфичес-ких гепатоцитов на основе iPSC.
В достижении этой цели существуют две основные сложности. Первая из них – разработка технологии эффективной направленной дифференцировки iPSC. В последние годы разработаны различные протоколы получения гепатоцитов из iPSC [64, 65]. Тем не менее, функциональная активность полученных гепатоцитов in vivo остаётся невыясненной. Помимо этого, необходимо установить, какая стадия многоступенчатого процесса дифференцировки гепатоцитов наиболее пригодна для регенерации повреждённой печени. Вторая сложность заключается в очистке полученных дифференцированных клеток от исходных плюрипотентных, поскольку даже незначительная примесь iPSC способна при трансплантации привести к образованию опухоли (тератомы).
IPSC также могут быть использованы для лечения некоторых заболеваний с помощью коррекции генетических дефектов. Принципиальная возможность подобной терапии была продемонстрирована на модели серповидноклеточной анемии мышей [66]. Серповидноклеточная анемия – наследственная гемогло- бинопатия, возникающая в результате мутации в гене бета-субъединицы гемоглобина (бета-глобина). В описанном эксперименте мутантный ген бета-глобина был заменён с помощью гомологичной рекомбинации на ген бета-гло-бина дикого типа. После произведённой генетической коррекции iPSC были подвергнуты направленной дифференцировке в предшественники кроветворных клеток, а затем трансплантированы мышам, страдающим серповидно-клеточной анемией. Дальнейшее исследование подопытных животных выявило, что их физиологические показатели (в частности, уровень содержания ретикулоцитов в крови) сопоставимы с таковыми для животных контрольной группы.
Несмотря на грандиозные перспективы технологии iPSC, SCNT остаётся незаменимым методом, в некоторых случаях более предпочтительным, чем iPSC. Например, SCNT технология более предпочтительна в случае лечения заболеваний, обусловленных митохондриальной наследственностью или в том случае, если соматические клетки пациента содержат мутации в ДНК митохондрий. Кроме того, перепрограммирование ооцита происходит всего лишь в течение нескольких часов, тогда как время, необходимое для получения iPSC, составляет дни или даже недели. Более длительное время индукции может приводить к накоплению нежелательных эпигенетических изменений в клетке. Показано, что iPSC обладают несколько видоизменённым профилем экспрессии генов и метилированием по сравнению с ЭС клетками [67-70], тогда как клетки, полученные в результате SCNT, таких изменений не имеют. Наконец, iPSC обладают остаточными эпигенетическими характеристиками донорных клеток, так называемой «транскрипционной» или «эпигенетической памятью» [68, 71], способной ограничивать их дифференцировочный потенциал. Плюрипотентные же клетки, полученные с помощью SCNT, подобной эпигенетической памятью не обладают [72].
В заключение необходимо отметить, что, хотя искусственное получение плюрипотентных клеток представляет собой многобещающую технологию, необходимы дополнительные многолетние исследования, прежде чем основанные на этой технологии методики можно будет применить в регенеративной медицине.
Список литературы Получение и перспективы применения генетически модифицированных плюрипотентных стволовых клеток
- Lavker R.M., Sun T.T. Epidermal stem cells: properties, markers, and location//Proc Natl Acad Sci USA. 2000. Vol. 97(25). P. 13473-75.
- Uchida N., Buck D.W., He D. Direct isolation of human central nervous system stem cells//Proc Natl Acad Sci USA. 2000. Vol. 97(26). P. 14720-25.
- Vessey C.J., de la Hall P.M. Hepatic stem cells: a review//Pathology. 2001. Vol.33(2). P.30-41.
- Mueller W.E. The stem cell concept in sponges (Porifera): Metazoan traits//Semin Cell Dev Biol. 2006 Vol. 17(4). P. 481-91.
- Bode H.R. The interstitial cell lineage of hydra: a stem cell system that arose early in evolution//J Cell Sci. 1996. V. 109 (6). P. 1155-64.
- Agata K., Watanabe K. Molecular and cellular aspects of planarian regeneration//Semin Cell Dev Biol. 1999. V.10(4). P. 377-83.
- Kuern U., Rendulic S., Tiozzo S. et al. Asexual propagation and regeneration in colonial ascidians//Biol Bull. 2011. V. 221(1). P. 43-61.
- Shukalyuk A.I., Golovnina K.A., Baiborodin S.I. et al. Vasa-related genes and their expression in stem cells of colonial parasitic rhizocephalan barnacle Polyascus polygenea (Arthropoda: Crustacea: Cirripedia: Rhizocephala)//Cell Biol Int. 2007. Vol. 31 (2). P. 97-108.
- Andrews P.W., Matin M.M., Bahrami A.R. et al. Embryonic stem (ES) cells and embryonal carcinoma (EC) cells: opposite sides of the same coin//Biochem Soc Trans. 2005. Vol. 33 (6). P. 1526-30.
- Kleinsmith L.J., Pierce G.B. Multipotentiality of single embryonal carcinoma cells//Cancer Res. 1964. V.24. P. 1544-51.
- Wang N., Trend B., Bronson D.L., et al. Nonrandom abnormalities in chromosome 1 in human testicular cancers//Cancer Res. 1980. Vol. 40 (3). P. 796-802.
- Niwa H. Mouse ES cell culture system as a model of development//Dev Growth Differ. 2010. Vol. 52 (3). P. 275-83.
- Nagy A., Gocza E., Diaz E.M., et al. Embryonic stem cells alone are able to support fetal development in the mouse//Development. 1990. Vol. 110 (3). P. 815-21.
- Lehman J.M. Studies of teratomas in mice: possibilities for the future production of animal models//Am J Pathol. 1980. Vol. 101 (3 Suppl.). P. 33-40.
- Doetschman T.C., Eistetter H., Katz M., et al. The in vitro development of blastocyst-derived embryonic stem cell lines: formation of visceral yolk sac, blood islands and myocardium//J Embryol Exp Morphol. 1985 Vol. 87 (1). P. 27-45.
- Hooper M., Hardy K., Handyside A., et al. HPRT-deficient (Lesch-Nyhan) mouse embryos derived from germline colonization by cultured cells//Nature. 1987. Vol. 326 (6110). P. 292-95.
- Jaenisch R. Transgenic animals. Science. 1988. Vol. 240 (4858). P. 468-74.
- Bronson S.K., Smithies O. Altering mice by homologous recombination using embryonic stem cells//J Biol Chem. 1994. Vol. 269 (44). P. 27155-58.
- Capecchi M.R. The new mouse genetics: altering the genome by gene targeting//Trends Genet. 1989. Vol. 5 (3). P. 70-76.
- Capecchi M.R. Altering the genome by homologous recombination//Science. 1989. Vol. 244 (4910). P. 1288-92.
- Gurdon J.B., Elsdale T.R., Fischberg M. Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei//Nature.1958. Vol. 182 (4627). P. 64-65.
- Elsdale T.R., Gurdon J.B., Fischberg M. A description of the technique for nuclear transplantation in Xenopus laevis//J Embryol Exp Morphol. 1960. Vol. 8. P. 437-44.
- Wilmut I., Schnieke A.E., McWhir J., et al. Viable offspring derived from fetal and adult mammalian cells//Nature. Vol. 385. P. 810-13.
- Wakayama T., Perry A.C., Zuccotti M., et al. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei//Nature. 1998. Vol. 394 (6691). P. 369-74.
- Zhou Q., Renard J.P., Le Friec G., et al. Generation of fertile cloned rats by regulating oocyte activation//Science. 2003. Vol. 302 (5648). P. 1179.
- Polejaeva I.A., Chen S.H., Vaught T.D., et al. Cloned pigs produced by nuclear transfer from adult somatic cells//Nature. 2000. Vol. 407 (6800). P. 86-90.
- Campbell K.H., McWhir J., Ritchie W.A., et al. Sheep cloned by nuclear transfer from a cultured cell line//Nature. 1996. V. 380 (6569). P. 64-66.
- Thomson J.A., Itskovitz-Eldor J., Shapiro S.S. et al. Embryonic stem cell lines derived from human blastocysts//Science. 1998. Vol. 282 (5391). P.1145-47.
- French A.J., Adams C.A., Anderson L.S., et al. Development of human cloned blastocysts following somatic cell nuclear transfer with adult fibroblasts//Stem Cells. 2008. Vol. 26 (2). P. 485-93.
- Hall V.J., Compton D., Stojkovic P., et al. Developmental competence of human in vitro aged oocytes as host cells for nuclear transfer//Hum. Reprod. 2007. Vol. 22 (1). P. 52-62.
- Stojkovic M., Stojkovic P., Leary C., et al. Derivation of a human blastocyst after heterologous nuclear transfer to donated oocytes//Reprod. Biomed. Online. 2005. Vol.11 (2). P. 226-31.
- Chung Y., Bishop C.E., Treff N.R., et al. Reprogramming of human somatic cells using human and animal oocytes//Cloning Stem Cells. 2009. Vol. 11 (2). P. 213-23.
- Takahashi K., Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors//Cell. 2006. Vol. 126 (4). P. 663-76.
- Okamoto K., Okazawa H., Okuda A., et al. A novel octamer binding transcription factor is differentially expressed in mouse embryonic cells//Cell. 1990. Vol. 60 (3). P. 461-72.
- Mitalipov S.M., Kuo H.C., Hennebold J.D., et al. Oct-4 expression in pluripotent cells of the rhesus monkey//Biol. Reprod. 2003. Vol. 69 (6). P. 1785-92.
- Palmieri S.L., Peter W., Hess H., et al. Oct-4 transcription factor is differentially expressed in the mouse embryo during establishment of the first two extraembryonic cell lineages involved in implantation.//Dev Biol. 1994. Vol. 166 (1). P. 259-67.
- Tanaka T.S., Kunath T., Kimber W.L., et al. Gene expression profiling of embryo-derived stem cells reveals candidate genes associated with pluripotency and lineage specificity//Genome Res. 2002. Vol. 12 (12). P. 1921-28.
- Niwa H., Miyazaki J., Smith A.G. Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells//Nat Genet. 2000. Vol. 24 (4). P. 372-76.
- Nichols J., Zevnik B., Anastassiadis K., et al. Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4//Cell. 1998. Vol. 95 (3). P. 379-91.
- Liu K., Lin B., Zhao M. et al. The multiple roles for Sox2 in stem cell maintenance and tumorigenesis//Cell Signal. 2013. Vol. 25 (5). P. 1264-71.
- Rizzino A. Sox2 and Oct-3/4: a versatile pair of master regulators that orchestrate the self-renewal and pluripotency of embryonic stem cells//Wiley Interdiscip Rev Syst Biol. Med. 2009. Vol. 1 (2). P. 228-36.
- Mueller R., Bravo R., Burckhardt J., et al. Induction of c-fos gene and protein by growth factors precedes activation of c-myc//Nature. 1984. Vol. 312 (5996). P. 716-20.
- Luescher B., Eisenman R.N. New light on Myc and Myb. Part I. Myc//Genes Dev. 1990. Vol. 4 (12A). P. 2025-35.
- Cole M.D. The myc oncogene: its role in transformation and differentiation//Annu Rev Genet. 1986. Vol. 20. P. 361-84.
- Rowland B.D., Bernards R., Peeper D.S. The KLF4 tumour suppressor is a transcriptional repressor of p53 that acts as a context-dependent oncogene//Nat Cell Biol. 2005.Vol. 7 (11). P. 1074-82.
- Zhang W., Geiman D.E., Shields J.M., et al. The gut-enriched Kruppel-like factor (Kruppel-like factor mediates the transactivating effect of p53 on the p21WAF1/Cip1 promoter//J Biol Chem. 2000. Vol. 275 (24). P. 18391-98.
- Kane N.M., Nowrouzi A., Mukherjee S., et al. Lentivirus-mediated reprogramming of somatic cells in the absence of transgenic transcription factors//Mol Ther. 2010. Vol. 18 (12). P. 2139-45.
- Mah N., Wang Y., Liao M.C. et al. Molecular insights into reprogramming-initiation events mediated by the OSKM gene regulatory network//PLoS One. 2011. Vol. 6 (8). P. 24351-67.
- Okita K., Nakagawa M., Hyenjong H. et al. Generation of mouse induced pluripotent stem cells without viral vectors//Science. 2008. Vol. 322 (5903). P. 949-53.
- Stadtfeld M., Nagaya M., Utikal J., et al. Induced pluripotent stem cells generated without viral integration//Science. 2008. Vol. 322 (5903). P. 945-49.
- Smith Z.D., Meissner A. DNA methylation: roles in mammalian development//Nat Rev Genet. 2013. Vol. 14 (3). P. 204-20.
- De Carvalho D.D., You J.S., Jones P.A. DNA methylation and cellular reprogramming//Trends Cell Biol. 2010. Vol. 20 (10). P. 609-17.
- Wolffe A.P., Hayes J.J. Chromatin disruption and modification//Nucleic Acids Res. 1999. Vol. 27 (3). P. 711-20.
- Huangfu D., Maehr R., Guo W. et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds//Nat Biotechnol. 2008. Vol. 26 (7). P. 795-97.
- Huangfu D., Osafune K., Maehr R., et al. Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2//Nat Biotechnol. 2008. Vol. 26 (11). P.1269-75.
- Ebert A.D., Yu J., Rose F.F. Jr., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 2009. Vol. 457 (7227). P. 277-80.
- Marchetto M.C., Carromeu C., Acab A., et al. A model for neural development and treatment of Rett syndrome using human induced pluripotent stem cells. Cell. 2010. Vol. 143 (4). P. 527-39.
- Rodriguez-Antona C., Donato M.T., Boobis A., et al. Cytochrome P450 expression in human hepatocytes and hepatoma cell lines: molecular mechanisms that determine lower expression in cultured cells. Xenobiotica. 2002. Vol. 32 (6). P. 505-20.
- Greenbaum L.E. From skin cells to hepatocytes: advances in application of iPS cell technology. J Clin Invest. 2010. Vol. 120 (9). P. 3102-5.
- Dambrot C., Passier R., Astma D., Mummery C.L. Cardiomyocyte differentiation of pluripotent stem cells and their use as cardiac disease models. Biochem J. 2011. Vol. 434 (1). P. 25-35.
- Bataller R., Brenner D.A. Liver fibrosis. J Clin Invest. 2005. Vol. 115 (2). P. 209-18.
- Lazaro C.A., Rhim J.A., Yamada Y., Fausto N. Generation of hepatocytes from oval cell precursors in culture. Cancer Res. 1998. Vol. 58 (23). P. 5514-22.
- Czyz J., Wiese C., Rolletschek A., et al. Potential of embryonic and adult stem cells in vitro. Biol Chem. 2003. Vol. 384 (10-11). P. 1391-1409.
- Song Z., Cai J., Liu Y., et al. Efficient generation of hepatocyte-like cells from human induced pluripotent stem cells. Cell Res. 2009. Vol. 19 (11). P. 1233-42.
- Sullivan G.J., Hay D.C., Park I.H. Generation of functional human hepatic endoderm from human induced pluripotent stem cells. Hepatology. 2010. Vol. 51 (1). P. 329-35.
- Hanna J., Wernig M., Markoulaki S., et al. Treatment of sickle cell anemia mouse model with iPS cells generated from autologous skin. Science. 2007. Vol. 318 (5858) P.1920-23.
- Chin M.H., Mason M.J., Xie W. et al. Induced pluripotent stem cells and embryonic stem cells are distinguished by gene expression signatures//Cell Stem Cell. 2009. Vol. 5 (1). P. 111-23.
- Ghosh Z., Wilson K.D., Wu Y., et al. Persistent donor cell gene expression among human induced pluripotent stem cells contributes to differences with human embryonic stem cells//PLoS One. 2010. Vol. 5 (2). P. 8975-84.
- Doi A., Park I.H., Wen B., et al. Differential methylation of tissueand cancer-specific CpG island shores distinguishes human induced pluripotent stem cells, embryonic stem cells and fibroblasts//Nat Genet. 2009. Vol. 41 (12). P. 1350-53.
- Lister R., Pelizzola M., Kida Y.S., et al. Hotspots of aberrant epigenomic reprogramming in human induced pluripotent stem cells//Nature. 2011. Vol. 471 (7336). P. 68-73.
- Polo J.M., Liu S., Figueroa M.E., et al. Cell type of origin influences the molecular and functional properties of mouse induced pluripotent stem cells//Nat Biotechnol. 2010. Vol. 28 (8). P. 848-855.
- Brambrink T., Hochedlinger K., Bell G., et al. ES cells derived from cloned and fertilized blastocysts are transcriptionally and functionally indistinguishable//Proc. Natl. Acad. Sci. U S A. 2006. Vol. 103 (4). P. 933-38.


