Получение эмульгированного пробиотического препарата Bacillus subtilis и его воздействие на микрофлору кишечника лабораторных крыс
Автор: Скворцов Е.В., Мухаммадиев риШ. С., Мухаммадиев риН. С., Валиуллин Л.Р., Валиуллина Д.А.
Статья в выпуске: 1 т.241, 2020 года.
Бесплатный доступ
Проведены исследования применения новой формы пробиотического препарата Bacillu ssubtilis в виде эмульсии бактерий в пальмитиновой кислоте. При оценке эффективности применения пробиотиков исходили из того, что содержание ДНК бактерий в кале пропорционально их содержанию в кишечнике. Анализ количества ДНК бактерий проводили методом ПЦР в реальном времени. Результаты показали наличие положительного влияния применения эмульгированных бактерий. Это отразилось в увеличении количества B. subtilis в кишечнике и, как следствие, их ДНК в кале крыс. Возрастание количества бактерий B. subtilis сопровождалось снижением численности Bifidobacterium sp., Lactobacillus sp. и E. coli в кишечнике. Показана способность пробиотического препарата бактерий B. subtilis оказывать положительное влияние на скорость роста крыс, отсутствие патогености и токсичности.
Пробиотики, микробное сообщество кишечника, генетический анализ
Короткий адрес: https://sciup.org/142224181
IDR: 142224181 | УДК: 619:615.379.9:579:577.21 | DOI: 10.31588/2413-4201-1883-241-1-187-193
Текст научной статьи Получение эмульгированного пробиотического препарата Bacillus subtilis и его воздействие на микрофлору кишечника лабораторных крыс
Использование пробиотиков в разведении животных становится неотъемлемой частью этого процесса, так как 80 % иммунитета животных зависит от работы кишечника, синтеза витаминов и аминокислот, переваривания пищи и усвоения всех необходимых витаминов и минералов из корма, утилизации продуктов обмена [3]. Между тем, хотя определено, что пробиотики полезны, но результаты сильно варьируются и информация о режиме их действия и влияния на желудочнокишечную микробную экологию ограни- ченная [5]. Даже близкородственные штаммы могут различаться по способу действия [2, 6].
Сделав количественный генетический анализ кала на содержание соответствующих, специфических генов бактерий (количественная полимеразно-цепная реакция (ПЦР)), изучив его динамику можно делать достоверные выводы об эффективности применения пробиотиков.
Особенностью пищеварения моногастричных животных, является то, что в ротовой полости и желудке жиры и жир- ные кислоты практически не перевариваются. Учитывая эти особенности, было решено провести исследования возможности транспорта пробиотических бактерий сквозь желудок в кишечник эмульгированными в пальмитиновой жирной кислоте.
Цель работы – исследование влияния эмульгированного в пальмитиновой кислоте пробиотического препарата Bacillus subtilis на содержание бактерий Bifidobacterium sp., Lactobacillus sp. и E.coli в кишечнике, физиологическое состояние и скорость роста лабораторных крыс.
Материал и методы исследований. Эксперименты выполнены на 60 белых беспородных крысах-самцах. Использовали крысят в начальном возрасте 4 недели массой 80 ± 9г. В работе использовали штамм бацилл Bacillus subtilis (штамм JH 642).
Для получения пробиотического препарата B.subtilis культивировали на L-бульоне до содержания 107 клеток/мл. Эмульгированный препарат получали перемешиванием клеток B. Subtilis с пальмитиновой кислотой. Одну дозу препарата принимали равной 106 клеток B. subtilis.
Рационы кормления крыс и дозы пробиотических добавок B.subtilis представлены в таблице 1.
Опытная группа 1 получала ячмень кормовой с добавками препарата в виде культуральной суспензии и через 1 сутки пальмитиновую кислоту, в количествах, приведенных в таблице 1. Опытная группа 2 получала ячмень кормовой с эквивалентной по количеству клеток B. subtilis добавкой в виде эмульсии в пальмитиновой кислоте. Контрольная группа получала ячмень кормовой с добавкой пальмитиновой кислоты, равной по количеству опытным группам, но без добавок пробиотического препарата. Методом количественной ПЦР анализировали содержание дезоксирибонуклеиновых кислот (ДНК) исследуемых бактерий в образцах кала. С использованием данных интернет ресурса Genbank, программы VectorNTI и интернет ресурса Blast были подобраны высокоспецифичные праймеры и флуорисцентные зонды к гену gyrA (AY663697.1) B. subtilis. Коли- чество ДНК бактерийBifidobacterium sp., Lactobacillus sp.и E.coli определяли с помощью набора реагентов «Колонофлор» (Альфалаб, Россия).
Для исследований методом ПЦР использовали амплификатор с флуоресцентной детекцией в режиме реального времени«Т-100 Real-Time PCR Detection System» (Bio-Rad, США).
Для статистической обработки результатов использовали математический аппарат программы Microsoft Excel. Достоверность различий между сравниваемыми средними величинами устанавливали, используя t-тест Стьюдента; различия считали значимыми при p<0,05.
Результаты исследований. Исследования, проведенные методом количественного ПЦР анализа, показали, что содержание ДНК исследованных бактерий в кале контрольной группы составляет: Bifidobacterium sp. – 8,0-8,5 lg ДНК/грамм, с тенденцией роста в диапазоне 5-10 недели возроста крыс. Количество ДНК Lactobacillus sp.5,5-6,0 lg ДНК/грамм. Количество B. subtilis было стабильным на уровне 1,5-1,8 lg ДНК/грамм на протяжении срока эксперимента, и это в кале контрольной группы, не получавшей пробиотической добавки B. Subtilis (Рис. 1). Такое содержание ДНК данных бактерий мы приняли за базовое, для проведения дальнейшего анализа влияния пробиотических препаратов B. Subtilis на рост и микрофлору кишечника крыс. В настоящее время обсуждается вопрос о том, способны ли живые бактерии проникать дальше желудка и выполнять пробиотическую функцию. Для прояснения этого вопроса был проведен эксперимент с двумя опытными группами крыс. Опытная группа 1, получала ячмень кормовой с добавками препарата B. subtilis в виде культуральной суспензии, и через 1 сутки пальмитиновую кислоту. Опытная группа 2, получала ячмень кормовой с равной с группой 1 по количеству клеток B. subtilis добавкой в виде эмульсии в пальмитиновой кислоте. Контрольная группа получала ячмень кормовой с добавкой пальмитиновой кислоты, равной по количеству опытным группам, но без добавок пробиотического препарата.
Таблица 1 – Рационы кормления и дозы пробиотических добавок B.subtilis
|
Возраст, недели |
Контрольная группа |
Опытная группа 1 |
Опытная группа 2 |
|||
|
ячмень-грамм/с утки |
добавки, 1 раз в начале недели |
ячмень грамм/ сутки |
добавки, 1 раз в начале недели |
ячмень грамм/с утки |
добавки, 1 раз в начале недели |
|
|
5 |
10 |
1 грамм пальмитиновой кислоты |
10 |
1 доза в культуральной суспен зии + 1 грамм паль-мити-новой кис лоты через 1 сутки |
10 |
1 доза в 1 грамме пальмитиновой кислоты |
|
6 |
10 |
– |
10 |
– |
10 |
– |
|
7 |
15 |
1,5 грамма пальмитиновой кислоты |
15 |
1,5 дозы в куль-ту-ральной суспензии + 1,5 грамма-пальмити-новой кислоты через 1 сутки |
15 |
1,5 дозы в 1,5 грам мах паль-мити-новой кислоты |
|
8 |
15 |
– |
15 |
– |
15 |
– |
|
9 |
20 |
2 грамма пальмитиновой кислоты |
20 |
2 дозы в культуральной суспензии + 2 грамма пальмити-новой кислоты через 1 сутки |
20 |
2 дозы в 2 граммах пальмитиновой кислоты |
|
10 |
20 |
– |
20 |
– |
20 |
– |
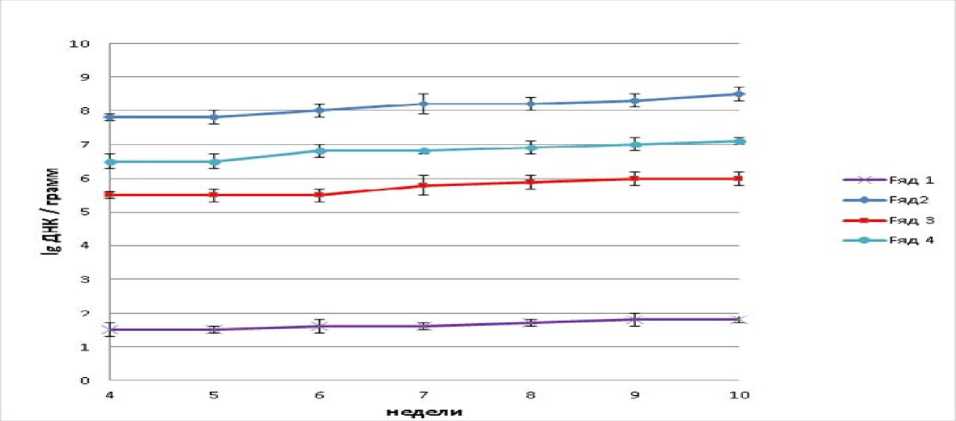
Рисунок 1 – Количество ДНК B. Subtilis (ряд – 1), Bifidobacterium sp. (ряд – 2), Lactobacillus sp. (ряд – 3) и E. coli (ряд – 4) в кале контрольной группы крыс
Время и количество введения в рацион крыс пробиотического препарата приведено в таблице 1. Одна доза препара- та содержала 106 клеток B. subtilis.
Учитывая, особенности пищеварения моногастричных, а именно то, что в ротовой полости жиры не подвергаются химическим изменениям из-за отсутствия липолитических ферментов, а также в желудке содержание липазы крайне низко было решено провести исследования возможности транспорта пробиотических бактерий сквозь желудок в кишечник эмульгированными в пальмитиновой жирной кислоте в качестве защитной среды, предотвращающей контакт живых бактерий с кислотой и протеазами желудка. Контрольная группа и опытная группа 1 получали пальмитиновую кислоту в количествах равных опытной группе 2, но без эмульгированных бактерий, для компенсации ее влияния на рост крыс. Эксперимент проводили с крысами в возрасте 4 недель. Первые экспериментальные данные получили в конце 5 недели возраста крыс. Общая продолжительность эксперимента со- ставила 6 недель. До возраста крыс 10 недель. По окончании каждой недели исследования анализировали содержание ДНК бактерий в кале методом количественного ПЦР анализа.
Полученные цифры опытной группы 1 составили для B. subtilis 1,5±0,1 lg ДНК/г в начале эксперимента и возросли до 4,0±0,2 lg ДНК/гв конце. На фоне роста количества B. subtilis в ходе проведения эксперимента наблюдалось снижение численности Bifidobacterium sp., Lactobacillus sp.и E. сoli в кале опытной группы крыс 1 (Рис. 2).
Результаты исследования опытной группы № 2 составили для B. subtilis 1,5±0,1 lg ДНК/г в начале эксперимента и выросли до 5,1±0,2 lg ДНК/г в конце. Также при росте количества B. subtilis наблюдалось снижение численности.
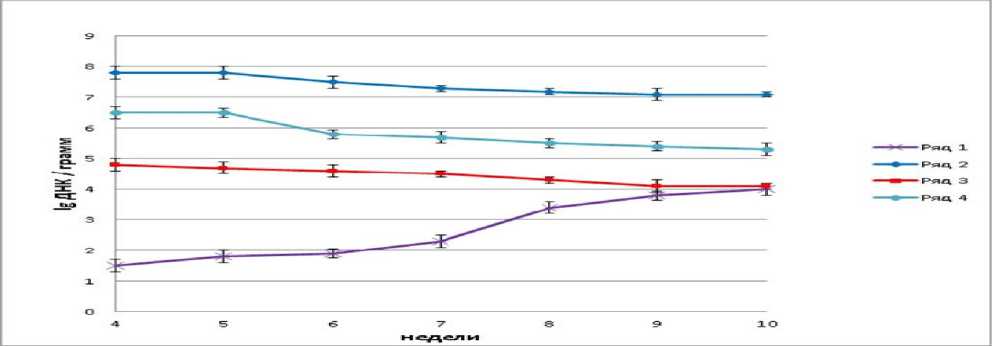
Рисунок 2 – Количество ДНК B. subtilis (ряд – 1), Bifidobacterium sp. (ряд – 2), Lactobacillus sp. (ряд – 3) и E. сoli (ряд – 4) в кале крыс опытной группы № 1
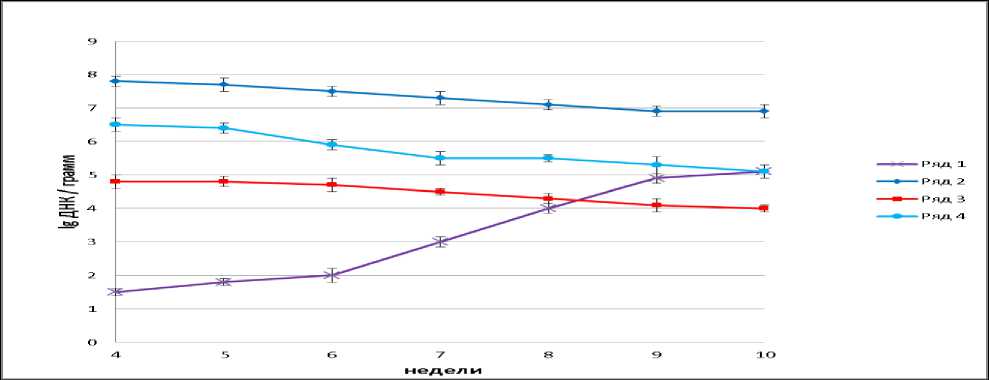
Рисунок 3 – Количество ДНК B. Subtilis (ряд – 1), Bifidobacterium sp. (ряд – 2), Lactobacillus sp. (ряд – 3) и E. сoli (ряд – 4) в кале крыс опытной группы № 2
Таблица 2 – Рост массы крыс в процессе применения препарата B.subtilis
|
Возраст, недели |
Контрольная группа |
Опытная группа 1 |
Опытная группа 2 |
|
4 |
81±2,8 |
81±3,1 |
80±3,0 |
|
5 |
93±3,0 |
95±3,2 |
98±3,2 |
|
6 |
115±3,3 |
123±3,3 |
128±3,2 |
|
7 |
130±3,5 |
154±3,6 |
169±3,4 |
|
8 |
155±3,7 |
168±3,8 |
180±3,8 |
|
9 |
180±4,7 |
199±4,5 |
212±4,2 |
|
10 |
239±4,8 |
264±4,8 |
279±5,1 |
Bifidobacterium sp., Lactobacillus sp. и E. coli в кале крыс опытной группы 2. (Рис. 3). В конце эксперимента у крыс всех групп физическое состояние хорошее. Шерстный покров густой, однородный. Глаза блестящие. Введение препаратов бактерий B. subtilis в кормовой рацион крыс не приводило к развитию вредных влияний и побочных эффектов.
В таблице 2 приведены данные увеличения массы крыс контрольной и экспериментальных групп. Наибольший привес в ходе эксперимента продемонстрировала опытная группа 2, которая принимала эмульгированный препарат B. subtilis. Средний вес крысы в конце эксперимента был равен 279±5,1 грамм. Средняя масса крыс опытной группы 2 в сравнении с контрольной в конце эксперимента была больше на 16,7 %. Несколько меньший привес продемонстрировала опытная группа 1, животные которой принимали препарат B. subtilis в виде водной суспензии в культуральной жидкости. Средний вес крысы в конце эксперимента был равен 264±4,8 грамма. Средняя масса крыс опытной группы 1 в сравнении с контрольной в конце эксперимента была больше на 10,5 %.
ДНК бактерий B. subtilis были обнаружены в кале крыс контрольной группы, хотя данный род бактерий не считается типичным обитателем кишечника. B. subtilis является своего рода транзитной бактерией, постоянно поступающей и выводящейся из пищеварительной системы. Поэтому прижиться в кишечнике B. subtilis не может. Между тем количество B. subtilis было стабильным на уровне 1,5-1,8 lg ДНК/грамм на протяжении срока эксперимента, и это в кале контрольной группы, не получавшей пробиотической добавки B. subtilis (Рис. 1).
При введении в рационы питания крыс препаратов B. subtilis в виде водной суспензии культуральной среды содержание их ДНК в кале увеличивалось. Следовательно, была подтверждена выживаемость бактерий B. subtilis при прохождении желудочно-кишечного тракта в виде водной суспензии. Пальмитиновая кислота давалась опытной группе 1 через сутки после приема пробиотического препарата крысами и не могла повлиять на прохождение желудка бактериями. Пальмитиновую кислоту давали крысам для компенсации ее влияния на их рост (Рис. 2).
При сопоставлении данных опытных групп 1 и 2 видно, что в конце эксперимента в обоих случаях содержание B. subtilis в кале возросло, но без применения пальмитиновой эмульсии оно увеличилось до 4,0±0,2 lg ДНК/г, а с применением – до 5,1±0,2 lg ДНК/г (Рис. 3). Это говорит о наличии положительного влияния применения эмульгированных в пальмитиновой кислоте бактерий на их выживаемость при прохождении желудочно-кишечного тракта. Пальмитиновая кислота защищает вегетативные клетки B.subtilis от агрессивных условий желудка и высоких концентраций желчи в двенадцатиперстной кишке в процессе пищеварения.
Отмечено ускорение роста крыс при добавлении в корм пробиотических препаратов B. subtilis. Средняя масса крыс опытной группы 2 в сравнении с контрольной в конце эксперимента была больше на 16,7 %. Средняя масса крыс опытной группы 1 в сравнении с контрольной в конце эксперимента была больше на 10,5 %. Причем ускорение роста крыс наблюдалось даже при некотором снижении численности Bifidobacterium sp. и Lactobacillus sp. в кале опытных групп крыс. Хотя по данным ряда источников [1, 4] уменьшение бифидобактерий и молочнокислых бактерий в кишечнике приводит к ухудшению процессов пищеварения и развитию болезнетворной микрофлоры. Это означает, что B. subtilisспособен функционально замещать эти бактерии в кишечнике без негативных последствий для пищеварения.
Заключение. Таким образом, можно сделать выводы, что результаты исследования показали способность пробиотического препарата бактерий B. subtilis оказывать положительное влияние на рост лабораторных крыс, отсутствие патогености и токсичности. Возрастание количества бактерий B. subtilis сопровождалось снижением численности Bifidobacterium sp. и Lactobacillus sp. и E. сoli в кишечнике. Проведены исследования применения новой формы пробиотического препарата в виде эмульсии бактерий B. subtilis в пальмитиновой кислоте. Результаты показали наличие положительного влияния применения эмульгированных бактерий на их выживаемость при прохождении желудочно-кишечного тракта. Это отразилось в увеличении их количества в кишечнике и как следствие в кале крыс. То есть эмульгированные бактерии обладают резистентностью к низким значениям рН желудка и высоким концентрациям желчи в двенадцатиперстной кишке. Это означает, что эмульгированные препараты B. subtilis проявляют признаки эффективных пробиотиков и могут быть рекомендованы для применения в животноводстве.
Резюме
Проведены исследования применения новой формы пробиотического препарата Bacillu ssubtilis в виде эмульсии бактерий в пальмитиновой кислоте. При оценке эффективности применения пробиотиков исходили из того, что содержание ДНК бактерий в кале пропорционально их содержанию в кишечнике. Анализ количества ДНК бактерий проводили методом ПЦР в реальном времени. Результаты показали наличие положительного влияния применения эмульгированных бактерий. Это отразилось в увеличении количества B. subtilis в кишечнике и, как следствие, их ДНК в кале крыс. Возрастание количества бактерий B.
subtilis сопровождалось снижением численности Bifidobacterium sp., Lactobacillus sp. и E. coli в кишечнике. Показана способность пробиотического препарата бактерий B. subtilis оказывать положительное влияние на скорость роста крыс, отсутствие патогености и токсичности.
Список литературы Получение эмульгированного пробиотического препарата Bacillus subtilis и его воздействие на микрофлору кишечника лабораторных крыс
- Амерханова А.М. Морфологическая изменчивость микроорганизмов рода Bifidobacterium / А.М. Амерханова // Здоровье населения и среда обитания. - 2012. - №12. - С. 35.
- Грязнева, Т.Н. Биологически активные вещества, продуцируемые бактериями рода Bacillus / Т.Н. Грязнева, // Лечащий врач. - 2013. - № 4. - С.54-63.
- Дементьев, Е.П. Влияние аэроионизации и пробиотика "лактобактерин" на микроклимат телятника, гематологические показатели и интенсивность роста телят / Е.П. Дементьев, Ж.В. Лободина, Е.В. Цепелева // Международный журнал-экспериментального образования. - 2015. -Т. 11. - № 1. - С. 113-155.
- Функ, И.А. Биотехнологический потенциал бифидобактерий / И.А. Функ, А.Н. Иркитова // Acta Biologica Sibirica. -2016. - Т. 2. - № 4. - С.67-79.
- Ajuwon, K. Toward a better understanding of mechanisms of probiotics and prebiotics action in poultry species / K. Ajuwon //Journal of Applied Poultry Research. - 2015. - № 25. - С. 277-283.
- Fioramonti, J. Probiotics: what are they? What are their effects on gut physiology? / J. Fioramonti, V. Theodorou, L. Bueno // Best Practice and Research Clinical Gastroenterology. - 2003. - № 17. - С. 711-724.


