Получение рекомбинантного антигена для серологической диагностики бруцеллеза
Бесплатный доступ
Бруцеллез сельскохозяйственных животных представляет собой одну из наиболее значимых проблем в сфере практической ветеринарии. Своевременное выявление и изоляция инфицированных животных являются критически важными для предотвращения распространения данной инфекции и обеспечения эпизоотического благополучия хозяйства. Диагностические исследования при бруцеллезе в большинстве своем основаны на серологических методах, таких как реакция связывания комплемента и иммуноферментный анализ (ИФА). Целью исследования являлось получение рекомбинантного антигена возбудителей бруцеллеза и изучение его серологической активности в непрямом твердофазном ИФА. В результате анализа иммуногенных эпитопов белков возбудителя бруцеллеза выполнен дизайн антигена, нуклеотидная последовательность которого была клонирована в составе экспрессирующей конструкции на основе вектора pET28а(+). Сконструированный рекомбинантный антиген бруцеллеза был успешно синтезирован в культурах бактериального штамма-продуцента и очищен с применением метода аффинной хроматографии. Полученный препарат использовали в разведении 10 мкг/мл в качестве антигена при проведении непрямого твердофазного ИФА для выявления антител против бруцеллеза. По результатам ИФА установлено, что рекомбинантный антиген проявлял серологическую активность в отношении противобуцеллёзных А-, Sи М-антител. Коэффициент специфичности рассчитывали относительно данных ИФА с сывороткой крови в разведении 1:128. Так, для рекомбинантного антигена при реакции с сывороткой крови крупного рогатого скота против Brucella abortus коэффициент специфичности составил 3,5, B. melitensis – 5,5, S антигена бруцелл – 14,25, R антигена – 0,75. Таким образом, разработанный антиген показал большой потенциал для применения в серологических реакциях для индикации антител против возбудителей бруцеллёза, для которых характерен рост в S-форме бактериальных колоний.
Бруцеллез, ИФА, диагностика, крупный рогатый скот, эпитоп, антиген
Короткий адрес: https://sciup.org/142246298
IDR: 142246298 | УДК: 579.841.93:616-07:61-097 | DOI: 10.31588/2413_4201_1883_3_263_100
Текст научной статьи Получение рекомбинантного антигена для серологической диагностики бруцеллеза
Несвоевременное выявление инфицированных животных приводит к заражению здорового поголовья и обуславливает стойкое неблагополучие хозяйства по бруцеллезу [2]. Эпизоотическая ситуация по бруцеллезу в Российской Федерации остается напряженной, особенно в Северо-Кавказском, Южном, Сибирском и Приволжском федеральных округах [3].
Одними из основных методов диагностики бруцеллеза являются серологические – реакция связывания комплемента (РСК), иммуно-ферментный анализ (ИФА), Роз-Бенгал проба (РПБ) [4]. Во многих серологических тест-системах в качестве антигена используются липополисахариды (ЛПС) клеточной стенки, однако, при использовании ЛПС-антигена встречаются перекрёстные реакции с антигенами других грамотрицательных бактерий [5]. Также на практике часто бывает необходимость дифференциации иммунизированных животных от естественно инфицированных особей. Применение современных серологических тестов, позволяющих различать поствакцинальные антитела от антител, возникающих в результате инфекции, в сочетании с регулярной профилактической иммунизацией, обеспечит возможность контроля и ликвидации бруцеллеза [6].
В последние годы в серологической диагностике инфекционных болезней животных с успехом применяются рекомбинантные антигены (искусственно созданные аминокислотные последовательности участков различных белковых молекул исследуемого возбудителя), которые имеют следующие преимущества: отсутствие необходимости культивирования вирулентного патогена; стандартизация анализа [7]; дифференциация поствакцинальных антител от антител естественно инфицированных животных [8], физико-химическая стабильность, возможность использования большего разнообразия потенциальных мишеней [9]. Таким образом, можно предположить, что применение рекомбинантных антигенов в серологических тестах повысит качество диагностики бруцеллёза и специфичность метода.
Целью исследования являлось получение рекомбинантного антигена возбудителей бруцеллеза и изучение его серологической активности в непрямом твердофазном ИФА.
Для наработки антигена разработанным плазмидным вектором трансформировали компетентные клетки Escherichia coli штамма DH5α с применением хлористого кальция, методом теплового шока, согласно протоколу F.M. Ausubel (2003) [10]. Культуру трансформированных клеток, содержащих модифицированную плазмиду с интегрированным геном, культивировали в 100 мл жидкой питательной среде LB (Lysogeny broth) с добавлением канамицина (20 мкг/мл). Выделение плазмидной ДНК из клеток E. coli осуществляли набором MiniPrep (ЗАО «Евроген», Россия), в соответствии с инструкцией производителя. Концентрацию выделенной плазмиды измеряли с помощью спектрофотометра UV5Nano (Mettler Toledo, США). Трансформацию компетентных клеток E. coli штамма BL21(DE3) осуществляли по аналогии с клетками штамма E. coli DH5α, следуя протоколу F.M. Ausubel (2003) [10]. После получения продуктов экспрессии и трансляции была проведена металл-аффинная хроматография антигена с применением сорбента на основе Ni2+-сефарозы. Концентрацию белка в препарате антигена бруцеллеза определяли с использованием спектрофотометра UV5Nano (Mettler Toledo, США).
В работе использовали сыворотку крови крупного рогатого скота против B. abortus, B. melitensis , а также S и R антигены бруцелл, входящие в состав набора для дифференциальной серологической диагностики бруцеллеза и контроля иммунного ответа крупного рогатого скота, иммунизированного вакциной из штамма B. abortus 82. В качестве отрицательного контрольного образца (ОКО) применяли сыворотку крови не инфицированного бруцел-лами крупного рогатого скота (из того же диагностического набора).
В качестве конъюгата антивидовых антител использовали коммерческий препарат ан-тивидового иммунопероксидазного конъюгата против IgG крупного рогатого скота в разведении 1:20000 («Sigma», США). Постановку способа ИФА на основе сконструированного антигена проводили по методике, опубликованной ранее [11]. Для определения минимального титра антител сыворотки вносили в объеме 4 мкл в первые лунки планшета в разведении 1:25 на ФБР и титровали методом последовательных двукратных разведений (последнее разведение 1:256). В процессе тестирования сывороток в одном разведении в качестве рабочего использовали разведение 1:25. Коэффициент специфичности определяли, как отношение значения оптической плотности, полученного в реакции с каждым наименованием сыворотки (отдельно, с A, S, M, R антителами) к значению оптической плотности полученного в реакции с отрицательным контролем.
Результаты и обсуждение . По результатам запроса информации в базе данных было выявлено девять иммуногенных эпитопов бруцелл. Детальный BLAST-анализ каждого иммуногенного эпитопа позволил для дальнейшей работы отобрать лишь три – qwallpylf (126905), avnaatynr (IEDB ID 92377) антиген Leucine-binding protein domain-containing protein (UniProt:A9MD94) и etvwpffy (92626). Анализ наличия сигнальных пептидов в полных аминокислотных последовательностях для отобранных антигенов показал, что в последовательности антигена «Leucine-binding protein domain-containing protein» на позициях 27-28 а.а. обнаружен сигнальный пептид, действующий по механизму Sec/SPI, что теоретически увеличивает его иммунный потенциал.
В линейном выражении аминокислотная последовательность трех применяющихся иммуногенных эпитопов была следующей qwall-pylfavnaatynretvwpffya, и характеризовалась соответствующими физическими свойствами: число аминокислот 27, молекулярная масса 3252.67 г/М, коэффициент экстинкции 15220 М-1см-1, изоэлектрическая точка возникает при pH = 6.53, суммарный заряд при нейтральном pH = 0, пептид плохо растворим в воде. Для повышения физико-химических свойств антигена была проведена его модификация. В структуру антигена было добавлено девять гидрофильных аминокислот из последовательности нитрат редуктазы, последовательность mkktaiaiavalagfatvaqa сигнального пептида Sec E. coli, а также комбинация нейтральных и гидрофильных аминокислот и гистидиновый тэг, к С-концу молекулы, что позволит обеспечить удобную и эффективную очистку. В результате изменения антиген приобрёл следующую аминокислотную последовательность: mkktaiaiavalagfatvaqahwkesqwallpylfadlkerierav naatynreraereygsetvwpffyagtqrdsihhhhhh. По результатам анализа разработанного антигена проведенном на пептидном калькуляторе установлено, что молекулярный вес аминокислотной последовательности, состоящий из 84 аминокислот, равен 9718.82 г/М, коэффициент экстинкции — 22190 М-1см-, изоэлектрическая точка достигается при pH = 9,11, суммарный заряд при нейтральном pH = 1,7, пептид плохо растворим в воде.
Следует отметить, что в полученной аминокислотной последовательности нет цистеинов, что свидетельствует об отсутствии формирования дисульфидных мостиков, негативно влияющих на конформацию и растворимость белка.
Для получения желаемой аминокислотной последовательности на прокариотическом продуценте была проведена кодонная оптимизация и перевод её из аминокислотной последовательности в нуклеотидную с учётом вида продуцента и добавлением кодона, останавливающего синтез белка. В результате была получена следующая последовательность: «atgaagaagactgccatcgccatcgccgtagcgttggcaggctttg caacggtcgcacaagcccactggaaggagagtcaatgggctttgtt accatatttgttcgctgacctgaaagagcgtattgagcgtgcagtgaa cgcagcaacttacaaccgtgaacgtgcagaacgtgagtacggtagc gagacagtctggccattcttctatgcaggtacccagcgtgattctattc atcaccatcatcaccattga». Длина данной последовательности составила 255 п.н. Затем она была вставлена в плазмидный вектор pET28a(+).
Далее осуществляли наработку разработанной плазмиды следующим образом. В начале провели трансформацию плазмиды в клетки E. coli . Затем выполнили селекцию трансформированных бактериальных клеток по гену устойчивости к ка-намицину. Визуально результат продуцента рекомбинантного антигена представлен на рисунке.
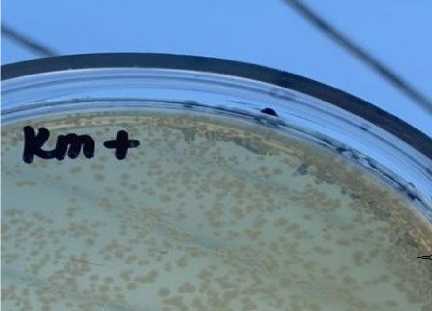
а)
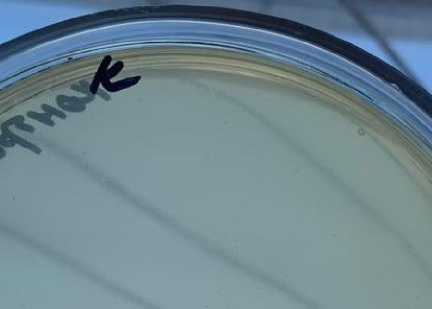
б)
Рисунок – Рекомбинантный антиген, сконструированный для выявления антител против бруцеллёза: а – рост бактериальных клеток, продуцентов рекомбинантного антигена на среде с селективным антибиотиком; б – отсутствие роста нетрансформированных бактериальных клеток на среде с селективным антибиотиком
К числу важнейших требований, предъявляемых к диагностическим антигенам, относится высокое качество применяемого антигенного материала. После получения продуктов экспрессии и трансляции проводили атмосферную аффинную хроматографическую очистку антигенов. Концентрация белка в препаратах антигена бруцеллеза составила 5,0 мг/мл. Полученный препарат был использован в разведении 10 мкг/мл в качестве антигена при проведении непрямого твердофазного ИФА для выявления антител против бруцеллеза. Результаты серологических реакций рекомбинантного антигена с сыворотками крупного рогатого скота, содержащими / не содержащими антитела против возбудителя бруцеллёза представлены в таблице.
Из представленных в таблице данных видно, что рекомбинантный антиген проявлял серологическую активность в отношении про-тивобуцеллёзных А-, S- и М-антител, в отношении R-антител такой активности не наблюдалось. Коэффициент специфичности рассчитывали относительно данных ИФА с сывороткой крови в разведении 1:128. Так для рекомбинантного антигена при реакции с сывороткой крови крупного рогатого скота против B. abortus коэффициент специфичности составил 3,5, B. melitensis – 5,5, S антигена бруцелл – 14,25, R антигена – 0,75.
Таблица - Результаты серологических реакций рекомбинантного антигена с сыворотками крупного рогатого скота
|
Разведение |
ОП сывороток крови μ± sd |
||||
|
A |
S |
M |
R |
ОКО |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
1:2 |
0,63±0,16 |
1,19±0,15 |
0,70±0,16 |
0,05±0,13 |
0,066±0,07 |
|
1:4 |
0,52±0,11 |
1,16±0,12 |
0,72±0,16 |
0,05±0,11 |
0,046±0,13 |
|
1:8 |
0,50±0,13 |
0,94±0,07 |
0,46±0,07 |
0,07±0,12 |
0,06±0,13 |
|
1:16 |
0,35±0,10 |
1,00±0,05 |
0,44±0,12 |
0,07±0,09 |
0,04±0,05 |
|
1:32 |
0,29±0,08 |
0,93±0,10 |
0,38±0,11 |
0,05±0,15 |
0,04±0,14 |
|
1:64 |
0,27±0,15 |
0,77±0,15 |
0,32±0,13 |
0,06±0,18 |
0,04±0,12 |
Продолжение Таблицы
|
1 |
2 |
3 |
4 |
5 |
6 |
|
1:128 |
0,14±0,12 |
0,57±0,09 |
0,22±0,08 |
0,03±0,14 |
0,04±0,17 |
|
1:256 |
0,10±0,09 |
0,32±0,03 |
0,14±0,05 |
0,05±0,03 |
0,05±0,06 |
Примечание: A – сыворотка крови крупного рогатого скота против B. abortus; S – сыворотка крови крупного рогатого скота против S антигена бруцелл; М – сыворотка крови крупного рогатого скота против B. melitensis; R – сыворотка крови крупного рогатого скота против R антигена бруцелл .
Таким образом, разработанный антиген показал большой потенциал для применения в серологических реакциях для индикации антител против возбудителей бруцеллёза, для которых характерен рост в S-форме бактериальных колоний.
Выводы. В результате анализа иммуногенных эпитопов белков возбудителя бруцеллеза выполнен дизайн антигена со следующей аминокислотной последовательностью «mkktaiaia valagfatvaqаhwkesqwallpylfadlkerieravnaatynre-raereygsetvwpffyagtqrdsihhhhhh». Сконструированный антиген характеризовался оптимальными физико-химическими показателями, такими как растворимость, коэффициент экстинкции, а также расчётными значениями рН и изоэлектрической точки молекулы. Созданная аминокислотная последовательность была переведена в нуклеотидную и клонирована в состав экспрессирующей конструкции на основе вектора pET28а(+). Установлено, что рекомбинантный антиген бруцеллеза может быть успешно произведен в культурах бактериального штамма-продуцента и очищен с использованием метода аффинной хроматографии. Полученный препарат был использован в разведении 10 мкг/мл в качестве антигена при проведении непрямого твердофазного ИФА для выявления антител против бруцеллеза. По результатам ИФА установлено, что коэффициент специфичности антигена при реакции с сывороткой крови крупного рогатого скота против B. abortus составил 3,5, B. melitensis - 5,5, S и R антигенов - 14,25 и 0,75 соответственно. Разработанный антиген показал большой потенциал для применения в серологических реакциях для индикации антител против возбудителей бруцеллёза, для которых характерен рост в S-форме бактериальных колоний.


