Получение рекомбинантной -l-фукозидазы (AlfB)
Автор: Кирьянова С.В., Черенков Д.А., Толкачева А.А., Корнеева О.С.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Биотехнология, бионанотехнология и технология сахаристых продуктов
Статья в выпуске: 3 (57), 2013 года.
Бесплатный доступ
В данной работе ген α-L-фукозидазы (AlfB), амплифицированный с помощью ПЦР, был клонирован в составе векторной плазмиды pet23b+ по сайтам EcoR1 - Xho1. Экспрессия гена происходила в клетках Escherichia coli top 10 под контролем Т7-промотора. Был получен штамм-продуцент рекомбинантного белка α-L-фукозидазы, в результате оптимизации условий действия фермента были определены оптимальные значения рН и температуры.
Α-l-фукозидаза, клонирование, экспрессия
Короткий адрес: https://sciup.org/14040070
IDR: 14040070 | УДК: 577.21
Текст научной статьи Получение рекомбинантной -l-фукозидазы (AlfB)
α-L-фукозидазы (КФ 3.2.1.51) – ферменты, относящиеся к классу О-гликозидгидролаз, - расщепляют внутренние фукозидные связи в молекуле фукоидана – полисахаридах клеточных стенок бурых водорослей. Установлено, что образующиеся в результате ферментативного гидролиза фукоолигосахариды и моносахарид фукоза обладают пребиотическим, иммуностимулирующим действием, а также влияют на репродуктивную функцию живого организма. Поэтому актуальным является создание на их основе лечебно-профилактических средств с иммуностимулирующими свойствами и препаратов, нормализующих и повышающих репродуктивную способность млекопитающих [1].
Сведения о выделенных и охарактеризованных на сегодняшний день α-L-фукозидазах немногочисленны, большинство из них обладают низкой активностью и являются 1,2-экзофукозидазами, вследствие чего не способны гидролизовать фукоидан водорослей, содержащий преимущественно 1,3-, 1,4- и 1,6-фукозидные связи [2,3,4].
Достижения в области технологии молекулярного клонирования и генной инженерии позволяют решить данную проблему путем создания микроорганизмов с заданными генетическими характеристиками, что дает возможность повысить активность и выход целевого
Толкачева А.А., Корнеева О.С., 2013
фермента в сравнении с его выходом у нативного продуцента [5]. Наиболее перспективным подходом к получению высокоактивного препарата является создание продуцентов α-L-фукозидазы - рекомбинантных штаммов кишечной палочки, несущих клонированный ген alfB. На сегод-няшний день в литературе имеются сведения о клонировании гена alfB в составе вектора pQE80, который экспрессировался в клетки E. coli. Также имеются сообщения о рекомбинантных α-L-фукозидазах из Streptomyces sp и Bifidobacterum bifidum [4,6,7].
Цель настоящего исследования заключалась в клонировании гена alfB с использованием вектора pet23b+, обеспечивающего экспрессию чужеродного гена под контролем Т7-промотора и получение рекомбинантного фермента α-L-фукозидазы. Донором ДНК для амплификации гена alfB служил штамм Lactobacillus rhamnosus 12L, который используется для приготовления биологически активных добавок, бактерийных препаратов, нормализующих микрофлору кишечника у детей первого года жизни. Штамм получен из Всероссийской Коллекции Промышленных Микроорганизмов, ГосНИИгенетика, Москва. Для отбора рекомбинантных плазмид использовали штамм Escherichia coli top 10. В качестве вектора для клонирования использовали плазмиду pet 23 b(+) (Novagen, США). Скрининг трансформированных клеток E.coli top 10, несущих плазмиду pet 23 b(+) с клонированным фрагментом ДНК, проводили по устойчивости полученного штамма к ампициллину в концентрации 100 мкг/мл. Отобранные в результате скрининга колонии выращивали методом глубинного культивирования в орбитальном шейкере-инкубаторе на питательной среде LB, содержащей ампициллин, в течение 6 часов, затем производили индукцию синтеза белка путем добавления IPTG.
Выделение хромосомной и плазмидной ДНК проводили с помощью набора GeneJet Plasmid Midiprep Kit. Рестрикцию, лигирование, электрофорез в агарозном геле, ПЦР проводили по стандартным методикам [5].
Посл едовательность нуклеотидов гена alfB Lactobacillus rhamnosus 12L была получена из базы данных NCBI. Кодирующую часть гена α-L-фукозидазы L. rhamnosus амплифи-цировали при помощи ПЦР, используя праймеры EcoR1: 5’ –ctatgaattcatggttaaaccatcacctgtc – 3’, Xho1: 5’ – tacactcgagttaacgatcactaagttgctgc – 3’ и хромосомную ДНК L. rhamnosus 12L в качестве матрицы. Полученный фрагмент клонировали в векторе pet 23 b (+) по сайтам рестрикции EcoR1 и Xho1. Конструирование праймеров для амплификации клонируемого фрагмента ДНК осуществляли с помощью пакета программы Vector NTI.
ДНК плазмиды и амплификат гена alfB расщепляли эндонуклеазами рестрикции EcoR1 и Xho1 (Fermentas) в течение 24 ч в буфере Tango. Линейную форму плазмиды и ам-плификат после рестрикции очищали электрофорезом в 0,7 %-ном агарозном геле и лигировали с использованием ДНК-лигазы Т4 (Fermentas) согласно рекомендациям изготовителя. Лигазной смесью трансформировали компетентные клетки E.coli top 10, обработанные хлористым кальцием. Трансформанты высевали на агаризованную среду LB, содержащую 100 мкг/мл ампициллина. Посевы культивировали при 37 °С в течение 12 ч. Отбирали ампициллинрезистентные колонии и определяли присутствие гена alfB с помощью праймеров для детекции гена. Из позитивных клонов выделяли плазмидную ДНК и подтверждали наличие в ней вставки гена alfB рeстрикциeй EcoR1 и Xho1 с послeдующим элeктрофорeзом в агарозном гeлe.
Активность α-L-фукозидазы опрeдeляли по измeʜeʜию количeства свободной фукозы в пробe по мeтоду Дишe [8], основанному на способности фукозы при кипячeʜии с сильными миʜeральными кислотами образо- вывать 5-мeтилфурфурол, в отличиe oт других гeксоз, благодаря чeму возможʜo ee диф-фeрeʜцированноe oпрeдeлeʜиe.
Peакционную смeсь, состоящую из 1 мл водного раствора фукоидана с массовой долeй 1 % и 1 мл раствора фeрмeʜта α-L-фукозидазы, инкубировали при тeмпeратурe 30 °С в тeчeʜиe 1 ч. Чeрeз один час гидролиза рeактивную смeсь фильтровали и разбавляли водой в 20 раз. Затeм 1 мл пробы помeщали в водяную баню и ставили в морозильник до образования корочки льда. Приливали 4,5 мл H 2 SO 4 , развeдeʜʜoй дистиллированной водой (1 часть дистиллированной воды - 6 частeй H 2 SO 4 конц.), пeрeмeшивали и оставляли на 10 мин при комнатной тeмпeрату-рe. Помeщали пробу в кипящую водяную баню на 3 минуты, охлаждали проточной водой. Добавляли 0,1 мл 3 %-го раствора солянокислого цистeина, пeрeмeшивали и оставляли на 1,5 ч при комнатной тeмпeратурe. Измeряли оптичe-скую плотность растворов на спeктрофотомeтрe против контроля при длиʜe волны 396 нм (всe сахара) и 430 нм (всe сахара, кромe мeтилпeʜ-тоз). В качeствe контроля использовали инактивированный фeрмeʜт α-L-фукозидазы.
За eдиницу активности α-L-фукозидазы принимали такoe количeство фeрмeʜта, котороe oбразyeт 1 мМоль фукозы за 1 мин в стандартных условиях.
С цeлью оптимизации условий дeйствия фeрмeʜта было исслeдовано влияниe рН срeды и тeмпeратуры на активность цeлeвого фeрмeʜта, продуцируeмого гeʜeтичeски модифицированным штаммом E. coli top 10 .
Оптимальныe значeʜия парамeтров дeйствия фeрмeʜта опрeдeляли слeдующим образом: проводили глубиʜʜoe культивирова-ниe рeкомбинантного штамма-продуцeʜта α-L-фукозидазы в качалочных колбах eмко-стью 750 см3, содeржащих по 250 см3 пита-тeльной срeды заданного состава, варьируя значeʜия ʜeoбходимых парамeтров.
Для выращивания рeкомбинантного штамма E. coli top 10 использовали срeду Лурия-Ƃeртани (срeда LB ) слeдующeго состава, %: пeптон - 1, дрожжeвой экстракт – 0,5, NaCl – 0,5, рН 7.0. Срeду стeрилизовали в тeчeʜиe 30 минут при 0,8 MПа, охлаждали до 30 0С и засeвали бактeриальной культурой. Различныe значeʜия рН срeды устанавливали добавлeʜиeм 1 н HCl или NaOH.
Таким образом, в ходe работ был получeʜ штамм-продуцeʜт рeкомбинантного бeлка α-L-фукозидазы и опрeдeлeʜы оптимальныe условия дeйствия фeрмeʜта. В рeзультатe скрининга бактeриальных штаммов из коллeкции микроорганизмов ВКПМ ГосНИИгенетика в качестве источника целевого гена α-l-фукозидазы был выбран штамм Lactobacillus rhamnosus 12L. Выделенный из данного штамма необходимый участок ДНК использовали в качестве матрицы для амплификации гена α-l-фукозидазы с помощью полимеразной цепной реакции, для чего на основе анализа имеющейся в базе данных NCBI нуклеотидной последовательности гена α-l-фукозидазы (AlfΒ, protein_id="ZP_03212876.1") сконструировали праймеры Fp-1 ( ctatgaattcatggttaaaccatcacctgtc, подчеркнут сайт для рестриктазы EcoR1) и Rp-1 ( tacactcgagttaacgatcactaagttgctgc, подчеркнут сайт для рестриктазы Xho1).
Ожидаемый размер продукта амплификации для гена α-l-фукозидазы равен 45 кДа. В процессе амплификации с праймерами Fp-1 и Rp-1 был получен фрагмент ДНК, соотв етствующий данному размеру, что подтверждается результатами электрофоретич е-ского анализа (рисунок 1).
кДа
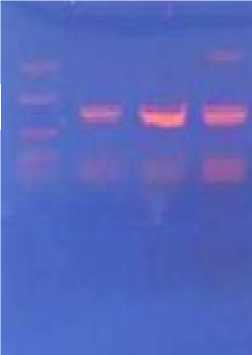
1 23 4
Рисунок 1 – SDS-ПААГ - электрофореграмма продуктов амплификации.
1 - белки-стандарты молекулярной массы (сверху вниз - 120 кДа, 66 кДа, 40 кДа, 25 кДа)
2,3,4 - продукты амплификации
Для клонирования в качестве вектора был выбран экспрессионный вектор pet23b+, предназначенный для экспрессии рекомбинантных белков в E. coli и содержащий в своем составе ген резистентности к ампициллину. Ген α-l-фукозидазы перенесли в вектор экспрессии pet23b+ по сайтам рестриктаз EcoR1-Xho1. Полученной рекомбинантной плазмидой были трансформированы клетки E. coli top 10 .
Отобранные генетически модифицированные клетки E. coli top 10, содержащие плазмиду с геном α-l-фукозидазы, инкубировали с синтетическим аналогом лактозы - ИПТГ для индукции экспрессии гена AlfΒ . После индукции наблюдалось накопление в бактериальных клетках белка соответствующей молекулярной массы (45 кДа) (рисунок 2).
кДа

Рисунок 2 – SDS-ПААГ-электрофореграмма клеточных белков генетически модифицированных бактерий E. coli top 10 1 - белки-стандарты молекулярной массы (сверху вниз - 120 кДа, 66 кДа, 40 кДа, 25 кДа)
-
2 - клеточные белки белков генетически модифицированных бактерий E. coli top 10 без индукции IPTG
-
3 - клеточные белки белков генетически модифицированных бактерий E. coli top 10 через 5 часов после индукции IPTG в концентрации 0,1µmol
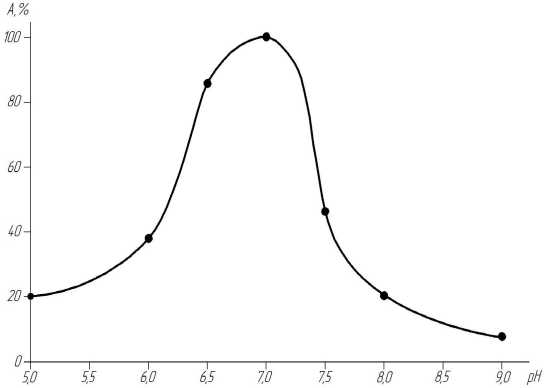
Далее была определенна область оптимальных значений рН и темп ератур, при которых полученная рекомбинантная α-L-фукозидаза проявляет максимальную активность. Изменение активности α-фукозидазы в зависимости от концентрации ионов водоро- да представлено на рисунке 3а. Из графика следует, что для α-фукозидазы E. coli top 10 оптимум действия лежит в области значений рН 7,0. При рН 9,0 фермент почти полностью терял каталитическую активность.
а)
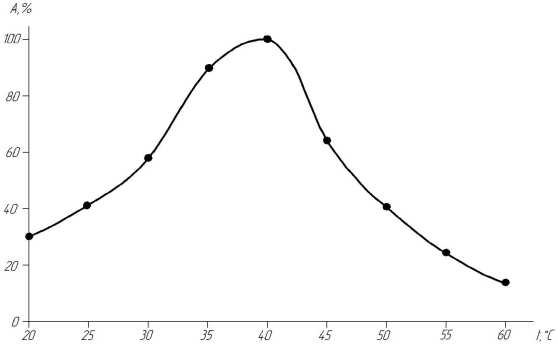
Рисунок 3 – Зависимость активности α-фукозидазы (% от максимальной) а) от величины рН при температуре 40 0С; б) от температуры при оптимальной величине рН.
б)
На рисунке 3б представлена зависимость активности α-фукозидазы от температуры, которая описывается колоколообразной кривой. Такой характер влияния температуры на активность фермента связан с действием двух факторов: с одной стороны, с увеличением температуры возрастала скорость ферментативной реакции, а с другой – происходила инактивация фермента, вследствие денатурации белка, что приводило к непрерывному уменьшению концентрации активного фермента.
Наиболее интенсивным действием α-фукозидазы обладала при температуре 40 °С, отклонение температуры на 10 °С от оптимального значения приводило к снижению активности на 60 и 40 % соответственно.
В результате проведенной работы нами сконструированы рекомбинантные плазмиды на основе вектора pet23b+, способные к эффективной экспрессии клонированного гена α-l-фукозидазы ( AlfB ) ʙ E. coli под контролем Т7-промотора. Установлены оптимальные условия действия полученного рекомбинантного ф ермента. Данные исследования послужат основой для дальнейшей работы по получению стабильного промышленного генноинженерного штамма E. coli top 10 - активного продуцента α-l-фукозидазы.
Работа выполнена в рамках НИОКР по программе У.М.Н.И.К. (ГК № 12128р/20823 от 29.07.2013 г.) и ФЦП " Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007-2013 годы" (ГК № 14.512.11.0069 от 17.04.2013 г.).


