Получение сухой белковой композиции на основе модифицированной плазмы крови
Автор: Омаров Р.С., Антипова Л.В., Шлыков С.Н.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технические науки
Статья в выпуске: 1, 2019 года.
Бесплатный доступ
В данной статье представлены результаты изучения целесообразности использования моди- фицированной путем ферментативного гидролиза плазмы крови в качестве основы для производства взбитых напитков. Для этого были подобраны условия получения гидролизата плазмы крови, предложена композиция сухой белковой основы; изучены физико-химические и функционально- технологические свойства, а также биологическая ценность разработанной сухой белковой основы. В ходе исследования, проведенного на базе научных лабораторий Ставропольского ГАУ, была оценена эффективность использования для гидролиза бел- ков плазмы таких протеолитических ферментов, как мегатерин, протосубтилин, коллагеназа и трипсин. Изучение влияния кислотности среды и температуры позволило установить, что опти- мальными условиями для действия ферментов протосублитина, коллагеназы и мегатерина яв- ляются t = 37 °С и pH = 6,8-7,2, для трипсина - t = 50 °С и pH = 8,0. При этом наибольшую полноту гидролиза показал фермент коллагеназа, обеспе- чивая деструкцию до 70 % суммарного белка при продолжительности процесса 3,0-3,5 ч и массовой доли фермента в системе 0,35 %...
Плазма крови, ферментативный гидролиз, коллагеназа, взбитые коктейли, животный белок
Короткий адрес: https://sciup.org/140243331
IDR: 140243331 | УДК: 637.661.6
Текст научной статьи Получение сухой белковой композиции на основе модифицированной плазмы крови
Введение. Имеющийся дефицит белка в рационах питания человека обуславливает необходимость увеличения объемов и расширения ассортимента производства белоксодержащих продуктов. При этом важным моментом является качество белка, что требует поиска нетрадиционных источников и путей рационального его использования. Одним из ценнейших источников полноценного животного белка является плазма крови убойных животных. Высокая биологическая ценность белкового состава плазмы крови обуславливает высокий коэффициент его перевариваемости, а наличие таких функционально-технологических свойств, как способность к геле- и пенообразованию, делает возможным ее использование в различных пищевых продуктах [1, 2, 7, 8].
В категории продуктов функциональной направленности значительная роль отводится напиткам, которые способны не только удовлетворять потребности организма в жидкости, но и служить источником дефицитных пищевых компонентов, играя роль инструмента для профилактики алиментарнозависимых заболеваний. Напитки являются прекрасной основой для обогащения витаминно-минеральными комплексами, внесения пищевых волокон, насыщения белками, аминокислотами и другими эссенциальными компонентами, становясь их источниками для организма человека. В этой связи представляет интерес изучение способов глубокой переработки жидкой фракции крови убойных животных – плазмы, как основы для производства биологически ценных напитков [3–6].
При этом одним из ограничений использования плазмы крови является короткий срок ее хранения, что требует подбора способа консервации, обеспечивающего сохранность ее питательных качеств и функциональных свойств.
Использование температурной обработки для повышения хранимоспособности плазмы крови не дает нужного бактерицидного эффекта, так как нагревать продукт свыше 52–55 °С не допускается из-за денатурации белков. Одним из способов решения данной проблемы видится направленное изменение структуры белков плазмы крови, которые не подвергались бы деструкции при тепловой обработке в интервале температур 60–65 °С. Этого можно достичь за счет проведения гидролиза с получением аминокислот и пептидов, обладающих большей термостабильностью за счет меньшей длины молекулы.
Кроме того, гидролиз способствует повышению биологической ценности сырья за счет увеличения усвояемости белкового субстрата.
Цель исследования : обоснование перспективности использования модифицированной плазмы крови в качестве основы для производства биологически ценных напитков.
Задачи исследования : подобрать условия получения гидролизата плазмы крови, предложить композицию сухой белковой основы; изучить физикохимические и технологические свойства, а также биологическую ценность разработанного сухого продукта.
Объекты и методы исследования . Экспериментальные исследования проводились на базе кафедры технологии производства и переработки сельскохозяйственной продукции, а также в аккредитованной учебно-научной испытательной лаборатории Ставропольского ГАУ.
В качестве объектов исследования использовались: плазма крови крупного рогатого скота; ферментные препараты протеолитического действия: мегатерин, коллагеназа, протосубтилин и трипсин; жидкие и сухие гидролизаты плазмы крови; пены на основе плазмы крови и сухой белковой основы.
В ходе проведения исследования основные показатели определяли следующими методами: содержание белка – методом Кьельдаля; содержание углеводов – методом Бертрана; содержание аскорбиновой кислоты – расчетным способом; содержание сухих веществ – рефрактометрическим способом; активную кислотность – потенциометрическим способом; ин- декс растворимости – по ГОСТ 30305.4-95; аминокислотный состав – на аминокислотном анализаторе ААА-400 по стандартным методикам; микробиологические показатели – по стандартной методике; аминокислотный скор и биологическую ценность – расчетным методом по Н.Н. Липатову; кратность пены устанавливали как отношение ее объема к объему раствора, пошедшего на образование пены; стабильность пены фиксировали по времени разрушения столба пены. Повторность опытов трехкратная, математическая обработка проводилась в программе Microsoft Office Exсel 2007.
Результаты исследования и их обсуждение. При производстве продуктов здорового питания наиболее целесообразно применение ферментатив- ного гидролиза, который позволяет инициировать глубокие изменения структуры белков. Кроме того, использование ферментных технологий обеспечит экологичность технологических процессов.
К преимуществам ферментного гидролиза также следует отнести мягкость условий протекания с получением смеси продуктов гидролиза с наименьшей степенью рацемизации аминокислот.
В исследовании были изучены оптимумы действия протеолитических ферментов при различных значениях рН и температуры для установления параметров их наибольшей активности.
В качестве субстрата для определения температурного оптимума использовали казеинат натрия при pH = 7 (рис. 1).
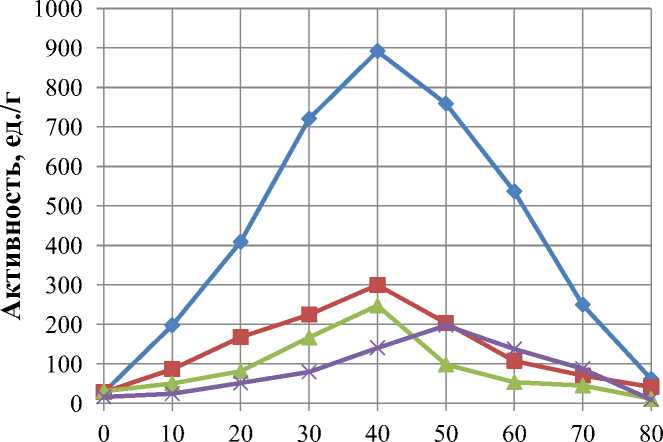
Температура, ºС
Мегатерин
Коллагеназа
Протосубтилин
Трипсин
Рис. 1. Влияние температуры на активность ферментных препаратов
Установлено, что мегатерин, протосубтилин и коллагеназа проявляют максимальную активность при температурах 37–40 °С. Для трипсина оптимум действия определен в интервале температур 48–52 °С.
Результаты изучения влияния активной кислотности среды на протеолитическую активность ферментов представлены на рисунке 2.
Максимальная активность протосубтилина и коллагеназы достигается при рН 6,8–7,2, для трипсина при t = 37 °С оптимальное значение pH – 7,4 ед., при этом максимум активности достигается при рН 8 (t = 50 °С). Для мегатерина были отмечены два пиковых значения активности (рН – 7,0; 7,8), что можно связать с гетерогенной природой данного ферментного препарата.
Дальнейшие исследования были направлены на изучение эффективности применения данных ферментных препаратов для гидролиза белков плазмы крови. На основе предварительных экспериментальных исследований было установлено, что для успешного проведения гидролиза необходимо обеспечить в системе соотношения белок субстрата : фермент как 100 : 1, вследствие чего плазму крови (субстрат) необходимо разбавлять водой 1 : 1. Результаты изучения влияния дозировок ферментов на эффективность гидролиза представлены на рисунке 3.
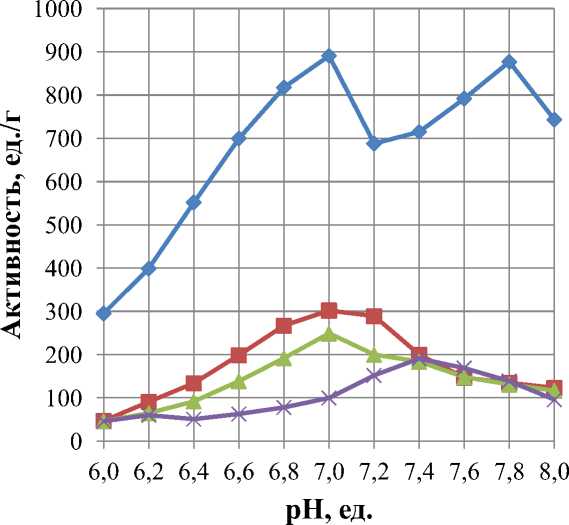
Мегатерин Коллагеназа Протосубтилин Трипсин
Рис. 2. Влияние pH среды на активность ферментных препаратов (t = 37 °С)
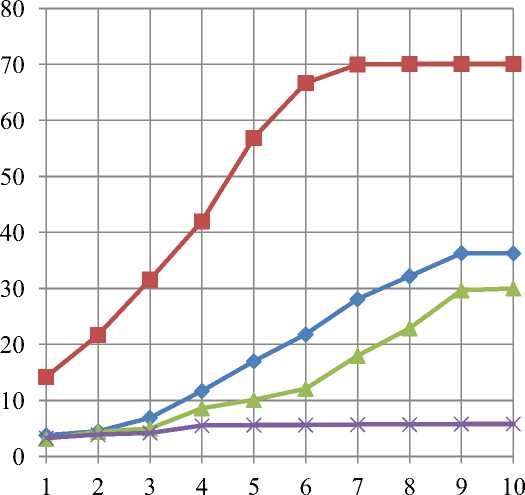
Мегатерин
Коллагеназа
Протосубтилин
Трипсин
Дозировка фермента на 1 г субстрата, мг
Рис. 3. Динамика гидролиза белков плазмы крови различными ферментами
Установлено, что внесение препарата коллагеназа в систему в количествах свыше 7∙10-3 г фермента на 1 г субстрата является нецелесообразным, так как не приводит к дальнейшему повышению степени гидролиза белков. Для мегатерина максимальное значение полноты гидролиза достигается при кон- центрации 3,8∙10-3 г, протосубтилина – 3,0∙10-3 г, что несколько ниже, чем для коллагеназы.
Оценка гидролитических показателей позволила установить, что препарат коллагеназа обеспечивает наиболее полное протекание гидролиза, образуя в сравнении с мегатерином в 2,9 раза больше свободных аминокислот, в том числе в 1,7 раза незаменимых.
Для дальнейших исследований использовали Результаты изучения влияния продолжительноферментные препараты, показавшие наибольшую сти гидролиза на его полноту представлены на ри-эффективность – коллагеназа и мегатерин. сунке 4.
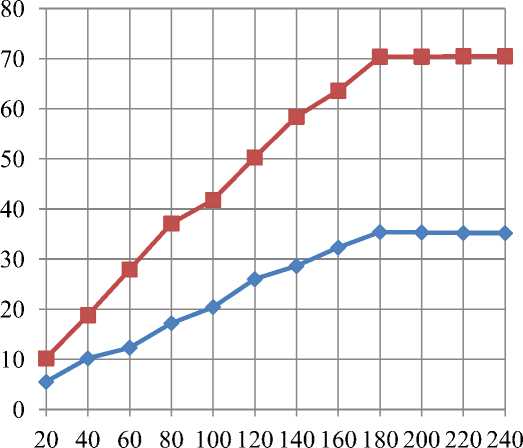
Продолжительность, мин
Рис. 4. Влияние продолжительности протекания гидролиза на его полноту
Мегатерин
Коллагеназа
Установлено, что наиболее интенсивно гидролиз протекает в течение 2,8–3,2 ч, дальнейшее течение процесса характеризовалось резким снижением накопления продуктов гидролиза. Оценка полученных данных показала, что препарат коллагеназа обеспечивает существенно большую полноту гидролиза.
Применив регрессионный анализ с использованием многофакторного планирования для обработки полученных экспериментальных данных, были получены оптимизированные параметры гидролиза белков плазмы крови препаратом коллагеназы (табл. 1).
Таблица 1
|
Параметры процесса |
Значение |
|
Массовая доля фермента, % |
0,35 |
|
Активная кислотность, ед. |
6,8–7,2 |
|
Температура, °С |
35–40 |
|
Продолжительность, ч |
3,0–3,5 |
|
Концентрация белка в субстрате, % |
3,5 |
Параметры проведения ферментативного гидролизата белков плазмы крови
Полученный гидролизат в дальнейшем подвергали пастеризации при температуре 56–58 °С, при сопутствующим снижении рН среды до 3,5–4,5 с помощью различных добавок. Это позволило избежать денатурации негидролизованных белков, выпадения осадка, а также вызвало инактивацию фермента.
Для удобства дальнейшего использования и увеличения хранимоспособности полученный гидролизат подвергали сушке на распылительной сушилке, что позволило предотвратить денатурацию белков и обеспечить высокую растворимость конечного продукта в воде.
Сухой гидролизат было решено использовать для разработки сухой основы для приготовления коктейлей. Помимо сухого гидролизата в состав сухой основы для коктейлей вносили фруктозу, как альтернативу свекловичному сахару, и аскорбиновую кислоту (табл. 2).
Рецептура композиции сухой основы для коктейлей
Таблица 2
|
Компонент |
Расход сырья, кг/100 кг продукта |
|
Сухой гидролизат плазмы крови |
56,8 |
|
Аскорбиновая кислота |
3,4 |
|
Фруктоза |
39,8 |
Результаты изучения физико-химических, орга- става предлагаемой сухой основы для коктейлей нолептических показателей и аминокислотного со- представлены в таблицах 3, 4.
Результаты изучения физико-химических и органолептических показателей сухой основы для коктейлей
Результаты изучения аминокислотного состава сухой основы для коктейлей
Таблица 3
|
Показатель |
Значение |
|
Содержание сухих веществ, % |
86,7 |
|
Растворимость, % |
96,0 |
|
Объемная масса, кг/м3 |
310,4 |
|
Титруемая кислотность, °Т |
20,0 |
|
Содержание белка, % |
46,8 |
|
Содержание углеводов, % |
37,1 |
|
Содержание аскорбиновой кислоты, мг/100 г |
1900,0 |
|
Вкус и запах |
Кисло-сладкий, присутствует приятный аромат и привкус белка |
|
Цвет |
Светло-кремовый, однородный по всей массе продукта |
|
Структура |
Порошкообразная, комочки легко разрушаются |
Таблица 4
|
Аминокислота |
Содержание аминокислоты, г/100 г продукта |
Аминокислотный скор, % |
Коэффициент утилитарности |
|
Треонин |
2,36 |
59,0 |
0,571 |
|
Метионин |
1,18 |
33,71 |
1,000 |
|
Лизин |
4,0 |
72,73 |
0,464 |
|
Лейцин |
5,19 |
74,14 |
0,455 |
|
Фенилаланин |
4,2 |
70,0 |
0,482 |
|
Изолейцин |
1,6 |
40,0 |
0,843 |
|
Валин |
1,84 |
36,8 |
0,916 |
|
Триптофан |
0,7 |
70,0 |
0,482 |
|
Расчетным путем установлено, что коэффициент гических свойств, как хорошая способность к пено- различия аминокислотного скора белка продукта образованию, кратность и стойкость пены. Кон- составляет 23,33 %, его биологическая ценность – трольным образцом выступал раствор сухой плазмы 76,67 %, а коэффициент сопоставимой избыточно- крови. Массовая доля белка в контрольном и опыт- сти равен 0,2650. ном образцах составляла 5 %, температура образ- Важным условием для возможности использова- цов находилась в пределах 4–6 °С. Результаты ис- ния разработанной сухой основы для производства следований представлены в таблице 5. взбитых коктейлей является наличие таких техноло- |
|||
Таблица 5
|
Компонент |
Пенообразующая способность, см3 за временной интервал, с |
Кратность пены за временной интервал, с |
||||||||
|
30 |
60 |
120 |
180 |
240 |
30 |
60 |
120 |
180 |
240 |
|
|
Раствор сухой плазмы крови |
171,0 |
199,0 |
248,0 |
226,0 |
294,0 |
1,4 |
1,7 |
2,1 |
2,7 |
2,9 |
|
Раствор сухой основы |
197,0 |
219,0 |
272,0 |
295,0 |
318,0 |
1,9 |
2,0 |
2,7 |
3,0 |
3,2 |
Результаты сравнения функциональных свойств сухой плазмы крови и разработанной белковой основы
Раствор сухой основы для взбитых коктейлей характеризовался лучшими значениями показателей пенообразования, кратности и стабильности пены, несколько превосходя контрольный образец на основе сухой плазмы крови. Возможно, это связано с присутствием в составе сухой белковой основы фруктозы и аскорбиновой кислоты. Стабильность пены раствора сухой плазмы крови составила около 40 мин, тогда как сухая белковая основа сохраняла полученный объем до 1,5 ч.
Изучение хранимоспособности выявило отсутствие патогенной микрофлоры в сухом продукте при сроках хранения до 12 недель при температуре не выше 4 °С. При этом показатель КМАФАнМ оставался в пределах 2,4∙103 КОЕ в 1 г продукта.
Выводы. Проведенное исследование позволило установить оптимальные параметры ферментативного гидролиза плазмы крови убойных животных протеолитическим препаратом коллагеназа. Сухая белковая основа на основе гидролизата плазмы крови характеризуется высокими качественными показателями и может рекомендоваться в качестве основы для производства взбитых коктейлей, обогащенных полноценным животным белком.
Список литературы Получение сухой белковой композиции на основе модифицированной плазмы крови
- Антипова Л.В., Кульпина А.Л. Возможность использования плазмы крови убойных животных в новых белковых продуктах//Изв. высших учебных заведений. Пищевая технология. -1998. -№ 5-6. -С. 53-55.
- Изгарышева Н.В., Кригер О.В., Лапин А.П. Основные аспекты переработки крови убойных животных для функциональных молочных продуктов//Биокаталитические технологии и технологии возобновляемых ресурсов в интересах рационального природопользования: мат-лы междунар. молодежной конф. -Кемерово, 2012. -С. 119-123.
- Крумликов В.Ю. и др. Разработка технологии белкового пенообразователя для использования в спортивном питании//Техника и технология пищевых производств. -2015. -№ 2. -С. 16-21.
- Пат. 2124853. Российская Федерация, МПК A23L 2/00. Способ получения основы для производства безалкогольных напитков/Л.В. Антипова, М.Б. Васильев; заявитель и патентообладатель Антипова Людмила Васильевна. -№ 97119664/13, заявл. 26.11.1997; опубл. 20.01.1999.
- Бабий Н.В., Соловьева Е.Н., Помозова В.А. и др. Тонизирующие напитки с функциональными свойствами//Техника и технология пищевых производств. -2013. -№ 3. -С. 101-105.
- Михеева Г.А. Специализированный продукт для питания беременных и кормящих женщин -оценка эффективности//Вопросы питания. -2014. -Т. 83. -№ S3. -С. 190.
- Vazquez-Moreno L. Functional properties of protein fractions isolated from porcine blood//Journal of Food Science. -2003. -№ 68. -P. 1196-1200.
- Howell N.K., Lawrie R.A. Functional aspects of blood plasma proteins. III. Interaction with other proteins and stabilizers.//Journal of Food Technology. -1984. -№ 19. -P. 297-313.


