Получение, свойства и применение инулиназы saccharomyces cerevisiae ВГШ-2
Автор: Шуваева Г.П., Корнеева О.С., Мальцева О.Ю., Свиридова Т.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Биотехнология, бионанотехнология и технология сахаристых продуктов
Статья в выпуске: 4 (62), 2014 года.
Бесплатный доступ
В работе представлены экспериментальные данные по кислотной и термической инактивации высокоочищенной инулиназы (2,1-β-D-фруктанфруктано-гидролаза, КФ 3.2.17) дрожжей Saccharomyces cerevisiae расы ВГШ-2. Продуцент получен методом индуцированного мутагенеза и депонирован в музей чистых культур кафедры биохимии и биотехнологии ФГБОУ ВПО «Воронежский государственный университет инженерных технологий» (ВГУИТ). Клетки исходной культуры (S. cerevisiae р. XII) ступенчато подвергались действию ультрафиолетового излучения (УФЛ) и УФЛ в комплексе с химическим мутагеном (этиленимином). Культуру выращивали методом жидкофазного глубинного культивирования на несменяемой питательной среде. Экспериментально подобраны условия выделения инулиназы разной степени очистки. Выявлены зависимости активности фермента от действия физико-химических факторов (рН и температуры), определены численные значения основных кинетических констант: K m и V max. Методом инфракрасной-спектроскопии изучена структура молекулы фермента: определены тип и относительное количество элементов вторичной структуры фермента, установлены группы активного центра энзима, связывающие субстрат. Проведена сравнительная оценка отдельных ферментных препаратов по степени гидролиза инулина, содержащегося в топинамбуре, и сравнительная оценка рас дрожжей S. cerevisiae ВГШ-2 и S. cerevisiae XI по способности к последующему его сбраживанию. Установлены оптимальные условия ферментативного гидролиза полисахарида (инулина). Проведены исследования по сбраживанию крахмалсодержащего сырья дрожжами рас S.cerevisiae ВГШ-2 и S.cerevisiae XI. Установлено, что использование культуры S. cerevisiae ВГШ-2 для сбраживания зернового сусла и экстракта из топинамбура позволяет увеличить выход этанола по сравнению с контрольной расой, улучшить качественные показатели продукта, а так же прогнозировать перспективу её внедрения в пищевой промышленности для получения этанола из зернового и инулинсодержащего сырья.
Ферментные препараты, протеолитическая активность, инулин, инулиназа
Короткий адрес: https://sciup.org/14040320
IDR: 14040320 | УДК: 663.12
Текст научной статьи Получение, свойства и применение инулиназы saccharomyces cerevisiae ВГШ-2
Мальцева О.Ю., Свиридова Т.В., 2014
Дрожжи S. cerevisiae широко используются в различных отраслях пищевой промышленности.
Новый штамм S. cerevisiae ВГШ–2 получен методом индуцированного мутагенеза и депонирован в музей чистых культур кафедры биохимии и биотехнологии ФГБОУ ВПО «Воронежский государственный университет инженерных технологий» ВГУИТ [1]. Клетки исходной культуры ( S. cerevisiae р. XII) ступенчато подвергались действию ультрафиолетового излучения (УФЛ) и УФЛ в комплексе с химическим мутагеном (этиленимином).
Дрожжи S. cerevisiae ВГШ–2 нацело сбраживают мальтозу, глюкозу, сахарозу, частично – галактозу. Не сбраживают лактозу, арабинозу, рамнозу, целлобиозу, трегалозу, мелибиозу, рибозу, рибит, D-маннит. Ассимилируют инулин; характерно максимальное потребление сахарозы. Незначительно ассимилируют галактозу.
Из источников азота потребляют аспарагиновую кислоту, метионин, глутаминовую кислоту, аргинин, лейцин, валин, треонин; не способны употреблять триптофан, гистидин, пролин, фенилаланин.
Хорошо растут на различных питательных средах. На глюкозно-пептонном дрожжевом агаре рост по штриху обильный, консистенция пастообразная, цвет штриха белый, слегка кремоватого оттенка. Клетки крупные, яйцевидные. На сусло-агаре рост также обильный, колонии белого, слегка кремового цвета, консистенция плотная, с гладкой поверхностью, рост равномерный, клетки крупные, овальные.
На синтетической среде с 0,5 % (NH 4 ) 2 SO 4 , 4 % глюкозы, 0,5 % дрожжевого экстракта, 0,1 % КН 2 РО 4 ; 0,05 % MgSO 4 ⋅ 7H n O; 0,01 % СаСl 2 ⋅ 2Н 2 О, 0,01 % NaCl рост умеренный, клетки крупные, слегка округлые.
На питательной среде с использованием экстракта топинамбура генеративная активность культуры возрастает (накопление биомассы увеличивается на 35 – 50 %).
Температурный интервал роста 10- 40 °С, с оптимумом 34°С, интервал рН 3,5 – 5,0 с оптимумом 4,2. Время выращивания 24 - 36 ч.
S. cerevisiae ВГШ–2 проявляет высокую ферментативную активность: мальтазная 7,8 ед/г; зимазная – 42,0 ед/г, содержание трегалозы 16,0 %, активность β -фруктофуранозидазы в 2,5–3,0 раза больше по сравнению с активностью исходного штамма; синтезирует инулиназу, что позволяет использовать данную расу дрожжей для сбраживания различного вида сырья, как сахаро- и крахмалсодержащего, так и инулинсодержащего [1].
Способность расы ВГШ-2 синтезировать инулиназу выгодно отличает её от других рас этого вида и позволяет прогнозировать использование в бродильных производствах при переработке инулинсодержащего сырья.
Фермент инулиназа (2,1-β-D-фруктанфруктано-гидролаза, КФ 3.2.17) в течение ряда последних лет привлекает пристальное внимание как энзимологов, так и биотехнологов.
Наиболее актуальными являются такие вопросы исследований как расшифровка структуры фермента, влияние различных физикохимических факторов на конформацию этой структуры и связанных с ней механизмов активации и инактивации фермента; идентификация функциональных групп каталитического центра, расшифровка механизма катализа. Решение этих вопросов внесёт большой практический вклад в рациональное использование ферментных препаратов разной степени очистки в интенсификацию биотехнологических процессов.
Нами изучалась структура инулиназ, синтезируемых продуцентами различных таксономических групп, исходя из предположения, что ферменты должны обладать сходным механизмом действия, как следствие общей структуры их активных центров, и специфичностью.
Сведений о физико-химических свойствах инулиназ из различных источников: Aspergillus, Penicillium, Fusarium, Sporidiobolus вполне достаточно. Было показано, что ферменты, полипептидные последовательности которых при наложении их друг на друга практически совмещались, обладали различной субстратной специфичностью. Различие в специфичности обусловлено небольшими изменениями в строении «кармана», связывающего боковую цепь аминокислоты.
Ряд исследователей считают [2, 3], что общим для большинства ферментов является способность субстрата связываться с их активным центром двумя или большим числом точек. Подобные многоточечные комплексы способствует тому, что полипептидные цепи белка-фермента, особенно боковые группы аминокислотных остатков, не зафиксированы слишком жестко и подвижны. Многоточечный характер фермент-субстратного взаимодействия в сочетании с повышенной микровязкостью активного центра приводит к практически полной диффузной неподвижности молекул субстрата и уменьшению энтропии. Молекула субстрата переходит из водного окружения в окружение, созданное аминокислотными остатками, оказываясь в поле сильных электрических взаимо- действий между реагентами, вносящими существенный вклад в энергетику ферментативного катализа. В комплексообразовании участвуют, как правило, функциональные группы белка, которые не принимают участия в последующей химической модификации молекул субстрата. Конформационное изменение пространственной структуры фермента происходит без изменения первичной структуры.
Выдвинуто предположение, что инулиназа действует по механизму одиночной цепи, начинающейся с концевого звена молекулы субстрата [3].
В предыдущих исследованиях нами изучались некоторые свойства энзима [4-7], однако, с точки зрения промышленного использования фермента в бродильных производствах, инулиназа Saccharomyces cerevisiae ВГШ-2 изучена недостаточно.
Объектом исследования служили селекционированные на кафедре микробиологии и биохимии ГОУВПО ВГТА дрожжи Saccharomyces cerevisiae ВГШ-2. Чистую культуру дрожжей поддерживали на агаризованном пивном не-охмеленном сусле. Дрожжи культивировали жидкофазным способом на несменяемой питательной среде в колбах емкостью 500 см3 на шейкер-культиваторе Infors, частота вращения 120 об/мин, уровень аэрации 1,4 г О 2 /дм3; температура 32-34оС; рН 4,8; объем питательной среды 100 см3; время культивирования 24 ч.
По окончании выращивания биомассу отделяли центрифугированием, промывали водой и отпрессовывали до влажности 75%.
Активность инулиназы определяли резорциновым методом по реакции Селиванова, используя инулин (Spofa, Прага).
При определении активности инулиназы учитывали содержание редуцирующих веществ, освобождающихся в процессе гидролиза субстрата под действием фермента. Редуцирующие сахара определяли двумя методоми: Сомоджи-Нельсона и Бертрана.
За единицу инулиназной активности принималось количество фермента, которое катализирует образование 2 мМ редуцирующих веществ за 1 мин в стандартных условиях.
В ходе очистки инулиназы применяли Сефадекс Д-25 (для освобождения фермента от низкомолекулярных примесей и разделения с близкими по размерам белковыми молекулами). При заполнении колонки [(1,5 х 25) см] наблюдались 3 зоны: слой осевшего геля, слой форсирующегося геля, зона чистого растворителя. Раствор фермента (3 х 10-4 М) в объеме 3 см3 в ацетатном буфере (рН 4,5) наносили на поверхность геля. По мере впитывания раствора, поверхность геля дважды промывали равными объемами элюента, после чего вели элюирование. Скорость элюции составила 1 см3 за 5 мин. В качестве элюирующей среды использовали 0,1 М ацетатный буфер (рН 4,5). Содержание белка во фракциях определяли методом Лоури.
Для анализа инулиназы методом инфракрасной спектроскопии (ИКС) в качестве носителя была выбрана таблетка из KBr. Измерения производили с помощью многофункционального ИК-спектрофотометра SPECORD M-80 (Германия).
При исследовании бродильной активности дрожжей продуцент культивировали на средах различного состава: зерновом сусле и экстракте топинамбура.
Инокулят получали в анаэробных условиях путем последовательных пересевов с увеличением объема среды: крахмалистое сусло и экстракт топинамбура с концентрацией сухих веществ, соответственно, не менее 18 % и 1214%. На первой стадии культивирования использовали солодовое сусло с концентрацией сухих веществ (СВ) 8-10%; на второй – 10-12% или смесь солодового сусла и экстракта из топинамбура в соотношении 1:1; на третей – 1215% или соотношение солодового сусла и экстракта из топинамбура 1:2.
Подготовку топинамбура к сбраживанию осуществляли следующим образом: измельченные клубни смешивали с водой (гидромодуль 2 : 1), подвергали тепловой обработке при температурах 93-95 ° С в течение 40 минут [8]. Для осахаривания использовали ферментный препарат Fructozyme, который вносили в количестве 2 ФЕ на 1 г условного инулина. Гидролиз проводили при естественном значении рН среды самого топинамбура и температуре 55 ° C. Параллельно осуществляли сбраживание топинамбура без предварительной тепловой обработки. Для сравнения в работе проводились эксперименты по сбраживанию зернового сусла, прошедшего традиционную для отрасли обработку, т.е. измельчение, разваривание, осахаривание, гидромодуль 1:3.
Концентрация сухих веществ сусла составляла 16 %, сбраживаемых углеводов – 14,5 г/100 см3, начальная рН 5,2. Дрожжи вносили в количестве 10 % к объему сбраживаемых проб. Сусло сбраживали при температуре 34 °С - для расы ВГШ - 2, и 30 ° С для XII расы в качестве контроля.
Бражку опытных проб исследовали по общепринятым показателям качества [9], а также по определению содержания этанола и летучих примесей методом хроматографического анализа на колонке НР FFAP 50 m 0,32 mm. Ход брожения контролировали по газовыделению.
В зрелой бражке определяли активную кислотность потенциометрически, титруемую кислотность выражали в см3 NaOH с массовой долей 1 моль/дм3 на 20 см3 бражки, содержание растворимых несброженных углеводов и нераство-ренного инулина – фотоэлектрокалориметриче-ским антроновым методом [9].
При получении высокоочищенной инулиназы руководствовались общими рекомендациями по очистке ферментных препаратов [4-6].
Ранее [4] было установлено, что для получения технического препарата инулиназы можно использовать этанол, изопропиловый спирт и ацетон, но более мягко с сохранением активности воздействует этанол, что положительно в аспекте использования фермента в пищевой биотехнологии. В наших исследованиях использовали этанол и ацетон.
Биомассу из культуральной жидкости осаждали центифугированием при 8000 об/мин в течение 15 мин. Извлечение фермента осуществляли путем дезинтегрирования клеток с помощью ультразвукового дезинтегратора УЗДН-2Т при мощности 500 Вт и частоте 22 кГЦ в течение 2 мин в ледяной бане. Гомогенат использовали для получения водной вытяжки (с массовой долей 10%) путем настаивания в течение 20 мин при (20 ±2) ºС и центрифугированием при 8000 об/мин в течение 10 мин.
Надосадочную жидкость (Supernatant) охлаждали до 2–4 оС и смешивали с растворителем. Характеристика препаратов, полученных осаждением различными растворителями, представлена в таблице 1.
Т а б л и ц а 1
Характеристика препаратов инулиназ
S. cerevisiae ВГШ-2, полученных с использованием различных растворителей
|
Содержание растворителя |
Общий белок, мг/100 мл |
Активность инулиназы |
сЗ Ч О X m |
S н S У о к S |
||
|
объемные соот-ношения |
% |
Общ. ед/см3 |
Удельная ед/мг белка |
|||
|
Этанол |
||||||
|
1:1,5 |
57,6 |
213,5 |
672.3 |
3,15 |
81,5 |
1,7 |
|
1:2,0 |
64,0 |
198,4 |
684,1 |
3,50 |
83,0 |
1,9 |
|
1:2,5 |
68,5 |
157,2 |
735,6 |
4,68 |
89,2 |
2,5 |
|
1:3,0 |
72,0 |
130,9 |
520,1 |
3,45 |
63,1 |
1,8 |
|
Исх. выт-ка |
0 |
439,8 |
824,5 |
1,87 |
100 |
0 |
|
Ацетон |
||||||
|
1:1,5 |
57,6 |
280,3 |
451,3 |
1,61 |
61,1 |
1,1 |
|
1:2,0 |
64,0 |
251,4 |
579,4 |
1,76 |
78,5 |
1,2 |
|
1:2,5 |
68,5 |
234,5 |
448,4 |
1,91 |
60,7 |
1,3 |
|
1:3,0 |
72,0 |
197,6 |
380,3 |
2,32 |
51,5 |
1,5 |
|
Исх. выт-ка |
0 |
496,1 |
738,5 |
1,51 |
100 |
0 |
Оба растворителя осаждают фермент монотонно с последовательным увеличением их концентрации в растворе, увеличивая выход энзима. Однако наиболее полное (89,2 %) осаждение инулиназы наблюдается при действии этанола с концентрацией в смеси 68,5 %, удельная активность при этом возрастает в 2,5 раза. Изучение зависимости каталитической активности инулиназы от температуры и рН показали (рисунки 1, 2), что фермент достаточно термостабилен: при 60 ºС сохраняется 20 % ак тивности от исходной её величины. Температурный оптимум находится в пределах 4346 ºС. Кривая рН-активности имеет характерную для многих ферментов колоколообразную форму с максимумом 4,5-4,7. Кривая несимметрична: в области рН 3,0 - 4,5 она имеет пологий подъем, а в щелочной зоне - крутой спад. Возможно, это связано с изменением функциональных групп активного центра в результате протеолиза и, как следствие, с изменением его структуры в целом. Интересно отметить, что оптимальное значение рН сохраняется при всех концентрациях субстрата.
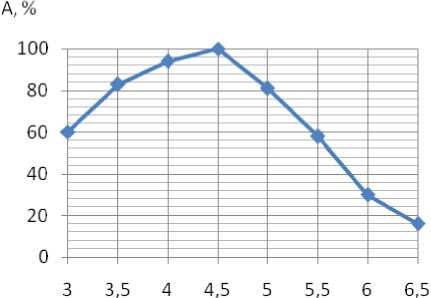
Рисунок 1. Изменение каталитической активности инулиназы S. cerevisiae ВГШ-2 в зависимости от рН
А.0 о
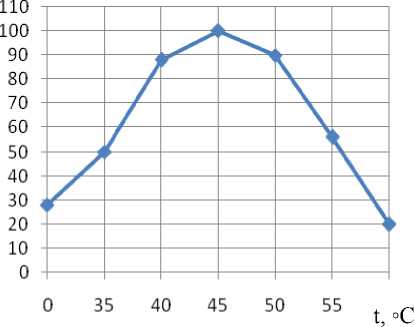
Рисунок 2. Изменение активности инулиназы S. cerevisiae ВГШ-2 в зависимости от температуры
По методу двойных обратных величин (Лайнуивера-Берка) были рассчитаны основные кинетические константы гидролиза инулина спиртоосаждённым препаратом «инуло-церевизином Г10Х»: К m и V max (таблица 2).
Т а б л и ц а 2
Основные кинетические константы реакции гидролиза инулина «инулоцеревизином Г10Х»
|
рН |
Константы |
еакции гидролиза |
|
К m , (х10-7)М |
V max , мкмоль х мг/мин |
|
|
3,0 |
2,02±0,14 |
4,95±0,22 |
|
3,5 |
3,54±0,08 |
5,22±0,31 |
|
4,0 |
1,90±0,17 |
8,71±0,19 |
|
4,5 |
1,26±0,20 |
10,02±0,22 |
|
4,7 |
1,17±0,07 |
7,03±0,36 |
|
5,0 |
1,93±0,09 |
7,11±0,17 |
|
5,5 |
2,89±0,08 |
5,18±0,22 |
|
6,0 |
2,01±0,11 |
3,17±0,39 |
Построив графики зависимости lgVmax от V рН; pK от pH; lg max от рН были получены Km значения pK - константы ионизации групп активного центра (pKE1 и рКЕ2), а также константы ионизации функциональных групп фермента, влияющих на его активность (рКЕS1, рКЕS2: рКЕ1=3,74; рКЕ2=4,95; рКЕS1=3.95; рКЕS2=5,42).
Полученные данные не противоречат литературным [7], что позволяет предполагать о наличии определённого сходства в составе активных центров ферментов, независимо от источника их выделения и происхождения продуцента.
Полученный ферментный препарат «инулоцеревизин Г10Х» использовали для осахаривания экстракта из топинамбура и в сравнении с применяемыми в отрасли отечественными ферментными препаратами – пек-тофоетидин П10х, экспериментальным – ину-лоаваморин П10х, ферментными препаратами Fructozyme и Viscozyme. На основании выполненных работ установлено, что наиболее эффективные ферментные препараты подвергают гидролизу экстракт топинамбура с массовой долей инулина 12 % при рН 5,5 и температуре 55 ºС. Продолжительность гидролиза 40 минут.
Как видно из таблицы 3, наибольшую инулиназную активность имеет Fructozyme, вследствие чего для осахаривания сусла из топинамбура использовали именно этот ферментный препарат.
Результаты исследований по влиянию дозировки ферментного препарата на эффективность сбраживания экстракта топинамбура представлены в таблицах 4 и 5. Очевидно, что наиболее рациональная дозировка ферментного препарата, с технологической и экономической точек зрения – 2 ФЕ/г инулина.
Т а б л и ц а 3
Характеристика ферментных препаратов, применяемых для осахаривания экстракта из топинамбура
|
Наименование ФП |
Инулиназная активность, ед/см3 |
Условия гидролиза |
РВ, % |
|
|
рН |
t, ° C |
|||
|
Ксилоглюканофо-етидин П10Х |
1400 |
4,7 |
55 |
– |
|
Пектофоетидин П10Х |
600 |
4,75 |
60 |
– |
|
Инулиназа К. marxianus |
9260 |
5,0 |
55 |
3,2 |
|
Инулиназа A. awamori |
800 |
4,2 |
60 |
4,3 |
|
Инулиназа S. cerevisiae ВГШ-2 |
735,6 |
4,6 |
45 |
4,1 |
|
Fructozyme LTM |
2360 |
5,5 |
55 |
4,5 |
|
Viscozyme |
257 |
5,0 |
50 |
1,5 |
Анализ данных по изучению влияния продолжительности брожения на выход этилового спирта показал, что наибольший выход спирта наблюдался в опытных образцах, брожение которых протекало в течение 72 ч. Сокращение продолжительности брожения до 60 ч приводило к незначительному снижению выхода этанола (0,5-1,0 %), что позволило впоследствии ограничиться временем 60 ч.
Т а б л и ц а 4
Влияние дозировки ферментного препарата Fructozyme LTM на процесс брожения
|
Дозировка ФП (ФЕ/г субстрата) |
Кислотность в конце брожения |
3 о VO § Щ |
)S 3 Щ xo о s ю 4 & s к |
я 5 К “ bri Я |
|
|
титруемая |
активная |
||||
|
0,5 |
0,14 |
4,5 |
0,24 |
0,6 |
5,80 |
|
1,0 |
0,34 |
4,5 |
0,05 |
0,44 |
6,10 |
|
2,0 |
0,38 |
4,63 |
0,15 |
0,16 |
6,20 |
|
3,0 |
0,43 |
4,34 |
0,13 |
0,63 |
5,70 |
|
10 |
0,44 |
4,50 |
0,24 |
0 |
6,25 |
|
без фермента |
0,26 |
4,85 |
0,24 |
0,75 |
4,25 |
Сусло из пшеницы сбраживали в течение 48 ч.
Была изучена способность дрожжей S. cerevisiae ВГШ-2 сбраживать среды различного состава. Как показали исследования, независимо от состава среды культивирования засевных дрожжей, наибольший выход этанола наблюдается при сбраживании экстракта топинамбура. Максимальный выход продукта наблюдается при их выращивании на среде, содержащей экстракт из топинамбура, полученный с применением Fructozyme LTM при дозировке 2 ФЕ/г инулина с термообработкой (таблица 5).
Т а б л и ц а 5
Физико-химические показатели сбраживания экстракта топинамбура дрожжами S. cerevisiae ВГШ-2
|
Показатели |
Дозировка Fructozyme LTM, ФЕ/г инулина |
|||
|
С термообработкой |
Без термообработки |
|||
|
1 |
2 |
1 |
2 |
|
|
Несброженные са хара, г/100 см3 |
0,04 |
0,05 |
0,07 |
0,06 |
|
Несброженный инулин, г/100 см3 |
0,02 |
0 |
0,05 |
0,04 |
|
Нерастворенный инулин, г/100 см3 |
0,21 |
0,15 |
0,18 |
0,16 |
|
Выход спирта, дал/т условного инулина |
54,57 |
57,14 |
30,9 |
43,43 |
При разработке технологического режима производства спирта одним из важнейших показателей является качество готовой продукции. В связи с этим полученные пробы бы- ных соединений. Содержание побочных продуктов брожения определяли методом газовой хроматографии. Результаты газохроматографического анализа бражек из топинамбура и пшеницы представлены в таблица 6.
Как видно из таблицы 6, качественные составы примесей бражки в опытных образцах идентичны, однако количественное содержание побочных продуктов при этом заметно отличается.
В образцах, полученных с использованием расы дрожжей S. cerevisiae ВГШ-2, суммарное содержание примесных соединений на 8-10 % меньше, чем при использовании промышленного штамма S. сerevisiae XI.
В результате эксперимента установлено, что накопление этанола в зерновых пробах при сбраживании их S. cerevisiae ВГШ-2 на 7-11 % выше, чем при использовании контрольной промышленной расы ( S. сerevisiae XI).
Таким образом, использование дрожжей S. cerevisiae ВГШ-2 для сбраживания зернового сусла и экстракта топинамбура позволяет увеличить выход этанола по сравнению с контрольной расой, улучшить его качественные показатели, а также прогнозировать перспективу её внедрения в пищевой промышленности для получения этанола из зернового и инулинсодержащего сырья.
ли исследованы на содержание микропримес-
Содержание микропримесных соединений в спирте-сырце при различных условиях брожения
Таблица 6
|
Наименование компонента |
Группа примесей |
Раса дрожжей |
||||
|
S.cerevisiae ВГШ-2 |
S. cerevisiae XI (с воднотепловой обработкой ) |
|||||
|
Зерновое сусло с воднотепловой обработкой |
Экстракт топинамбура |
Экстракт топинамбура |
Зерновое сусло |
|||
|
с водно-тепловой обработкой |
без водно-тепловой обработки |
|||||
|
Этиловый эфир, мг/л |
эфир |
- |
- |
- |
17,451 |
- |
|
Ацетальдегид, мг/л |
альд. |
3,21 |
25,475 |
263,92 |
550,81 |
1,6 |
|
Ацетон, мг/л |
кетон |
- |
0,6594 |
0,774 |
- |
- |
|
Метилацетат, мл/л |
сл. эф |
- |
- |
2,6309 |
- |
- |
|
Этилацетат, мг/л |
сл. эф. |
1,34 |
16,145 |
19,43 |
1,7195 |
2,90 |
|
Метанол, мг/л |
% об. |
- |
0,0262 |
0,0255 |
0,0782 |
- |
|
Пропанол-1, мг/л |
сив.м. |
7,42 |
259,48 |
72,842 |
325,78 |
6,08 |
|
Пропанол-2, мг/л |
сив.м. |
- |
- |
- |
- |
|
|
Изобутанол, мг/л |
сив.м. |
7,61 |
75,379 |
59,069 |
125,92 |
18,76 |
|
Бутанол, мг/л |
сив.м. |
- |
2,2897 |
1,9056 |
3,8249 |
- |
|
Изоамилол, мг/л |
сив.м. |
25,0 |
240,08 |
77,75 |
224,91 |
43,1 |
|
Гексанол, мг/л |
сив.м. |
- |
0,3575 |
4,3099 |
7,9909 |
- |
|
Сумма |
сив.м. |
40,0 |
577,5 |
215,88 |
688,42 |
67,94 |
Вестник ВГУИТ, №4, 2014


