Получение жизнеспособной молоди русского осетра (Acipenser gueldenstaedtii) при использовании криоконсервированной спермы и оценка поведенческих реакций у криопотомства
Автор: Красильникова А.А., Тихомиров А.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Аквакультура
Статья в выпуске: 4 т.53, 2018 года.
Бесплатный доступ
Криоконсервирование репродуктивных клеток самцов рыб - актуальное направление в стратегии сохранения генетического биоразнообразия и в аквакультуре. Жизнеспособность криоконсервированной спермы обычно подтверждают оплодотворением яйцеклеток рыб в лабораторных условиях, но дальнейших наблюдений за полученной молодью не проводят. В настоящем исследовании впервые проанализированы поведенческие реакции предличинок, личинок и молоди русского осетра ( Acipenser gueldenstaedtii von Brandt & Ratzeburg 1833) при использовании размороженной спермы для оплодотворения икры и доказана физиологическая полноценность развивающихся особей. Икру получали в производственных условиях от самки русского осетра массой 20 кг и длиной 142 см, рабочая плодовитость - 229500 икринок. Одну часть икры оплодотворили размороженной спермой русского осетра, хранившейся в криобанке 2 года, другую - нативной спермой по стандартной заводской технологии (контроль). Вылупившихся предличинок учитывали сплошным поштучным методом...
Осетровые рыбы, русский осетр, сперма, криоконсервация, криопотомство, предличинка, личинка, молодь, поведение
Короткий адрес: https://sciup.org/142216576
IDR: 142216576 | УДК: 39.3.034.2 | DOI: 10.15389/agrobiology.2018.4.762rus
Текст научной статьи Получение жизнеспособной молоди русского осетра (Acipenser gueldenstaedtii) при использовании криоконсервированной спермы и оценка поведенческих реакций у криопотомства
В настоящее время актуально сохранение генофонда редких и исчезающих популяций и видов рыб, особенно тех, которые представляют практический интерес для увеличения уловов в естественных водоемах или для введения их в аквакультуру как перспективных объектов рыборазведе-
-
* Работы выполнены с использованием УНУ «МУК» ЮНЦ РАН и Биоресурсной коллекции редких и исчезающих видов рыб ЮНЦ РАН ¹ 73602 в рамках реализации ГЗ ЮНЦ РАН на 2018 год «Оценка современного состояния, анализ процессов формирования водных биоресурсов южных морей России в условиях антропогенного стресса и разработка научных основ технологии реставрации ихтиофауны, сохранения и восстановления хозяйственно ценных видов рыб», ¹ госрегистрации 01201354245 и Гранта Президента РФ МК-115.2017.11, ¹ АААА-А17-117051110132-5.
ния (1-3). Одним из основных источников формирования и поддержания запасов редких, исчезающих и хозяйственно ценных видов рыб становится их искусственное воспроизводство (4, 5). Однако на рыбоводных заводах подход к формированию маточных стад упрощен из-за дефицита производителей. Использование близкородственных пар при скрещивании чревато инбридингом и потерей природного генетического полиморфизма, что ведет к значительному снижению адаптивного потенциала популяции (6-8).
Криотехнологии считаются стратегически важными, в том числе антикризисными, для сохранения биологического разнообразия рыб (9, 10). Прогресс в технологиях криоконсервирования расширит сферу их применения в рыбном хозяйстве и аквакультуре, позволит поддерживать генетическое разнообразие промысловых стад рыб, стабилизировать их воспроизводство и тем самым будет способствовать устойчивому рыболовству, а также создаст предпосылки для роста производства рыбы и других гидробионтов в хозяйствах аква- и марикультуры (11-13). Использование крио-консервированной спермы позволит получать генетически разнородную молодь, сократить затраты и площади на содержание самцов. Как следствие, будет увеличено количество самок в маточном стаде (14-16). Применение спермы из криобанка возможно в любое время года, что исключает риск несвоевременного созревания самцов или получения от них эякулята ненадлежащего качества (17, 18).
Накопленные данные по криоконсервированию биологических объектов свидетельствуют о том, что длительное хранение генетического биоматериала в криобанке не оказывает существенного влияния на сохранность клеток (19-21). При этом жизнеспособность криоконсервированной спермы обычно подтверждают оплодотворением яйцеклеток рыб в лабораторных условиях (22-24), но дальнейших наблюдений за молодью не проводят.
В настоящей работе впервые проанализированы поведенческие реакции предличинок, личинок и молоди русского осетра ( Acipenser guelden-staedtii von Brandt & Ratzeburg 1833) полученные при использовании крио-консервированной спермы и доказана физиологическая полноценность развивающихся особей.
Целью работы было применение размороженной спермы при искусственном воспроизводстве русского осетра и оценка поведенческих реакций у криопотомства.
Методика. Работу выполняли в период нерестовой кампании на Александровском осетровом рыбоводном заводе (Астраханская обл.). Икру получали от самки русского осетра ( Acipenser gueldenstaedtii ) массой 20 кг и длиной 142 см, рабочая плодовитость — 229500 икринок. Одну часть икры оплодотворили дефростированной спермой русского осетра, хранившейся в криобанке 2 года, другую — нативной спермой по стандартной заводской технологии (контроль). Обесклеивание оплодотворенной икры осуществляли танином из расчета 1 г на 5 л воды (25). Икру инкубировали в аппарате Осетр (Россия) в течение 6 сут. Во время инкубации ее обрабатывали органическим красителем (фиолетовый К) чтобы избежать заражения сапролегниозом (25). Вылупившихся предличинок учитывали сплошным поштучным методом. Предличинок выдерживали в прямоугольных бассейнах объемом 250 л. При помощи компрессора воду обогащали кислородом. Молодь, перешедшую на активное питание, кормили дафнией.
-
У предличинок (1-е сут после вылупления), личинок (8-е сут), перешедших на активное питание, и молоди (15-е сут) учитывали морфометрические показатели (массу и длину).
Поведенческие реакции особей, полученных по традиционной тех- нологии, и криомолоди оценивали с применением теста «открытое поле» (26, 27). Тест проводили индивидуально, помещая исследуемый объект (предличинку, личинку, молодь) в специальную установку с нанесенной координатной сеткой. При размещении объекта в устройство для проведения теста «открытое поле» сначала определяли его ориентировочную активность в течение 3 мин (ОА, ед/мин), регистрируя число пересечений объектом координатных линий установки. Двигательную активность с 4-й по 7-ю мин принимали за фоновую (ФА, ед/мин). Первым раздражителем был свет (освещенность 20 лк), который включали на 7-й мин тестирования. Освещенность измеряли с помощью люксметра. Величину двигательной активности в первые 30 с после воздействия раздражителя (число пересечений линий координатной сетки) определяли как Р1, ед/мин. Через 9 мин после начала опыта применяли второй раздражитель (Р2, ед/мин) — низкочастотный прямоугольный сигнал (частота 20 Гц). На 11-й мин включали яркий свет (100 лк) — Р3, ед/мин. Через 13 мин от начала тестирования применяли воздействие высокочастотным прямоугольным сигналом (300 Гц) — Р4, ед/мин. Виброакустический раздражитель (Р5, ед/мин) использовали на 15-й мин исследования. Тестировали по 10 особей из опытной и контрольной групп на трех этапах развития: предличинка (1-е сут после вылупления), личинка, которая перешла на активное питание (8-е сут после вылупления) и молодь (15-е сут после вылупления).
В программе Microsoft Excel для показателей рассчитывали средние арифметические ( M ) и средние квадратичные отклонения ( σ ). Статистическую значимость различий устанавливали по t -критерию Стьюдента (28).
Результаты . Доля подвижных клеток в нативной сперме составила 90 %, в криоконсервированной — 60 %; время подвижности спермиев после размораживания спермы — 14,2 мин, в нативной сперме — 26,3 мин; доля оплодотворения в опытной партии — 50 %, в контрольной — 80 %. За период подращивания смертность в опытных и контрольных группах существенно не различалась и составила соответственно 7 и 5 %.
Динамика морфометрических показателей у потомства русского осетра ( Acip-enser gueldenstaedtii von Brandt & Ratzeburg 1833) при оплодотворении икры криоконсервированной (опыт) и нативной (контроль) спермой ( M ± σ )
|
Этап развития |
Масса, мг |
Длина, мм |
||
|
контроль |
опыт |
контроль |
опыт |
|
|
Предличинка (возраст 1 сут) |
18,9±0,28 |
20,5±0,22* |
12,3±0,21 |
14,2±0,2* |
|
Личинка, перешедшая на активное питание (8 сут) |
28,2±0,55 |
35,0±0,30* |
20,7±0,21 |
21,4±0,34 |
|
Молодь (15 сут) |
43,8±0,33 |
47,5±0,33* |
24,0±0,15 |
25,2±0,13* |
|
Прим еч ани е. Различия с контролем статистически значимы при p ≤ 0,001. |
||||
Согласно результатам измерений предличинок (1-е сут), экземпляры из опытной группы по морфометрическим показателям превосходили контроль (табл.). Были установлены статистически значимые различия (p ≤ 0,001) как по массе, так и по длине исследуемых особей. При сравнении личинок, которые перешли на активное питание (8 сут), выявили значимые различия (p ≤ 0,001) между массой в опыте и контроле, но длина личинок в этих вариантах не различалась. У молоди (15 сут) в опытной партии сохранялась тенденция превосходства над контрольными особями по массе и длине.
Любой организм, попадая в незнакомую обстановку и ориентируясь в пространстве, начинает проявлять повышенную двигательную активность. Согласно данным литературы, после вылупления у предличинок сформирован рецепторный комплекс, но без адекватной информации из внешней среды продолговатый мозг не может нормально развиваться (29). 764
Именно в продолговатом мозге сосредоточены основные анализаторы систем, ответственных за взаимосвязь особи со средой (системы боковой линии, статоакустические органы, вкусовые рецепторы), а также центры нейромоторных реакций, питания и дыхания (30). В этой связи мы оценили качество особей, полученных с использованием криоконсервированной и нативной спермы, на основании сравнения их поведенческих реакций.
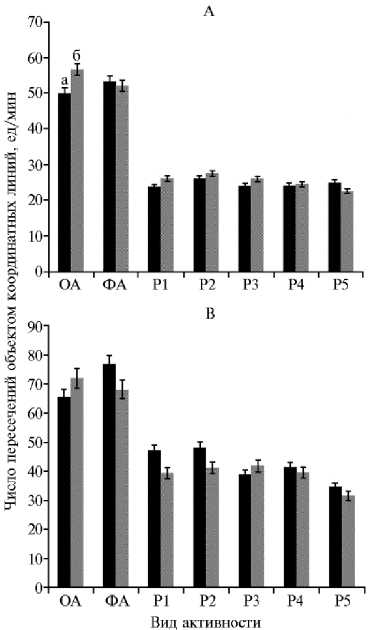
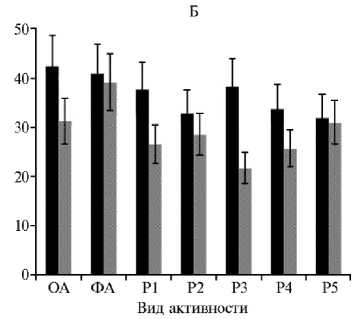
Активность в тесте «открытое поле» у предли-чинок (1-е сут после вылупления, А) , личинок (8-е сут после вылупления, Б) и молоди (15-е сут после вылупления, В) русского осетра ( Acipenser gueldenstaedtii von Brandt & Rat-zeburg 1833), полученной из икры, которая была оплодотворена нативной (а) и криокон-сервированной (б) спермой: ОА — ориентировочная активность, ФА — фоновая активность, Р1-Р5 — двигательная активность в первые 30 с после воздействия различных раздражителей. Описание раздражителей см. в разделе «Методика».
В тесте «открытое поле» предличинки из контрольной группы проявляли низкую ориентировочную активность, демонстрируя реакцию затаивания, которая переходила в медленные передвижения по опытной установке (рис.). Предличинки из опытной группы вели себя более активно, показывая классическую реакцию при изучении незнакомой обстановки, которая характерна для особей различных эволюционных групп. Не было выявлено значимых различий между ориентировочной и фоновой активностью ни в контрольной группе, ни в опытной. Реакции на различные раздражители между особями в опыте и контроле также статистически значимо не различались.
Личинки, которые были полученные с использованием криокон-сервированной спермы, после перехода на смешанное питание (8-е сут) по реакции центральной нервной системы достоверно не отличались от контроля, за исключением реакции на третий раздражитель — яркий свет (100 лк) (р ≤ 0,05). Особи в опытной группе проявляли реакцию затаивания, что было свидетельством более стремительного формирования ассоциативных связей в двухолмии среднего мозга по сравнению с личинками из контрольной партии, которые на этот раздражитель не отреагировали и сохранили активность на уровне фоновой. На 15-е сут развития особи в обоих вариантах опыта адекватно реагировали на воздействие раздражителей классической реакцией затаивания. При анализе от-765
ветных реакций на раздражители были установлены значимые различия (р ≤ 0,05) как в контроле, так и в опыте. Это указывает на начало формирования межнейронных связей в продолговатом мозге. В целом значимых различий между группами мы не выявили.
Аналогичные исследования по оценке поведенческих реакций молоди осетровых рыб, полученной из спермы, хранившейся в криобанке, ранее проводились на стерляди ( Acipenser ruthenus Linnaeus, 1758) (31). По итогам теста «открытое поле» криомолодь не отличалась от молоди контрольной группы, однако при анализе динамики двигательной активности опытная партия демонстрировала более яркую реакцию на предложенные раздражители. Авторы отмечают, что этот факт имеет важное значение для адаптации при выпуске молоди в естественную среду обитания.
Таким образом, молодь русского осетра, полученная с применением замороженной и отогретой спермы, по морфометрическим показателям имела преимущество по сравнению с рыбой, полученной по традиционной технологии. Криомолодь оказалась жизнеспособной, а по реактивности центральной нервной системы и рецепторного комплекса в некоторых случаях превосходила контрольную партию. Незначительная разница в развитии предличинок, личинок и молоди рыб в опытной и контрольной партиях может быть следствием различий в криоустойчивости субпопуляций замораживаемых клеток. Однако при оценке совокупности реакций особей, полученных по традиционной технологии и с использованием размороженной спермы, различий между опытной и контрольной партиями не выявлено. Сперма из криобанка может быть рекомендована для использования на государственных заводах при искусственном воспроизводстве осетровых рыб и на частных предприятиях аквакультуры.
Список литературы Получение жизнеспособной молоди русского осетра (Acipenser gueldenstaedtii) при использовании криоконсервированной спермы и оценка поведенческих реакций у криопотомства
- Worm B., Barbier E.B., Beaumont N., Duffy J.E., Folke C., Halpern B.S., Jackson J.B.C., Lotze H.K., Micheli F., Palumbi S.R., Sala E., Selkoe K.A., Stachowicz J.J., Watson R. Impacts of biodiversity loss on ocean ecosystem services. Science, 2006, 314: 787-790 ( ) DOI: 10.1126/science.1132294
- Béné Ch., Arthur R., Norbury H., Allison E.H., Beveridge M., Bush S., Campling L., Leschen W., Little D., Squires D., Thilsted S.H., Troell M., Williams M. Contribution of fisheries and aquaculture to food security and poverty reduction: assessing the current evidence. World Dev., 2016, 79: 177-196 ( ) DOI: 10.1016/j.worlddev.2015.11.007
- Ottinger M., Clauss K., Kuenzer C. Aquaculture: relevance, distribution, impacts and spatial assessments -a review. Ocean Coast. Manage., 2016, 119: 244-266 ( ) DOI: 10.1016/j.ocecoaman.2015.10.015
- Bronzi P., Rosenthal H., Gessner J. Global sturgeon aquaculture production: an overview. J. Appl. Ichthyol., 2011, 27: 169-175 ( ) DOI: 10.1111/j.1439-0426.2011.01757.x
- Safina C., Duckworth A. Fish conservation. In: Encyclopedia of biodiversity (second edition)/S.A. Levin (ed.). Princeton University, New Jersey, USA Academic Press, 2013: 443-455 ( ) DOI: 10.1016/B978-0-12-384719-5.00315-4
- Olesen I., Rosendal G.K., Tvedt M.W., Bryde M., Bentsen H.B. Access to and protection of Aquaculture genetic resources -structures and strategies in Norwegian Aquaculture. Aquaculture, 2007, 1: S47-S61 ( ) DOI: 10.1016/j.aquaculture.2007.08.012
- Gjedrem T., Robinson N., Rye M. The importance of selective breeding in Aquaculture to meet future demands for animal protein: a review. Aquaculture, 2012, 350-353: 117-129 ( ) DOI: 10.1016/j.aquaculture.2012.04.008
- Duncan N.J., Sonesson A.K., Chavanne H. Principles of finfish broodstock management in aquaculture: control of reproduction and genetic improvement. In: Advances in aquaculture hatchery technology. A volume in Woodhead Publishing Series in Food Science, Technology and Nutrition/G. Allan, G. Burnell (eds.). Woodhead Publishing, Cambridge, 2013: 23-75 ( ) DOI: 10.1533/9780857097460.1.23
- Cabrita E., Sarasquete C., Martínez-Páramo S., Robles V., Beirão J., Pérez-Cerezales S., Herráez M.P. Cryopreservation of fish sperm: applications and perspectives (review). J. Appl. Ichthyol., 2010, 26(5): 623-635 ( ) DOI: 10.1111/j.1439-0426.2010.01556.x
- Herráez P., Cabrita E., Robles V. Fish gamete and embryo cryopreservation: state of the art. In: Aquaculture biotechnology/G.L. Fletcher, M.L. Rise (eds.). Wiley-Blackwell, 2011: 303-317 ( ) DOI: 10.1002/9780470963159.ch20
- Цветкова Л.И., Пронина Н.Д., Докина О.Б., Рекубратский А.В., Парнышков В.А. Формирование низкотемпературного генного банка спермы рыб (состояние, развитие, перспективы). Вопросы рыболовства, 2012, 13(3-51): 538-545.
- Labbé C., Robles V., Herraez M.P. Cryopreservation of gametes for aquaculture and alternative cell sources for genome preservation. In: Advances in aquaculture hatchery technology. A volume in Woodhead Publishing Series in Food Science, Technology and Nutrition/G. Allan, G. Burnell (eds.). Woodhead Publishing, Cambridge, 2013: 76-116 ( ) DOI: 10.1533/9780857097460.1.76
- Kopeika J., Thornhill A., Khalaf Y. The effect of cryopreservation on the genome of gametes and embryos: Principles of cryobiology and critical appraisal of the evidence. Hum. Reprod., 2015, 21(2): 209-227 ( ) DOI: 10.1093/humupd/dmu063
- Robles V., Cabrita E., Kohli V., Herráez M.P. Prospects and development in fish sperm and embryo cryopreservation. In: Aquaculture research progress/T.K. Nakamura (ed.). Nova Science Publishers, Inc., NY, 2009: 199-210.
- Красильникова А.А. Совершенствование процесса криоконсервации репродуктивных клеток самцов рыб. Автореф. канд. дис. Астрахань, 2015.
- Sampath Kumar J.S., Betsy C.J. Cryopreservation of fish gametes and its role in enhancing aquaculture production. In: Advances in marine and brackishwater aquaculture/S. Perumal, A.R. Thirunavukkarasu, P. Pachiappan (eds.). Springer, New Delhi, 2015: 241-246 ( ) DOI: 10.1007/978-81-322-2271-2_22
- Tsai S., Lin C. Advantages and applications of cryopreservation in fisheries science. Braz. Arch. Biol. Tech., 2012, 55(3): 425-434 ( ) DOI: 10.1590/S1516-89132012000300014
- Пономарева Е.Н., Красильникова А.А., Тихомиров А.М., Фирсова А.В. Новые биотехнологические методы криоконсервации репродуктивных клеток осетровых видов рыб. Юг России: экология, развитие, 2016, 11(1): 59-68 ( ) DOI: 10.18470/1992-1098-2016-1-59-68
- Красильникова А.А., Тихомиров А.М. Объем замораживаемого образца как один из факторов выживаемости сперматозоидов осетровых видов рыб при криоконсервации. Естественные науки, 2014, 2: 62-69.
- Krasilnikova A.A., Tikhomirov A.M. Alternative methods of preparation of fish sperm to freeze at ultra-high values of cooling rate. Вестник Астраханского государственного технического университета. Серия Рыбное хозяйство, 2014, 2: 72-78.
- Красильникова А.А., Тихомиров А.М. Корреляция объемов эндоцеллюлярного протектора в криозащитных средах и внутриклеточной жидкости сперматозоидов осетровых рыб. Естественные науки, 2015, 3(52): 105-111.
- Aramli M.S., Nazari R.M. Motility and fertility of cryopreserved semen in Persian sturgeon, Acipenser persicus, stored for 30-60 min after thawing. Cryobiology, 2014, 69(3): 500-502 ( ) DOI: 10.1016/j.cryobiol.2014.10.006
- Dzyuba B., Boryshpolets S., Cosson J., Dzyuba V., Fedorov P., Saito T., Psenicka M., Linhart O., Rodina M. Motility and fertilization ability of sterlet Acipenser ruthenus testicular sperm after cryopreservation. Cryobiology, 2014, 69(2): 339-341 ( ) DOI: 10.1016/j.cryobiol.2014.07.008
- Nynca J., Dietrich G.J., Dobosz S., Grudniewska J., Ciereszko A. Effect of cryopreservation on sperm motility parameters and fertilizing ability of brown trout semen. Aquaculture, 2014, 433: 62-65 ( ) DOI: 10.1016/j.aquaculture.2014.05.037
- Чебанов М.С., Галич Е.В., Чмырь Ю.Н. Руководство по разведению и выращиванию осетровых рыб. М., 2004: 148.
- Витвицкая Л.В., Никоноров С.И., Тихомиров А.М., Козлов А.В. Оценка качества продукции рыбоводных заводов по эколого-физиологическим показателям. В сб.: Фундаментальные науки -народному хозяйству. М., 1990: 123-149.
- Никоноров С.И., Витвицкая Л.В. Эколого-генетические проблемы искусственного воспроизводства осетровых и лососевых рыб. М., 1993.
- Ивантер Э.В., Коросов А.В. Введение в количественную биологию. Петрозаводск, 2011.
- Шмальгаузен И.И. Основы сравнительной анатомии. М., 1947.
- Абдурахманов Г.М., Зайцев В.Ф., Ложниченко О.В., Федорова Н.Н., Тихонова Э.Ю., Лепилина И.Н. Развитие жизненно важных органов осетровых в раннем онтогенезе. М., 2006.
- Пономарева Е.Н., Неваленный А.Н., Белая М.М., Красильникова А.А. Использование криоконсервированной спермы для формирования маточного стада стерляди. Вестник Астраханского государственного технического университета. Серия Рыбное хозяйство, 2017, 4: 118-127 ( ) DOI: 10.24143/2073-5529-2017-4-118-127


