Популяционно-экологические аспекты адаптивных реакций системы крови Emys orbicularis (Reptilia: Emydidae) при инвазии
Автор: Романова Елена Борисовна, Столярова Ирина Александровна, Бакиев Андрей Геннадьевич, Горелов Роман Андреевич
Журнал: Принципы экологии @ecopri
Рубрика: Оригинальные исследования
Статья в выпуске: 4 (46), 2022 года.
Бесплатный доступ
Проведена оценка лейкоцитарного профиля крови и анализ зараженности гемопаразитами болотной черепахи Emys orbicularis (Linnaeus, 1758) из Астраханской области России. В динамике двухлетних наблюдений в лейкоцитарных профилях болотной черепахи отмечено повышение относительного содержания гетерофилов (самцы) и снижение доли моноцитов (самцы, самки), возрастание индекса сдвига лейкоцитов (самцы, самки), понижение лимфоцитарно-гранулоцитарного индекса (самцы), что иллюстрировало снижение реагирования иммунитета в целом и доминирующую роль гранулоцитов в неспецифических адаптивных реакциях организма. Доля пораженных эритроцитов, экстенсивность и интенсивность инвазии Haemogregarina spp. самок возросла, у самцов осталась на прежнем уровне. Выявлены половые различия в морфометрических параметрах инфицированных эритроцитов черепах. Площадь эритроцитов самцов значимо превышала аналогичный показатель самок, но не изменялась по сравнению с инфицированными клетками. Пораженные эритроциты самок отличались большей площадью и имели измененную форму. В крови инфицированных особей изменялось соотношения лейкоцитарных клеток в пользу гранулоцитов при уменьшении числа клеток лимфоцитарно-моноцитарного звена. Выявлена положительная слабая взаимосвязь между показателями инвазии и содержанием в периферической крови черепах эозинофилов, отрицательная слабая взаимосвязь с интегральными лейкоцитарными индексами соотношения лимфоцитов и гетерофилов к эозинофилам. Совокупность значений интегральных лейкоцитарных индексов отражала влияние паразита, при котором реактивность организма хозяина не выходила за пределы нормальных значений. Установленная положительная умеренная корреляционная взаимосвязь между интенсивностью инвазии и длиной карапакса болотной черепахи позволяет прогнозировать более высокую интенсивность заражения в процессе онтогенетического развития рептилий.
Черепахи, лейкоцитарные индексы, периферическая кровь, лейкоцитарная формула крови, гемопаразиты
Короткий адрес: https://sciup.org/147240092
IDR: 147240092 | УДК: 598.132.4:591.111.1 | DOI: 10.15393/j1.art.2022.12862
Текст научной статьи Популяционно-экологические аспекты адаптивных реакций системы крови Emys orbicularis (Reptilia: Emydidae) при инвазии
У11ИВЕРСИТЕТ
Обширная область исследований посвящена изучению морфофизиологических адаптаций черепах к существованию на границе водной, наземной и воздушной среды (Wyneken et al., 2007). В дельту Волги заходит восточная часть ареала вида с таким образом жизни – болотной черепахи Emys orbicularis (Linnaeus, 1758), представленной здесь популяциями гаплолинии I номинативного подвида E. o. orbicularis (Lenk et al., 1999; Дуйсебаева и др., 2019). В связи с нарастающими отклонениями сезонных температурных показателей и прессом антропогенной нагрузки особое внимание привлекает изучение эколого-физиологических механизмов адаптации черепах к новым формирующимся условиям, которые вызваны деградацией и загрязнением окружающей среды, болезнями или интродукцией инвазивных видов. Гематологические показатели являются индикаторами детерминантов окружающей среды (Alleman et al., 1992; Соколина и др., 1997; Вершинин, 2004; Павлов, 2019), а также ценными диагностическими инструментами при оценке состояния организма животных и изучении экофизиологическо-го статуса организмов и популяций in situ (Davis et al., 2008; Perpinan, Sanchez, 2009). При этом весьма плодотворным методологическим подходом считается определение лейкоцитарной формулы крови с расчетом связанных с ней интегральных индексов. Ранее проведенными исследованиями в эритроцитах черепах E. orbicularis из природных популяций речных бассейнов Урала (Оренбургская область) и Волги (Астраханская область) обнаружены и идентифицированы гемопаразиты Haemogregarina spp. (Романова и др., 2021). В цикле работ, посвященных распространению и интенсивности инвазии водных черепах, выделяется два современных направления: во-первых, молекулярная идентификация (Ozvegy et al., 2015; Arizza et al., 2016) и морфология (Mihalca et al., 2002; Soares et al., 2014) гемопаразитов; во-вторых, иммуногематологический подход, позволяющий оценивать видоспецифиче- ские адаптивные реакции и состояние иммунной системы организма системы крови черепах при инвазии с учетом гендерных, возрастных и биотопических различий. Следует отметить, что в рамках этого направления имеющиеся сведения о характере количественных изменений в крови черепах при заражении гемогрегаринами носят фрагментарный характер и зачастую противоречивы (Mihalca et al., 2002; Salakij et al., 2002; Ozvegy et al., 2015; Arizza et al., 2016). Кроме того, полностью отсутствуют динамические исследования по сравнительному анализу популяционных иммуногематологических характеристик водных черепах, обеспечивающих важнейшие гомеостатические функции организма. В этой связи задача отслеживания изменений направленности адаптивных реакций системы крови болотной черепахи в условиях естественных биотопов при инвазии является актуальной и необходимой как для теории, так и для решения практических природоохранных вопросов в области экофизиологии рептилий.
С учетом вышеизложенного целью работы являлся сравнительный анализ зараженности гемогрегаринами и лейкоцитарного профиля крови болотной черепахи E. orbicularis из Астраханской области в период двухлетних наблюдений (2020–2021 гг.).
Материалы
Объект исследования – особи E. orbicularis , добытые в окрестностях пос. Комсомольский Красноярского района Астраханской области, в слабопроточном озере на правобережье р. Ахтуба. За два года было выловлено 108 особей: 48 особей (28 самок и 20 самцов) 27–29 августа 2020 г.; 60 особей (20 самок, 20 самцов и 20 молодых) 25–26 августа 2021 г. Проанализировано 204 гематологических препарата.
Работы проводили в соответствии с «Международными руководящим принципами для биомедицинских исследований на животных» (International Guiding…, 2012). Кровь у черепах брали путем прокола хвостовой вены. После взятия крови всех осо- бей возвратили в места отлова.
Методы
Мазки крови (по два от каждой особи) готовили с помощью гематологического штапеля, высушивали на воздухе, затем фиксировали в спиртоэфирной смеси (1:1). Зафиксированные мазки хранили до окрашивания при комнатной температуре. Мазки окрашивали в течение 20 минут красителем Гимза азур-эозин по Романовскому (10–12-кратный раствор, фирма «Биолот», Россия), приготовленном на фосфатном буфере ( рН 6.8–7.2). Готовые мазки просматривали на микроскопе «Meiji Techno», Япония, серия МТ 4000 с иммерсией, при увеличении ×1500, с дифференцированным подсчетом лейкоцитов (Alleman et al., 1992; Соколина и др., 1997). По морфологическим особенностям определяли пять типов лейкоцитарных клеток (в %): гранулоциты (гетерофилы, базофилы, эозинофилы) и агранулоциты (моноциты, лимфоциты). Цифровые изображения препаратов выполняли камерой «Vision САМ» для тринокулярного микроскопа «Meiju Techno» (увеличение ×1500).
На основании лейкоцитарной формулы крови рассчитали интегральные лейкоцитарные индексы в относительных единицах:
-
1) индекс сдвига лейкоцитов, ИСЛ = ∑ гранулоцитов / ∑ агранулоцитов;
-
2) индекс соотношения лимфоцитов и эозинофилов, ИСЛЭ = Л / Э ;
-
3) индекс соотношения гетерофилов и эозинофилов, ИСГЭ = Г / Э ;
-
4) лимфоцитарно-гранулоцитарный индекс, ИЛГ = Л × 10 / ( Э + Г + Б );
-
5) индекс соотношения гетерофилов и лимфоцитов, ИСГЛ = Г / Л ,
где Л – лимфоциты; Э – эозинофилы; Г – гетерофилы; Б – базофилы.
Пол взрослых черепах определяли по внешним морфологическим признакам, у молодых особей половую принадлежность не устанавливали. Измеряли длину карапакса (в мм) черепах по его прямой средней линии от переднего края загривкового щитка до заднего конца шва между надхвостовыми щитками штангенциркулем.
Учет гемопаразитов проводили на 500 эритроцитов у каждой особи. Экстенсивность инвазии (Е – количество особей вида, зараженных гемопаразитами, по отношению ко всему числу исследованных особей) рассчитывали по формуле: E = (n / N) × 100 %. Среднюю интенсивность инвазии (I – количество паразитов, приходящихся в среднем на одну черепаху) рассчитывали по формуле: I = m / n. Индекс обилия (ИО – количество гемопаразитов, приходящихся на одну исследованную особь) рассчитывали по формуле: ИО = m / N, где n – количество зараженных особей; m – количество обнаруженных гемопаразитов; N – количество исследованных особей хозяев.
Окуляр-микрометром проводили измерение диаметра лейкоцитарных клеток (2 r ), большой (2 a ) и малой (2 b ) осей здоровых и инфицированных эритроцитов. Площадь (мкм2) клеток рассчитывали по формулам круга S = π × r 2 или эллипса: S = π × a × b , где r – диаметр круга; а – большая полуось эллипса; b – малая полуось эллипса; π = 3.14.
Полученные первичные данные проверяли на соответствие нормальному распределению по специальным критериям Шапиро – Уилка, Лиллиефорса и Андерсона – Дарлинга. Ввиду несоответствия первичных данных нормальному распределению, центральные тенденции и рассеяние показателей описывали медианой ( Me ) и интерквартильным размахом ( IQR ). Многофакторным дисперсионным анализом с использованием лямбды Уилкса (λWilks) в качестве критериальной статистики оценивали влияние факторов (пола, возраста, зараженности, года взятия) на лейкоцитарные показатели; значимость отличий ( p -значения) рассчитывали путем рандомизации с использованием перестановочной процедуры (Шитиков, Розенберг, 2014; Якимов, 2019). Данные сравнивали методами непараметрической статистики с расчетом критериев: Краскела – Уоллиса ( H ) (при множественном сравнении независимых групп по одному признаку), Данна ( D ) (множественный критерий при попарном сравнении групп), Манна – Уитни ( u ) при сравнении двух групп, Вилкоксона ( w ) при сравнении зависимых выборок, критерием z – при сравнении долей с поправкой Холма, при α = 0.007, ранговым коэффициентом корреляции Спирмена ( ρ ) в пакете прикладных программ «Rstudio». За величину статистической значимости принимали α = 0.05.
Результаты
Средняя длина карапакса половозрелых самок болотной черепахи составляла 137.25 ± 5.31 мм, самцов 155.00 ± 1.92 мм. Половых различий по этому показателю у взрослых болотных черепах не выявлено ( D = 2.07, p = 0.07). У сеголеток он равен 90.50 ± 0.90 мм, что значимо меньше по сравнению с самками ( D = 6.10, p < 0.001) и самцами ( D =
-
8.18, p < 0.001). Самцы и самки болотной черепахи, добытые в разные годы, по средней длине карапакса не различались (самки: w = 0.27, p = 0.77; самцы w = 0.57, p = 0.56).
При дифференциации округлых лейкоцитарных клеток болотной черепахи с учетом расположения, наличия зернистости в цитоплазме и формы ядра окуляр-микрометром измерили диаметр и рассчитали площадь клеток. Лейкоцитарные клетки самцов, за исключением эозинофилов, были крупнее аналогичных клеток самок и молодых особей. Самыми крупными лейкоцитами у всех особей являлись гетерофилы, самыми мелкими – лимфоциты (табл. 1).
Таблица 1. Морфометрия клеток лейкоцитарного ряда крови Emys orbicularis изученной популяции в 2021 г.
1. Самцы 2. Самки поло- 3 с еголетки
Показатели лейко- половозре- возрелые, . , Статистические показате-
|
граммы |
лые, n = 20 n = 20 n ли Me IQR Me IQR Me IQR |
|
Гетерофилы |
d 16 2 15 3 14 2 Н = 42.298, р < 0.001 D1-2 = 4.725, р < 0.001 S 201.06 50.27 176.71 68.33 153.94 43.98 D1-3 = 6 . .233 , , р р < < 0 . .001 |
|
Эозинофилы |
d 14 3 13 2.25 13 3 S 153.94 63.62 132.73 46.53 132.73 63.62 Н = 3.970, р = 0.137 |
|
Базофилы |
d 13 2 12 2 12 1 Н = 25.890, p < 0.001 D1-2 = 3.404, р = 0.001 S 132.73 40.84 113.1 37.7 113.1 18.06 D1-3 = 4 . .977 , , p p < 0 . .001 |
|
Моноциты |
d 13 3 12 2 12 2 Н = 37.811, p < 0.001 D1-2 = 5.477, p < 0.001 S 132.73 63.62 113.1 37.7 113.1 37.7 D1-3 = 5.160, p < 0.001 |
|
Лимфоциты |
d 10 1 9 3 9 1 Н = 25.332, p < 0.001 D1-2 = 3.723, р< 0.001 S 78.54 14.92 63.62 31.22 63.62 13.35 D1-3 = 4 . .795 , , p p < < 0 . .001 |
Примечание. d – диаметр клетки, мкм; S – площадь клетки, мкм2; H – критерий Краскела – Уоллиса; D – критерий Данна; p – достигнутый уровень значимости.
|
Таблица 2. Изменение лейкоцитарного профиля самцов Emys orbicularis в течение 2020–2021 гг. |
||||||
|
Показатели лейко-граммы |
Самцы 2020, n = 20 |
Самцы 2021, n = 20 |
Статистические показатели |
|||
|
Me |
IQR |
Me |
IQR |
Критерий Вилкоксона ( w ) |
Уровень значимости ( р ) |
|
|
Гетерофилы, % |
11.50 |
9.50 |
15.00 |
13.00 |
2.56 |
0.01 |
|
Эозинофилы, % |
12.00 |
7.50 |
13.00 |
11.50 |
1.48 |
0.13 |
|
Базофилы, % |
21.50 |
13.50 |
20.50 |
7.50 |
0.63 |
0.52 |
|
Моноциты, % |
10.00 |
8.00 |
6.00 |
3.00 |
4.70 |
0.000003 |
|
Лимфоциты, % |
42.00 |
8.50 |
41.00 |
7.00 |
0.64 |
0.52 |
|
ИСЛ, отн. ед. |
0.86 |
0.33 |
1.10 |
0.41 |
3.09 |
0.001 |
|
ИСЛЭ, отн. ед. |
3.41 |
3.45 |
3.11 |
3.06 |
0.81 |
0.41 |
|
ИСГЭ, отн. ед. |
1.15 |
0.91 |
1.08 |
1.38 |
0.90 |
0.36 |
|
ИЛГ, отн. ед. |
9.29 |
3.38 |
6.54 |
3.03 |
2.28 |
0.02 |
|
ИСГЛ, отн. ед. |
0.26 |
0.23 |
0.22 |
0.45 |
2.50 |
0.01 |
|
Примечание. Жирным выделены статистически значимые показатели |
. |
|||||
|
В анализируемый период времени в крови моноцитов (табл. 3). |
||||||
|
самок обнаружено пониженное содержание |
||||||
|
Таблица 3. Изменение лейкоцитарного профиля самок Emys orbicularis в течение 2020–2021 гг. |
||||||
|
Самки 2020, n = 28 |
Самки 2021, n = 20 Статистические показатели |
|||||
|
Показатели лейко- |
||||||
|
граммы |
Me |
IQR |
Me |
Критерий Вил- Уровень значи- IQR |
||
|
коксона ( w ) |
мости ( р ) |
|||||
|
Гетерофилы, % |
12.00 |
10.00 |
17.00 |
7.50 |
1.89 |
0.05 |
|
Эозинофилы, % |
10.50 |
10.00 |
8.00 |
9.50 |
0.73 |
0.46 |
|
Базофилы, % |
23.50 |
10.00 |
24.00 |
10.00 |
1.86 |
0.06 |
|
Моноциты, % |
7.50 |
3.00 |
4.00 |
3.00 |
3.24 |
0.001 |
|
Лимфоциты, % |
45.00 |
11.00 |
38.00 |
9.50 |
1.08 |
0.27 |
|
ИСЛ, отн. ед. |
0.88 |
0.37 |
1.11 |
0.31 |
2.27 |
0.02 |
|
ИСЛЭ, отн. ед. |
4.15 |
5.40 |
4.90 |
6.24 |
0.04 |
0.96 |
|
ИСГЭ, отн. ед. |
1.27 |
1.50 |
1.70 |
2.22 |
1.12 |
0.25 |
|
ИЛГ, отн. ед. |
9.36 |
4.53 |
8.03 |
2.81 |
1.81 |
0.06 |
|
ИСГЛ, отн. ед. |
0.24 |
0.25 |
0.38 |
0.27 |
1.47 |
0.13 |
Примечание. Жирным выделены статистически значимые показатели.
a
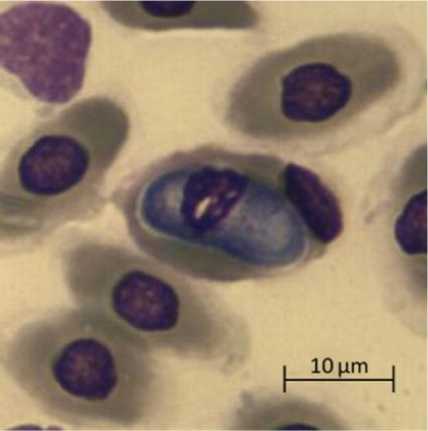
б
в
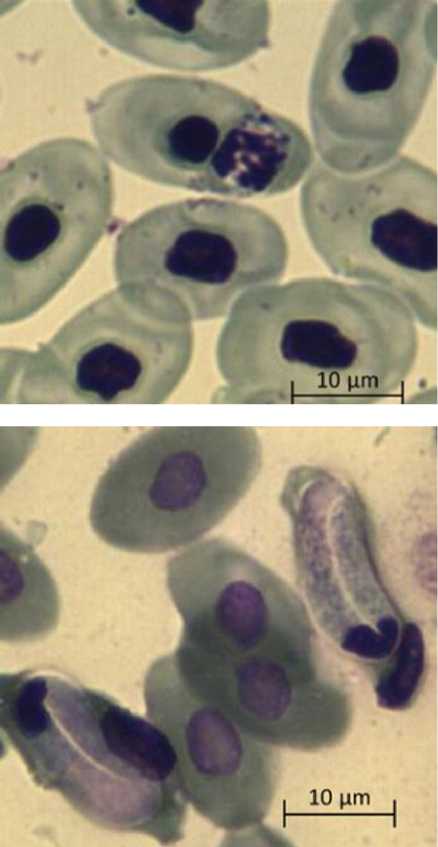
Микрофотографии паразитарных форм Haemogregarina spp . , выполненные камерой Vision CAM для тринокулярного микроскопа Meiji Techno (×1500): а – макрогаметоциты; б – микрогаметоциты; в – трофозоиты
Micrographs of parasitic forms of Haemogregarina spp. made by the Vision CAM camera for the Meiji Techno trinocular microscope (×1500): a – macrogametocytes; б – microgametocytes; в – trophozoites
|
Таблица 4. Лейкоцитарный состав крови здоровых и инфицированных половозрелых самцов и самок болотной черепахи разных лет взятия (2020–2021 гг.) |
||||||||
|
Самцы |
Самки |
|||||||
|
Показатели |
Здоровые |
Инфицированные |
Здоровые |
Инфицированные |
||||
|
лейкограммы |
Me |
IQR |
Me |
IQR |
Me |
IQR |
Me |
IQR |
|
2020 год |
||||||||
|
Гетерофилы, % |
6.00 |
7.00 |
12.00 |
8.00 |
9.00 |
4.00 |
13.50 |
11.00 |
|
Эозинофилы, % |
12.00 |
6.00 |
12.00 |
9.00 |
12.00 |
10.00 |
12.00 |
7.50 |
|
Базофилы, % |
28.00 |
12.00 |
21.00 |
12.00 |
25.00 |
8.00 |
20.00 |
10.00 |
|
Моноциты, % |
12.00 |
7.00 |
10.00 |
7.00 |
7.00 |
2.00 |
9.70 |
4.50 |
|
Лимфоциты, % |
44.00 |
4.00 |
42.00 |
9.00 |
47.00 |
8.00 |
42.00 |
11.50 |
|
Гранулоциты , % от лейкоцитов |
49.00 |
11.00 |
46.00 |
9.00 |
47.00 |
10.00 |
48.50 |
11.50 |
|
Агранулоциты , % от лейкоцитов |
51.00 |
11.00 |
54.00 |
9.00 |
53.00 |
10.00 |
51.50 |
11.00 |
|
2021 год |
||||||||
|
Гетерофилы, % |
22.00 |
8.00 |
15.00 |
13.00 |
22.50 |
4.50 |
16.50 |
7.00 |
|
Эозинофилы, % |
11.00 |
4.00 |
13.50 |
13.00 |
17.00 |
22.00 |
8.00 |
8.50 |
|
Базофилы, % |
27.00 |
8.00 |
20.00 |
7.00 |
20.00 |
12.50 |
24.00 |
9.50 |
|
Моноциты, % |
2.50 |
3.00 |
6.00 |
3.00 |
4.50 |
4.00 |
6.00 |
3.00 |
|
Лимфоциты, % |
37.50 |
1.00 |
41.50 |
8.00 |
34.00 |
2.00 |
44.50 |
9.00 |
|
Гранулоциты , % от лейкоцитов |
60.00 |
4.00 |
52.00 |
8.00 |
60.00 |
5.00 |
52.00 |
6.50 |
|
Агранулоциты , % от лейкоцитов |
40.00 |
4.00 |
48.00 |
8.00 |
40.00 |
5.00 |
48.50 |
6.50 |
Таблица 6. Морфометрические параметры эритроцитов Emys orbicularis ( Me / IQR )
|
Пол черепах |
Эритроциты крови |
a, мкм |
b, мкм |
a / b |
S, мкм2 |
|
1. Без |
|||||
|
паразитов, |
20.00 / 2.00 |
12.00 / 1.00 |
1.73 / 0.32 |
188.50 / 33.97 |
|
|
Самки |
n = 100 |
||||
|
2. С паразитами, n = 100 |
20.00 / 2.50 |
13.00 / 3.00 |
1.53 / 0.50 |
197.92 / 54.98 |
|
|
3. Без |
|||||
|
паразитов, |
20.00 / 2.00 |
12.00 / 2.00 |
1.73 / 0.37 |
197.92 / 44.77 |
|
|
Самцы |
n = 100 |
||||
|
4. С паразитами, n = 100 |
20.00 / 2.00 |
12.00 / 2.00 |
1.70 / 0.51 |
193.99 / 36.91 |
|
|
H = 20.42, p < 0.001; |
H = 8.31, |
||||
|
H = 13.15, |
H = 19.58, |
D1-2 = 4.05, |
p = 0.04; |
||
|
Статистические показатели |
p < 0.001; |
p < 0.001; |
p < 0.001; |
D1-2 = 2.11, |
|
|
D2-3 = 3.56, |
D1-2 = 4.39, |
D2-3 = 3.60, |
p = 0.02; |
||
|
p = 0.003 |
p < 0.001 |
p = 0.001; |
D1-3 = 2.74, |
||
|
D2-4 = 3.23, |
p = 0.003 |
||||
|
p < 0.001 |
|||||
|
В целом по |
Без паразитов, n = 200 |
20.00 / 1.00 |
12.00 / 2.00 |
1.73 / 0.32 |
188.50 / 34.56 |
|
выборке |
С паразитами, n = 200 |
20.00 / 3.00 |
12.00 / 3.00 |
1.66 / 0.49 |
193.99 / 43.20 |
|
Статистические показатели: |
u = 22283, p = 0.04 |
u = 16923, p = 0.007 |
u = 23610, p = 0.002 |
u = 19025, p = 0.40 |
|
Примечание. a – длина большой оси; b – длина малой оси; S – площадь клетки; n – количество просмотренных клеток; H – критерий Краскела – Уоллиса; D – критерий Данна; u – критерий Манна – Уитни.
|
Таблица 7. Зараженность болотных черепах из Астраханской области гемогрегаринами |
|||||
|
Выборки |
Число за раженных особей |
Число па- п Доля клеток разитов на с паразита- 500 эритро- к ми цитов |
E , % |
I , отн. ед. |
ИО, отн. ед. |
|
2020 г. |
|||||
|
Самки ( n = 23) |
9 |
32 0.064 |
39.13 |
3.55 |
1.39 |
|
Самцы ( n = 19) |
14 |
82 0.164 |
73.68 |
5.85 |
4.31 |
|
В целом по выборке ( n = 42) |
23 |
114 0.228 |
54.76 |
4.95 |
2.71 |
|
2021 г. |
|||||
|
Самки ( n = 20) |
18 |
141 0.282 |
90 |
7.42 |
7.05 |
|
Самцы ( n = 20) |
19 |
106 0.212 |
95 |
5.88 |
5.3 |
|
Молодые ( n = 20) |
8 |
18 0.036 |
40 |
2.25 |
0.9 |
|
В целом по выборке ( n = 60) |
45 |
265 0.530 |
75 |
5.88 |
4.41 |
Таблица 8. Значение лейкоцитарных индексов здоровых болотных черепах и при инвазии гемопаразитами
|
Лейкоцитарный индекс, отн. ед. |
1. Без инвазии |
При инвазии |
Статистические показатели |
||||
|
2. 2020 г. |
3. 2021 г. |
||||||
|
Me |
IQR |
Me |
IQR |
Me |
IQR |
||
|
Самки |
|||||||
|
ИСЛ |
0.88 |
0.34 |
0.94 |
0.45 |
1.08 |
0.28 |
Н = 2.06, р = 0.35 |
|
ИСЛЭ |
4.41 |
6.40 |
4.19 |
3.92 |
5.14 |
6.02 |
Н = 2.30, р = 0.31 |
|
ИСГЭ |
0.83 |
1.50 |
1.47 |
1.60 |
1.70 |
1.69 |
Н = 6.04, р = 0.04 D = 2.40, p = 0.04 |
|
ИЛГ |
9.56 |
3.51 |
9.03 |
4.18 |
8.33 |
2.85 |
Н = 1.56, р = 0.45 |
|
ИСГЛ |
0.21 |
0.26 |
0.45 |
0.30 |
0.35 |
0.21 |
Н = 7.40, р = 0.02 D = 2.58, p 1-3= 0.02 |
|
Самцы |
|||||||
|
ИСЛ |
1.00 |
0.68 |
0.85 |
0.31 |
1.08 |
0.34 |
Н = 8.99, р = 0.01 D =2 .98, p = 0.008 |
|
ИСЛЭ |
3.66 |
3.62 |
3.33 |
3.18 |
3.11 |
3.10 |
Н = 1.62, р = 0.44 |
|
ИСГЭ |
1.20 |
1.58 |
1.22 |
1.08 |
1.05 |
1.33 |
Н = 1.16, р = 0.92 |
|
ИЛГ |
8.57 |
5.06 |
9.50 |
3.27 |
8.00 |
3.25 |
Н = 2.69, р = 0.25 |
|
ИСГЛ |
0.21 |
0.48 |
0.28 |
0.22 |
0.34 |
0.43 |
Н = 3.61, р = 0.16 |
|
В целом по выборке |
|||||||
|
ИСЛ |
0.94 |
0.43 |
0.88 |
0.42 |
1.08 |
0.34 |
Н = 8.87, р = 0.01 D = 2.78, p 2-3= 0.01 |
|
ИСЛЭ |
4.02 |
5.55 |
3.50 |
3.63 |
4.36 |
4.53 |
Н = 0.70, р = 0.70 |
|
ИСГЭ |
0.95 |
1.35 |
1.25 |
1.50 |
1.40 |
1.75 |
Н = 2.88, р = 0.23 |
|
ИЛГ |
9.19 |
4.58 |
9.09 |
3.84 |
9.07 |
2.94 |
Н = 2.90, р = 0.23 |
|
ИСГЛ |
0.21 |
0.35 |
0.30 |
0.20 |
0.34 |
0.29 |
Н = 9.69, р = 0.007 D = 3.10, p 1-=3 0.005 |
Примечание. Жирным выделены статистически значимые показатели.
Таблица 9. Анализ взаимосвязи интенсивности инвазии с лейкоцитарным профилем крови болотной черепахи коэффициентом ранговой корреляции Спирмена ( ρ )
специального дополнительного паразитологического исследования и сравнительного экофизиологического анализа иммунного статуса инфицированных особей.
Список литературы Популяционно-экологические аспекты адаптивных реакций системы крови Emys orbicularis (Reptilia: Emydidae) при инвазии
- Бейер Т. В., Сидоренко Н. В. Цитохимическое исследование гемогрегарин рептилий Армении. II. Сдвиги в содержании гемоглобина и общих белков в эритроцитах скальных ящериц, зараженных гемогрегаринами // Паразитология. 1972. Т. VI. Вып. 4. C. 385-390.
- Васильев Н. В. Очерки о роли кроветворной ткани в антителообразовании . Томск: Изд-во Томского ун-та, 1975. 302 с.
- Вершинин В. Л. Гемопоэз бесхвостых амфибий - специфика адаптациогенеза видов в современных экосистемах // Зоологический журнал. 2004. Т. 83, № 11. С. 1367-1374.
- Данилевский В. Я. Исследования по сравнительной паразитологии крови. Зоопаразиты крови у пресмыкающихся . Т. 2. Харьков, 1891. 145 с.
- Дуйсебаева Т. Н., Доронин И. В., Малахов Д. В., Кукушкин О. В., Бакиев А. Г. ГИС-анализ распространения и условий обитания Emys orbicularis orbicularis (Testudines, Emydidae): методические аспекты // Известия высших учебных заведений. Поволжский регион. Естественные науки. 2019. № 1. С. 28-40. DOI: 10.21685/2307-9150-2019-1-4.
- Кирдей Е. Г., Дмитриева Л. А. Роль эритроцитов в регуляции и реализации иммунного ответа // Сибирский медицинский журнал. 1995. Т. 4, № 3. С. 5-8.
- Мкртчян З. А. Материалы к изучению паразитов крови рептилий Армении // Биологический журнал Армении. 1966. Т. XIX, № 10. С. 92-100.
- Павлов А. В. Ключевые моменты гематологии рептилий: особенности оценки лейкоцитарной части крови // Известия высших учебных заведений. Поволжский регион. Естественные науки. 2019. № 1. С. 138-152. DOI: 10.21685/2307-9150-2019-1-14.
- Прокопенко Л. Г., Сипливая Л. Е. Эритроциты как модуляторы иммунологических реакций // Успехи физиологических наук. 1992. Т. 23, № 4. С. 89-106.
- Романова Е. Б., Столярова И. А., Бакиев А. Г., Горелов Р. А. Сравнительный лейкоцитарный профиль Emys orbicularis (Reptilia: Emydidae) из двух популяций // Современная герпетология. 2021. Т. 21, № 1/2. С. 30-42. DOI: 10.18500/1814-6090-2021-21-1-2-30-42.
- Соколина Ф. М., Павлов А. В., Юсупов Р. Х. Гематология пресмыкающихся: Методическое пособие по курсу герпетологии, большому практикуму и спецсеминарам . Казань: Казан. гос. ун-т, 1997. 31 с.
- Финкельштейн Н. Я. Чужеядные крови холоднокровных Кавказа // Архив Биологических Наук. 1908. Т. 13. Вып. 2. С. 132-164.
- Шитиков В. К., Розенберг Г. С. Рандомизация и бутстреп: статистический анализ в биологии и экологии с использованием R. . Тольятти: Кассандра, 2014. 314 с.
- Якимов В. Н. Основы анализа биомедицинских и экологических данных в среде R. Часть 2: Учебное пособие. . Нижний Новгород: Нижегородский госуниверситет, 2019. 168 с.
- Adl S. M., Simpson A. G. B., Heiss A., Lane C. E., Lukes J., Bass D., Bowser S. S., Brown M. W., Burki F., Dun-thorn M., Hampl V., Hoppenrath M., Lara E., Mitchell E. A. D., Gall L. L., Lynn D. H., Mcmanus H., Mozley-Stanridge S. E., Parfrey L. W., Pawlowski J., Rueckert S., Shadwick L., Spiegel F. W., Schoch C. L., Smirnov A. The revised classification of eukaryotes // Journal of Eukaryotic Microbiology. 2012. Vol. 59. Issue 5. P. 429-493. DOI: 10.1111/j.1550-7408.2012.00644.x.
- Alleman A. R., Jacobson E. R., Raskin R. E. Morphologic and cytochemical characteristics of blood cells from the desert tortoise (Gopherus agassizii) // American Journal of Veterinary Research. 1992. Vol. 53. P. 1645-1651.
- Arizza V., Sacco F., Russo D., Scardino R., Arculeo M., Vamberger M., Marrone F. The good, the bad and the ugly: Emys trinacris, Placobdella costata, and Haemogregarina stepanowi in Sicily (Testudines, Annelida, and Apicomplexa) // Folia Parasitologica. 2016. Vol. 63: 029. DOI: 10.14411/fp.2016.029.
- Danilewsky B. Die Hâmatozoën der Kaltblüter // Archiv für Mikroskopische Anatomie. 1885. Band 24. S. 588-598.
- Davis A. K., Maney D. L., Maerz J. C. The use of leukocyte profiles to measure stress in vertebrates: a review for ecologists // Functional Ecology. 2008. Vol. 22. P. 760-767. DOI: 10.1111/j.1365-2435.2008.01467.x.
- Dvorakova N., Kvicerova J., Hostovsky M., Siroky P. Haemogregarines of freshwater turtles from Southeast Asia with a description of Haemogregarina sacaliae sp. n. and a redescription of Haemogregarina pellegrini Laveran and Pettit, 1910 // Parasitology. 2015. Vol. 42. Issue 6. P. 816-826. DOI: 10.1017/ S0031182014001930.
- Dvorakova N., Kvicerova J., Papousek I., Javanbakht H., Tiar G., Kami H., Siroky P. Haemogregarines from western Palaearctic freshwater turtles (genera Emys, Mauremys) are conspecific with Haemogre-garina stepanowi Danilewsky, 1885 // Parasitology. 2014. Vol. 141. Issue 4. P. 522-530. DOI: 10.1017/S0031182013001820.
- International Guiding Principles for Biomedical Research Involving Animals. 2012. URL: https://grants.nih. gov/grants/olaw/guiding_principles_2012.pdf (дата обращения: 27.05.2022).
- Lenk P., Fritz U., Joger U., Wink M. Mitochondrial phylogeography of the European pond turtle, Emys orbicularis (Linnaeus, 1758) // Molecular Ecology. 1999. Vol. 8. Issue 11. P. 1911-1922.
- Mihalca A., Achelaritei D., Popescu P. Haemoparasites of the genus Haemogregarina in a population of European pond turtles (Emys orbicularis) from Draga§ani, Valcea county, Romania // Scientia Parasitologica. 2002. Vol. 2. P. 22-27.
- Ozvegy J., Marinkovic D., Vucicevic M., Gajic B., Stevanovic J., Krnjaic D., Aleksic-Kovacevic S. Cytologi-cal and molecular identification of Haemogregarina stepanowi in blood samples of the European pond turtle (Emys orbicularis) from quarantine at Belgrade Zoo // Acta Veterinaria-Beograd. 2015. Vol. 65, No 4. P. 443-453. DOI: 10.1515/acve-2015-0037.
- Paperna I. Developmental cycle of chelonian haemogregarines in leeches with extra-intestinal multis-porozoite oocysts and a note on the blood stages in the chelonian hosts // Diseases of Aquatic Organisms. 1989. Vol. 7. P. 149-153.
- Perpiñán D., Sánchez C. Morphologic and Cytochemical Characteristics of Blood Cells from the European Pond Turtle (Emys orbicularis) and the Mediterranean Pond Turtle (Mauremys leprosa) // Journal of Herpetological Medicine and Surgery. 2009. Vol. 19. No 4. P. 119-127.
- Salakij C., Salakij J., Suthunmapinunta P., Chanhome L. Hematology, Morphology and Ultrastructure of Blood Cells and Blood Parasites from Puff-faced Watersnakes (Homalopsis buccata) // Kasetsart Journal - Natural Science. 2002. Vol. 36. P. 35-43.
- Sawyer R. T. Leech biology and behavior. Vol. 3. Oxford: Oxford University Press; Clarendon Press, 1986. 240 p.
- Segade P., Crespo C., Ayres C., Cordero A., Arias M. C., García-Estévez J. M., Iglesias Blanco R. Eimeria species from the European pond turtle, Emys orbicularis (Reptilia: Testudines), in Galicia (NW Spain), with description of two new species // Journal of Parasitology. 2006. Vol. 92. Issue 1. P. 69-72. DOI: 10.1645/GE-3491.1.
- Siddall M. E., Desser S. S. Transmission of Haemogregarina balli from painted turtles to snapping turtles through the leech Placobdella ornata // Journal of Parasitology. 2001. Vol. 87. Issue 5. P. 12171218. DOI: 10.1645/0022-3395(2001)0872.0.03.
- Soares P., de Brito E. S., Paiva F., Pavan D., Viana L.A. Haemogrerarina spp. in a wild population from Podocnemis unifilis Troschel, 1848 in the Brazilian Amazonia // Parasitology Research. 2014. Vol. 113. P. 4499-4503. DOI: 10.1007/s00436-014-4139-7.
- Stacy N. I., Alleman A. R., Sayler K. A. Diagnosic hematology of reptiles // Clinics in Laboratory Medicine. 2011. Vol. 3. P. 87-108. DOI: 10.1016/j.cll.2010.10.006.
- Telford Jr. S. R. Hemoparasites of the Reptilia: Color Atlas and Text. New York: CRC Press, 2009. 376 p.
- Thrall M. A., Dale C., Baker E., Lassen E. D. Hematology of reptiles // Veterinary Hematology and Clinical Chemistry. Pennsylvania, USA: Lippincott Williams & Wilkins, 2004. P. 259-276.
- Wyneken J., Bels V. L., Godfrey M. H. Biology of Turtles. Boca Raton: CRC Press, 2007. 408 p.
- Zelmer D. A., Platt T. R. Structure and similarity of helminth communities of six species of Australian turtles // Journal of Parasitology. 2008. Vol. 94. Issue 4. P. 781-787. DOI: 10.1645/GE-1487.1.


